يجمع مخطط الطور بين مخططات الضغط مقابل درجة الحرارة لتوازنات انتقال طور الغاز السائل، والصلب السائل، والغاز الصلب للمادة. تشير هذه المخططات إلى الحالات الفيزيائية الموجودة في ظل ظروف معينة للضغط ودرجة الحرارة وتوفر أيضًا اعتماداً على الضغط لدرجات حرارة انتقال الطور (نقاط الانصهار ، نقاط التسامي، نقاط الغليان). تمثل المناطق أو المناطق التي تحمل علامة صلبة وسائلة وغازية مراحل واحدة، بينما تمثل الخطوط أو المنحنيات مرحلتين تتعايشان في حالة توازن (أو طور) نقاط التغيير). تشير النقطة الثلاثية إلى ظروف الضغط ودرجة الحرارة التي تتعايش فيها المراحل الثلاث. وعلى النقيض من ذلك، تشير النقطة الحرجة إلى درجة الحرارة والضغط التي فوقها مرحلة واحدة— خصائصها الفيزيائية هي وسيطة بين الحالة الغازية والسائلة— موجود.
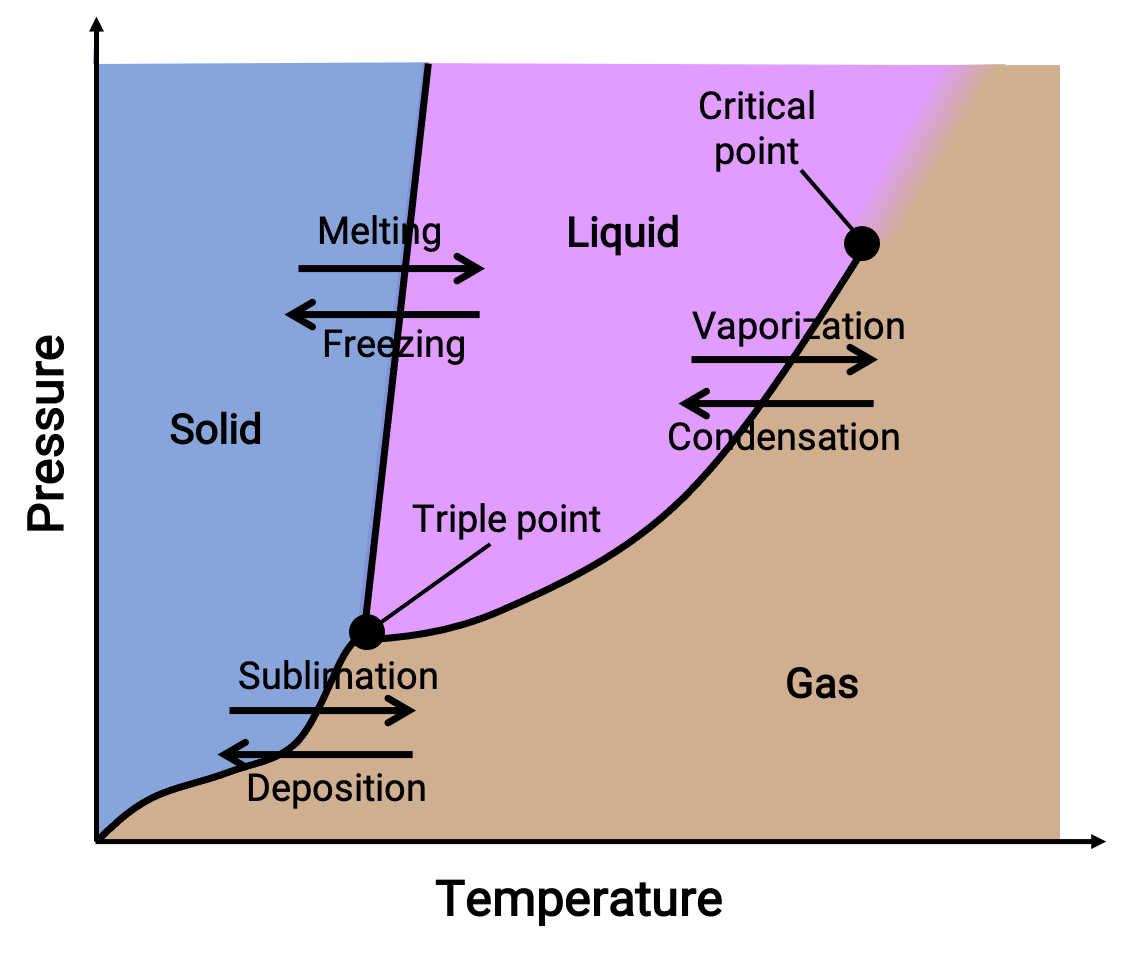
Figure 1. مخطط نموذجي مرحلي.
يحدد مخطط الطور الحالة الفيزيائية للمادة في ظل ظروف محددة للضغط ودرجة الحرارة. لتوضيح فائدة هذه المخططات ، ضع في اعتبارك مخطط طور الماء ، الموضح أدناه .
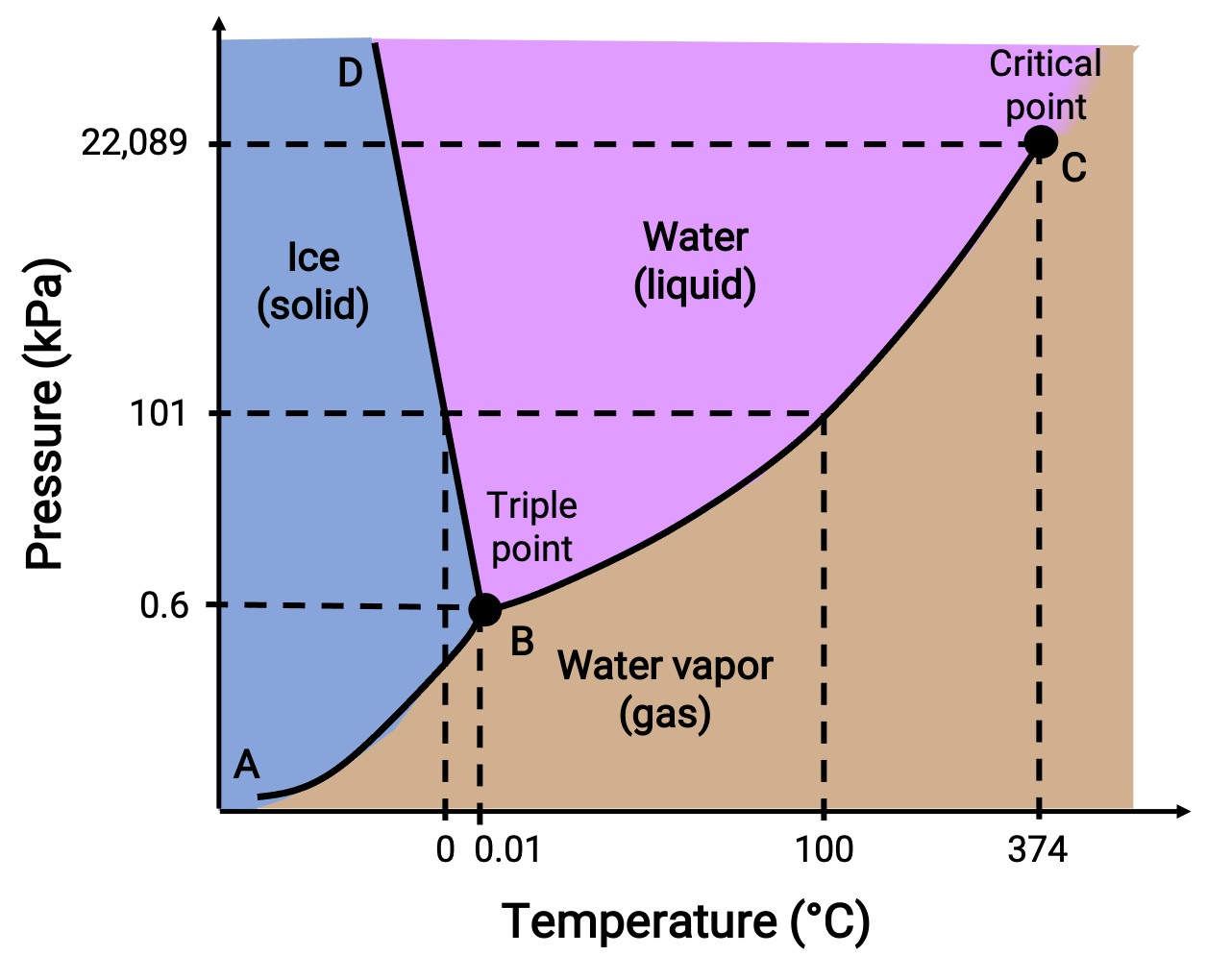
Figure 2. مخطط طور الماء.
ضغط 50 كيلو باسكال ودرجة حرارة −10 °C يتوافق مع منطقة الرسم البياني المسمى “جليد.” في ظل هذه الظروف ، يوجد الماء فقط كمادة صلبة. يقابل ضغط 50 كيلو باسكال ودرجة حرارة 50 °C المنطقة التي يوجد فيها الماء فقط كسائل. عند 25 كيلوباسكال و 200 °C، يوجد الماء فقط في الحالة الغازية. المنحنى BC هو منحنى بخار السائل الذي يفصل بين المناطق السائلة والغازية في مخطط الطور ويوفر نقطة غليان الماء عند أي ضغط. على سبيل المثال ، عند 1 atm ، تكون نقطة الغليان 100 °C. لاحظ أن منحنى بخار-سائل ينتهي عند درجة حرارة 374 & # 176 ؛ C وضغط 218 atm ، مما يشير إلى أن الماء لا يمكن أن يوجد كسائل فوق درجة الحرارة هذه ، بغض النظر عن الضغط. الخصائص الفيزيائية للماء في ظل هذه الظروف هي وسيطة بين تلك الخاصة بمرحلتها السائلة والغازية. هذه الحالة الفريدة للمادة تسمى السائل فوق الحرج. يشير منحنى بخار-صلب المسمى AB إلى درجات الحرارة والضغوط التي يكون فيها الجليد وبخار الماء في حالة توازن. تتوافق أزواج بيانات درجة الحرارة والضغط هذه مع نقاط التسامي أو الترسيب للمياه.
يوضح منحنى سائل-صلب المسمى BD درجات الحرارة والضغوط التي يكون عندها الجليد والماء السائل في حالة توازن، مما يمثل نقاط انصهار/تجميد الماء. لاحظ أن هذا المنحنى يُظهر ميلًا سلبيًا طفيفًا، مما يشير إلى أن نقطة انصهار الماء تنخفض قليلاً مع زيادة الضغط. يعتبر الماء مادة غير معتادة في هذا الصدد ، حيث أن معظم المواد تظهر زيادة في درجة الانصهار مع زيادة الضغط. نقطة تقاطع جميع المنحنيات الثلاثة— المسماة B— هي النقطة الثلاثية للماء، حيث تتعايش المراحل الثلاث في حالة توازن. عند ضغوط أقل من النقطة الثلاثية، لا يمكن أن يوجد الماء كسوائل، بغض النظر عن درجة الحرارة.
ضع في اعتبارك مخطط الطور لثاني أكسيد الكربون كمثال آخر.
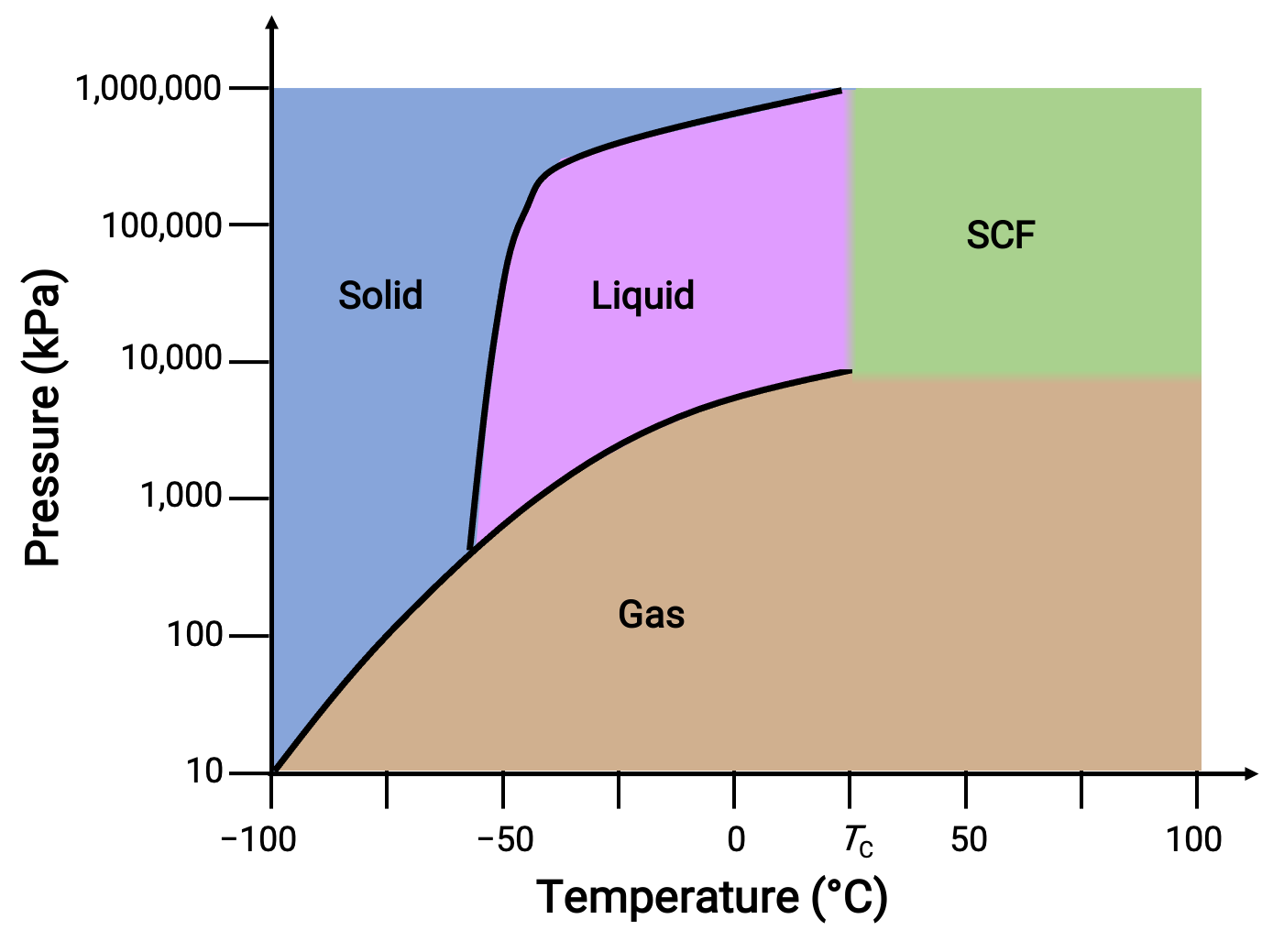
Figure 3. مخطط الطور لثاني أكسيد الكربون.
يُظهر منحنى السائل الصلب ميلاً موجباً، مما يشير إلى أن نقطة انصهارCO2 تزداد مع الضغط كما هو الحال بالنسبة لمعظم المواد. لاحظ أن النقطة الثلاثية أعلى بكثير من 1 atm، مما يشير إلى أن ثاني أكسيد الكربون لا يمكن أن يوجد كسائل تحت ظروف الضغط المحيط. بدلاً من ذلك ، يؤدي تبريد ثاني أكسيد الكربون الغازي عند 1 ضغط جوي إلى ترسبه في الحالة الصلبة. وبالمثل ، لا يذوب ثاني أكسيد الكربون الصلب عند ضغط 1 ضغط جوي ولكن بدلاً من ذلك يتسامى لينتج غازCO2. أخيراً، يتم ملاحظة النقطة الحرجة لثاني أكسيد الكربون عند درجة حرارة وضغط متواضعين نسبيًا مقارنة بالماء.
هذا النص مقتبس من Openstax, Chemistry 2e, Section 10.4: Phase Diagrams.
From Chapter 11:

Now Playing
11.13 : مخطّطات المرحلة
Liquids, Solids, and Intermolecular Forces
37.9K Views

11.1 : مقارنة جزيئية بين الغازات والسوائل والمواد الصلبة
Liquids, Solids, and Intermolecular Forces
39.6K Views

11.2 : القوى بين الجزيئية مقابل القوى الجزيئية
Liquids, Solids, and Intermolecular Forces
83.4K Views

11.3 : القوى بين الجزيئات
Liquids, Solids, and Intermolecular Forces
54.7K Views

11.4 : مقارنة القوى بين الجزيئيات
Liquids, Solids, and Intermolecular Forces
43.2K Views

11.5 : التوتر السطحي والعمل الشعري واللزوجة
Liquids, Solids, and Intermolecular Forces
27.0K Views

11.6 : انتقالات المرحلة
Liquids, Solids, and Intermolecular Forces
18.3K Views

11.7 : انتقالات المرحلة: التبخير والتكثيف
Liquids, Solids, and Intermolecular Forces
16.7K Views

11.8 : ضغط البخار
Liquids, Solids, and Intermolecular Forces
33.6K Views

11.9 : معادلة كلاوزيوس-كلايبرون
Liquids, Solids, and Intermolecular Forces
54.4K Views

11.10 : انتقالات المرحلة: الذوبان والتجميد
Liquids, Solids, and Intermolecular Forces
12.1K Views

11.11 : انتقالات المرحلة: التصاعد والترسب
Liquids, Solids, and Intermolecular Forces
16.4K Views

11.12 : منحنيات التسخين والتبريد
Liquids, Solids, and Intermolecular Forces
21.7K Views

11.14 : تراكيب المواد الصلبة
Liquids, Solids, and Intermolecular Forces
13.3K Views

11.15 : المواد الصلبة الجزيئية والأيونية
Liquids, Solids, and Intermolecular Forces
16.2K Views
See More
Copyright © 2025 MyJoVE Corporation. All rights reserved