الديناميكا الحرارية لتفاعل الأكسدة والاختزال
الديناميكا الحرارية هي فرع الفيزياء الذي يتعامل مع العلاقة بين الحرارة وأشكال الطاقة الأخرى. في الخلية الكهروكيميائية ، يتم تحويل الطاقة الكيميائية إلى طاقة كهربائية.
وبالتالي ، يمكن التنبؤ بوجود ارتباط بين جهد الخلية وتغير الطاقة الحرة وثابت التوازن للتفاعل. يمكن أيضًا قياس جهد الخلية كعامل مؤكسد أو قوة الاختزال ، وتنعكس مقاييس قوة القاعدة الحمضية المماثلة في ثوابت التوازن.
جيبس’ الطاقة الحرة والعلاقة بين E°الخلية و ΔG°
إن طاقة جيبس الحرة هي الكمية المستخدمة لحساب أقصى قدر من العمل القابل للعكس الذي يؤديه نظام ديناميكي حراري يتم الحفاظ عليه عند درجة حرارة ثابتة وظروف ضغط. يُشار إليه بالرمز G ، ويتم تمثيل تغييره كـ ∆G. يتم تعريف التغيير القياسي في الطاقة الحرة للنظام، ΔG°، على أنه الحد الأقصى للعمل الذي يؤديه النظام، wأقصى. بالنسبة إلى تفاعل الأكسدة والاختزال الذي يحدث داخل خلية جلفانية في ظل الظروف القياسية، فإن كل العمل المنجز يرتبط بنقل الإلكترون من عامل الاختزال إلى عامل الأكسدة، welec. Thus,
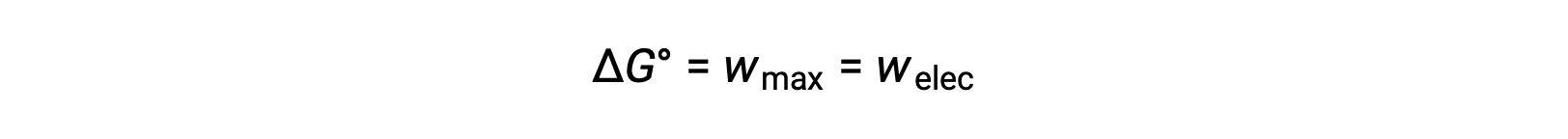
ومع ذلك ، فإن أي عمل مرتبط بنقل الإلكترون يعتمد على الشحنة المنقولة في كولوم بالإضافة إلى إمكانات الخلية:
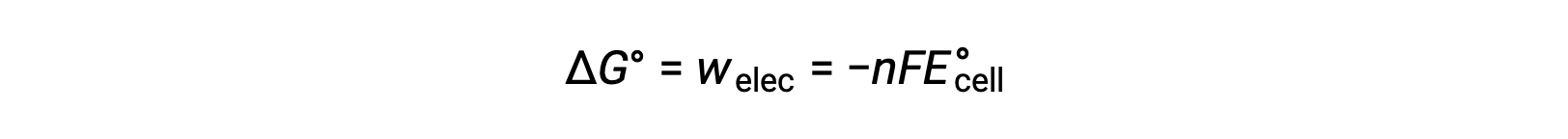
حيث n = عدد مولات الإلكترونات المنقولة، F هو ثابت فاراداي’، الذي يمثل الشحنة الكولومبية لمول واحد من الإلكترونات، و E°خلية هي إمكانات الخلية القياسية. العلاقة بين ΔG° و ΔE°خلية تؤكد اصطلاحات الإشارات ومعايير تلقائية التفاعل. تفاعلات الأكسدة والاختزال العفوية لها إمكانات إيجابية وقيم سلبية للطاقة الحرة.
العلاقة بين الخلية E°خلية و K
التغيير القياسي في الطاقة الحرة ΔG° يرتبط بثابت التوازن K لتفاعل الأكسدة والاختزال على النحو التالي:
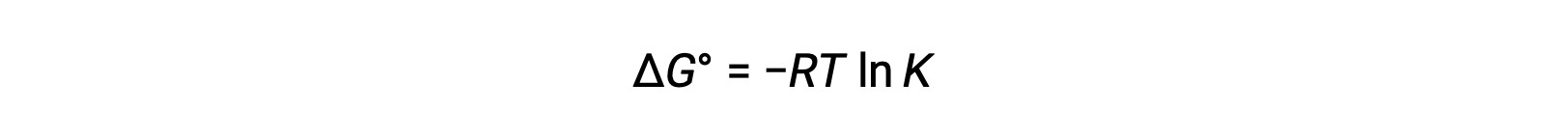
دمج علاقة مشتقة سابقًا بين ΔG° و K والمعادلة المتعلقة بـ ΔG° و E°خلية ينتج عنها ما يلي:
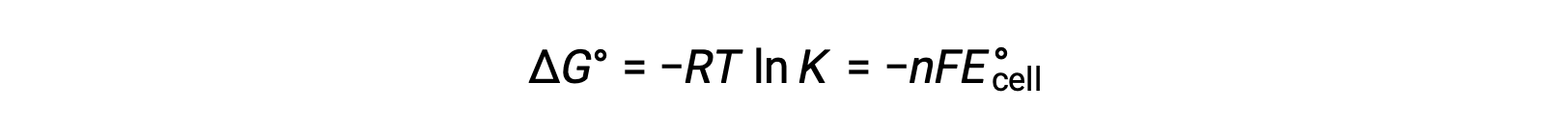
لذلك
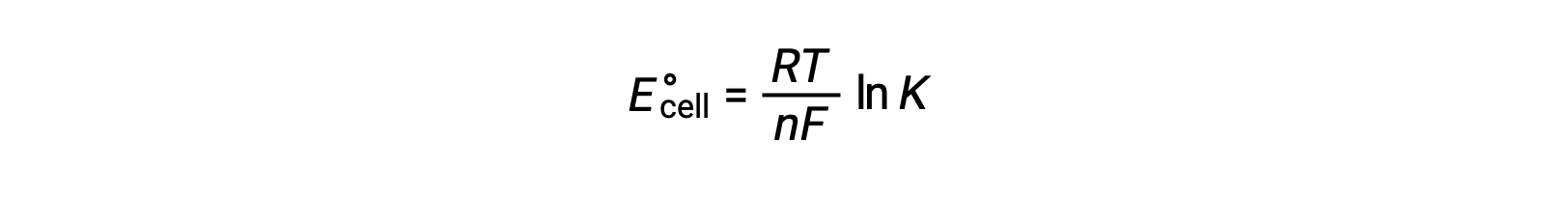
تشير هذه المعادلة إلى أن تفاعلات الأكسدة والاختزال مع إمكانات الخلية القياسية الكبيرة أو الإيجابية ستواصل نحو الاكتمال ، وتصل إلى التوازن عندما يتم تحويل معظم المواد المتفاعلة إلى منتج.
تُظهر التفاعلات أو التفاعلات غير التلقائية التي تسير في اتجاهات عكسية إمكانات خلوية سالبة وقيم طاقة حرة موجبة وثابت توازن أقل من واحد. يرتبط ثابت الاتزان لواحد وقيم إمكانات الخلية والطاقة الحرة التي تساوي صفرًا بتفاعل في ظل حالة توازن في الظروف القياسية.
يمكن أن تكون العلاقة بين جهد الخلية في ظل الظروف القياسية والثوابت الديناميكية الحرارية ΔG° و K موضح بالشكل الموضح أدناه:
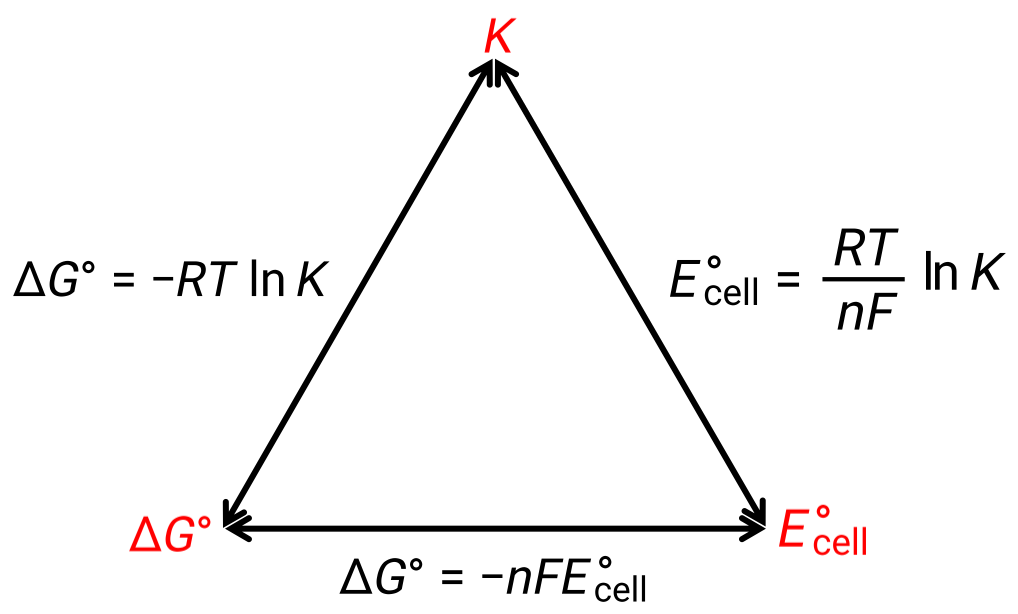
الشكل 1: رسم يوضح العلاقة بين ثلاث خصائص ديناميكية حرارية مهمة.
تم اقتباس هذا النص منOpenstax,Chemistry 2e, Section17.4: Potential, Free Energy, and Equilibrium.
Copyright © 2025 MyJoVE Corporation. All rights reserved