A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
الخلايا الجذعية الجنينية المستمدة من الخلايا البطانية لعلاج نقص التروية Hindlimb
In This Article
Summary
العملية الجراحية لتسليم الخلايا الجذعية الجنينية المشتقة من الخلايا البطانية ويتجلى في hindlimb الدماغية ، مع المنظمات غير الغازية التي تتبع التصوير تلألؤ بيولوجي.
Abstract
الشرايين المحيطية المرض (PAD) النتائج من تضييق الشرايين الطرفية التي تزود الدم المؤكسج والمواد الغذائية في الساقين والقدمين ، وهذا يسبب أعراض أمراض مثل العرج المتقطع (الألم مع المشي) ، تقرحات مؤلمة الدماغية ، أو حتى غرغرينا الأطراف للخطر. ويعتقد عموما أن بطانة الأوعية الدموية ، وهو أحادي الطبقة من الخلايا البطانية التي تستثمر سطح اللمعية جميع الأوعية الدموية واللمفاوية ، يلعب دورا مهيمنا في التوازن الأوعية الدموية وتجديد الأوعية الدموية. ربما نتيجة لذلك ، المستندة إلى الخلايا الجذعية لتجديد البطانة يكون نهجا واعدا لعلاج PAD.
في هذا الفيديو ، وندلل على زرع الخلايا الجذعية الجنينية (ESC) المشتقة من الخلايا البطانية لعلاج نقص التروية hindimb الأحادية بوصفها نموذجا للPAD ، تليها غير الغازية تتبع خلية صاروخ موجه في البقاء والتصوير تلألؤ بيولوجي. وسيتم وصف المواد وإجراءات محددة لتسليم خلية والتصوير. هذا البروتوكول يلي منشور آخر في وصفه للتحريض نقص التروية hindlimb بواسطة Niiyama آخرون 1
Protocol
1. التفريق بين المجالس الاقتصادية والاجتماعية الفئران الى الخلايا البطانية
- يوصف بروتوكول للتمييز بين المجالس الاقتصادية والاجتماعية في الخلايا البطانية في مكان آخر وليس التركيز على هذا البروتوكول 2،3. باختصار ، يسمح للخلايا للتمييز ، وتنقيته ثم الخلايا التي هي علامات ايجابية لمثل البطانية أو CD31 كادهيرين بطانة الأوعية الدموية (VE - كادهيرين) بواسطة الفرز مضان تنشيط الخلايا (FACS).
2. بناء الجينات فيوجن مراسل المزدوجة وتنبيغ Lentiviral
- يمكن استخدامها لتعقب الخلايا تلألؤ بيولوجي التي يتم تعديلها في التعبير عن الجينات مراسل luciferase مثل يراعة (fluc). لهذا التطبيق ، خلايانا تحتوي على البروتين وتعزيز fluc مضان أخضر (eGFP) الجين الانصهار تحت سيطرة المروج an اليوبيكويتين الداخلية. من أجل تعديل هذه الخلايا ، وناقلات التحوير lentiviral تحتوي على عناصر وراثية رئيسية الأمثل للوفاء بمعايير السلامة الحيوية فضلا عن زيادة الكفاءة تنبيغ ، يمكن استخدام pFU - FG ناقلات المتقدمة في مختبرنا تحمل مراسل الانصهار fluc - eGFP الجيني لستابلي تنبيغ الخلايا بعد تمايز. هذا الانصهار بناء تمكن كلا تلألؤ بيولوجي وتتبع مضان من الخلايا المزروعة. إجراءات لتوليد جزيئات الفيروس ، تنبيغ وإنتاج خلايا تسمى الجينات الموصوفة مراسل التعبير عن أماكن أخرى 4.
3. زرع ESC المستمدة من الخلايا البطانية في hindlimb الدماغية
- تبدأ في الإجراء عن طريق إعداد الفأر الذي خضع لعملية زرع نقص التروية hindlimb الخلية. للقيام بذلك ، ضع الماوس في غرفة التخدير التي تحتوي على تحريض 1-3 ٪ isoflurane في الأكسجين 100 ٪ في معدل تدفق 1L/min.
- ترك الماوس في غرفة تحريض حتى لا يستجيب للمؤثرات الخارجية. ثم إزالة الحيوان من غرفة التعريفي.
- ثم ، ضع الحيوان في موقف ضعيف على طاولة العمليات وتوصيله إلى التدفق المستمر لل1-3 ٪ isoflurane في الأكسجين 100 ٪ في معدل تدفق 1L/min.
- مسح الجلد من hindlimb مع ثلاثة betadine الدعك والكحول بالتناوب.
- بمجرد أن يتم تنظيف الجلد ، والحصول على 1000000 ESC المستمدة من الخلايا البطانية في 30 ميكرولتر من الفوسفات مخزنة المالحة (PBS). تحميل هذه الخلايا في إبرة قياس 28.
- عندما الخلايا جاهزة ، ورفع بلطف وتمديد hindlimb لتصور أفضل موقع في عضلة الساق. في حين تم تمديد الساق ، وإدراج إبرة من خلال الجلد في العضلات الأساسية. الحرص على عدم الاقتراب من العظام. برفق وببطء حقن خليط الخلية 30 ميكرولتر في الساق. عن طريق الحقن العضلي ، 30 ميكرولتر ، على مقربة من الحد من حجم التي يمكن حقنها. لذلك ، ويفضل قياس 28 المحاقن على الأنسولين ، لأنه في تجربتنا ، فإنهما ينفيان حجم الخسارة في إبر المحاقن.
- بعد حقن اكتمال عودة الماوس إلى قفص الانتعاش ومراقبة بشكل مستمر حتى يستيقظ. السماح للحيوان لاستعادة لعدة ساعات ومن ثم المضي قدما في تلألؤ بيولوجي المجراة في مجال التصوير من الخلايا المزروعة.
4. التصوير تلألؤ بيولوجي ESC المستمدة من الخلايا البطانية في الجسم الحي
- تم تعديل ESC زرع الخلايا المشتقة من endothelials للتعبير عن كل من وfluc الجين الانصهار eGFP تحت سيطرة المروج an اليوبيكويتين الداخلية. ولذلك ، يمكن استخدام تلألؤ بيولوجي لتعقب الخلايا داخل hindlimb الدماغية.
- لبدء هذه الخطوة ، تلألؤ بيولوجي بدوره على نظام التصوير والبرامج الحية الحصول على الصور. ثم تهيئة نظام الشراء وتحديد أبعاد مجال الرؤية.
- المقبل ، ورقة سوداء على مكان ماتي مربع لاستيعاب الانبعاث التصوير الخلفية.
- مرة واحدة في مربع التصوير جاهز ، ضع الماوس في غرفة التخدير التي تحتوي على تحريض 1-3 ٪ isoflurane في الأكسجين في إخراج 1L/min. ترك الماوس في غرفة تحريض حتى لا يستجيب للمؤثرات الخارجية. ثم إزالة الحيوان من غرفة التعريفي.
- إزالة الشعر من كل hindlimbs باستخدام ماكينة حلاقة كهربائية عند الضرورة.
- ضخ 10 ميكرولتر مد luciferin لكل غرام من وزن الجسم في الصفاق. استعداد مد luciferin مقدما إلى حلول تصفية المخزون من 15 ملغ / مل في برنامج تلفزيوني.
- بمجرد حقن luciferin ، ضع الحيوان في خانة التصوير أكثر من ورقة سوداء في موقف ضعيف ، متصلة التدفق المستمر للisoflurane.
- وضع الحيوانات في مربع التصوير والاتصال isoflurane.
- تبدأ في الحصول على صور عن 10-60 ثانية لتحديد الوقت الأمثل لالتعرض التي لا تشبع الصورة. إذا كانت الصورة تصبح مشبعة ، والحد من التعرض الوقت. إذا كانت إشارة تلألؤ بيولوجي ضعيف جدا ، وزيادة مدة التعرض.
- النقيبز وقت التعرض الأمثل ، ومواصلة الحصول على صور كل 1-3 دقائق حتى إشارة يصل إلى الحد الأقصى ثم يتلاشى. عند اكتمال اكتساب ، حفظ الملف.
- لتحليل البيانات ، وتحديد المناطق ذات الأهمية (رويس) التي تغطي موقع الحقن. كعنصر تحكم السلبية ، يمكن تحديد العائد على الاستثمار مماثلة للمرحلة عدم تشغيلها. باستخدام البرمجيات ، وقياس الاشعاع الكلي ، وهو ما يعبر عنه في وحدات من الفوتونات / ثانية / سم 2 / ستيراديان (ع / ق / سم 2 / ريال) ، لرويس لكل timepoint. وينبغي استخدام القيمة القصوى في البيانات النهائية. ويمكن أيضا أن تكون البيانات تصديرها إلى جدول بيانات Excel لاستخدامها في المستقبل.
- مرة واحدة يتم الحصول على كافة البيانات ، والعودة للحيوان في قفص الانتعاش ورصد مستمر حتى يستيقظ الحيوان.
- كرر هذا الإجراء لتعقب الخلايا مع مرور الوقت.
- في نقطة الوقت المطلوب ، يمكن أن يتم التخلص من الحيوانات لتقييم وظيفة الأنسجة.
5. ممثل النتائج
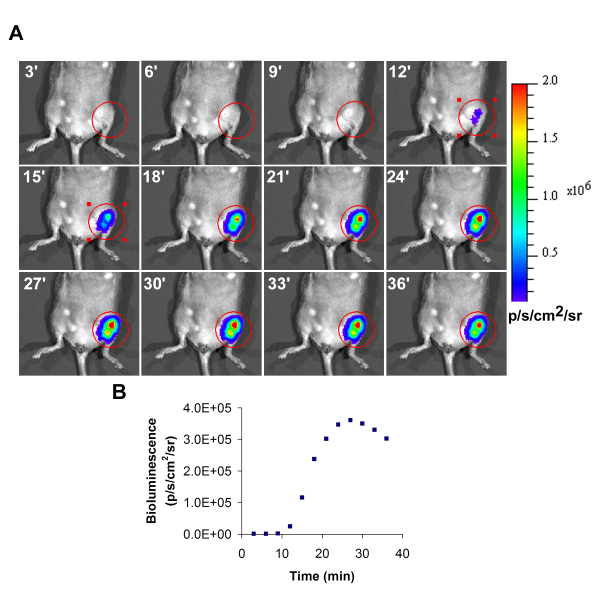
يظهر صورة تلألؤ بيولوجي ممثل الخلايا التي تم زرعها في hindlimb ونقص تروية اليسار في الشكل 1. خلال اقتناء تلألؤ بيولوجي ، فإن زيادة كثافة مع الوقت ، وينبغي الإبلاغ عن الحد الأقصى للقيمة التي تم الحصول عليها خلال الوقت كقيمة نهائية.
Discussion
المجالس الاقتصادية والاجتماعية هي مصدر الخلايا واعدة لعلاج نقص التروية الأنسجة بسبب اللدونة من التمايز وقدرتها على أن تؤدي إلى خلية تضم الأنساب كل الطبقات الجرثومية الثلاث ، بما في ذلك الخلايا البطانية. للتغلب على المخاوف الأخلاقية المرتبطة المجالس الاقتصادية والاجتماعية ، ?...
Acknowledgements
المؤلفان بالشكر اندريا Axtell ، إيتوه ساتوشي ، MD ، Velotta جيف ، MD ، هويت غرانت ، روبرت روبنز C. ، MD ، يو جين ، MD ، تيم دويل ، دكتوراه ، والتصوير ستانفورد الحيوانات الصغيرة الأساسية للحصول على المساعدة التقنية. الكتاب أيضا أن أشكر AM بيكفورد ، وشركة للحصول على الدعم من المعدات البيطرية. وأيد هذا البحث عن طريق المنح البحثية من المعاهد الوطنية للصحة (R01 HL - 75774 ، CA098303 R01 ، R21 HL085743 ، 1K12 HL087746) ، والتبغ كاليفورنيا بحوث أمراض ذات صلة برنامج من جامعة كاليفورنيا (15IT - 0257 و1514RT 0169) ، ومعهد كاليفورنيا للطب التجديدي (RS1 - 00183).
معتمد من قبل NH الزمالة من جمعية القلب الاميركية. ويمكن لجمعية القلب.
Materials
| Name | Company | Catalog Number | Comments | |
| Surgical tools | Tool | Fine Science Tools | ||
| Syringe needle | Tool | BD Biosciences | 28G insulin syringe is preferred | |
| Phosphate Buffered Saline | Reagent | Invitrogen | ||
| D-luciferin | Reagent | Biosynth International, Inc | Prepare D-luciferin in advance into filtered stock solutions of 15 mg/mL in PBS | |
| IVIS 200 Bioluminescence imaging system and acquisition software | Equipment |  Xenogen Corporation Xenogen Corporation |
References
- Niiyama, H., Huang, N. F., Rollins, M., Cooke, J. P. Murine model of hindlimb ischemia. JoVE. , (2008).
- Levenberg, S., Golub, J. S., Amit, M., Itsakovitz-Eldor, J., Langer, R. Endothelial cells derived from human embryonic stem cells. Proc. Natl. Acad. Sci. U.S.A. 99, 4391-4396 (2002).
- Yamashita, J., Itoh, H., Hirashima, M., Ogawa, M., Nishikawa, S., Yurugi, T., Naito, M., Nakao, K., Nishikawa, S. Flk1-positive cells derived from embryonic stem cells serve as vascular progenitors. Nature. 408, 926-926 (2000).
- De, A., Yaghoubi, S. S., Gambhir, S. S. Applications of lentiviral vectors in noninvasive molecular imaging. Methods Mol Biol. 433, 177-202 (2008).
- Niiyama, H., Kai, H., Yamamoto, T., Shimada, T., Sasaki, K., Murohara, T., Egashira, K., Imaizumi, T. Roles of endogenous monocyte chemoattractant protein-1 in ischemia-induced neovascularization. J. Am. Coll. Cardiol. 44, 661-666 (2004).
- Cook, M. J. The anatomy of the laboratory mouse. , (1976).
- Contag, P. R., Olomu, I. N., Stevenson, D. K., Contag, C. H. Bioluminescent indicators in living mammals. Nature Med. 4, 245-247 (1998).
- Ray, P., De, A., Min, J. J., Tsien, R. Y., Gambhir, S. S. Imaging tri-fusion multimodality reporter gene expression in living subjects. Cancer Res. 64, 1323-1330 (2004).
- Huang, N. F., Lee, R. J., Li, S. Chemical and physical regulation of stem cells and progenitor cells: potential for cardiovascular tissue engineering. Tissue Eng. 13, 1809-1823 (2007).
- Cao, F., Lin, S., Xie, X., Ray, P., Patel, M., Zhang, X., Drukker, M., Dylla, S. J., Connolly, A. J., Chen, X., Weissman, I. L., Gambhir, S. S., Wu, J. C. In vivo visualization of embryonic stem cell survival, proliferation, and migration after cardiac delivery. Circulation. 113, 1005-1114 (2006).
- Wilson, K., Yu, J., Lee, A., Wu, J. C. In vitro and in vivo bioluminescence reporter gene imaging of human embryonic stem cells. J Vis Exp. , (2008).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved