A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
مضان الفرز الخلية النباتية المنشط من Protoplasts
In This Article
Summary
ويتجلى طريقة لعزل أنواع معينة من الخلايا من المواد النباتية. تستخدم هذه التقنية خطوط علامة المعدلة وراثيا في التعبير عن البروتينات الفلورية أنواع الخلايا وجه الخصوص ، والإسفار الخلوية تفارق الفرز الخلية المنشط. بالإضافة إلى ذلك ، يتم تأسيس الإعداد النمو هنا تسهل علاج thaliana Arabidopsis الشتلات قبل الفرز الخلية.
Abstract
عالية الدقة ، الخلية نوع معين من تحليل التعبير الجيني يحسن إلى حد كبير فهم التنظيم التنموية والاستجابة للمؤثرات البيئية في أي كائن متعدد الخلايا. التهجين في الموضع والتصور مراسل الجين يمكن إلى حد محدود يمكن استخدامها لهذه الغاية ولكن لارتفاع القرار الكمي RT - PCR أو الإنتاجية العالية transcriptome على نطاق التحليل عزل الحمض النووي الريبي من أنواع الخلايا معين هو المطلوب. تفكك النسيج الخلوي معربا عن علامة بروتين فلوري في نوع من الخلايا المحددة واللاحقة الإسفار الفرز الخلية المنشط (FACS) يجعل من الممكن لجمع كميات كافية من المواد اللازمة لاستخراج الحمض النووي الريبي ، [كدنا] توليف / ميكروأري التضخيم والتحليل.
مجموعة واسعة من الخلايا نوع محدد خطوط مراسل الفلورسنت يتوفر لمحطة المجتمع البحثي. في هذه الحالة ، يتم استخدام خطوط علامة اثنين من الجذر thaliana Arabidopsis : P SCR : : GFP (endodermis ومركز هادئة) و ف WOX5 : GFP (وسط هادئة). تزرع بأعداد كبيرة (آلاف) من الشتلات hydroponically أو على لوحات أجار وحصادها للحصول على ما يكفي من المواد الجذرية لمزيد من التحليل. ويتحقق الخلوية تفارق من المواد النباتية التي الهضم الأنزيمية للجدار الخلية. هذا الإجراء يجعل من استخدام الأسمولية انفكاك الجبلة التي يسببها ارتفاع والسليلوزات المتاحة تجاريا ، وpectinases hemicellulases للافراج عن protoplasts الى حل.
FACS من GFP إيجابية الخلايا يستفيد من التصور الأخضر مقابل الانبعاثات الأطياف الحمراء protoplasts ولع ليزر 488 نانومتر. ويمكن تمييز ايجابي GFP protoplasts التي زادت نسبتهم من الأخضر إلى الأحمر الانبعاثات. عادة يتم فرز Protoplasts مباشرة في استخراج الحمض النووي الريبي العازلة وتخزينها لمزيد من المعالجة في وقت لاحق.
وكشفت هذه التقنية لتكون واضحة وقابلة للتنفيذ. علاوة على ذلك ، تبين أنه يمكن استخدامه دون صعوبة لعزل أعداد كافية من الخلايا لتحليل transcriptome ، حتى بالنسبة لأنواع الخلايا نادرة جدا (مثل خلايا مركز هادئة). وأخيرا ، أظهرت الإعداد لنمو الشتلات Arabidopsis المعاملة غير معقدة تمكن من النباتات قبل الفرز الخلية (على سبيل المثال لنوع محدد من الخلايا تحليل استجابات التوتر الحيوية أو غير الحيوية). تكميلي محتمل يستخدم لمراقبة الأصول الميدانية من محطة protoplasts تمت مناقشتها.
Protocol
1) إعداد المواد النباتية
- يمكن استخلاص العديد من Protoplasts الأنواع النباتية المختلفة والأنسجة شريطة استخدام المزيج الصحيح من جدار الخلية الانزيمات هضم 1. قبل إجراء تجربة على نطاق واسع ، والهضم الصغيرة من المواد ينصح من أجل تقييم كفاءة protoplasting من الأنسجة ، والانزيمات وغيرها ، وعلى تقدير إيجابي الخلايا في المئة لفرز الخلايا. هنا ، protoplasts المشتقة من جذور الشتلات thaliana Arabidopsis تلك الخلية من نوع خاص تستخدم تعبير الخضراء بروتين فلوري (GFP). يتم وضع علامة على endodermis وهادئة من قبل مركز SCR P : : GFP ومركز هادئة WOX5 بواسطة P : : GFP 2،3 (الشكل 1).
- تزرع الشتلات في hydroponically phytatrays (سيغما ؛ الشكل 2A) على فلتر النايلون (250 ميكرومتر شبكة ؛ NITEX) الذي يتيح للجذور النمو من خلال النمو في المتوسط (0.22 ٪ W / V Murashige وسكوغ بصل متوسطة [سيغما] ، 1 ٪ ث / ت السكروز ، 0.05 ٪ W / V زارة التربية والعلم [2 -- (N - morpholino) ethanesulfonic حامض] ، ودرجة الحموضة 5.7 مع KOH). بدلا من ذلك ، يمكن زراعة النباتات على رأس مرشح النايلون (100 ميكرومتر شبكة) في وضع عمودي لوحات أجار 1 ٪ (الشكل 2B).
- استخدام مرشحات معينات المذكور ليس فقط في موسم الحصاد من الجذور ، وتسهل أيضا من السهل معالجة إضافية من الشتلات ، وإذا رغبت في ذلك. مرشحات تسمح نقل الشتلات بشكل جماعي لphytatrays جديدة أو لوحات أجار تستكمل مع حافزا للاهتمام. على سبيل المثال ، مجموعة phytatray يصل استخدمت لتحليل نوع معين من الخلايا على الاستجابة للعلاج الترانسكربتي النيتروجين في الشتلات Arabidopsis 4.
- المجهر ضمان أن يتم التعبير بشكل صحيح علامة الخاص فلوري (خاصة عند استخدام خيار المعالجة ، باعتبارها الخلية نوع علامات محددة قد تكون أثرت نفسها من العلاج). في هذه الحالة ، يتم فحص الشتلات تحت المجهر مضان (نيكون ؛ الشكل 1). لاحظ أن يجب أن تكون خلية نوع محدد خطوط علامة فلوري في البداية تحت المجهر مبائر لتحديد بالضبط التي تحمل أنواع الخلايا وتحديد التباين في التعبير.
2) إعداد الحل protoplasting
- تذوب 1.25 ٪ ث / ت سلولاز (Yakult) ، 0.3 ٪ ث / ت Macerozyme (Yakult) ، 0.4 D - M مانيتول ، 20 ملم وزارة التربية والعلم بوكل 20 ملم (من الأسهم M 1) في المياه المنزوعة المعادن وضبط درجة الحموضة إلى 5.7 مع 1 درجة الحموضة تريس / M حمض الهيدروكلوريك 7.5. سيكون هذا الحل عكر قليلا.
- الحل الحرارة إلى 55 درجة مئوية لمدة 10 دقيقة (سيقوم بدوره حل واضح) وندعه يبرد إلى درجة حرارة الغرفة قبل ان يضيف 0.1 ٪ W / V BSA (ألبومين المصل البقري) ، و 10 ملي CaCl 2 ، و 5 ملي β - المركابتويثانول .
3) حصاد وprotoplasting من المواد النباتية
- ويتم حصاد جذور لهم عن طريق كشط قبالة شبكة النايلون مع مشرط وأودعت في قارورة تحتوي على حل protoplasting. عموما ، يتم استخدام 10 مل من محلول protoplasting في جذور الشتلات 1500.
- يهز القوارير بلطف (75 دورة في الدقيقة) في درجة حرارة الغرفة لمدة ساعة واحدة. قد وقتا أطول حضانة زيادة الغلة الجبلة المجردة لكنه سيضيف ايضا الى تأثير protoplasting نفسها على التعبير الجيني.
- تصفية حل الجبلة المجردة مع مصفاة الخلية 40 ميكرومتر دينار بحريني (فالكون) ويقسم على حل أنابيب مخروطية 15 مل دينار بحريني (فالكون).
- تدور الأنابيب في جهاز للطرد المركزي سوينغ دلو لمدة 10 دقيقة في ملاحظة أن هذا G. 500 سرعة الطرد المركزي ستتوقف على نوع protoplasts المستخدمة ، وهشاشتها ، ومبلغ من حطام خلية أنتجت خلال فترة العلاج الأنزيمية.
- إزالة معظم طاف ، وresuspend protoplasts في حل المتبقية وتفتيشها المجهر (الشكل 3).
- الاستفادة من عدادة الكريات لتقدير عدد وكثافة protoplasts. وسوف تحدد كثافة الخلية عينة سرعة الحقن ، والأحداث التي وقعت في الدرجة الثانية ، وبالتالي فإن مجموع الوقت اللازم لفرز الخلايا في نظام مراقبة الأصول الميدانية (انظر أيضا القسم 4.3).
- 3.7) إما مباشرة إلى نظام مراقبة الأصول الميدانية أو غسل وresuspend في protoplasts في محلول الحضانة ، مثل W5 (154 ملي مول كلوريد الصوديوم ، و 125 ملي CaCl2 ، 5 بوكل ملم ، 5 ملم زارة التربية والعلم ، وضبط درجة الحموضة إلى 5.7 مع كوه) أو حل دون protoplasting وأضاف الانزيمات. وخصوصا عندما تبحث في التغييرات النسخي ، فإنه من الأهمية للحد من التعرض لعينات منها للظروف التي قد تؤثر على التعبير الجيني ، مثل تغيير العازلة يتم الاحتفاظ protoplasts فيها ولذلك يوصى للحفاظ على protoplasts في حل protoplasting والمضي قدما لنظام مراقبة الأصول الميدانية في أقرب وقت ممكن.
4) الإسفار الفرز المنشط للخلية protoplasts
- تشغيل وإعداد فارز الخلايا. هنا ، يتم استخدام FACSAria دينار بحريني ().
- تشكيل تيار مع تدفق 100 متر وش ؛ فوهة م وضغط 20 رطل غمد.
- يمكن ضبط كثافة الخلايا وسرعة حقن عينة لتجربة معينة على أساس ما إذا كانت هناك رغبة في تحقيق عائد أفضل ما يمكن تحقيقه أو سرعة أسرع. لقد قمنا بفرز بنجاح مع كثافة تصل إلى 10000000 خلية / مل.
- استخدام الخيار التحريض على عينة FACS لمنع الترسيب من protoplasts. إذا كان انسداد FACS هو المشكلة ، هناك ثلاث خطوات لحل المشاكل المحتملة : 1. تنفيذ backflush عينة الخط. 2. الجبلة المجردة تمييع التعليق الخاص للحد من الكثافة. 3. تنظيف الحل الجبلة المجردة من خلال تكرار خطوة الترشيح (3.3) بعد الطرد المركزي وإعادة تعليق.
- إعداد جهاز لقياس التشتت إلى الأمام (FSC) ، مبعثر الجانب (SSC) و 530/30 في الانبعاثات نانومتر ونانومتر لGFP 610/20 لطيف أحمر تألق ذاتي (RSA) بعد الإثارة التي كتبها ليزر 488 نانومتر. هذه هي في الجوهر المعلمات الوحيدة المستخدمة لعزل GFP protoplasts إيجابية. هنا ، تم ضبط الجهد على النحو التالي : FSC -- 60V ، 250V محكمة أمن الدولة ، و335V 350V GFP RSA. علما أن إعدادات الجهد الأمثل سيكون مختلفا عن كل نظام مراقبة الأصول الميدانية ، وسوف تحتاج حتى إلى تعديل طوال عمر فارز الخلايا.
- بداية من خلال إنشاء لdotplot مبعثر إلى الأمام مقابل مبعثر الجانب. تطبيق الإعدادات الجهد بحيث تتركز الأحداث تقاس في المؤامرة.
- المقبل ، وخلق مؤامرة نقطة من الإشارات مضان أخضر مقابل الحمراء. تطبيق الإعدادات الجهد بحيث تقاس الأحداث تسفر عن تركز السكان قطري في المؤامرة عندما تبحث في تعليق من النوع البري الجبلة المجردة (غير GFP). وهناك تعليق الجبلة المجردة مشتقة من سطر علامة GFP إنتاج سكانية واضحة للأحداث الفلورية الخضراء لم يسبق له مثيل في البرية من نوع العينات.
- تعيين قيود التعويضات لضبط التداخل بين الأطياف وGFP RSA. سوف الإعدادات المناسبة القيد التعويض تسمح للأفضل فصل protoplasts GFP إيجابية من protoplasts غير GFP والحطام. القيود المستخدمة هنا هي على النحو التالي : RSA ، ناقص GFP 17.91 ٪.
- إنشاء بوابة للتعرف على أحداث GFP إيجابية ، وينبغي أن تستخدم لمراقبة سلبية غير GFP protoplasts للمساعدة في تحديد حدود البوابة (الشكل 4).
- تنفيذ قطع مبعثر إلى الأمام من أجل ترك الحطام صغيرة من التحليل. تصور أحداث GFP إيجابية في مؤامرة ضد أمن الدولة FSC للمساعدة في تحديد موضع قطع. هنا ، تم ضبط قطع في 5000. قد نلاحظ أن نظام مراقبة الأصول الميدانية سوف تحسب الحطام كأحداث الفرز وعينة لديهم مستويات عالية من الحطام في المئة لديها GFP الأحداث الإيجابية المختلفة مما كان متوقعا. هذا ليس بالضرورة مشكلة. ومع ذلك ، فإن المزيد من الحطام في العينة ، ويعد هذا النوع سوف تتخذ.
- اعتمادا على التجربة وفرة من نوع من الخلايا لتحليلها ، على وضع نظام مراقبة الأصول الميدانية الدقة سواء للالعائد الأمثل أو النقاء الأمثل للخلايا التي تم فرزها.
- لاستخراج الحمض النووي الريبي ، وإعداد مجموعة أنابيب (أنابيب microfuge 1.5 مل) مع كمية مناسبة من العازلة استخراج الحمض النووي الريبي. مع هذا الإعداد ، فإن الأحداث 20000 الفرز تسفر عن إجمالي حجم ما يقرب من 100 ميكرولتر التي تم فرزها في 350 ميكرولتر من استخراج العازلة (RNeasy الصغيرة عدة ، QIAGEN). مزيج عينات بعد الانتهاء من الفرز ويمكن أن تجمع تعليق خلية في الأعلى.
- تخزين عينات أو الانتقال مباشرة إلى RNA الاستخراج. وقد تم تحليل بريفورميد ميكروأري ناجحة مع الحمض النووي الريبي المستخرج من اقل من 500 الأحداث التي تم فرزها. هنا ، استخدمنا عدة RNeasy استخراج الصغرى (QIAGEN) ، والحفاوة WT - RNA نظام التضخيم بيكو وFL - الحفاوة [كدنا] البيوتين الوحدة V2 (NuGEN).
ممثل النتائج
واحد من حوالي 1500 phytatray SCR ف مدة أسبوع واحد من العمر : حققت الشتلات GFP حوالي 60،000 protoplasts (مقاسا عدادة الكريات). وقد تم تحديد 2.6 ٪ من 65000 الأحداث FACS المجهزة GFP بأنها ايجابية وكانت مصنفة (الشكل 4B).
ثماني لوحات من ف اربعة ايام من العمر حوالي 1500 WOX5 : حققت كل شتلة GFP (12000 الكل) حول protoplasts 30000000 (مقاسا عدادة الكريات). وقد تم تحديد 0.063 ٪ من 16000000 الأحداث FACS المجهزة GFP بأنها ايجابية وكانت مصنفة (4C الشكل).
وعادة ما تستخدم 10000 فرز الأحداث لاستخراج الحمض النووي الريبي ، ويمكن أن تسفر 20-140 نانوغرام مجموع RNA (الشكل 5).
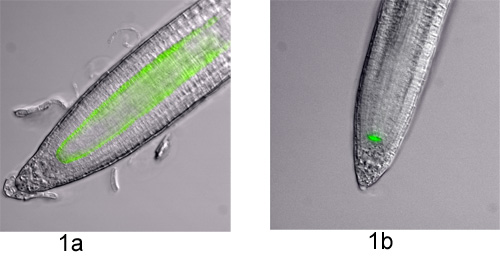
الشكل 1. واتخذت الخلية علامة GFP اكتب خطوط محددة في جذر Arabidopsis. الصور المجهري الإسفار مع النقيض تدخل الفرق (DIC) وتصفية GFP على مجهر 90i الكسوف (نيكون) يعمل على برنامج Metamorph (الأجهزة الجزيئية). وكانت مدينة دبي للإنترنت مضافين الصور وGFP لأغراض التصور. وتظهر علامة خطوط اللتين استخدمتا في هذه التجربة البصرية ؛أ) P SCR : : GFP وب) P WOX5 : GFP.

الشكل 2. كانت تزرع النباتات ظروف النمو. الشتلات في وحدة تحكم في البيئة hydroponically phytatrays (أ) أو وضعه على لوحات أجار عموديا (ب).
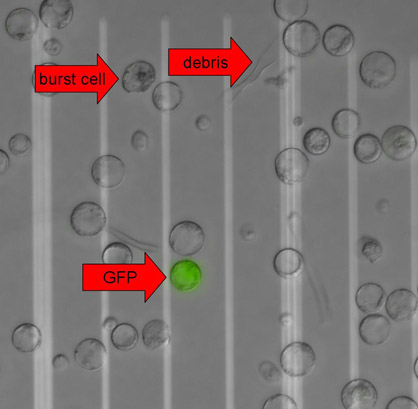
الشكل 3. protoplasts النباتية معربا عن GFP وتم التقاط صور مع المجهري الإسفار المقابل تدخل الفرق (DIC) وتصفية GFP على مجهر 90i الكسوف (نيكون) يعمل على برنامج Metamorph (الأجهزة الجزيئية). وكانت مدينة دبي للإنترنت مضافين الصور وGFP لأغراض التصور. سهام تشير إلى وجود خلية تنفجر ، والحطام الخلوي وعلى الجبلة المجردة GFP إيجابية. المسافة بين اثنين من خطوط بيضاء على بعد 50 ميكرون.
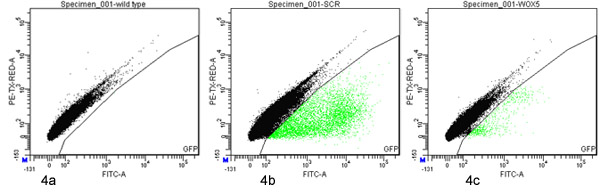
الشكل 4. مضان تنشيط الخلايا الفرز من GFP إيجابية protoplasts Protoplasts المستمدة من نوع البرية (أ) ف SCR : : GFP (ب) أو ف WOX5 : GFP (ج) تم تحليل خطوط العلامة وفرزها مع FACSAria دينار بحريني () باستخدام بوابات المعرفة على dotplot الخضراء (530 / 30 نانومتر ؛ محور س) مقابل الحمراء (610 / 20 نانومتر ؛ ذ المحور) مضان. وتعرض 100،000 الأحداث في كل قطعة. وسلط الضوء على الأحداث التي تقع في GFP بوابة الفرز الخضراء.
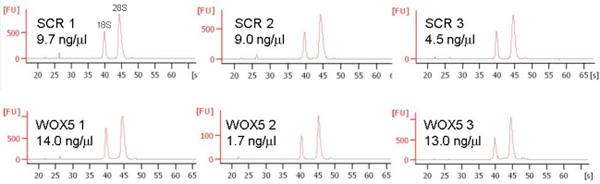
الشكل 5. ممثل RNA الاستخراج من 10،000 الخلايا التي تم فرزها. تم فرز خلايا مباشرة في استخراج الحمض النووي الريبي العازلة (QIAGEN) ، وتنقيته من الحمض النووي الريبي والتحقق من النقاء والنزاهة وتركيز على Bioanalyzer 2100 (اجيلنت). ثلاث نسخ متماثلة لكلا الخطين تظهر علامة.
Discussion
يمكن Protoplasts من حيث المبدأ ، يمكن أن تستمد من مجموعة متنوعة من الأنسجة النباتية ، وتحسين الظروف المواتية سوف يعزز كثيرا نوعية وكمية الحمض النووي الريبي. سيكون كل من حل protoplasting وحضانة الانتخابية العازلة المستخدمة تؤثر على هذا الجانب.
Acknowledgements
وأيد هذا العمل من قبل مؤسسة العلوم الوطنية (منحة رقم 0519984 DBI) ، والمعاهد الوطنية للصحة (منحة لا. 5R01GM078279)..
Materials
| Name | Company | Catalog Number | Comments |
| 250 μm nylon mesh | Sefar Filtration | NITEX 03-250/50 | |
| 100 μm nylon mesh | Sefar Filtration | NITEX 03-100/47 | |
| Square petri dishes | Fisher Scientific | 08-757-10k | |
| Phytatrays | Sigma-Aldrich | P1552 | |
| Murashige and Skoog Basal Medium (MS) | Sigma-Aldrich | M5519 | |
| sucrose | Fisher Scientific | S5-3 | |
| MES | Sigma-Aldrich | M2933 | |
| KOH | Sigma-Aldrich | P1767 | 10 M stock |
| Eclipse 90i microscope | Nikon Instruments | ||
| Cellulase R-10 | Yakult Pharmaceutical | ||
| Macerozyme R-10 | Yakult Pharmaceutical | ||
| D-mannitol | Sigma-Aldrich | M9546 | |
| KCl | Sigma-Aldrich | P8041 | 1 M stock |
| BSA | Sigma-Aldrich | A3912 | |
| β-mercapt–thanol | Calbiochem | 444203 | |
| CaCl2 | Sigma-Aldrich | C2536 | 1 M stock |
| orbital shaker | Labline Instruments | ||
| 40 μm cell strainer | BD Biosciences | 352340 | |
| conical 15 ml tubes | BD Biosciences | 352196 | |
| table centrifuge | Sorvall, Thermo Scientific | Legend RT | |
| NaCl | Sigma-Aldrich | S3014 | |
| FACSAria | BD Biosciences | ||
| 1.5 ml microfuge tubes | VWR international | 20170-38 | |
| RNeasy micro kit | Qiagen | 74004 | |
| WT-Ovation Pico RNA Amplification System | NuGEN | 3300_12 | |
| FL-Ovation cDNA Biotin Module V2 | NuGEN | 4200_12 |
References
- Sheen, J. Signal transduction in maize and Arabidopsis mesophyll protoplasts. Plant Physiol. 127, 1466-1475 (2001).
- Wysocka-Diller, J. W., Helariutta, Y., Fukaki, H., Malamy, J. E., Benfey, P. N. Molecular analysis of SCARECROW function reveals a radial patterning mechanism common to root and shoot. Development. 127, 595-603 (2000).
- Blilou, I., Xu, J., Wildwater, M., Willemsen, V., Paponov, I., Friml, J., Heidstra, R., Aida, M., Palme, K., Scheres, B. The PIN auxin efflux facilitator network controls growth and patterning in Arabidopsis roots. Nature. 433, 39-44 (2005).
- Gifford, M. L., Dean, A., Gutierrez, R. A., Coruzzi, G. M., Birnbaum, K. D. Cell-specific nitrogen responses mediate developmental plasticity. Proc Natl Acad Sci U S A. 105, 803-808 (2008).
- Bargmann, B. O. R., Birnbaum, K. D. Positive fluorescent selection permits precise, rapid, and in-depth overexpression analysis in plant protoplasts. Plant Physiol. 149, 1231-1239 (2009).
- Petersson, S. V., Johansson, A. I., Kowalczyk, M., Makoveychuk, A., Wang, J. Y., Moritz, T., Grebe, M., Benfey, P. N., Sandberg, G., Ljung, K. An Auxin Gradient and Maximum in the Arabidopsis Root Apex Shown by High-Resolution Cell-Specific Analysis of IAA Distribution and Synthesis. Plant Cell. 21, 1659-1668 (2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved