A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
A عكسية ، غير الغازية طريقة لقياس مقاومة مجرى الهواء وأخذ عينات السوائل غسل القصبات في الفئران
In This Article
Summary
القياسات المتكررة لفسيولوجيا الجهاز التنفسي القوارض وأخذ العينات من الخلايا الهوائية الملتهبة مرغوب فيها ، ولكن عموما ليست مجدية. نحن هنا تصف طريقة لتكرار intubating شفويا الفئران التي تسمح القياسات المتكررة لhyperreactivity الهوائية وأخذ العينات من الخلايا الهوائية الملتهبة.
Abstract
hyperreactivity الهوائية (AHR) القياسات وأخذ العينات الشعبى غسل السائل (BAL) ضرورية لنماذج تجريبية الربو ، ولكن إجراءات المتكررة للحصول على مثل هذه القياسات في نفس الحيوان هي عموما ليست مجدية. هنا ، علينا أن نظهر للحصول على البروتوكولات من الفئران القياسات المتكررة لAHR والقصبات عينات السائل غسيل. وقد تم الطعن الفئران الأنف سبع مرات على مدى 14 يوما مع حساسية قوية صورية أو المعالجة. قبل التحدي الأولي ، وفي غضون 24 ساعة بعد كل تحد الأنف ، تم تخدير الحيوانات نفسها ، intubated شفويا والتهوية ميكانيكيا. وتم تحديد AHR ، المقررة بمقارنة منحنيات الاستجابة للجرعة مقاومة الجهاز التنفسي (RRS) الناجم عن زيادة جرعات في الوريد من كلوريد (ACH) أستيل بين الشام وحساسية تحدى الحيوانات. بعد ذلك ، وعبر التنبيب نفسه ، كان lavaged الرئة اليسرى بحيث يمكن أن يؤديها تعداد الفرق من الخلايا الهوائية. هذه الدراسات تكشف أن القياسات المتكررة لAHR BAL وجمع السوائل ممكن من الحيوانات نفسها ، ويتم تحقيق ذلك فرط الاستجابة القصوى مجرى الهواء وكثرة اليوزينيات مجرى الهواء في غضون 7-10 أيام من بدء التحدي حساسية. هذه التقنية الجديدة يقلل بشكل ملحوظ من عدد من الفئران اللازمة لإجراء التجارب الطولية وينطبق على مختلف أنواع القوارض ، ونماذج الأمراض والصكوك الهوائية الفيزيولوجيا.
Protocol
حساسية التحدي :
- C57BL / 6 الفئران ، 4-8 أسابيع من العمر ، يتم تخدير في غرفة محكمة الإغلاق شبكي تطهير isoflurane مع 3.2 ٪ في خليط بخار الأكسجين لمدة 10 دقائق لتحقيق التخدير العام العميق.
- تدار حساسية الأنف التحديات (45μL OVA (22.5 ميكروغرام) و7μL ألف الرزية (7 ميكروغرام) ، في برنامج تلفزيوني) ، كل يوم ثلاثاء والخميس والأحد ، على ما مجموعه سبعة طلبات متتالية.
التخدير :
- قبل كل التحديات حساسية ، وبعد التحدي 7 ، تدار الفئران حقن داخل الصفاق من إيتوميدات ملغم / كغم من 48 (2 ملغ / مل) ، قبل وضعها في وعاء للضوء استبعاد.
- الموضوع لا يزال في وعاء حتى يتم الكشف عن عدم استجابة عصبية يمكن ملاحظتها عند تطبيق الضغط على الكفوف الخلفيتين (5-10 دقيقة).
التنبيب :
- مصباح مشع الحرارة ، حافظت على مسافة لضمان الحفاظ على ~ 37 درجة مئوية وينبغي تركيز حرارة الجسم الأساسية ، حول هذا الموضوع في جميع أنحاء الإجراء لمنع انخفاض حرارة الجسم. وينبغي استخدام الترمومتر الشرجي في البداية على الأقل لتأكيد euthermia بغض النظر عن مصدر الحرارة المستخدمة.
خطوات حاسمة ويتعين على جميع السوائل والأدوات التي تلقاها حيوانات التجارب تكون عقيمة ، ويجب أن يتم تنفيذ إجراءات صارمة تحت ظروف معقمة. وانخفاض حرارة الجسم لفترات طويلة تحت التخدير بينما تؤدي الى البيانات الشاذة و / أو الوفاة من الحيوانات. وينبغي تطوير كفاءة مع جميع الإجراءات الغازية باستخدام حيوانات جثي قبل محاولة العمل على الحيوانات الحية. وينبغي استخدام زيوت التشحيم العينية لمنع سحجات القرنية من الحيوانات تحت التخدير العام. - تتم إزالة تخدير الفئران من وعاء ووضعها في موقف راقد (بطني حتى الجانب) ، على طاولة مخطاط التحجم ، بعد تعديلها إلى زاوية 45 درجة.
- يتم إدراج الشريط المطاطي تطويق وراء طاولة في الصف العلوي من القواطع ذلك لتأمين هذا الموضوع في مكانه. مع ملاقط في اليد اليمنى ، وقبضة وتوسيع ورفع اللسان من الفم قبل تأمين في مكانه مع معدن خافضة في اليد اليسرى ، والسماح بالتالي لمجرى الهواء دون عوائق التنبيب.
- يتم إدراج قطرها 0.8 مم الصفحات الالياف البصرية ، وصلة لمصدر الضوء ، من خلال angiocatheter ومددت 10 مم خارج الحافة. كما استقر في خافضة مع اليد اليسرى ، وتسترشد في نهاية مضيئة في الموضوع الالياف البصرية من خلال تجويف الفم والبلعوم بواسطة اليد اليمنى حتى الحبال الصوتية والمرئية. توقيت ثم يتم تمرير الخيط تحت التصور المباشر من خلال الحبال الصوتية والمتحركة وإلى القصبة الهوائية ، لتحدث عند الحبال مفتوحة إلى الحد الأقصى.
- ثم يتم تمرير angiocatheter على مدى الصفحات الالياف البصرية في القصبة الهوائية حتى غيض القسطرة تكمن في منتصف الجزء من القصبة الهوائية. 17-22 جرام للفئران ، وهذا يتوافق مع الجزء المتبقي القسطرة 10 مم وضوحا بين الموصل والمتطرفة في الجمجمة من الفك السفلي للموضوع ق. وينبغي تحديد المبلغ الفعلي الذي يتم تمرير القسطرة عن طريق التفتيش المباشر للالقصبة الهوائية 2-3 الفئران مقسطر حجم ذات الصلة والخلفية الوراثية.
- إزالة الصفحات الالياف البصرية وأكد التنبيب ناجحة من خلال مراقبة نفسا عميقا العادية (الرحلات الايقاعي من الصدر والبطن) والذي توقف على الفور إطباق التالية من الرابط مع الإبهام. استجابة الاختناق ، بغض النظر عن إطباق الإبهام ، الأنفاس غير النظامية ، أو غيرها من علامات تدل صعوبة في التنفس من angiocatheter malpositioning وتشير عادة التنبيب المريء.
يمكن فشل الخطوة الحاسمة لعكس سرعان ما التنبيب المريء تكون قاتلة. إذا اشتبه التنبيب المريء ، ينبغي إزالتها بسرعة القسطرة وإعادة إدراجها مرة الحيوان استأنفت نمط التنفس الطبيعي. إيتوميدات هو المخدر المفضل الاقتضاء ، من جميع العقاقير المخدرة القوارض المتاحة ، وهذا العامل يثير أقل سمية القلب والأوعية الدموية (نقص ضغط الدم ، عدم انتظام ضربات القلب ، السكتة القلبية). - انخفاض الجدول مخطاط التحجم حتى بالتوازي مع العمل على مقاعد البدلاء وتحويل الموضوع 180 درجة حتى تواجه الميناء الجوي التنفس الصناعي. بدوره الحيوانية على جانبها قبل الاتصال جهاز التنفس الصناعي.
- وأكد كذلك على التنبيب ناجحة عندما ، بعد تأمين اتصال محكمة الغلق وتنشيط التنفس الصناعي (150 عاملة على الأنفاس / دقيقة ، 9 مل / ز حجم المد والجزر ، 100 الأوكسجين ٪) ، وينظر إلى رحلة thoracoabdominal مواكبة التنفس الصناعي.
الوريد سطر :
- A 10 مم ، تتم إزالة الإبرة 27ga من الموصل ، في حقنة عن طريق ذوبان مجانا ، والانحناء الإبرة 90 درجة في منتصف باستخدام ملقط معقم ومرقئ بحيث يواجه شطبة في زاوية. توصيل نهاية غير مشطوف لأنابيب PE10 المؤدية إلى الميناء رابعا الحقن.
- لمنع احتماليتم تطهير فادح الانصمام الهواء ، وأنابيب والإبرة مع 37 درجة مئوية ، وكلوريد الصوديوم 0.9 ٪ عن طريق حقنة 1 مل. يتكون الميناء حقن إبرة 27ga ، دفعت من خلال ثقب حفر في السقف من أنبوب الطرد المركزي 15ml. تملأ سقف مع مثل هذه المياه المالحة التي يتم المغمورة باستمرار نهاية الإبرة ، وبالتالي تقليل احتمال مجرور الهواء في إبر وحقن في الوريد.
- مع الماوس المتبقية تحت مصباح الحرارة ، ويتم محاذاة الإبرة في المدقع الذيلية من الذيل موازية لوعلى المنوال الجانبية. يتم تشغيل إبرة تحت الجلد قليلا ، في حين وجهت cranially بطول الوريد ق تحت الجلد ودفع إلى الانحناء. ويؤكد نجاح الرابع التنسيب من خلال مراقبة ارتجاعي الدم في أنابيب رابعا مع سحب خفيفة من المكبس المحاقن. علاوة على ذلك ، ينبغي أن يكون هناك تدفق دون عوائق من خلال خط الرابع على حقن 5-10 المالحة ميكرولتر في الوريد الذيل. لا يمكن أن تكون عرضية أوردة الذيل مقنى ثابت. في هذه الحالات ، يمكن للماوس أن استدارة 180 درجة إلى الجهة الأخرى وغيرها من الذيل الرابع عادة دون صعوبة الوصول إليها.
- بعد إزالة مصباح الحرارة من الإعداد ، تم تضمينه في الموضوع في مخطاط التحجم ، بعد ذلك المضمون وضيق في الهواء مع التطبيق من 4 المشابك.
سيكون خطوة حاسمة السماح للمصباح الحرارة لتبقى على حرارة الهواء في حجرة تغيير مخطاط التحجم ويحتمل أن تكون قياسات لاحقة من العقم RS R الرابع من الإبر والحلول يجب الحفاظ عليها. ويتم إنجاز تعقيم الإبر التي تخبط وبيغ الايثانول مع 70 ٪ تليها الشطف والتنظيف مع محلول ملحي معقم قبل الإدراج الرابع. وعلاوة على ذلك ، ينبغي تنظيف الذيل مع 70 ٪ من الإيثانول أو الكحول الآيزوبروبيل قبل الإدراج الرابع.
القياسات الهوائية المقاومة :
- يتم تحديد الكميات التي كتبها ذروة المقاومة المستمرة للحاصل DPT / V (DPT حيث هو تغير في ضغط القصبة الهوائية والخامس هو تدفق الهواء) في نقاط تساوي حجم الرئة (70 ٪ حجم المد والجزر). يتحدد DPT باستخدام محول الضغط متصلا angiocatheter القصبة الهوائية. لتحديد الخامس ، ومعايرة الضغط الاختلافات مخطاط التحجم للتغيرات في الحجم على مدى يتراوح الفسيولوجية التي شملتها الدراسة. تباين حجم مخطاط التحجم بمرور الوقت ، على النحو الذي يحسب وحدة preamp ، هو الخامس بعد إنشاء خط الأساس مستقرة R RS (<الاختلاف 5 ٪ على مدى 3 دقائق) ، وخمس جرعات متتالية (حجم 2 = وزن الجسم ميكرولتر / ز) من زيادة يتم حقن تركيز أستيل كلوريد (0.058 ، 0.18 ، 0.59 ، 1.58 و 5.8 ملغم / كغم من وزن الجسم ، في المياه المالحة 0.9 ٪ عند pH 7.4 ، حافظت على الجليد ودرجة حرارة اليد وقبل كل حقنة) خلال ثانية واحدة عن طريق الرابع ، مع كل جرعة لاحقة تديرها لدى عودته من RS R لخط الأساس ، وحتى ثلاثة اضعاف المقاومة الأساس (حوالي 12 سم H 2 O مل س س -1 ثانية ، أي زيادة بنسبة 200 ٪ في مقاومة مجرى الهواء فوق خط الأساس نموذجية من حوالي 4 سم ويتحقق H 2 O مل س س -1 ثانية). يتم حساب تركيز الاستفزازية من منظمة العمل ضد الجوع ، في ملغ / غرام من وزن الجسم ، والذي يؤدي إلى زيادة 200 ٪ في RS R من القيم الأساسية (وهو ما يسمى PC 200) ، عن طريق الاستقراء الرياضي للمنحنيات منظمة العمل ضد الجوع - R RS الاستجابة للجرعة.
- بمجرد أن يتم التوصل إلى قيم PC 200 ، والسحابات الإفراج عنهم ، وتفكيك مخطاط التحجم. ويرد أقصى 5 جرعات متزايدة من منظمة العمل ضد الجوع. مجموعة تركيز منظمة العمل ضد الجوع الواردة أعلاه هي مناسبة لتحقيق PC 200 قيم معظم سلالات الفأر السذاجة.
خطوة حاسمة عندما يتم تأسيس خط الأساس لحوالي 4 سم H 2 O س س -1 مل ثانية على شاشة مقاومة لمدة 30 ثانية ، يمكن حقن ميكرولتر 60 من العادي الرابع المالحة لتأكيد ما تم إنجازه الطائرة المناسبة للتخدير. مع التخدير الكامل ، لن يكون هناك تغيير كبير في المقاومة ؛ زيادة في المقاومة أو حركة الأطراف أو الذيل يمثل علامة على الضائقة المادية ويشير إلى الحاجة إلى تخدير إضافية. - إزالة الرابع من الوريد ثم قطع الذيل والحيوان من المروحة ، والحفاظ على مجرى الهواء عن طريق الحفاظ على البراءة قنية القصبة الهوائية في المكان. الحيوانات عرضية فشل لاستئناف التنفس التلقائي على الفور. في هذه الحالات ، يمكن تشجيع التنفس عن طريق تدليك بلطف القفص الصدري.
ويجب وضع الخطوة الحرجة التنفس العفوي قبل أن ينقل إلى غرفة الإنعاش ؛ الوفيات خلاف ذلك سيحدث. - عند استئناف التنفس التلقائي ، يتم نقل الفئران مع حقنة عادية القصبة الهوائية في مكان ، لتطهير الغرفة مع 100 ٪ O 2 والحفاظ على 37 درجة مئوية باستخدام مصباح الحرارة. في غضون 15-20 دقيقة ، والفئران والتنفس بقوة وبداية لتحريك أطرافه ، وعند هذه النقطة يمكن إزالة القسطرة والقصبة الهوائية ليالي الحيواناتنقل afely إلى أقفاصها العادية.
خطوة حاسمة لعرقلة مجرى الهواء بسهولة في الماوس اللاوعي بسبب أستيل التي يسببها فرط إفراز اللعاب ، والسبب الرئيسي للوفاة ذات الصلة اختناقا في تخدير الفئران التالية القياسات الفسيولوجية الهوائية. لهذا السبب ، يجب على قنية القصبة الهوائية تبقى في مكانها ، حتى في الفئران لا يخضع غسيل القصبات ، حتى أنهم arousable ولا ينبغي إزالتها حتى فرط salivaton قد توقف.
غسل القصبات :
- جمع السائل غسل القصبات آمنة بما فيه الكفاية عند الفئران استعادة منعكس على هفوة (~ 20 دقيقة بعد وضعهم في غرفة الإنعاش). يتم تقييم منعكس هفوة من الانزلاق برفق angiocatheter الداخل والخارج ؛ السعال واضحة أو تكافح إلى أن منعكس هفوة قد عاد.
سيكون خطوة حاسمة السماح لفترة طويلة جدا وقت الانتعاش انخفاض كبير في كفاءة العودة BAL من الفئران الفردية ، وبالتالي ، لا بد من رصد رد الفعل أسكت كل بضع دقائق ، وبعد فترة 20 دقيقة اقترح يستريح. إذا الفئران غير قادر على تحمل الإجراء غسل بسبب صحوة جزئية ، يمكن استخدام التخدير 3.2 ٪ بخار isoflurane. - يتم إدخال سلك معدني دليل التنبيب (0.5mm OD) ، مع استمرار منحنى ~ 30 درجة الموجهة إلى الفص الأيسر من الرئة ، إلى angiocatheter. متقدمة السلك دليل وangiocatheter معا في الفص الأيسر من الرئة ، بحيث القسطرة (محور مستبعد) يمتد إلى أبعد من الأسنان الأمامية بواسطة 1MM فقط.
وفشل الخطوة الحرجة لعزل الرئة اليسرى الحد بشكل كبير من المحصول ، في الوقت الذي تعزز من احتمال وفاة الحيوان. يجب توخي الحذر لضمان أن غيض من الأسلاك دليل لا يمر من خلال النهاية المفتوحة للangiocatheter. ويمكن المضي قدما في angiocathether مع طرف معدني جاحظ يؤدي وجود تمزق القصبة الهوائية وفاة ناجمة عن تمزق القصبة الهوائية. - حفظ angiocatheter في مكان ، يتم إزالة guidewire و 300 ميكرولتر من برنامج تلفزيوني (7.4 درجة الحموضة ، معقمة) يتم مسح في الرئة اليسرى عن طريق حقنة 1 مل. مباشرة بعد ، في حين وضع المكبس حقنة لخلق ضغط سلبي ، وangiocatheter ببطء (3 ق) في حين إزالة تدليك بشكل مكثف في الرئة. ومن المتوقع ان يعود BAL ميكرولتر من 100-200.
- العودة فورا الفئران lavaged إلى 37 درجة مئوية ، و 100 ٪ في حين O 2 غرفة تدليك الصدر باستمرار. الفئران مكان الى جانبهم اليسار حتى تعافى تماما (~ 20 دقيقة). ثم توضع الحيوانات في أقفاصها مرة أخرى.
التوقيت :
في الماوس ، وينبغي اتخاذ الإجراء بأكمله لا تزيد عن 1 ساعة لإنجاز : الخطوة 3-4 ، 5-10 دقيقة ؛ خطوات 21/05 ، 10 دقيقة ، الخطوة 22 ، 20-30 دقيقة ؛ خطوات 23-24 ،... 10 دقيقة. ويمكن تجهيزها مع زيادة الكفاءة والموضوعات مذهلة في البروتوكول ، ما يصل إلى 3 الفئران / ساعة.
ممثل النتائج :
hyperreactivity الهوائية في الفئران ، على النحو الذي يحدده مقاييس القيم 200 PC ، هو نتيجة لتنشيط والتجنيد إلى الرئتين من الخلايا T وإفراز خلوى IL - 135-7. وهكذا ، hyperreactivity الهوائية ليست نتيجة حتمية للتحدي مع حساسية الشعب الهوائية ، ولكن يعتمد بدلا من ذلك على حجيرة تي خلية سليمة المناعة ، والوقت المطلوب للاستجابة خلايا T للتطوير في تحديد تكرار التعرض لمسببات الحساسية. كما هو مبين في الشكل. 2A ، hyperreactivity مجرى الهواء ، كما تم تعريفها 200 PC القيم التي هي أقل بكثير بالمقارنة مع القيم الأساسية والتحديات التي وضعت بعد 5 حساسية مع زيادة كبيرة لا مزيد من التحدي بعد السادسة. وذلك لأسباب ليست مفهومة تماما ، فقد انخفض مجرى التفاعلات (PC 200 قيم زيادة) بعد التحدي حساسية الأول (الشكل 2A). اتجاهات مماثلة واضحة من خلال مقارنة منحنيات الاستجابة للجرعة لمنظمة العمل ضد الجوع الفئران نفسه (الشكل 2B). ومع ذلك ، فمن الواضح هنا أن كامل hyperreactivity مجرى تطور مفاجئ بعد التحدي حساسية الخامسة ، بحيث أصبحت الفئران أكثر من 30 أضعاف أكثر حساسية لمنظمة العمل ضد الجوع بين التحديات الرابعة والسادسة. معا ، وهذه النتائج تشير إلى أن يتم الحصول على قياسات الأكثر موثوقية من التحديات حساسية AHR بعد ستة (12 يوما) ؛ القياسات في وقت سابق timepoints من المرجح أن تسفر البيانات المتغيرة للغاية. الفئران تحدى مرارا مع الأنف السيارة (المالحة) لا تتطور hyperreactivity مجرى الهواء ، وعلى كل جرعة من منظمة العمل ضد الجوع معين ، R RS القياسات لا تختلف كثيرا عن القيم الأساسية (الشكل 3 والبيانات لا تظهر).
قبل ظهور AHR قوية ، وكان نوع من الخلايا المسيطرة على مجرى الهواء الناجم عن الحساسية على العدلات (الشكل 4). مماثلة للاتجاه لAHR ، ومع ذلك ، عززت كثرة اليوزينيات تدريجيا مع تكرار التحدي حساسية ويوزينية أصبح نوع من الخلايا المسيطرة عدديا في السائل AF BALثالثا التحدي السادس ، تتزامن مع انخفاض ملحوظ في أعداد neutrophis (الشكل 4). الضامة في البداية في زيادة عدد مع التحديات حساسية القليلة الأولى ، ويتقلب في الوفرة بعد ذلك. لم فرة اللمفاويات لا يتغير بغض النظر بكثير من عدد من التحديات وحساسية ، نظرا لأهميتها المفارقة الأساسية لهذا النموذج ، وعادة ما تكون الخلية الأقل عددا في السائل BAL.
لم قياسات مقاومة مجرى الهواء لدى الفئران تلقي التحدي لا حساسية ولا أخذ العينات BAL لا يختلف على مدى 17 يوما من التجريب. وأجريت أيضا أخذ عينات السائل BAL المتكررة في غياب قياسات فسيولوجيا التنفس أو حساسية التحدي ، وأظهرت فقط العدلة تعزيز التوظيف والبلاعم إلى الشعب الهوائية التي لم تستمر إلى ما بعد 5 أيام (لا تظهر البيانات). هذه النتائج تثبت أن neutrophilia بارزة لوحظت في الفئران حساسية تحدى هو إلى حد كبير نتيجة لهذا الإجراء ، وليس للمستضد.
في السيطرة ، PBS ، تحدى الفئران ، وقياسات مقاومة مجرى الهواء كما لم تختلف بشكل كبير مع مرور الوقت. واعتبر أيضا تعزيز البلاعم والعدلات ، ولكن ليس يوزينية والتجنيد لBAL السائل في هذه الفئران ، مماثلة لتلك التغيرات الملحوظة في فئران لم تحصل إلا على تكرار أخذ العينات السائل BAL (الشكل رقم 4 ب ، د). معا ، وهذه المعطيات تؤكد أهمية للحساسية ، وليس التلاعب مختلفة من مجرى الهواء ، لتحريض كل من حساسية التهاب الشعب الهوائية (اليوزيني) وAHR.
ويمكن توقع نتائج مماثلة باستخدام المواد المسببة للحساسية الأنف مشابهة للبروتين التي استخدمناها هنا. ومع ذلك ، العديد من المحققين للحث على استخدام ovalbumin الحساسية مرض الرئة. بعد فترة مناسبة من فتيلة أدمية أو داخل الصفاق (1-2 أسابيع) مع ovalbumin عجلت في الملح الألومنيوم ، وهو النمط الظاهري الربو قوية ، بما في ذلك hyperreactivity الهوائية ، يمكن توقع في غضون 24 ساعة بعد الطعن في الأنف واحد مع ovalbumin قابلة للذوبان.
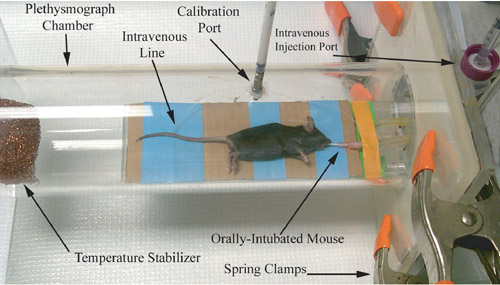
الشكل 1. التمثيل الفوتوغرافي مخطاط التحجم من القوارض ، ومباشرة قبل تسجيل مجرى القياس الفسيولوجي.

الرقم المقاومة إيرواي 2. القياسات. أ) لأغراض الإحصائية ، وتفيد التقارير antilog PC 200 القيم. ملاحظة الزيادة الكبيرة في antilog PC 200 بعد أول تحد وتقلل اللاحقة التالية مزيدا من التحديات. ب) الجهاز التنفسي مقاومة النظام (RRS) : لاحظ شدة الانحدار في منحنيات الاستجابة للجرعة ، منظمة العمل ضد الجوع بعد RRS التحديات السادس والسابع. أشرطة الخطأ تمثل SEM.
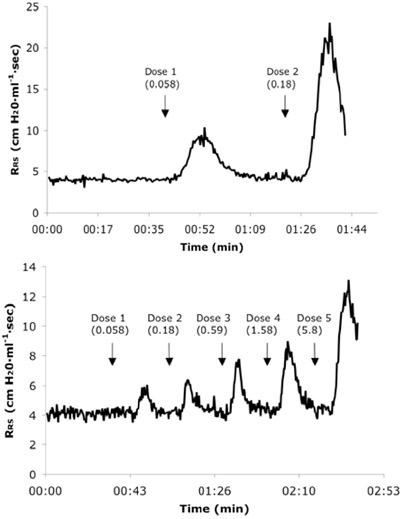
الشكل 3. الممثل في الوقت الحقيقي مقاومة الجهاز التنفسي (R RS) اقتفاء أثر من حساسية ساذجة (أ) و 6X تحدى الماوس (ب) تلقي جرعات متتالية الرابع من منظمة العمل ضد الجوع. وتعرض قيم الجرعة في ملغم / كغم من الوحدات.

الشكل 4. التفاضلية عدد الخلايا المناعية في عينات غسيل القصبات المستمدة من الرئتين الأيسر من الفئران التي عولجت مع التحديات 7 الأنف متتالية. النسبة المئوية (٪) وفرة من الخلايا المناعية في الفئران التي عولجت مع مسببات الحساسية (A) أو برنامج تلفزيوني (B). مجموع عدد الخلايا المناعية من الفئران التي عولجت مع مسببات الحساسية (C) أو برنامج تلفزيوني (D). تمثل القيم كما يعني + / -- SEM.
Discussion
دراسة الربو وانسداد مجرى الهواء ومختلف الأمراض الأخرى ، يشكل حقل نشط ، وتوسيع البحوث الطبية الحيوية. عنصرا هاما من عناصر المتعلقة بالربو البحوث التجريبية هي القدرة على قياس التغيرات في حجم مجرى الهواء تحت ظروف مختلفة. تضييق مجرى الهواء المفرط في الاستجابة لتحدي است?...
Acknowledgements
نشكر الدكتور جورج Mintzer لاقتراح إجراء التنبيب فموي رغامي الالياف البصرية. بدعم من المنح U19AI070973 ، R01AI057696 ، K02HL75243 وR01HL082487 من المعاهد الوطنية للصحة.
Materials
وكان مجرى القياس الفسيولوجي البرنامج (Rescomp) مخصص أعدت (رئيس المجموعة للألفية ؛ 415-519-4371).
وتم تحليل البيانات باستخدام محطة عمل كمبيوتر يعمل بنظام التشغيل ويندوز إكس بي ومجهزة وحدة المعالجة المركزية بنتيوم الثالث (إنتل ، وشركة سانتا كلارا ، كاليفورنيا) والتناظرية 17 - pin لتحويل الاشارات الرقمية (صكوك الوطنية ، # PC - LPM16).
وكان من محطة صغيرة فسيولوجيا الحيوان الهوائية المخصصة تجميعها (الألفية رئيس الفريق) باستخدام محولات الضغط المتاحة تجاريا (الجزء # TRD5700 وTRD4510) ، وحدات preamp (الجزء # MAX2270) ، هيكل (الجزء # MAX1320 ، وكل من شركة Buxco يلمينغتون ، نورث كارولاينا ) والمخصصة مخطاط التحجم الحيوانات الصغيرة.
0.5mm الخارجية القطر الصفحات الألياف البصرية ، وصلة لمصدر الضوء (كول بالمر المنور ، سلسلة 41722)
منفسة (جهاز ماوس مروحة هارفارد ، # 687)
10 ملم وإبر 27ga دينار بحريني (العلوم البيولوجية ، والقط. رقم 309602)
حرارة المصباح
1 مل حقنة دينار بحريني (العلوم البيولوجية ، والقط. رقم 305109)
4 المشابك (المهر المشبك ربيع 3200)
0.5 ملم سلك خارجي لدليل التنبيب
عدادة الكريات
شرائح مجهرية Superfrost / الجمع (فيشر القط. رقم 12-550-15)
Shandon تصفية بطاقات (الحرارية القط. رقم 5991022)
الفرق الشريحة الخلية وصمة عار (فيشر القط. رقم 122911)
مجهر ضوئي (لايكا)
Cytospin 3 (Shandon)
20 GA ، 1.25 بوصة ProtectIV القسطرة الوريدية (سميث الطبية)
الألياف الضوئية 0.5 مم البوليمر (ادموند البصريات # NT02 - 532).
References
- Hamelmann, E. Noninvasive measurement of airway responsiveness in allergic mice using barometric plethysmography. Am. J. Respir. Crit. Care Med. 156, 766-775 (1997).
- Adler, A., Cieslewicz, G., Irvin, C. G. Unrestrained plethysmography is an unreliable measure of airway responsiveness in BALB/c and C57BL/6 mice. J. Appl. Physiol. 97, 286-292 (2004).
- Bates, J. The use and misuse of penh in animal models of lung disease. Am. J. Respir. Cell Mol. Biol. 31, 373-374 (2004).
- Lundblad, L. K., Irvin, C. G., Adler, A., Bates, J. H. A reevaluation of the validity of unrestrained plethysmography in mice. J. Appl. Physiol. 93, 1198-1207 (2002).
- Grunig, G. Requirement for IL-13 independently of IL-4 in experimental asthma. Science. 282, 2261-2263 (1998).
- Corry, D. B. Requirements for allergen-induced airway hyperreactivity in T and B cell-deficient mice. Mol. Med. 4, 344-355 (1998).
- Corry, D. B. Interleukin 4, but not interleukin 5 or eosinophils, is required in a murine model of acute airway hyperreactivity. J. Exp. Med. 183, 109-117 (1996).
- Amdur, M. O., Mead, J. Mechanics of respiration in unanesthetized guinea pigs. Am J Physiol. 192, 364-368 (1958).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved