Method Article
دراسة ديناميكية بتكوين جزئي للبروتينات الغشاء في الموقع مع الموقع الموجه وصفها الإسفار
In This Article
Summary
سنقوم بشرح طريقة الذي يقيس حركية النقل ايون للبروتينات غشاء جنبا إلى جنب مع مواقع محددة تحليل التغيرات متعلق بتكوين باستخدام مضان على الخلايا واحد. هذه التقنية هي قابلة للتكيف مع القنوات الأيونية ، ومضخات نقل أيون ويمكن استخدامها لتحديد المسافة بين القيود مفارز البروتين.
Abstract
الجهد الكهربائي اثنين المشبك الكهربية (TEVC) هو أداة قوية لتحقيق آلية ايون transport1 لطائفة واسعة من البروتينات الغشاء بما في ذلك قنوات ايون 2 ، 3 مضخات ايون ، والنقل 4. تضافرت التطورات الأخيرة في مواقع محددة إلى جانب العلامات fluorophore TEVC لدراسة ديناميات بالتزامن بتكوين جزئي في وظيفة محددة ، وبقايا من هذه البروتينات على سطح الخلايا واحد.
سنقوم بشرح طريقة لدراسة ديناميات بتكوين جزئي للبروتينات غشاء من خلال رصد التغيرات في وقت واحد ومضان الحالي باستخدام الجهد المشبك قياس التألق. ويمكن استخدام هذا الأسلوب لفحص الحركة الجزيئية للبروتينات غشاء الموقع تحديدا استبدال السيستين التالية وموقع الموجه fluorophore 5،6 الوسم. وعلاوة على ذلك ، وهذه الطريقة توفر نهجا لتحديد المسافة بين بقايا القيود المحددة 7،8. ويتحقق ذلك عن طريق ربط الجهات المانحة بشكل انتقائي ومتقبل لاثنين من مخلفات fluorophores السيستين تحولت من الاهتمام.
باختصار ، يتم تنفيذ هذه التجارب التالية التعبير الفنية المطلوبة من البروتين على سطح leavis القيطم البويضات. مساحة كبيرة من هذه البويضات وظيفية تمكن القياسات السطحية وإشارة قوية مضان 5. ومن الممكن أيضا لتغيير الأوضاع بسهولة خارج الخلية مثل يجند ، ودرجة الحموضة أو الكاتيونات / الأنيونات ، والتي يمكن أن توفر مزيدا من المعلومات عن آلية للبروتينات غشاء 4. أخيرا ، مكنت التطورات الأخيرة أيضا للتلاعب من الأيونات الداخلية حدد التالية شاركت في التعبير مع بروتين الثانية 9.
يوصف بروتوكول لدينا في أجزاء متعددة. الأولى ، شرع الطفرات السيستين المسح بواسطة اكتمال وضع العلامات على مخلفات fluorophore يقع في واجهة من والمجالات عبر الغشاء خارج الخلية. وتهدف التجارب اللاحقة للتعرف على بقايا التي تبين التغيرات الكبيرة في كثافة مضان (<5 ٪) 3 عند تغيير متعلق بتكوين جزئي من البروتين. الثانية ، وتتم مقارنة هذه التغييرات في كثافة مضان لمعلمات الحركية للبروتين الغشاء من أجل ربط ديناميكية بتكوين جزئي إلى وظيفة البروتين 10. وهذا يتيح إجراء تحليل دقيق للاقتراح البيوفيزيائية الجزيئي للبروتين الهدف. أخيرا ، يمكن أن يكون المسمى two مخلفات عميم الإنزيم مع الجهات المانحة وfluorophore متقبل من أجل تحديد القيود المسافة باستخدام أساليب الأنحلال الضوئي المانحة. ومن الممكن أيضا لرصد الحركة النسبية للمفارز البروتين العلامات التالية مع الجهات المانحة وfluorophore المتقبلة.
Protocol
1. بروتين التعبير
استنساخ بروتينات غشاء الفائدة الى ناقلات مناسبة للتعبير القيطم البويضة المورق مثل pTLN 11 أو 12 pSG01MX. ناقلات الأمثل تحتوي على 5 'و 3' القيطم المورق β - غلوبين المناطق غير مترجمة 11،12 ، وهو موقع قيود فريدة من نوعها ، وموقع مروج RNA الموجود قبل UTR 5 '11. هذه المكونات مطلوبة للتعبير الأمثل في البويضات ، الخطية من قبل البلازميد التوليف مرنا مرنا والتوليف ، على التوالي.
2. السيستين الطفرة
- يعمل مؤامرة Kyte - دوليتل لتحديد المجالات عبر الغشاء من البروتين المستهدفة باستخدام تسلسل البروتين من الأحماض الأمينية (ProtScale ، ExPASy) 13. يتم عرض البيانات كما hydrophobicity مقابل رقم التسلسل. من المرجح العثور على البقايا التي تعرض القيم الإيجابية في المجال عبر الغشاء. استخدام هذا المخطط لتحديد بقايا الأكثر احتمالا التي تقع في واجهة بين خارج الخلية عبر الغشاء والمجالات التي سيتم تحولت إلى السيستين. كما لا يمكن تحديد واجهة المجال والمنطقة خارج الخلية عبر الغشاء يمكن التنبؤ به بيقين كامل المؤامرة Kyte - دوليتل ، فمن المهم أن تدرس مجموعة من المخلفات التي من المتوقع أن تكون في الواجهة. تم اختيار هذه المنطقة من البروتين للحركة وتوقع من التغيير متعلق بتكوين fluorophore.During ، سوف تنقل بين fluorophore بيئة المائية ومسعور أو بين تبريد المزيد من المياه والبيئة أقل تبريد المياه. ولكل من هذه التغيرات المتوقعة في البيئة نتيجة تغير في كثافة مضان.
- ويستخدم الموقع QuickChange - تطفير موجه كيت (Stratagene) لإنشاء واحد يبني السيستين يمكن الوصول إليها خارج الخلية. باختصار ، مزيج 5 ميكرولتر من رد فعل العازلة 10X ، 2 ميكرولتر من الحمض النووي نانوغرام / 5 ميكرولتر البلازميد ، 1.25 ميكرولتر كل من الأمام نانوغرام / ميكرولتر 100 و التمهيدي العكسي ، 1 ميكرولتر من dNTP (100 ملم) ، و 39.5 ميكرولتر من المقطر المزدوج الماء. أخيرا ، إضافة 1 ميكرولتر من الحمض النووي بوليميريز PfuTurbo (Stratagene). وينبغي تصميم الاشعال المستخدمة لهذه الخطوة مع الطفرة السيستين في جامعة النجاح مخلفات خارج الخلية من الفائدة.
- برنامج cycler الحرارية للمواصفات التالية : 1 دورة في 95 درجة مئوية لمدة 30 ثانية ، 12-18 درجة مئوية في دورات لمدة 30 ثانية 95 و 55 درجة مئوية لمدة 1 دقيقة ، و 68 درجة مئوية لمدة 1 دقيقة لكل كيلوبايت البلازميد. ويتم احتساب درجة الحرارة الصلب (55 درجة مئوية) مباشرة من درجة حرارة انصهار كل التمهيدي. يمكن برمجتها والخطوة النهائية لعقد درجة حرارة 4 درجات مئوية إذا أجري التفاعل بين عشية وضحاها. عدد دورات تعتمد على الطفرات. 12 دورات لاستخدام الطفرات نقطة و 16 دورات للتغيير حمض أميني واحد ، أو 18 دورات لعدة ملاحق من الأحماض الأمينية.
- إضافة 1 ميكرولتر من DpnI (نيو إنجلاند Biolabs) إلى خليط التفاعل ، من خلال مزيج pipetting ، وأجهزة الطرد المركزي (6000 دورة في الدقيقة) لمدة 1 دقيقة. احتضان لمدة 1 ساعة بمعدل 37 في حمام مائي درجة مئوية.
- ذوبان الجليد أكبر 10 الكهربائية المختصة الخلايا (Invitrogen) على الجليد واحتضان وسائل الاعلام العقيمة SOC (20 ملغ / مل تريبتون ، 5 خلاصة الخميرة ملغ / مل ، 1 ملغ / مل كلوريد الصوديوم ، 0.4 ملغ / مل بوكل ، 0.02 م 2 + المغنيسيوم ، 0.02 M الجلوكوز ، ddH2O) عند 37 درجة مئوية لحين الحاجة إليها. قسامة 20 ميكرولتر من الخلايا في أنابيب الطرد المركزي 1.5 مل وإضافة 1 ميكرولتر من الحمض النووي للخلايا هضمها.
- ملء الخلوي Porator (تكنولوجيا الحياة) مع الماء المثلج ، تعيين السعة إلى 330 μF ، نسبة الرسوم على الصوم ، والمقاومة على الجهد الداعم إلى 4 أوم.
- ماصة 20 ميكرولتر من الحل خلية / الحمض النووي في الخلايا porator cuvettes. ضع cuvettes في Porator سيل ، أغلق الغطاء وتوصيل سلك الكهرباء ، وتحويل الطلب الى كفيت الصحيح. تعيين امدادات الطاقة لشحن والانتظار "حتى" حتى يقرأ الجهد 430. بدوره الطلب لتسليح وتحريك الصحافة. إذا كان هناك صوت تفرقع ، أعد محاولة electroporation.
- ماصة الخلايا من كفيت ونقلها إلى 1.5 مل من وسائل الاعلام SOC. احتضان مقابل 1.5 ساعة عند 37 درجة مئوية مع الهز.
- نقل 30 ميكرولتر من الحل SOC / خلية لLB / لوحات أجار الأمبيسيلين (10 ملغ / مل تريبتون ، خلاصة الخميرة 5 ملغ / مل ، 10 ملغ / مل كلوريد الصوديوم ، و 15 ملغ / مل آغار ، DDH O 2 و 100 نانوغرام الأمبيسيلين / ميكرولتر ). انتشار الخلايا على لوحة واحتضان لوحة عند 37 درجة مئوية خلال الليل.
- المستعمرات الحصاد واحدة من لوحات وتطعيم 5 مل تحتوي على الثقافات LB / الأمبيسيلين (10 ملغ / مل تريبتون ، خلاصة الخميرة 5 ملغ / مل ، 10 ملغ / مل كلوريد الصوديوم ، و 100 نانوغرام / ميكرولتر الأمبيسيلين DDH 2 O) وسائل الإعلام. هزة في 37 ساعة ل16-20 درجة مئوية.
- تنفيذ miniprep الحمض النووي باستخدام عدة Nucleospin البلازميد (Macherey - ناجل). دراسة المنتج من قبل نوعيا هلام إستشراد agarose. Quantitiate العائد من الحمض النووي باستخدام 2000c Nanodrop الطيف (الحرارية العلمية).
- التحقق من الطفرة التي الإدراج تسلسل الحمض النووي.
"jove_title"> 3. مرنا التجميعي
- ليصبح خطي من الحمض النووي ، وهضم 3 ميكروغرام من الحمض النووي البلازميد في 50 L حجم التفاعل مع العازلة المناسبة ميكرولتر 5 و 1 ميكرولتر من انزيم التقييد لمدة 1 ساعة بمعدل 37.0 درجة مئوية.
- PCR باستخدام المنتج الرفيع الصرفة تنقية كيت (روش العلوم التطبيقية) ، إضافة 350 ميكرولتر العازلة ملزمة للهضم وقارورة دوامة لفترة وجيزة. وتستخدم هذه المجموعة لأنها تحتوي على guanidiniumisothiocyanate الذي يجعل الرنا الصف المنتج.
- مكان الأعمدة تدور في أنابيب جمع وتحميل العمود مع حل هضم الحمض النووي. ز الطرد المركزي في 18000 لمدة 20 ثانية وتجاهل من خلال تدفق.
- إضافة 500 ميكرولتر من غسل العازلة إلى العمود. أجهزة الطرد المركزي في 20 ثانية 18000 جم وتجاهل من خلال تدفق.
- إضافة 200 ميكرولتر من غسل العازلة إلى العمود. الطرد المركزي 30 ثانية أو حتى العمود الجاف في 18000 ز
- مكان العمود تدور في تعقيمها 1.5 مل أنبوب الطرد المركزي ، وإضافة 50 ميكرولتر من DEPC المياه المعالجة إلى العمود. أزل بواسطة الطرد المركزي لمدة 30 ثانية عند 18000 جرام.
- تركيز الحمض النووي eluted إلى ما يقرب من 15 ميكرولتر الذي ينتج 0.5 ميكروغرام في 3 ميكرولتر من الحل.
- اختيار الصحيح mMessage mMachine كيت (Ambion) وفقا لتسلسل موقع المروج في الحمض النووي البلازميد (SP6 ، T7). إضافة 5 ميكرولتر 1 NTP الحد الأقصى للمزيج ، 3 DNA خطي ميكرولتر من الخطوة السابقة ، 1 ميكرولتر العازلة النسخ ، و 1 ميكرولتر من بوليميريز RNA المناسبة. لاحتضان 1،5-2 ساعة في 37 درجة مئوية.
- إضافة 12.5 ميكرولتر من LiCl من المجموعة ، 15 ميكرولتر DEPC الماء ، لفترة وجيزة مزيج (لا الدوامة) ، الطرد المركزي في 11000 ز لمدة 10 ثانية ، وتخزينها في -20 درجة مئوية لمدة لا تقل عن 30 دقيقة هطول الأمطار.
- بارد قبل الطرد المركزي إلى 4 درجات مئوية ، وأجهزة الطرد المركزي لا يقل عن 15 دقيقة بأقصى سرعة بعد هطول الأمطار.
- بعد الطرد المركزي يجب أن بيليه البني تكون مرئية في الجزء السفلي من الأنبوب. بعناية وبشكل كامل إزالة طاف وإضافة 150 ميليلتر من الإيثانول 70 ٪ RNA يتم تبريده الى درجة -20 درجة مئوية. الطرد المركزي في 4 درجة مئوية لمدة 5 دقائق بأقصى سرعة.
- إزالة طاف تماما ، لفترة وجيزة الجافة (1-2 دقائق) في بلاس Vacufuge إيبندورف ، وحل بيليه الأبيض الآن في 12 ميكرولتر من المياه DEPC. Quantitiate العائد من مرنا باستخدام 2000c Nanodrop الطيف (الحرارية العلمية).
4. إزالة البويضة
- وقد تم اعتماد هذا البروتوكول من قبل العناية WPI الحيوانية في اللجنة المؤسسية والاستخدام.
- قبل العملية ، ينبغي أن صام الضفدع لمدة 12 ساعة لمنع القيء أثناء الجراحة.
- جعل حل 0،5-3،0 ز MS - 222 المذاب في الماء. إضافة بيكربونات الصوديوم حتى الحل 7،0-8،0 درجة الحموضة. MS - 222 يستخدم كمخدر للضفدع أثناء الجراحة. من المهم أن ترتدي قفازات النتريل في جميع الأوقات أثناء التعامل مع MS - 222 ، وإعداد الحل تحت غطاء الكيميائية
- تزج الضفدع في حل MS - 222 حتى الضفدع فقدت المقوم وردود الفعل قرصة أخمص قدميه. للتأكد من تجاوب ، قرصة إصبع القدم من الضفادع.
- مكان الضفادع على الجانب الظهري على الجانب ماصة لوحة حفاضات الرطب. يتجنب هذا الضرر على الجلد من الضفادع. الحفاظ على منشفة ورقية مبللة على مقربة من الضفادع في كل الأوقات ، كما يجب أن تبقى رطبة طوال الضفدع الجراحة. إذا نظر الضفدع مفتوحة ، فمن المهم أن يبلل لهم محلول ملحي. اذا كان الضفدع تظهر علامات الصحوة ، من أجل حل مخدر على الضفدع وانتظر حتى يصبح ضفدعة لا يستجيب. تنفيذ قرصة إصبع القدم الثاني قبل مواصلة الإجراء.
- إجراء شق صغير الجوف العام إلى اليسار أو اليمين من خط الوسط والضفدعة. وينبغي بذل شقوق على الجانبين بالتناوب مع جراحات لاحقة.
- جلب المبيض إلى السطح الخارجي للضفدع وإزالة المبيض. تجنب لمس المبيضين لجلد الضفدع. إذا كان النزيف يحدث ، والضغط مع تلميح - Q عقيمة حتى يتوقف النزيف.
- خياطة الفتحة باستخدام نمط خياطة توقف مع 3،0-4،0 Ethicon مواد خياطة الجروح Vicryl (جونسون آند جونسون). عندما خياطة ، واستخدام الأدوات الجراحية لربط one عقدة في وقت وتجنب ملامسة جلد الضفدع. من المهم أيضا إلى الجوف العام للخياطة وطبقات الجلد بشكل منفصل. وهذا يتفق مع المبادئ التوجيهية لمعاهد الصحة القومية البيض والحصاد في البويضة المورق القيطم (انظر : http://oacu.od.nih.gov/arac/XenopusOocyte_101007_Fnl.pdf ).
- بعد الجراحة ، يجب أن لا تخضع لعملية الضفدع لا يقل عن 2 أشهر. وينبغي أيضا أن تحدد إذا كان الضفدع يتمتع بصحة جيدة بما يكفي للخضوع لعملية جراحية لاحقة. يمكن إجراء جراحات الحد الأقصى من 6 على كل ضفدع مع محطة ال 6 يجري عملية جراحية.
5. Defoculation البويضة وحقن مرنا
- وينقسم الفص المبيض معزولة بالمقص إلى أجزاء أصغر. يتم نقل كتل في محلول رينغر كا + 2 + مع كولاجيناز (8.6ز / لتر كلوريد الصوديوم ، 0.3 غرام / لتر بوكل ، و 0.33 جم / L CaCl 2).
- يهز بلطف حل هضم لمدة 2 ساعة على 18 درجة مئوية. إذا كان يتم فصل معظم البويضات ، وغسل البويضات مع حلول رينغر -- كا 2 + (8.6 غرام / لتر كلوريد الصوديوم و 0.3 بوكل ز / لتر). احتضان البويضات لمدة عشر دقائق في محلول رينغر -- كا 2 +.
- نقل البويضات في محلول رينغر + 2 + كا.
- حقن البويضات مع 25 نانوغرام من مرنا ، في الحجم النهائي من 50 NL مع Nanoject الحاقن التلقائي نانولتر الثاني (دروموند) ، مع 3.5 "الأنابيب الشعرية دروموند ملاحظة : كمية مرنا يختلف وفقا للبروتين الهدف.
- بعد البويضات ، وحقن احتضان 3-7 أيام في محلول رينغر (90 ملي مول كلوريد الصوديوم ، 2 مم بوكل ، 5 اجتماعات الأطراف ملم ، 2 ملم CaCl 2 ، ودرجة الحموضة 7.4) و 1 ملغ / مل الجنتاميسين على 18 درجة مئوية في الظلام 8
6. مواقع محددة وصفها الإسفار
- قبل القياس ، واحتضان لمدة 45 دقيقة البويضات في العازلة تحميل (110 ملي مول كلوريد الصوديوم ، سترات الصوديوم 2.5 ملم ، و 10 ملي اجتماعات الأطراف / تريس عند pH 7.4) و 45 دقيقة في مرحلة ما بعد تحميل العازلة (100 ملي مول كلوريد الصوديوم ، CaCl 2 1 ملم ، 5 BaCl 2 مم ، 5 مم NiCl 2 ، و 10 ملي اجتماعات الأطراف / تريس عند pH 7.4) لزيادة تركيز الخلايا نا + 14.
- لقياسات مضان ، البويضات في احتضان منطقة عازلة بعد التحميل الذي يحتوي على 5 ميكرومتر من fluorophore المطلوب [السابقين. tetramethylrhodamine - 6 - maleimide (TMRM) أو فلوريسئين - 5 - maleimide (FM)] لمدة 5-10 دقائق. بعد وضع العلامات fluorophore ، وغسل البويضات باستفاضة مع العازلة بعد تحميل صبغة خالية 3.
7. الكهربية
- جعل microelectrodes عن طريق سحب البورسليكات الشعيرات الدموية (1B150F - 4 ، الآلات الدقيقة الدولي) باستخدام مجتذب micropipette (النموذجي PC - 10 ، Narishige). ملء مع أقطاب بوكل م 3 واختبار المقاومة. وينبغي أن يكون بين المقاومة 0،5-1،5 MΩ 15.
- تجهيز مضان المجهر (كارل زايس ، محوري مجهر الإسفار ممتحن) مع تصفية 535DF50 الإثارة ، وهو 565 EFLP الانبعاثات التصفية ، ومرآة مزدوج اللون 570DRLP (أوميغا الضوئية) لتجارب السيستين المسح.
- وضع البويضة في غرفة RC - 10 (وارنر صكوك) على المسرح مضان المجهر برفق وإدراج الأقطاب ملفقة في البويضة. باستخدام توربو تك - 05X مكبر للصوت (NPI الإلكترونيات) ، عقد في غشاء المحتملة قيمة ثابتة وقياس تدفق الأيونات عبر غشاء تبادل الحل التالي أو عن طريق تغيير محتمل الغشاء. لقياسات مضان المتزامنة ، استخدم التنغستن W 100 مصدر للضوء لإثارة fluorophore المانحة وPIN - 022A الضوئي (تكنولوجيز المتحدة الكاشف) للكشف عن تغيرات في كثافة مضان. كل من مكبر للصوت والضوئي وتفاعل ، عن طريق نظام 1440A Digidata الحصول على البيانات (أكسون صكوك) ، مع جهاز كمبيوتر باستخدام pCLAMP10 البرمجيات (أكسون صكوك) للحصول على البيانات وتسجيلها.
- لمسح السيستين ، وقياس التغير في كثافة مضان في خطوات ثابتة الحالي باستخدام التيار الكهربائي التي يتم التحكم فيها بواسطة برنامج pCLAMP 10 (الأجهزة الجزيئية). اعتمادا على بروتين غشاء الفائدة ، وصمم لضمان حل خارج الخلية الحالية ثابتة.
- ربط التغيرات في كثافة مضان لقياسات وظيفية من البروتين المستهدفة.
8. تباين القياسات وتحديد المعوقات المسافة.
- وينبغي اتخاذ جانب تباين القياسات قياسات المسافة 8 لحساب مجموعة من القيم 2 κ. تباين التدابير التنقل النسبي للfluorophore الاعتبار الواجب للتناوب 16. باستخدام مرشحات الاستقطاب (لينوس الضوئيات شركة) ، وقياس الضوء المتوازية والمتعامدة التي تنبعث من وزير الخارجية أو الإثارة TMRM التالية مع الضوء المستقطب في مخلفات الأحماض الأمينية في المصالح. يتم أخذ القياسات في ظل ظروف الصرف حل دائم 8 و غشاء المحتملة لتحديد التنقل من fluorophores.
- وتعطى عن طريق تباين ص = (I | | I - ⊥) / (أنا | | + 2I ⊥) حيث كنت | | هو الضوء المنبعث موازية وأنا ⊥ هو الضوء المنبعث عمودي 16. لحساب الخطأ في القياسات عن بعد ، وبحد أقصى 2 κ = 2 / 3 (1 + F الثالث + F + را 3F الثالثة * F RA) وκ 2 دقيقة = 2 / 3 (1 -- (F + F را الثالثة) / 2 ) حيث F = الثالثة (ص د / ص س) 0.5 و F = را (ص أ / ص س) 0.5 ؛ ص A هو تباين من TMRM ، ص د هو تباين في وزير الخارجية ، وس ص هو تباين الأساسية لكل fluorophore 8 .
- لقياس المسافة القيود ، واستخدام عميم الإنزيم الذي فقد اثنين من الوصول RESID السيستين خارج الخليةUES. كما سيتم عقد البويضات في غشاء المحتملة مستمر وثابت بعد ذلك خلال القياسات ، وأنه لا حاجة إلى أن يكون التغيير مضان بوصفها وظيفة للدولة بتكوين جزئي من البروتين. في تطور البويضات في العازلة تحميل آخر يحتوي على 1 ميكرومتر FM (متقبل fluorophore) و 4 TMRM ميكرومتر (fluorophore المانحة) لمدة 30 دقيقة على الجليد في الظلام ، أو فقط 1 ميكرومتر FM. وهذا يسمح للقياسات لإجراء لholoenzymes المسمى مع وبدون متقبل fluorophore 8. تجهيز المجهر مع فلتر 475DF40 الإثارة ، 530DF30 تصفية الانبعاثات ، ومرآة 505DRLP مزدوج اللون.
- قياس الوقت من الاعتماد على المانحين تبيض في حضور وغياب fluorophore المتقبلة. خلال وقت هذه القياسات ، ينبغي أن يكون الحل التدفق المستمر. خلاف ذلك ، قد يكون لوحظ زيادة الحرارة التي يسببها مضان على مر الزمن. وتستخدم الفرق في الأنحلال الضوئي مع وبدون fluorophore متقبل لحساب المسافة بين بقايا اثنين. وسوف تتضمن فقط Holoenzymes fluorophore المانحة تجربة بمعدل أسرع من الأنحلال الضوئي holoenzymes مع fluorophore المتقبلة. وسوف تتضمن كل من Holoyenzymes المانحة وfluorophore متقبل المعرض معدلات بطيء عند الأنحلال الضوئي على مقربة من بعضها البعض 8.
- باستخدام ميزة Clampex pClamp10 في المتوسط ، على نتائج الأنحلال الضوئي fluorophore من الجهات المانحة لمدة لا تقل التسجيلات البويضة الأربعة.
- بمجرد متوسط النتائج ، استخدم الدالة الأسية (monoexponential ، biexponential) للحصول على منحنى أفضل مناسبا. ويمكن استخدام منحنى الأنسب لتحديد وقت ثابت للالأنحلال الضوئي fluorophore من الجهات المانحة مع وبدون المتقبلة.
- تحديد كفاءة نقل الطاقة التي قدمها المعادلة E = 1 - DA Γ / Γ 17 D ، حيث GDA يشير إلى الوقت المستمر للزوج fluorophore المانحة / متقبل وΓ D يشير إلى الوقت المستمر لfluorophore فقط الجهة المانحة.
- باستخدام equation17 فورستر ، E = 1 / (1 + R 6 / R س 6) ، يمكن تحديد المسافة بين بقايا السيستين المسمى ؛ E هو الحنق الكفاءة ، R هي المسافة بين الجهات المانحة وfluorophore متقبل ، وR س المسافة الكفاءة 50 ٪ للالمانحة ومتقبل الاقتران 17. ويحكم يا R من المعادلة س = R (9.7x10 3 JΦ D ن -4 κ 2) حيث J هو التداخل تطبيع الطيفي لانبعاث وامتصاص متقبل المانحة ، Φ D هو العائد الكم من الانبعاثات المانحة دون fluorophore متقبل ، n هو مؤشر الانكسار ، وκ 2 هو عامل التوجه لثنائي القطب ، ثنائي القطب التفاعلات 8.
9. النسبية حركة الوحدات الصغرى البروتين
- الاستخدام المزدوج الذي يبني السيستين وصفت مع متقبل وfluorophores المانحة. لهذه التجارب ، سيتم قياس التغير في المسافة بين بقايا السيستين اثنين. لأن هذا هو الحال ، يجب أن كثافة مضان العلامات التالية في كل مخلفات تكون مستقلة عن الدولة بتكوين جزئي من البروتين 8. وبالتالي ، فإن أي تغيير في مضان بالرنين نقل الطاقة يكون نتيجة لتغيير المسافة بين الجهات المانحة وfluorophores المتقبلة.
- تجهيز المجهر مع فلتر 475AF40 الإثارة ، 595AF60 مرشح الانبعاثات و505DRLP مرآة مزدوج اللون. لهذه التجارب ، هو متحمس للمانحين ويقاس مضان من fluorophore المتقبلة. استخدم الأسلوب المناسب (الجهد ، يجند ، والحل الصرف) لتنشيط بروتين الغشاء في وقت واحد وقياس التغير في كثافة مضان. وزيادة في كثافة مضان تشير إلى أن اثنين وبالتالي fluorophores مخلفات الطرفان يسيران معا. وهناك انخفاض في كثافة مضان تشير إلى أن اثنين وبالتالي fluorophores مخلفات هما ابتعادا بعضها عن بعض. أخيرا ، فإن أي تغيير في كثافة مضان تشير إلى أن اثنين ومخلفات fluorophores بالتالي هما على مسافة واحدة على تغيير في التشكل من البروتين.
10. ممثل النتائج
وسم بقايا السيستين خارج الخلية مع fluorophores محددة تمكن التحقيق من حركة بروتينات غشاء على التغييرات متعلق بتكوين جزئي. ويرد المشبك الجهد نموذجية تتبع قياس التألق في الشكل 1. التغير في كثافة مضان (أقل التتبع) ، وهو حركة fluorophore من ماء أكثر من ألف إلى بيئة أكثر مسعور أو من المياه لتبريد أكثر كميات أقل من المياه تروي البيئة ، والنتائج من تغيير متعلق بتكوين جزئي في البروتين عند تبادل الحل (العلوي التتبع).
ويمكن هذا الأسلوب extenدائرة التنمية الاقتصادية لتحديد القيود المسافة بين اثنين من المخلفات. وتظهر هذه النتائج التجريبية في الشكل 2. في وجود flurophore متقبل (الحمراء) ، photobleaching يحدث بمعدل أبطأ من دون fluorophore متقبل (أسود). يرتبط ارتباطا مباشرا معدل photobleaching لبعد المسافة بين اثنين fluorophores وفقا للمعادلة فورستر 17. يمكن ربط هذه النتائج إلى الدول متعلق بتكوين مختلفة من البروتين والتحقق منها من قبل اثنين من التجارب الجهد الكهربائي المشبك تؤدى في وقت واحد.
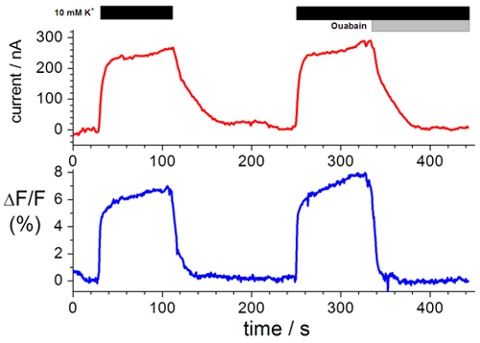
الشكل 1. تسجيل الممثل النقل ايون والتغيرات في كثافة مضان. أعلى ، والقياسات الحالية المشبك في وجود حل نا اختبار + والحل K + اختبار في وجود 10 و 10 ميكرومتر ouabain ملم. القاع ، والتغيرات في كثافة يقاس تنوير بالترادف مع القياسات الحالية 3،8،19 المشبك.
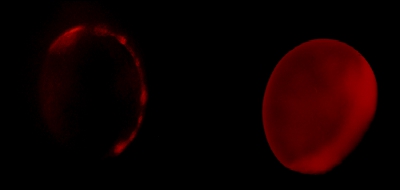
الشكل 2. الاعتماد وقت Photobleaching. يقاس الأنحلال الضوئي المانحة في غياب (الأسود) وجود fluorophore متقبل (الحمراء). كل التتبع هو متوسط التسجيلات البويضة 4.
Discussion
المنهج التجريبي الذي يجمع بين وصفنا في مواقع محددة واثنين من العلامات fluorophore الجهد الكهربائي المشبك للتحقيق في العلاقة بين البنية والوظيفة من بروتينات الغشاء. ويمكن استخدام هذه التقنية للحصول على وقت حلها معلومات عن ديناميات بتكوين جزئي للبروتينات غشاء أثناء النقل الأيوني. وعلاوة على ذلك ، يمكن أن تصمم هذا النهج في العمل مع مختلف البروتينات مثل مضخات ايون ، وقنوات ايون والناقلين.
بالإضافة إلى التحقيق في ديناميكية بتكوين جزئي في بقايا محددة ، فمن الممكن أيضا استخدام مضان نقل الطاقة الرنين لتحديد المسافة قيود داخل عميم الإنزيم. يمكن تحديد المسافات بين بقايا فضلا عن قياس الحركة النسبية بين مفارز مساعدة في حل المسائل الرئيسية التي تنطوي على آليات النابضة.
Disclosures
Materials
| Name | Company | Catalog Number | Comments |
| كاشف / معدات | شركة | كاشف / معدات | شركة |
|---|---|---|---|
| 100W المصدر بالتنغستن الخفيفة | كارل زايس Microimaging | فلوريسئين - 5 - maleimide | Invitrogen |
| 1B150F - 4 | العالم آلات دقيقة | عالية الصرفة كيت استخراج PCR | روش |
| 3،0-4،0 Ethicon Vicryl | جونسون آند جونسون | mMessage mMachine كيت | Ambion |
| 475AF40 الإثارة تصفية | أوميغا البصرية | MS - 222 | سيغما الدريخ |
| 505DRLP مزدوج اللون المرآة | أوميغا البصرية | Nucleospin كيت البلازميد | Macherey - ناجل |
| Macherey - ناجل | أوميغا البصرية | Nanodrop 2000c Sprectrophotometer | الحرارية العلمية |
| 535DF50 الإثارة تصفية | أوميغا البصرية | PC - 10 Micropipette بولير | Narishige |
| 560DRLP مزدوج اللون المرآة | أوميغا البصرية | pCLAMP 10 برامج | محوار الآلات |
| 565ALP الانبعاثات التصفية | أوميغا البصرية | PfuTurbo بوليميراز الدنا | Strategene |
| 565EFLP الانبعاثات التصفية | أوميغا البصرية | PIN - 022A الضوئي | المتحدة للكشف عن تقنيات |
| 570DRLP مزدوج اللون المرآة | أوميغا البصرية | مرشحات الاستقطاب | شركة لينوس Phtonics |
| شركة لينوس Phtonics | أوميغا البصرية | QuickChange الموقع الموجه Mutagenisis كيت | Stratagene |
| محوري مجهر ممتحن الإسفار | كارل زايس MicroImaging GMBH | RC - 10 غرفة الإسفار | نذير الآلات |
| نذير الآلات | الحياة تكنولوجيز | tetramethylrhodamine - 6 - maleimide | Invitrogen |
| Digidata نظام الحصول على البيانات 1440A | محوار الآلات | TOP10 خلايا Electrocompetent | Invitrogen |
| أنا DPN | نيو إنجلاند Biolabs | توربو تك - 05X مكبر للصوت | NPI |
References
- Cole, K. S., Moore, J. W. Potassium Ion Current in the Squid Giant Axon: Dynamic Characteristic. Biophys. J. 1, 1-14 (1960).
- Taglialatela, M., Toro, L., Stefani, E. Novel voltage clamp to record small, fast currents from ion channels expressed in Xenopus oocytes. Biophys. J. 61, 78-82 (1992).
- Dempski, R. E., Friedrich, T., Bamberg, E. The beta subunit of the Na+/K+-ATPase follows the conformational state of the holoenzyme. J. Gen. Physiol. 125, 505-520 (2005).
- Miller, A. J., Zhou, J. J. Xenopus oocytes as an expression system for plant transporters. BBA - Biomembranes. 1465, 343-358 (2000).
- Cha, A., Bezanilla, F. Characterizing Voltage-Dependent Conformational Changes in the Shaker K+ Channel with Fluorescence. Neuron. 19, 1127-1140 (1997).
- Mannuzzu, L. M., Moronne, M. M., Isacoff, E. Y. Direct Physical Measure of Conformational Rearrangement Underlying Potassium Channel Gating. Science. 271, 213-216 (1996).
- Koch, H. P., Larsson, P. H. Small-scale molecular motions accomplish glutamate uptake in human glutamate transporters. J. Neurosci. 25, 1730-1736 (2005).
- Dempski, R. E., Hartung, K., Friedrich, T., Bamberg, E. Fluorometric Measurements of Intermolecular Distances between the α- and β-Subunits of the Na+/K+-ATPase. J. Biol. Chem. 281, 36338-36338 (2006).
- Geys, S. A., Bamberg, E., Dempski, R. E. Ligand-Dependent Effects on the Conformational Equilibrium of the Na+,K+-ATPase As Monitored by Voltage Clamp Fluorometry. Biophys. J. 96, 4561-4561 (2009).
- Geibel, S., Kaplan, J. H., Bamberg, E., Friedrich, T. Conformational Dynamics of the Na+/K+-ATPase Probed by Voltage Clamp Fluorometry. Proc. Natl. Acad. Sci. U.S.A. 100, 964-969 (2003).
- Lorenz, L., Pusch, M., Jentsch, T. J. Heteromultimeric CLC chloride channels with novel properties. Proc. Natl. Acad. Sci. U.S.A. 93, 13362-13366 (1996).
- Mruk, K., Kobertz, W. R. Discovery of a Novel Activator of KCNQ1-KCNE1 K+ Channel Complexes. Biophys. J. 177a, (2009).
- Kyte, J., Doolittle, R. F. A method for diplaying the hydropathic character of a protein. J. Mol. Biol. 157, 105-132 (1982).
- Rakowski, R. F. Charge movement by the Na/K pump in Xenopus oocytes. J. Gen. Physiol. 101, 117-144 (1993).
- Tsunoda, S. P., Hegemann, P. Glu 87 of Channelrhodopsin-1 Causes pH-dependent Color Tuning and Fast Photocurrent Inactivation. Photochem. Photobiol. 85, 564-569 (2009).
- Cha, A., Bezanilla, F. Structural implications of fluorescence quenching in the Shaker K+ channel. J. Gen. Physiol. 112, 391-391 (1998).
- Förster, T. . Ann Physik. 2, 55-75 (1948).
- Dong, X., Stothard, P., Forsythe, I. J., Wishart, D. S. PlasMapper: a web server for drawing and auto-annotating plasmid maps. Nucleic Acids Res. 32, W660-W664 (2004).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved