A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
جيل من الخلايا الجذعية العصبية من الأنسجة الجنينية البشرية المهملة القشرية
In This Article
Summary
ووصف طريقة بسيطة وموثوق بها عن العزلة وثقافة من الخلايا الجذعية العصبية من أنسجة الأجنة البشرية تجاهل القشرية. ويمكن استخدام الثقافات المستمدة من الاضطرابات العصبية يعرف الإنسان المرضية لتوصيف العمليات الخلوية والجزيئية ، فضلا عن توفير منبر لتقييم فعالية العقاقير.
Abstract
الخلايا الجذعية العصبية (NSCs) يقيمون على طول منطقة البطين الظهارة العصبية خلال وضع لوحة القشرية. هذه الأسلاف في وقت مبكر يعطي في نهاية المطاف إلى ظهور الأسلاف والمتوسطة في وقت لاحق. مختلف أنواع فرعية الخلية العصبية والدبقية التي تشكل القشرة الدماغية القدرة على توليد وتوسيع NSCs الإنسان (ما يسمى neurospheres) من أنسجة الأجنة تجاهل العادي مع توفر وسيلة للدراسة بشكل مباشر على الجوانب الوظيفية العادية التنمية البشرية NSC 1-5. ويمكن أيضا أن يكون هذا النهج الموجه نحو جيل من NSCs من الاضطرابات العصبية المعروفة ، مما يتيح الفرصة لتحديد العمليات التي تغير انتشار المرض السلف ، والهجرة ، وتمايز 6-9. وقد ركزنا على تحديد الآليات المرضية في الإنسان NSCs متلازمة داون التي قد تساهم في مرض الزهايمر النمط الظاهري لتسريع 10،11. ولا يستطيع أحد في الجسم الحي ، ولا في نماذج الماوس المختبر تكرار ذخيرة مماثلة من الجينات الموجودة على الكروموسوم البشري 21.
هنا نستخدم طريقة بسيطة وموثوق بها لعزل متلازمة داون NSCs من القشور أجهضت الجنين البشري وزرعها في الثقافة. المنهجية توفر جوانب محددة من حصاد الأنسجة ، والتشريح مع معالم التشريحية محدودة ، والفرز الخلية ، والطلاء ، والركض من NSCs الإنسان. كما نقوم بتوفير بعض البروتوكولات الأساسية لإحداث تمايز NSCs الإنسان في خلية فرعية أكثر انتقائية.
Protocol
1. تحضير محاليل ومواد للتشريح وصيانة الجذعية العصبية خلية ثقافة
- إعداد 100ML المتوسطة تشريح (خروج المغلوب DMEM/F12 ، Invitogen) في وقت سابق والثلاجة.
- Prepare100 مستنبت مل (الجذعية برو NSC SFM ، Invitrogen) والاحتفاظ ب 37 درجة مئوية في حمام مائي.
- إعداد تجميد الخلايا المتوسطة (خروج المغلوب DMEM/F12 +10 ٪ + FBS DMSO 5 ٪) لحفظ البرودة على المدى الطويل من الخلايا.
- إذا رغبت في ذلك ، وإعداد بارافورمالدهيد 4 ٪ (PFA) لتثبيت الأنسجة.
- وتستخدم عقيمة ، ملقط تعقيمها وشفرات المشرط مع مقابض للتشريح.
- جانبا بندقية ماصة ، 10 ماصات نقل لتر ، و 40 ميكرومتر مصفاة الخلية دينار بحريني (352340 فالكون) للتفكك.
- الثقافة جانبا عدة أطباق 10 سم (دينار بحريني) للتشريح ، و 50 مل أنابيب الطرد المركزي (دينار بحريني) لتفارق ، 1.5 مل أنابيب الطرد المركزي لتخزين الأنسجة والقنينات المجمدة (دينار بحريني) لتجميد الخلايا.
2. عزل خلايا الجذعية العصبية من المخ الجنينية البشرية
- حصاد أنسجة قابلة للحياة على الفور بعد انتهاء الجنين أمر حيوي لنجاح العملية. للإجراءات الانتخابية ، ويمكن ترتيب موعد للحصول على عينات في وقت مبكر وذلك للتقليل من الوقت بعد وفاة الجنين. ويتم حصاد المنتجات الحمل في حدود 2 إجراء آخر ساعة ، ولكن من الناحية المثالية لا يمكن أن يتحقق على الإجراءات الانتخابية في غضون دقائق. أنسجة الجنين وغالبا ما مجزأة. لكن ، بشكل عام جزءا هاما من الدماغ لا يزال سليما لتحديد البصرية. ويتم تحديد حدود عمر الحمل (GA) من القانون الوضعي ولكن لم يتم تنفيذها باستخدام هذا البروتوكول بين 18-22 أسبوعا GA.
- يوضع دماغ الجنين في طبق بتري 10 مل تحتوي على الجليد الباردة خروج المغلوب DMEM/F12 الحل. التعرف على أجزاء مختلفة من قشرة بواسطة معالم التشريحية. حدود لقشرات الجبهي والجداري القذالي ، موجهة من قبل تقاطع استقراء من التلم المركزي والشق سيلفيوس. تشريح الأنسجة من اللحاء الجبهي الأمامي للتلم المركزي وعلى طول الحدود مع الشق سيلفيوس ريش الجراحية ، والتأكد من الحفاظ على البطين سليمة وغير تالفة.
- إزالة أي بقايا الدم والسحايا من كتلة فصل من القشرة الأمامية. إذا كانت العينة كافية من الجودة ، وهو مثالي لتشريح كتلة صغيرة في عدة عينات لأغراض مختلفة : المقاطع (الثابتة في بارافورمالدهيد 4 ٪ ، PFA) والبروتين / مرنا المقايسات (المجمد سريع في -80 درجة مئوية).
- نقل كتلة الدماغ المحدد إلى أنبوب الطرد المركزي 50 مل ، وإضافة الثلج الباردة DMEM/F12 خروج المغلوب في حل 3 مرات تقريبا من حجم النسيج و. فصل بلطف الأنسجة التي pipetting الميكانيكية مع ماصة 10 مل نقل أنسجة حتى يصبح كل مجزأة (عادة 20-30 مرات) ، ثم وتصفية الخلايا من خلال مصفاة الخلية 40 ميكرومتر دينار بحريني (352340 فالكون) للحصول على خلية واحدة واحدة أو بالقرب منها التعليق.
- الطرد المركزي تعليق خلية في 2000 دورة في الدقيقة ودرجة حرارة الغرفة لمدة 5 دقائق ، وبيليه resuspend خلية في 10 مل الطازجة مستنبت الدافئة (الجذعية برو SFM NSC) ، وحساب عدد الخلايا مع عدادة الكريات.
- إضافة 5 مل مستنبت الدافئة في كل ثقافة القوارير 25 سم 2 ، ونقل 2X10 6 خلايا في كل قارورة. تتم المحافظة على الثقافات في 37 درجة مئوية / 5 ٪ CO 2 حاضنة لل1 قبل أسبوع من التحليل. تغيير نصف المتوسط مرة واحدة في الأسبوع لثقافات أخرى أو تجارب.
3. Manipulaton من الخلايا الجذعية العصبية لتوصيف أخرى أو التجريب
- Neurospheres عادة في شكل 1-2 أسابيع في ظل الظروف ثقافة أوصى مجلس الأمن القومي بقطر يتراوح بين 200 و 400 ميكرومتر. Neurospheres يمكن في هذه المرحلة يمكن فصلها مع 0.2 غرام / لتر في EDTA هانكس الكالسيوم والمغنيسيوم المتوسطة الحرة (هانكس) في 37 درجة مئوية لمدة 15 دقيقة للحصول على خلايا واحد. هي نسج خلايا التعليق على 2000 دورة في الدقيقة ، تشطف في هانكس العذبة ، وreplated في المتوسط الدافئة للثقافة فرعية.
- للشروع في التمايز ، وفصلها عن الخلايا مطلي coverslips 1 poly-D-lysine/laminin المغلفة في مناطق ذات كثافة الخلايا 5 1X10 في ساترة (24mmX24mm). ويتحقق من خلال الحفاظ على تمايز Oligodendrocyte الخلايا في خروج المغلوب DMEM/F12 (Invitrogen ، الرئيسي ، MD) +2 ٪ B27 (50X ، Invitrogen ، الرئيسي ، MD) +10 نانوغرام / مل bFGF +100 نانوغرام / مل + SHH 10ng/ml PDGF - AA لل 2days ، والتحول بعد ذلك إلى وسيلة واحدة دون عوامل النمو لمدة 5 أيام. ويتم تحقيق تمايز الخلايا العصبية من الخلايا في الحفاظ على خروج المغلوب DMEM/F12 +2 ٪ B27 (50X) لمدة 7 أيام. ويتم التفريق من قبل خلايا نجمية في زراعة خروج المغلوب DMEM/F12 FBS +1 ٪ لمدة أسبوع.
- ويمكن القيام ترنسفكأيشن من الخلايا الجذعية العصبية مع جينات الخلايا مع فصلها عن neurospheres بريفورميد. هنا ، نحن أظهرت الخلايا الجذعية العصبية transfected مع EGFP - C1 بواسطة electroporation. تم إجراء electroporation من EGFP - C1 بناء باستخدام AMAXA أطقم Nucleofector للخلايا الجذعية العصبية (VPG -1004) مع جهاز Nucleofector AMAXA (Lonza AAD - 1001) ، في أعقاب تعليمات الشركة. باختصار ، كانت مختلطة 5 ميكروغرام الحمض النووي مع 1 6 10 X الخلايا مع 100 ميكرولتر ترنسفكأيشن المتوسطة ، وبعد electroporation النبض ، ومعلق الخلايا في الخلايا الجذعية العصبية الحفاظ على المتوسط للثقافة أخرى. تم تجهيز التفريق بين الخلايا transfected مع تفكك neurospheres 3-4 أيام بعد electroporation ، يتبع الإجراءات نفسها الموصوفة في الخطوة 3.2.
4. تجميد الخلايا الجذعية العصبية ، والثقافات الفرعية
- وطرد الايقاف الخلية وفصلها معلق في تجميد المتوسطة مع التركيز على الخلايا 1X10 7 / فيال / مل. تجميد الخلايا ببطء في -20 درجة مئوية ، -80 درجة مئوية ثم نقل إلى النيتروجين السائل لتخزين وقت طويل.
- يتم إذابة الخلايا سريع مع 37 درجة مئوية حمام المياه ومعلق في درجة حرارة DMEM/F12 +10 ٪ مصل ليغسل ، وطرد لإزالة التجمد المتوسطة ، ومعلق في درجة حرارة متوسطة الثقافة.
5. ممثل النتائج :
ومثقف الخلايا الجذعية العصبية من الأجنة العادية في 18 أسبوعا من عمر الحمل التالية يمكن أن ينظر إلى الأساليب المذكورة وneurospheres بعد اسبوع واحد مع جولة والحدود على نحو سلس ومتجانس إلى حد ما حجم (Fig.2A). يمكن أن تكون هذه transfected neurospheres مع EGFP - C1 أو بنيات أخرى وتابعت تحت المجهر مضان (Fig.2B ،). وقد أنشئت neurospheres فصلها ثم مع EDTA ومطلي على شكل خلايا متناثرة coverslips المغلفة. تم إصلاح الخلايا المتمايزة بموجب بروتوكولات منها مع parafamaldehyde 4 ٪ ، وملون مع مختلف علامات نوع من الخلايا المحددة. ويلاحظ Multipotentiality مع التعبير عن علامات تدل على الخلايا العصبية (Fig2C ، D ، رودامين) النجمية (Fig2E ، F ، رودامين) وoligodendrocytes (Fig2G ، H ، رودامين). وكانت متباينة أيضا الخلايا لا تخضع لelectroporation EGFP إلى أنواع مختلفة من الخلايا وملطخة علامات مختلفة من الخلايا المحددة. ويلاحظ Multipotentiality مع التعبير عن علامات تدل على الخلايا العصبية (Fig3A ، B ، fluoroscein) النجمية (Fig3C ، ورودامين Fig3D ، fluoroscein) وoligodendrocytes (Fig3E ، F ، رودامين).
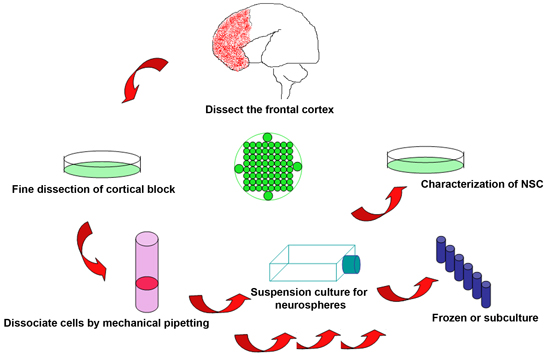
الشكل 1. تخطيطي لإجراء التجريبي لعزل الخلايا الجذعية العصبية من المخ تجاهل الجنين البشري

الشكل 2. متمايزة ومتباينة الخلايا العصبية البشرية propogated في المختبر. (أ) تظهر تحت المجهر Neurospheres مرحلة إثبات العكس على نحو سلس ، حدود الدور والنمو السريع للثقافة بعد أكثر من 1 في الاسبوع. (ب) يمكن أن يتحقق مقدمة من مختلف البلازميدات ويبني من خلال ترنسفكأيشن. ثلاثة أيام في أعقاب EGFP - C1 ترنسفكأيشن ، تظهر خلايا متعددة في التعبير عن بروتين الفلورية الخضراء ينظر إليها على أنها تحت المجهر immunostaining fluoroscein ومضان. EGFP - C1 neurospheres transfected يتم فصلها وتحت ظروف مختلفة متباينة في الخلايا العصبية (C ، D) ، النجمية (E ، F) وoligodendrocytes (G ، H) ، وينظر تحت رودامين مضان. في الوقت نفسه ، تظهر الخلايا transfected EGFP الايجابية في ظل fluoroscein مضان. خلايا Transfected (رؤساء السهم الأبيض) لا يمكن تمييزها من الخلايا untransfected (السهام البيضاء). هي ملطخة نواة الخلية مع Hoechst33342. الحانات هي مقياس 200 ميكرومتر لA ، B عن 100 ميكرون و 25 ميكرون للCH.
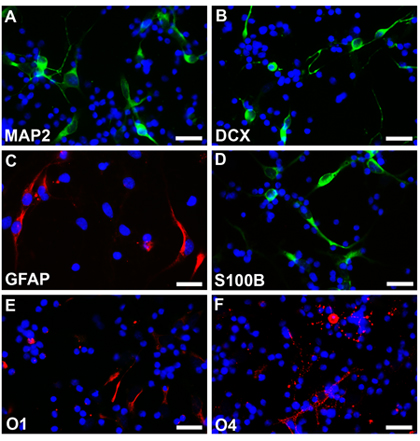
الشكل 3. Neurospheres دون ترنسفكأيشن يتم فصلها وتحت ظروف مختلفة متباينة في الخلايا العصبية (A ، B ، fluoroscein) ، النجمية (C ، رودامين ، D ، fluoroscein) وoligodendrocytes (E ، F ، رودامين). هي ملطخة نواة الخلية مع Hoechst33342. أشرطة مقياس هي 25 ميكرومتر لAF.
Access restricted. Please log in or start a trial to view this content.
Discussion
هناك نهج مختلف تجاه نسيج ثقافة جديدة وانتاج خطوط الخلايا البشرية. تاريخيا ، لم تحصد أنسجة جديدة وتربيتها على الفور لتوليد مختلف أنواع الخلايا في الجهاز العصبي المركزي. هذا النهج غير محدودة بشكل واضح من قبل عدد من العينات التي يمكن الحصول عليها والتي في حالة العينات ا...
Access restricted. Please log in or start a trial to view this content.
Disclosures
Acknowledgements
وأيد هذا العمل في جزء من المعاهد الوطنية للصحة : HD054347 وNS063997 - 01 إلى VLS. كما أيد هذا العمل في جزء من صندوق الدولة الإمبراطورية الخلايا الجذعية من خلال إدارة ولاية نيويورك للصحة العقد # C024324 لVLS. الآراء التي أعرب عنها هنا هي فقط تلك التي للمؤلف ، ولا تعبر بالضرورة عن مجلس الدولة الإمبراطورية الخلايا الجذعية ، وولاية نيويورك وزارة الصحة ، أو ولاية نيويورك. VLS هو عالم دوريس ديوك السريرية التنموي مستلم الجائزة. كما نشكر الأستاذ تيموثي فارتانيان عن هديته المضادة للأجسام المضادة للO1 O4.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| اسم كاشف | شركة | فهرس العدد | تعليقات (اختياري) |
|---|---|---|---|
| خروج المغلوب DMEM/F12 | Invitrogen | 12660-012 | تفارق المتوسطة |
| الجذعية برو NSC SFM | Invitrogen | A10509 - 01 | مستنبت |
| المصل البقري الجنين | Invitrogen | 10091-148 | المجمدة المتوسطة |
| هانكس الحل (ولاية كاليفورنيا 2 + ، 2 + - MG) | Invitrogen | 14175-095 | تفارق المتوسطة |
| DMSO | سيغما الدريخ | D2650 | المجمدة المتوسطة |
| EDTA | سيغما الدريخ | 431788 | تفارق المتوسطة |
| بارافورمالدهيد | سيغما الدريخ | 158127 | تثبيت الحل |
| bFGF | R & D | 234 - FSE | تمايز المتوسطة |
| SHH | R & D | 1845 - SH | تمايز المتوسطة |
| PDGF - AA | R & D | 221 - AA | تمايز المتوسطة |
| B27 | Invitrogen | 17504-044 | تمايز المتوسطة |
| الماوس المضادة للMAP2 | سيغما الدريخ | M2320 | 1:200 |
| أرنب المضادة للDCX | إشارات الخلية | 4604s | 1:200 |
| أرنب المضادة للGFAP | داكو | Z0334 | 1:200 |
| أرنب المضادة للS100B | داكو | Z0311 | 1:200 |
| أرنب المضادة للO1 | الهدايا البروفسور تيموثي فارتانيان * | 01:50 | |
| أرنب المضادة للO4 | الهدايا البروفسور تيموثي فارتانيان * | 01:50 | |
| 40μm الخلية مصفاة | فالكون دينار بحريني | 352340 |
* تيموثي فارتانيان ، دكتوراه في الطب ، دكتوراه ، وإدارة الولايات المتحدة الأمريكية الأعصاب وعلم الأعصاب ، كلية طب وايل كورنيل في نيويورك ،
References
- Gage, F. H., Ray, J., Fisher, L. J. Isolation, characterization, and use of stem cells from the CNS. Annu. Rev. Neurosci. 18, 159-192 (1995).
- Vescovi, A. L., Snyder, E. Y. Establishment and properties of neural stem cell clones: plasticity in vitro and in vivo. Brain Pathol. 9, 569-598 (1999).
- Schwartz, P., Bryant, P., Fuja, T., Su, H., O'Dowd, D., Klassen, H. Isolation and characterization of neural progenitor cells from post-mortem human cortex. J Neurosci Res. 74, 838-851 (2003).
- Martinez-Serrano, A., Rubio, F. J., Navarro, B., Bueno, C., Villa, A. Human neural stem and progenitor cells: in vitro and in vivo properties, and potential for gene therapy and cell replacement in the CNS. Curr Gene Ther. 1, 279-299 (2001).
- Rajan, P., Snyder, E. Neural stem cells and their manipulation. Methods Enzymol. 419, 23-52 (2006).
- Ruiz-Lozano, P., Rajan, P. Stem cells as in vitro models of disease. Curr Stem Cell Res Ther. 2, 280-292 (2007).
- Sheen, V., Ferland, R., Harney, M., Hill, R., Neal, J., Banham, A., Brown, P., Chenn, A., Corbo, J., Hecht, J., Folkerth, R., Walsh, C. Impaired proliferation and migration in human Miller-Dieker neural precursors. Ann Neurol. 60, 137-144 (2006).
- Bahn, S., Mimmack, M., Ryan, M., Caldwell, M., Jauniaux, E., Starkey, M., Svendsen, C., Emson, P. Neuronal target genes of the neuron-restrictive silencer factor in neurospheres derived from fetuses with Down's syndrome: a gene expression study. Lancet. 359, 310-315 (2002).
- Ferland, R. J., Batiz, L. F., Neal, J., Lian, G., Bundock, E., Lu, J., Hsiao, Y. C., Diamond, R., Mei, D., Banham, A. H. Disruption of neural progenitors along the ventricular and subventricular zones in periventricular heterotopia. Hum Mol Genet. 18, 497-516 (2009).
- Esposito, G., Imitola, J., Lu, J., De Filippis, D., Scuderi, C., Ganesh, V. S., Folkerth, R., Hecht, J., Shin, S., Iuvone, T., Chesnut, J., Steardo, L., Sheen, V. Genomic and functional profiling of human Down syndrome neural progenitors implicates S100B and aquaporin 4 in cell injury. Hum Mol Genet. 17, 440-457 (2008).
- Esposito, G., Scuderi, C., Lu, J., Savani, C., De Filippis, D., Iuvone, T., Steardo, L. J. r, Sheen, V., Steardo, L. S100B induces tau protein hyperphosphorylation via Dickopff-1 up-regulation and disrupts the Wnt pathway in human neural stem cells. J Cell Mol Med. 12, 914-927 (2008).
- Flax, J. D., Aurora, S., Yang, C., Simonin, C., Wills, A. M., Billinghurst, L. L., Jendoubi, M., Sidman, R. L., Wolfe, J. H., Kim, S. U., Snyder, E. Y. Engraftable human neural stem cells respond to developmental cues, replace neurons, and express foreign genes. Nat Biotechnol. 16, 1033-1039 (1998).
- Fults, D., Pedone, C. A., Morse, H. G., Rose, J. W., McKay, R. D. Establishment and characterization of a human primitive neuroectodermal tumor cell line from the cerebral hemisphere. J Neuropathol Exp Neurol. 51, 272-280 (1992).
- Conti, L., Cattaneo, E. Neural stem cell systems: physiological players or in vitro entities? Nat Rev Neurosci. 11, 176-187 (2010).
- Svendsen, C. N., ter Borg, M. G., Armstrong, R. J., Rosser, A. E., Chandran, S., Ostenfeld, T., Caldwell, M. A. A new method for the rapid and long term growth of human neural precursor cells. J Neurosci Methods. 85, 141-152 (1998).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved