A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
Photobleaching فحوصات (FRAP و FLIP) لقياس حيوية الكروماتين البروتين في الخلايا الحية الجذعية الجنينية
In This Article
Summary
نحن تصف الأساليب بما في ذلك الاسترداد photobleaching بعد الإسفار Photobleaching (FRAP) والخسارة في الإسفار Photobleaching (FLIP) لمراقبة ديناميات البروتين في الخلايا الجنينية لونين (ES) الجذعية. ويتعزز لونين ديناميات البروتين ، الذي يعتبر واحدا من الوسائل لدراسة اللدونة لونين ، في الخلايا المحفزة.
Abstract
الاسترداد بعد مضان Photobleaching (FRAP) وخسارة في الإسفار Photobleaching (FLIP) تمكن من دراسة ديناميات البروتين في الخلايا الحية مع جيدة القرار المكانية والزمانية. هنا نحن تصف كيفية تنفيذ FRAP والمقايسات FLIP لونين من البروتينات ، بما في ذلك H1 و HP1 في الخلايا الجنينية الماوس (ES) الجذعية. في تجربة FRAP ، يتم transfected الخلايا ، إما عابرة أو ثابت ، مع الاهتمام البروتين تنصهر مع بروتين الفلورية الخضراء (GFP) أو مشتقاتها (YFP ، CFP ، الكرز ، الخ). في الخلايا ، transfected الاستشعاع ، مكثفة تركز شعاع الليزر التبييض منطقة صغيرة نسبيا من الاهتمام (ROI). يتم تحديد طول الموجة الليزر وفقا لبروتين فلوري المستخدمة في الانصهار. ضوء الليزر التبييض لا رجعة فيه إشارة الفلورسنت من الجزيئات في العائد على الاستثمار ، ومباشرة بعد التبييض ، واستعادة للإشارة الفلورسنت في منطقة المبيض -- هو رصدها باستخدام التصوير مرور الوقت -- بوساطة استبدال جزيئات مبشور مع الجزيئات غير المبيض. ولدت في منحنيات الانتعاش مضان تقديم معلومات عن التنقل البروتين. إذا كانت الجزيئات الفلورسنت هي جامدة ، سوف يلاحظ أي انتعاش مضان. في اتباع نهج متكامل ، الخسارة في الإسفار Photobleaching (FLIP) ، شعاع الليزر التبييض نفس المكان مرارا وتكرارا ويتم قياس كثافة إشارة في أماكن أخرى في الخلية الاستشعاع. تجارب FLIP قياس بالتالي تسوس إشارة بدلا من الانتعاش مضان ومفيدة لتحديد التنقل ، فضلا عن البروتين البروتين في رحلات مكوكية بين مقصورات الخلوية. عابر ملزم هو خاصية مشتركة من لونين المرتبطة البروتينات. على الرغم من المحتم أن جزءا كبيرا من كل من البروتين لونين لونين في أي لحظة في حالة مستقرة ، وملزم هو عابر وبروتينات أكثر لونين وارتفاع معدل دوران على لونين ، مع وقت الإقامة في ترتيب ثواني. هذه الخصائص هي حاسمة لتوليد يونة عالية في التعبير الجينوم 1. تجارب Photobleaching بالتالي فهي مفيدة بشكل خاص لتحديد اللدونة باستخدام لونين GFP الانصهار إصدارات البروتينات الهيكلية لونين ، وخصوصا في خلايا ES ، حيث تبادل ديناميكي للبروتينات لونين (بما في ذلك البروتين المغاير 1 (HP1) ، H1 هيستون رابط وhistones الأساسية) هو أعلى من 2،3 في الخلايا المتمايزة.
Protocol
1. طلاء للخلايا ES
T = 0 ساعات
MEF تصفيح
- معطف التصوير يعيش جيدا μ - 8 - الشرائح (ibidi ؛ ميونيخ ، ألمانيا) مع الجيلاتين أو في غرف تغطية النظارات (لاب تيك ؛ روتشستر ، نيويورك) أو في أطباق زجاجية الثقافة القاع (ماتيك ؛ آشلاند ، MA). 50-30 دقيقة للمغادرة ونضح بعيدا الجيلاتين الحرة.
- البذور 22000 MEFs / جيدا في حجم اجمالي 250 ميكرولتر من DMEM [تستكمل مع مصل بقري جنيني من 10 ٪ (FBS)]. السماح لزراعة الخلايا في نسيج الثقافة الحاضنة (37 درجة مئوية ، 5 ٪ CO2).
T = 6 ساعات
ES خلية الطلاء
- نضح DMEM.
- كل البذور MEF مغلفة بشكل جيد مع خلايا 15000 R1 / جيدا في حجم اجمالي 250 ميكرولتر من وسائل الاعلام الخلية ES [تستكمل مع مصل الجنين بنسبة 10 ٪ ESC الصف البقر (FBS) ، 1 البيروفات الصوديوم ملم ، 0.1 ملم الأحماض الأمينية غير الأساسية ، و 0.1 ملم β المركابتويثانول ، و 1000 عامل اللوكيميا يو / مل المثبطة (LIF)] ، والحصول على 30 ٪ إلى 50 ٪ التقاء في اليوم التالي.
2. Transfecting خلايا ES
T = 24 ساعة
عابر ترنسفكأيشن
- استبدال وسائل الإعلام الخلية وفاق مع 250 ميكرولتر / بئر جديدة وسائل الاعلام وفاق الخلية.
- في أنبوب اختبار 1.5 مل العقيمة ، إضافة 100 مصل وسائل الاعلام الحرة ميكرولتر [OPTI - MEM (Gibco)] ، ثم إضافة 10 العابر LT1 ميكرولتر كاشف ترنسفكأيشن (Mirus) مباشرة في وسائل الاعلام الحرة في المصل. مزيج لطيف من قبل pipetting ويحضن في درجة حرارة الغرفة ل50-20 دقيقة.
- إضافة الانصهار 1،5 ميكروغرام GFP DNA البلازميد (H1e ، أو H1o HP1) إلى المخفف العابر LT1 كاشف. مزيج لطيف من قبل pipetting ويحضن في درجة حرارة الغرفة ل15-30 دقيقة.
- إضافة 13.5 ميكرولتر / الخليط جيدا ترنسفكأيشن. دوامة 8 - μ - الشرائح جيدا لضمان انتشار أكبر. بعد 24 ساعة يحل محل الخلايا القديمة وفاق وسائل الاعلام مع 250 ميكرولتر من خلية جديدة وسائل الاعلام وفاق.
3. أداء FRAP وFLIP
T = 48-72 ساعة
- يمكن إجراء التجربة على أي مجهر المسح الضوئي ليزر متحد البؤر (CLSM) ولكن منذ ذلك الحين في تجربة FRAP / FLIP العادية ، يتم الحصول على العديد من الصور المتتالية ، فمن المستحسن استخدام المجهر الغزل القرص مبائر ، والتي تمكن سرعة اقتناء ويضمن أن لا وعينة غير مرغوب فيها تبيض تحدث بعد الحدث الأولي المتعمد التبييض. هنا ، ونحن نوصي باستخدام الثورة الغزل نظام القرص مبائر (www.Andor.com) ، مع CSU - X يوكوجاوا رئيس القرص الغزل. هذا النظام لديه القدرة المزدوجة لphotobleach باستخدام وحدة متخصصة FRAPPA نقطة مع نظام المسح الضوئي ، والتبديل بسرعة الضوء مرة أخرى لجمع الصور باستخدام القرص الغزل. والبروتينات 3 الاستشعاع الأكثر شيوعا لphotobleaching التجارب هي GFP ، YFP والكرز. إذا استخدمت أو GFP YFP ، مطلوب ~ الليزر 488 نانومتر. لالكرز ، واستخدام ليزر ~ 560 نانومتر. في جميع الحالات ، ونحن نوصي باستخدام الليزر في الحالة الصلبة. بعد مرحلة الآلي هو مفيد ولكن ليس المطلوب. حيث يتم تصوير الخلايا الحية ، فمن الضروري لاستخدام الغرفة البيئية (التي نستخدمها واحد من LIS ، سويسرا) ، والأكسجين السيطرة والرطوبة وثاني أكسيد الكربون (2) ودرجة الحرارة. يتم تنفيذ FRAP تستخدم الحد الأقصى لكثافة الليزر ، بينما يتم التصوير مع قوة الليزر الحد الأدنى المطلوب (عادة في المنطقة بنسبة 10 ٪ ، عند مستوى الاستشعاع الكافي).
مراقبة الخلايا مع ضوء الفلورسنت من الطول الموجي المناسب وحدد خلية معربا عن GFP باستخدام الغمر النفط 60X العدسة. ضمان التوزيع الصحيح التحت خلوية. أحيانا ، عند مستويات مرتفعة للغاية التعبير ، قد التوطين في البروتين "تسرب" لالمقصورات الأخرى مثل نوية. لا ينبغي أن تكون مثل هذه الخلايا المحددة. - الآن تعيين بروتوكول التصوير : جمع الإطارات 3-5 قبل photobleaching ، ثم photobleach في كروماتين حقيقي أو المغاير (ينظر إليها على أنها بؤر مكثف GFP) وجمع الإطارات 90-120 بعد photobleach ، مع فترات مللي 250-1000 : H1e - GFP ، 1000 مللي ، وH1o HP1 - GFP ، 250 مللي ثانية (الوقت الفاصل التغييرات وفقا لديناميات البروتين ، حيث البروتينات ديناميكية للغاية تتطلب فترة زمنية أقصر). نستخدم عادة 8-10 ٪ كثافة ليزر لphotobleaching مع نبضة ليزر من μseconds 20-40 (1-2 تكرارات) ، ولكن هذه الأرقام يمكن أن تتغير وفقا لتحليل البروتينات ومستويات التعبير. عندما photobleaching غير مناسبة ، يجب الانتباه إلى "ثقب أسود" في مضان GFP الخاص. تدريجيا الثقب الأسود إعادة الانتعاش التالية مليئة مضان. على الرغم من أن القرص الغزل يمكن الحصول على ما يصل الى نحو 60 صورة في الثانية الواحدة (مع كثافة مضان جيدة ، وعندما نركز اهتمامنا على خلية واحدة) ، ونحن لا نوصي باستخدام هذا النظام في مثل هذه السرعات العالية نظرا لجودة الصورة منخفضة والضيائية زيادة محتملة.
- عن تجربة الآخر ، إعداد بروتوكول التصوير المختلفة : 3-5 جمع الإطارات قبل التبييض ، ثم تبدأ المتكررة تبيض في نفس المكان في حين جمع الصور. لH1e - GFP ، التبييض كل ثانية 5 ، لH1o - GFP ، التبييض كل 2 ثانية ، وHP1 - GFP التبييض كل ثانية 1. التبييض anد جمع الصور مرارا وتكرارا طوال التجربة بأكملها.
- اما عن تقنية ، كرر العملية على خلايا 20-30. للأغراض الإحصائية ، وتكرار التجربة 3 مرات أو أكثر ، ويفضل في أيام مختلفة. في المجتمعات المتجانسة والضبط الصحيح ، الانحراف المعياري هو عادة منخفضة (<5 ٪).
لكلا FRAP والوجه ، وحجم وشكل المنطقة ابيض يؤثر على ديناميكية الانتعاش ويجب أن يظل ثابتا في إطار التجربة. أيضا ، عندما تتم مقارنة خليتين ، يجب استخدام بروتوكولات متطابقة ويجب تحليل الخلايا بالتسلسل في نفس اليوم ليزر الطاقة وغيرها من الشروط قد تتغير ويمكن أن تؤثر على نتائج التجربة.
4. FRAP FLIP وتحليل البيانات
- في جميع الأطر FRAP جمعها ، وقياس كثافة مضان في العائد على الاستثمار (ROI ب = منطقة ابيض) ، والمنطقة الخلفية (ROI BG) ، ومنطقة غير المقشور النووية (ROI ملحوظة) بوصفها وظيفة من الزمن قبل وبعد التبييض. ويمكن عند منطقة المبيضة لا يكاد يذكر سيتم اختيار نواة بأكملها لأغراض التطبيع.
- من أجل كل نقطة زمنية ، وتطبيع البيانات وفقا للصيغة : (ROI ب -- ROI BG) / (ROI ملحوظة -- ROI BG) / (pbROI ب -- pbROI BG) / (ملحوظة pbROI -- pbROI BG) ، ترمز للبرميل قبل المبيضة. لمرحلة ما قبل التبييض الصور يجب أن تحصل على قيمة 1 تقريبا. والصورة الأولى بعد التبييض تشير إلى العمق التبييض. طرح قيمة من 1 لقيمة بليتش العمق الفعلي. كرر لكل خلية ومتوسط 20-30 الخلايا من كل تجربة.
- FLIP في جميع الأطر التي تم جمعها ، وقياس كثافة مضان في منطقة غير المقشور النووية ، والمنطقة الخلفية (ROI ملحوظة = غير المقشور المنطقة ، وعائدات الاستثمار BG = الخلفية). حساب البيانات FLIP يشبه منحنى FRAP ، ينبغي فقط ROI تحليلها (ROI ملحوظة) تكون مختلفة من منطقة ابيض الفعلية ، والتي لا تستخدم في الحساب : (ROI ملحوظة -- ROI BG) / (ملحوظة pbROI -- pbROI BG) . ومن الممكن أيضا استخدام الخلايا المجاورة (ROI = ن خلية الجار) لأغراض التطبيع : (ROI ملحوظة -- ROI BG) / (ROI ن -- ROI BG) / (ملحوظة pbROI -- pbROI BG) / (pbROI ن -- pbROI BG ).
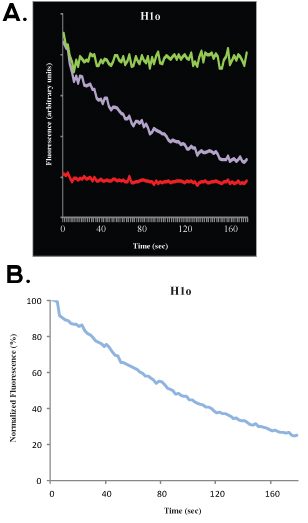
بعد جمع البيانات ، فمن الممكن لاحتواء البيانات التجريبية لمحاكاة الكمبيوتر. وهذا يسمح حساب ، مع القرب جيدة ، والكسر المحمول ، وجزء متحرك والنصف كحد أقصى. لن نناقش الجوانب الرياضية والإحصائية لتحليل FRAP هنا وتحيل القارئ إلى منشورات أخرى ممتازة 4-9. عمق التبييض يشير إلى المسافة (على المحور الصادي) بين إشارة (100 ٪) ما قبل التبييض والصورة الأولى بعد التبييض ، والكسر المحمول يشير إلى المسافة (على المحور الصادي) بين عمق والتبييض إشارة عندما تعافى حركية تصل إلى الهضبة ، وجزء متحرك يشير إلى المسافة (على المحور ص) بين إشارة وتعافى قبل التبييض إشارة (100 ٪) (انظر الأرقام 1B و 2B). بعد هذا التحليل ، وهناك نماذج رياضية جيدة لاحتواء البيانات. للداعية واحد ، المعادلة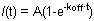
حيث t هو الوقت ، A هو جزء المحمول ، 1 - A هو جزء ثابت وك إيقاف التفكك المستمر ، يمكن استخدامها لاحتواء البيانات ، وتقدير المباشر لنسبة الخروج من الملزمة (ك إيقاف) يمكن أن يكون الحصول عليها ، فضلا عن المعلمة ألف ، والتي يمكن استخدامها لحساب معدل تكوين الجمعيات.
5. ممثل النتائج :
الشكل 1. ألف وباء منحنيات FRAP تظهر ممثل HP1 (يسار) ، H1o (وسط) وH1e (يمين) في خلايا ES R1. عن الشكل 1A البساطة والوضوح ويبين البيانات الخام من خلية واحدة قبل أي تطبيع والحساب. المنحنى الأصفر يناظر المنطقة ابيض ، المنحنى الأرجواني يتوافق مع منطقة غير المقشور النووية (عند منطقة المبيضة لا يكاد يذكر ويمكن تحديد نواة بأكملها لأغراض التطبيع) ، والخط الأحمر يتوافق مع مضان الخلفية ، وهي الحد الأدنى في هذه القضية. السهم العمودي يمثل الوقت التبييض. وتظهر بيانات تطبيع وبلغ متوسط في الشكل 1B. لاحظ تباطؤ انتعاش H1 (الأزرق) مقارنة مع HP1 (الحمراء). أيضا متغير H1e (أزرق غامق) أبطأ من المتغير H1o (الضوء الأزرق). يشار إلى كسور متحركة ومتنقلة والعمق لبليتش HP1.
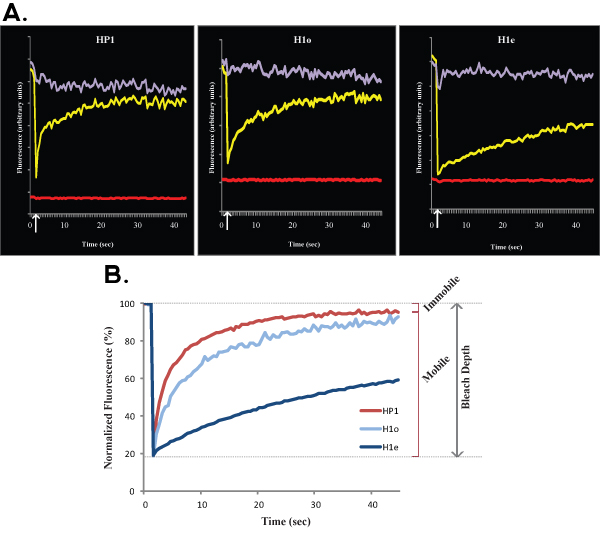
الشكل 2 ألف وباء منحنيات FRAP تظهر المقارنة بين ممثل كروماتين حقيقي (اليسار) مع المغاير (يمين) في الخلايا من HP1 ES R1. وعلى غرار الشكل 1 ، ويبين الشكل 2A البيانات الخام من خلية واحدة ، ومنحنى الصفراء يناظر المنطقة ابيض ، منحنى الأرجواني يتوافق مع منطقة غير المقشور النووية ، والخط الأحمر يتوافق مع مضان الخلفية. السهم العمودي يمثل الوقت التبييض. وتظهر بيانات تطبيع وبلغ متوسط 2B في الشكل. لاحظ تباطؤ انتعاش المغاير (أحمر غامق) مقارنة مع كروماتين حقيقي (الضوء الأحمر). يشار إلى كسور متحركة ومتنقلة والعمق بليتش للكروماتين حقيقي.
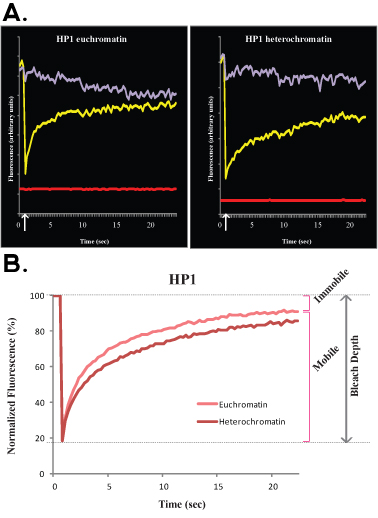
الشكل 3. ويرد تجربة نموذجية FLIP الخلايا H1o ES R1 في الشكل 3A (الخام ، وبرنامج الأمم المتحدة للتطبيع البيانات) وباء (تطبيع البيانات وبلغ متوسط). في هذه التجربة المنحنى الأرجواني يتوافق مع منطقة غير المقشور النووية ، فإن الخط الأخضر يناظر نواة الخلية المجاورة ، والخط الأحمر يتوافق مع مضان الخلفية.
Discussion
بخلاف معظم التقنيات المتاحة ، والتي تنطوي على لونين المنقى من السكان خلية أو خلايا ثابتة ، والتجارب FRAP متابعة التغيرات في ديناميات البروتين في الخلايا الحية لونين. وجدنا ديناميات البروتين لونين لتكون مؤشرا جيدا ليونة لونين. ومع ذلك ، لأنه يتطلب دمج الجينات في المصال...
Disclosures
Acknowledgements
نشكر أعضاء Meshorer المختبر ، وخاصة شاي Melcer ، Alajem عدي ، Edupuganti رام راغو بديع Sailaja لانكا ، وآنا Mattout بيران ألفا ، لتعليقات انتقادية وتحديد مواطن الخلل في التجارب photobleaching على أساس يومي. EM هو H. R. جوزيف وبيلي براون أستاذ محاضر في علوم الحياة ومعتمد من قبل مؤسسة العلوم اسرائيل (ISF 943/09) ، ووزارة الصحة الإسرائيلية (6007) والاتحاد الأوروبي (IRG - 206872 و 238176) ، إسرائيل للسرطان مؤسسة أبحاث ، والمنح الداخلية طبية تطبيقية في الجامعة العبرية ومعهد أو الرعاية اسرائيل.
Materials
| Name | Company | Catalog Number | Comments |
| اسم كاشف | شركة | فهرس العدد | |
|---|---|---|---|
| DMEM | سيغما | D5671 | |
| الجيلاتين | ميرك | 1.04078 | |
| OPTI - MEM | Gibco | 31985 | |
| العابر LT1 | Mirus | MIR2300 | |
| 8 - جيدا μ - الشرائح | ibidi | 80826 |
References
- Phair, R. D. Global nature of dynamic protein-chromatin interactions in vivo: three-dimensional genome scanning and dynamic interaction networks of chromatin proteins. Mol Cell Biol. 24, 6393-6402 (2004).
- Meshorer, E., Girard, L. . Imaging chromatin in embyonic stem cells in StemBook. , (2008).
- Meshorer, E. Hyperdynamic plasticity of chromatin proteins in pluripotent embryonic stem cells. Dev Cell. 10, 105-116 (2006).
- Bancaud, A., Huet, S., Rabut, G., Ellenberg, J. . Fluorescence perturbation techniques to study mobility and molecular dynamics of proteins in live cells: FRAP, photoactivation, photo conversion, and FLIP. , (2009).
- Dundr, M., Misteli, T. Measuring dynamics of nuclear proteins by photobleaching. Curr Protoc Cell Biol. Chapter 13, Unit 13-Unit 13 (2003).
- Ellenberg, J. Nuclear membrane dynamics and reassembly in living cells: targeting of an inner nuclear membrane protein in interphase and mitosis. J Cell Biol. 138, 1193-1206 (1997).
- Lenser, T., Weisshart, K., Ulbricht, T., Klement, K., Hemmerich, P. Fluorescence fluctuation microscopy to reveal 3D architecture and function in the cell nucleus. Methods Cell Biol. 98, 2-33 (2010).
- Mueller, F., Mazza, D., Stasevich, T. J., McNally, J. G. FRAP and kinetic modeling in the analysis of nuclear protein dynamics: what do we really know. Curr Opin Cell Biol. 22, 403-411 (2010).
- Phair, R. D., Misteli, T. Kinetic modelling approaches to in vivo imaging. Nat Rev Mol Cell Biol. 2, 898-907 (2001).
- Poser, I. BAC TransgeneOmics: a high-throughput method for exploration of protein function in mammals. Nat Methods. 5, 409-415 (2008).
- Sigal, A. Generation of a fluorescently labeled endogenous protein library in living human cells. Nat Protoc. 2, 1515-1527 (2007).
- Cohen, A. A. Dynamic proteomics of individual cancer cells in response to a drug. Science. 322, 1511-1516 (2008).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved