Method Article
Vibrodissociation من الخلايا العصبية من الدماغ القوارض شرائح لدراسة نقل صورة متشابك ومحطات قبل المشبكي
In This Article
Summary
هذا التقرير يوضح تقنية لعزل الخلايا العصبية ميكانيكية قابلة للحياة الفردية الاحتفاظ حبات قبل المشبكي المرفقة. Vibrodissociated الخلايا العصبية لديها مزايا الإنتاج السريع ، ومراقبة الدوائية ممتازة وتحسين الفضاء المشبك دون تأثير من الخلايا المجاورة. ويمكن استخدام هذه الطريقة لتصوير وتسجيل العناصر متشابك التصحيح ، المشبك.
Abstract
الميكانيكي تفكك الخلايا العصبية من الجهاز العصبي المركزي لديه ميزة أن حبات قبل المشبكي تظل تعلق على الخلايا العصبية معزولة من الفائدة. وهذا يسمح للفحص انتقال متشابك في ظل الظروف التي يمكن فيها للبيئات خارج الخلية بعد المشبكي وتسيطر عليها بشكل جيد داخل الخلايا. وهناك تقنية الاهتزاز المستندة دون استخدام البروتياز ، والمعروفة باسم vibrodissociation ، هو الأسلوب الأكثر شعبية بالنسبة للعزلة الميكانيكية. يتم وضع micropipette ، مع تلميح النار مصقولة على شكل كرة صغيرة ، إلى شريحة الدماغ مصنوعة من القوارض P1 P21. هو صدي للmicropipette موازية لسطح شريحة وخفضت من خلال شريحة سمك مما أدى إلى التحرر من الخلايا العصبية معزولة. الخلايا العصبية معزولة مستعدون للدراسة في غضون دقائق قليلة من vibrodissociation. هذه التقنية على استخدام مزايا الثقافات العصبية الأولية ، وشرائح الدماغ والخلايا العصبية معزولة إنزيمي بما في ذلك : الإنتاج السريع للخلايا العصبية ، قابلة للحياة ناضجة نسبيا المناسبة للدراسة الكهربية والتصوير ، والسيطرة متفوقة على البيئة خارج الخلية خالية من تأثير الخلايا المجاورة ؛ ملاءمة لجيد للرقابة الدوائية التجارب باستخدام التطبيق السريع والكامل للمخدرات superfusion الخلية ؛ وتحسين الفضاء المشبك في خلية كاملة التسجيلات المتعلقة الخلايا العصبية في شريحة أو مستحضرات ثقافة الخلية. ويمكن استخدام هذا الإعداد لدراسة متشابك الفيزيولوجيا وعلم الصيدلة وتعديل واللدونة. في الوقت الحقيقي التصوير كل من العناصر السابقة وبعد المشبكي في الخلايا الحية وحبات من الممكن أيضا استخدام الخلايا العصبية vibrodissociated. ويمكن أيضا توصيف المكونات الجزيئية من العناصر قبل وبعد المشبكي أن يتحقق مع النهج المناعية والتصوير القائم.
Protocol
1. إعداد Micropipette زجاج لهب المختومة
- استخدام الزجاج microelectrode ، وسحب معيار التصحيح ، المشبك micropipette على مجتذب micropipette يلهب براون أو ما يعادلها (قطر الحافة ~ 2 ميكرون). micropipette مكان غيض من اللهب في ناسخ بنسن لثوانى 2 ~ حتى تنصهر فيها أشكال الكرة التي يبلغ قطرها 200-300 ميكرون.
- مكان اللهب مختومة ماصة التصحيح على حامل على micromanipulator التي يمكن صدي بسرعة جنبا إلى جنب (المسافة السفر 100-200 ميكرون) باستخدام bimorph كهرضغطية ، والتتابع ، أو جهاز فعال مكافئ.
2. إعداد شرائح من دماغ الفئران P21 - P1 أو الفئران
- إعداد الاصطناعي السائل النخاعي (aCSF) مع التشكيل التالي (مم) : 124 كلوريد الصوديوم ، 4.5 بوكل ، 1.2 ناه 2 ص 4 و 26 NaHCO 3 ، و 10 D - غلوكوز. الحل فقاعة مع الأكسجين 95 ٪ / 5 ٪ CO 2 للغاز ~ 15 دقيقة ، ثم يضاف 2 مم CaCl 2 و 1 ملي MgCl 2.
- قطع شرائح الدماغ :
- تخدير الحيوانات أو مع هالوثان isoflurane. قطع رأس الحيوان -- إزالة الدماغ -- المخ كتلة في اتجاه المطلوب (، مجاور للسهمي الاكليلية ، عرضية ، وغيرها) لتشمل مناطق من الاهتمام.
- يضعوا في الدماغ لمنع تقطيع مرحلة من مراحل الدماغ تهتز الغارقة في aCSF -- انفجر في مكان شرائح aCSF مع كربوجين في غرفة "حضن مسبق" على المعاوضة التي تسمح للسوائل / التعرض للغاز على جميع الأسطح -- القسم في الدماغ 250-400 ميكرون سمك -- شرائح تسمح للتوازن في هذا الوسط لمدة ساعة على الأقل.
3. Vibrodissociation
- ملء طبق قطره 35 ملم مع ثقافة HEPES - مخزنة في محلول ملحي على التشكيل التالي (ملم) : 150 كلوريد الصوديوم ، 5 بوكل ، 10 HEPES ، 1 MgCl 2 ، 2.5 CaCl 2 ، 10 D - غلوكوز مع تعيين الرقم الهيدروجيني إلى 7.4 باستخدام هيدروكسيد الصوديوم و الأسمولية تعديلها لmOsM 300 ~ استخدام السكروز. قد تكون ثقافة الأطباق أطباق تعليق ، ومعيار ثقافة الخلية الأطباق والصحون الثقافة مع تدرج ساترة الزجاج ، أو أطباق مغطاة ، على سبيل المثال ، وبولي - L - يسين ، اعتمادا على الحاجة لالتزام أقوى الخلية إلى أسفل الطبق.
- وضع شريحة في صحن الثقافة وتصور مع المجسام تشريح في 250 العاشر عقد شريحة إلى أسفل باستخدام سلك البلاتين عازمة (0.5 مم) وضعت على السطح العلوي من شريحة ليكون بمثابة الوزن.
- موقف غيض من micropipette اللهب مختومة على سطح شريحة في منطقة الدماغ المطلوبة. تنشيط micromanipulator ليهتز طرف أفقيا في 10-30 هرتز ، وعلى مسافة نزهة ~ 100 ميكرون. باستخدام micromanipulator ، نقل معلومات سرية الى عمق النسيج شريحة من النوع الذي يمر عبر شريحة بأكملها داخل ~ 30 ثانية. كرر هذه الخطوة حسب الحاجة لزيادة عدد الخلايا العصبية المعزولة التي يمكن الحصول عليها من منطقة الدماغ معين.
- إزالة غيض من شريحة -- التقاط ملقط مع شريحة ويهز برفق في حين لا يزال الحل -- ثم إزالة شريحة وتجاهل تماما.
- السماح للخلايا نأت لتسوية والانضمام إلى أسفل الطبق لا يقل عن 10 دقيقة.
4. تسجيل الكهربية
- ضع صحن يحتوي على خلايا عصبية في مرحلة مجهر مقلوب وتصور مع 10 x إلى 63 هدف س. بحث عن الخلايا العصبية مع غشاء البراءة على نحو سلس ، blebbing لا ، ولكن نواة للاكتشاف لا المتضخم. إذا تم استخدام البصريات النقيض المرحلة ، والبحث عن التخلص من الخلايا العصبية مشرق مع مسحة صفراء ، وليس أزرق أيضا. خلايا Superfuse مع الحل المنشود خارج الخلية التي تحتوي على أملاح والمغذيات ومضادات مستقبلات ، الخ (معيارنا هو المالحة HEPES - مخزنة المذكورة أعلاه (القسم 3.1)) ، على أن تستكمل في كثير من الأحيان مع 5 ميكرومتر 2،3 - dioxo - 6 - نترو - 1 ، 2،3،4 - tetrahydrobenzo [و] quinoxaline - 7 - سلفوناميد ثنائي الصوديوم (NBQX) ، و25-100 ميكرومتر D - 2 - الأمينية - 5 - phosphonopentanoic حمض (AP5) لمنع المستقبلات الغلوتامات ionotropic الذي يسمح لعزل GABA سريع A IPSCs مستقبلات بوساطة 1،2.
- سحب micropipette التصحيح القياسية باستخدام مجتذب يلهب براون أو ما يعادلها. وينبغي أن تكون المقاومة ماصة غيض MΩ 2-4 (اعتمادا على حجم الخلية الهدف) عندما مليئة الكلورين -- -- الحل القائم.
- تسجيل إنشاء خلية كاملة من الخلايا العصبية باستخدام تقنيات تصوير الكهربية القياسية.
- سجل التيارات بعد المشبكي عفوية (sPSCs) باستخدام فجوة خالية من الحصول على البيانات البروتوكول. تطبيق 0،2-1 سم الأسماك الرباعية الأسنان ميكرومتر و / أو منخفضة الكالسيوم 2 + -- خارج الخلية التي تحتوي على حل لتسجيل التيارات بعد المشبكي مصغرة (mPSCs).
- يمكن أن تكون الحلول وكلاء الدوائية تطبيقها مباشرة على الخلايا. نستخدم superfusion المحلية من تنصهر أنابيب زجاجية مربعة ذات الرؤوس التي تنطوي على حل مع تبادل الحركة الجانبية للأنابيب التي شنت على micromanipulator السائر ، بالمحركات. هذا ألووكان الحل في لتبادل 10S إلى 100s من مللي ثانية لتحقيق التغيرات السريعة في المحتوى الجزيئي خارج الخلية ، وتطبيق مستقبلات ، الخ.
- وقد وضعت Akaike ورفاقه تقنيات لتحفيز حبات قبل المشبكي واحدة 3،4. يتم وضع micropipette قرب حبة تصور وتعطى التحفيز (الحافز السلبي للتيارات أمبير 10/05 ، 0،1-0،2 مللي ثانية مدتها). وتسجل IPSCs الوحدوي ، ويمكن استخدام أساليب مثل أسلوب من الاخفاقات لدراسة التغيرات في وظيفة قبل المشبكي وبعد المشبكي.
5. محطات التصوير قبل المشبكي
- يمكن ملء الخلايا العصبية بعد المشبكي مع الأصباغ المختلفة عن طريق ماصة التصحيح. ويمكن أيضا أن تكون مصنوعة من الخلايا العصبية الفئران معربا عن البروتينات الفلورية (FPS) مثل البروتين الفلوري الأخضر (GFP) في السكان الخلوية المحددة.
- ويمكن تصور أن تكون محطات قبل المشبكي على الخلايا العصبية vibrodissociated مصنوعة من الفئران التي تعبر عن ضباط في السكان عصبون معينة. على سبيل المثال ، معربا عن الفئران GFP مدفوعا كربوكسيل الغلوتامات 65 (GAD65) مروج خضراء somata تظهر الخلايا والعمليات في سلة interneurons قرن آمون وغيرها. العصبونات الهرمية Vibrodissociated من منطقة قرن آمون ومحطات CA1 محوار GFP إيجابية لapposed somata والتشعبات القريبة (الشكل 1A). العصبونات الهرمية vibrodissociated من الفئران التي تعبر عن synaptopHlourin (درجة الحموضة حساسة GFP متحولة تنصهر للبروتين متشابك VAMP2 حويصلة المرتبطة) تحت سيطرة المروج Thy1 كما حبات FP - الإيجابية المرفقة التي تظهر مضان الحموضة حساسة (1B الشكل).
- يمكن تحميلها مع حبات قبل المشبكي الأصباغ مؤشر الكالسيوم والجزيئات الأخرى التي تستخدم فلوري أسترته AM - 5 مركبات. ويبين الشكل 2 مثالا للتحميل باستخدام الصبغة الكالسيوم مؤشر Fluo4 - AM. هو أول تطبيق ، 1-2 ميكرومتر AM - أسترته لصبغ الخلايا العصبية في 37 درجة لمدة 10 دقيقة. يمكن صبغ اختراق في البيئة داخل الخلايا ، حيث يلتصق esterases جزيء ، مما أسفر عن الحر ، صبغ الخلايا impermeant وunquenched. هذا النهج يحمل كلا العنصرين قبل وبعد المشبكي الخلوية. بعد التحميل ، ويتم غسل الخلايا مع HEPES - مخزنة محلول ملحي والاحتفاظ بها في 37 درجة للحصول على 10 دقيقة إضافية. قبل اتخاذ GΩ ختم مع الزجاج الكهربائي ماصة ، يتم شطف الخلايا 3 مرات مع حل خارجي مخزنة.
- ثم يتم تأسيس وتسجيل كامل الخلية باستخدام محلول الصبغة خالية من الخلايا. 2-5 بعد دقيقة من التسجيل ، وتتم إزالة الصبغة معظمهم من عصبون بعد المشبكي ، مما يتيح تصور Fluo - 4 - تحميل حبات متشابك. كان رائدا من خلال هذه التقنية يي وآخرون 5.
- يمكن لحبات صبغ تحميله ثم تصور باستخدام التكبير العالية ، وارتفاع الهدف الفتحة العددية مع المجهر إما الكاميرا أو المستندة إلى multiphoton. لا يمكن أن يتحقق في وقت واحد كامل الخلية تسجيل الكالسيوم والتصوير باستخدام الإعداد كما هو مبين في الشكل 3. تم القبض على لوحات من الخلايا العصبية وحبات هو مبين في الشكل 2C مع الإلكترون multiplying تهمة device يقترن (EMCCD) الكاميرا. كانت القوة مصدر للضوء لإثارة الموهن إلى 1.2 ٪ مع مرشح الكثافة 1.0 محايدة وتصفية قزحية تعديلها لانتاج 12 ٪. ويمكن ملاحظة العابرين من الكالسيوم قبل المشبكي وحبات الخضراء وسجلت في الوقت الحقيقي ، وقياسها حاليا.
6. ممثل النتائج :
عفوية والحقن الحالية مستدعى إطلاق الخلايا العصبية Vibrodissociated
وتظهر تسجيلات من vibrodissociated الحصين نموذجي الخلايا العصبية CA1 في الشكل الهرمي 4A. ويمكن ملاحظة عفوية تجاوزت امكانات العمل في الخلايا العصبية الهرمية فصلها عن الفئران basolateral اللوزة ، الحصين وVTA 1،5. خلال المشبك الجاري التسجيلات من العصبونات الهرمية CA1 ، hyperpolarizing الحقن الحالية تنتج ردود الجهد نموذجي بينما التيارات depolarizing من حجم كاف انتزاع امكانات العمل تجاوزت مع نمط اطلاق تأخر نموذجي مع المستويات الحالية المعتدلة وإمكانات عمل غير استيعاب استجابة لحقن أقوى الحالية ( الشكل 4B).
GABAergic تحريمي عفوية والتيارات مصغرة في الخلايا العصبية بعد المشبكي Vibrodissociated
خلال الجهد المشبك التسجيلات مع CSCL حل يستند إلى داخل الخلايا ، ويلاحظ التيارات متشابك عفوية (الشكل 5A). يتم التخلص من هذه الأحداث في محلول يحتوي على الكالسيوم وانخفاض 2،6 ، وفي معظم أنواع الخلايا العصبية يتم حظرها تماما GABA ومستقبلات مثل bicuculline gabazine أو (الشكل 5B ، C) ، مشيرا إلى أن هذه هي sIPSCs بوساطة الافراج GABA وتفعيل هذا النوع الفرعي ionotropic مستقبلة. ومع ذلك ، في الخلايا العصبية الرئيسية من مناطق الدماغ مثل اللوزة basolateral (2) والمنطقة البطنية السقيفية 5،7 ، والحصار مستقبلات GABAيكشف EPSCs أقصر مدة بوساطة تفعيل glutamatergic أمبا من نوع المستقبلات. ومن المثير للاهتمام ، وتطبيق TTX بتركيزات التي هي محددة لحصار معظم السم قنوات الصوديوم الحساسة الجهد بوابات يقلل من وتيرة واتساع sIPSCs وحظ في الخلايا العصبية في الدماغ vibrodissociated من مناطق عدة (الشكل 6A) 2،4،7. وهكذا ، الصوديوم يشارك في نشاط قناة الإفراج GABA في حبات قرصه حالا متشابك. ليس واضحا بعد إذا كاملة امكانات العمل الصوديوم تحدث في هذه المحطات. ومن الجدير بالذكر أن المقاومة مدخلات بئر مختومة محطة ميكرومتر 1 محوار القطر ومن المرجح أن يكون جيدا في نطاق GΩ. وبالتالي ، قد فتح عدد ولو صغير من قنوات الصوديوم يكون كافيا ليزيل الاستقطاب محطات لتنشيط قنوات الكالسيوم التي تتوسط اقتران إفراز الإثارة. حول هذا الموضوع من هذه القنوات الكالسيوم ، وتشير الدلائل إلى أن N و P / Q - نوع قنوات المشاركة في الإفراج في محطات GABAergic في التحضيرات vibrodissociated CA1 من الحصين وغيرها 8.
وقد درست التشكيل واللدونة من انتقال المرض من خلال عدد من الناقلات العصبية والمستقبلات العصبية باستخدام vibrodissociated 3،4،9. والناقلات العصبية أظهرت أن مثل هذه الإجراءات modulatory ، GABA الأدينوساين ، السيروتونين ، endocannabinoids ، الخ 2،6،10،11،12. بالإضافة إلى ذلك ، كما تم قصيرة الأجل اللدونة متشابك ، مثل قمع الاستقطاب الناجم عن endocannabinoid التي تعتمد على تثبيط (DSI) وصفها في هذا التحضير 2،11. هذه النتائج تشير إلى أن العديد من أشكال الوساطة ومستقبلات الإشارات العابرة للمتشابك بواسطة neuromodulators الذاتية سليمة في إعداد vibrodissociated.
العابرون الكالسيوم والنسخة الحويصيلية في الفرض أكسون في إعداد Vibrodissociated
باستخدام المجهر EMCCD مجهزة مقلوب وصف أعلاه ، فقد درسنا العابرين الكالسيوم في محطات قبل المشبكي في إعداد الخلايا العصبية ، حبة vibrodissociated. ويبين الشكل 2 تحميل زنزانة مع AM - أسترته Fluo - 4 واللاحقة تخفيف الصبغة بعد المشبكي في الخلايا العصبية CA1 الحصين الهرمي. ويلاحظ والعابرين الكالسيوم عفوية في بعض حبات صبغ مليئة المناطق كما هو مبين في المصالح (رويس) في الشكل 6B. تطبيق سم الأسماك الرباعية الأسنان ميكرومتر 1 (TTX) نتخلص من هذه العابرين عفوية ، مشيرا إلى أن وساطة من قبل التيارات تفعيل الجهد الصوديوم المعزولة التي يتم تفعيلها تلقائيا في حبات ، مما يؤدي إلى ارتفاع الكالسيوم اللاحقة. زيادة بوكل خارج الخلية من 10 ملم الى 40 ملم مع تبادل حل سريع ينتج زيادة في مضان مقاسا رويس التي تتوافق مع محطات قبل المشبكي (7A الشكل). يستخدم تسجيل متزامنة من عصبون بعد المشبكي sIPSCs لرصد وتحديد ما إذا كان هو زيادة وتيرة الحدث الاستقطاب عالية + K (7B الشكل).
لتصور الانصهار الحويصلة في حبات قبل المشبكي استخدمناها الفئران معربا عن synaptopHlourin بناء تحت سيطرة المروج Thy1 (المسمى spH21 الفئران). SynaptopHluorin في بناء الجزيئية التي ترتبط pHlourin مسير الشمس (أ متحولة GFP بحساسية تعزيز درجة الحموضة) 12 إلى غشاء الحويصلة يرتبط البروتين (VAMP2) 13. هذا الترتيب situates عزر pHlourin في تجويف الحويصلة حيث البيئة الحمضية نسبيا يروي مضان. على الانصهار الحويصلة يتعرض هذا عزر للبيئة خارج الخلية أكثر حيادا مع الزيادة الناتجة في مضان في نقاط والتي تتوافق مع حويصلات / محطات قبل المشبكي. Vibrodissociation من الخلايا العصبية قرن آمون من الفئران spH21 يسمح التصور من نقاط والفلورسنت من حجم وموقع المتوقعة لمحطات GABAergic (الشكل 8A). تطبيق عالية K + -- التي تحتوي على حل خارجي يزيد من التألق في هذه المحطات ، ويتم حظر هذا الغرض في وجود حل الخارجية التي يتم تقليل الكالسيوم خارج الخلية إلى 0.2 ملم (8B الشكل). وبالتالي ، فإن الزيادة التي يسببها الاستقطاب في مضان يبدو أن تعكس الإثارة - إفراز اقتران في نقاط الاشتباك العصبي GABAergic في إعداد الخلايا العصبية ، حبة.
القدرة على قياس الكالسيوم قبل المشبكي العابرين والانصهار الحويصلة في محطات محوار إعداد الخلايا العصبية ، حبة يسمح لنا لدراسة الآثار الناجمة عن المخدرات ، وإساءة المعاملة وneuromodulators اللدونة متشابك على آليات المشاركة في الإثارة قبل المشبكي ، واقتران إفراز إيماس / الإلتقام. ويمكن أيضا أن تكون هذه التقنيات مجتمعة مع غيرها من الأدوات الجزيئية والفئران المهندسة وراثيا لدراسة دور البروتينات في وظيفة معينة قبل المشبكي والتشكيل / اللدونة.
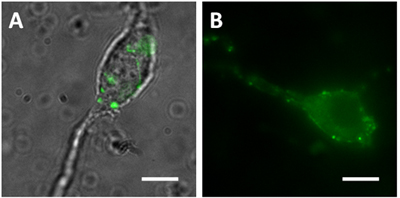
الشكل 1. Vibrodissociated الخلايا العصبية من المنطقة CA1 الحصين (أ) صورة من مدينة دبي للإنترنت مدموجة aالصور الثانية ومضان أخضر من ماوس GAD65. مدينة دبي للإنترنت يتم دمج الصورة لتظهر بوضوح مواقع المحطات الخضراء (ب) صورة من الإسفار ماوس (spH21) synaptophluorin. مقياس بار = 10 ميكرومتر

الشكل 2 الكالسيوم مؤشر التحميل الداخلي : (أ) يتم تحميل خلية كاملة مع AM - أسترته صباغة ، (B) خلية كاملة تسجيل يخفف صبغة ؛ (C) والمحطات المرئية والمناطق ذات الاهتمام (السهام).

الشكل 3. رسم تخطيطي من الإعداد التجريبية لتسجيل كامل الخلية في وقت واحد والتصوير الكالسيوم في المحطات على الخلايا العصبية قبل المشبكي vibrodissociated. EMCCD ضرب الإلكترون = تهمة جانب الجهاز.

الشكل 4. يظهر الممثل الطول الموجي (A) إمكانات العمل من تلقاء أنفسهم من الخلايا العصبية CA1 vibrodissociated و (ب) الاستجابات الجهد لغشاء hyperpolarizing وdepolarizing الحقن الحالية في التسجيلات الجاري المشبك من الخلايا العصبية CA1.
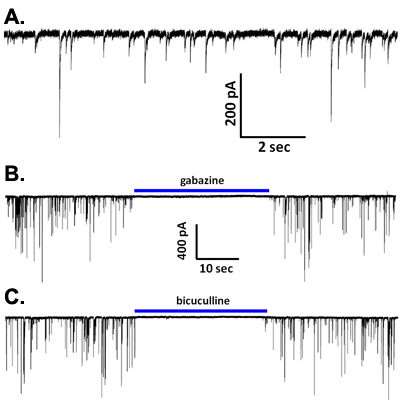
الشكل 5 : (أ) الطول الموجي من الممثل IPSCs عفوية من الخلايا العصبية CA1 الهرمي. (قبل الميلاد) كانت منعت من قبل أي من IPSCs gabazine (10 ميكرومتر ؛ B) أو bicuculline (20 ميكرومتر ؛ جيم).
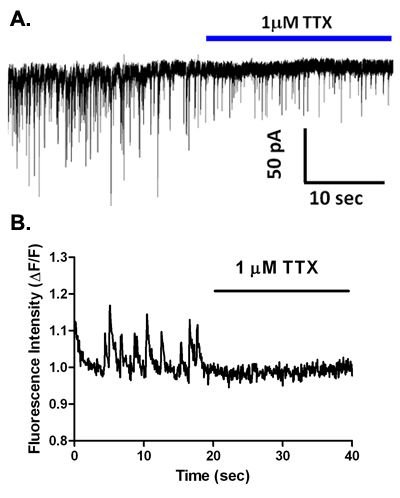
الشكل 6. TTX يمنع انتقال متشابك GABAergic عفوية ، ويزيل العابرين الكالسيوم قبل المشبكي استعدادا للقرن آمون vibrodissociated. (أ) تسجيل من الخلايا العصبية vibrodissociated قبل وأثناء TTX التطبيق. لاحظ انخفاضا في وتيرة واتساع sIPSCs. (ب) العابرين الكالسيوم التي لوحظت في محطة Fluo - 4 - تحميلها على الخلايا العصبية قبل المشبكي vibrodissociated قبل وأثناء TTX التطبيق. لاحظ خسارة كاملة من العابرين.
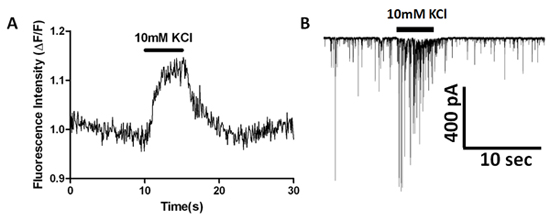
الشكل 7. التصوير الفورية مؤشر الكالسيوم وsIPSC كامل الخلية تسجيل تظهر آثار ارتفاع K + التشويق. (A) الإسفار يقاس على مر الزمن من قبل المشبكي حبة محملة Fluo ، 04:00 صباغة. (ب) زيادة فورية للتردد sIPSC والسعة العالية أثناء تطبيق + K.

الشكل 8. كا 2 + التي تعتمد على ارتفاع - K + استجابة في حبات من قبل المشبكي spH21 عصبون هرمي من المنطقة CA1 الحصين. (أ) صورة من الخلايا العصبية الإسفار vibrodissociated. (ب) K الرفيع أدى تطبيق + (المشار إليها بواسطة شريط أسود) في زيادة مستمرة في التألق في وجود طبيعي لدينا حل خارج الخلية التي تحتوي على الكالسيوم + 2 (2 ملي CA2 +). لم يلاحظ أي زيادة في الكالسيوم خارج الخلية مضان منخفضة 2 + (0.2 ملي كا 2 +). تم تطبيع البيانات في الرسم البياني إلى مستويات ما قبل ارتفاع + - K مضان ، وتظهر استجابة المتوسط في الفترة من 3 حبات.
Discussion
vibrodissociation الناجحة تتطلب أن شرائح تحتوي على الخلايا العصبية السليمة والتي مسافات خلالي مرنة بما فيه الكفاية للسماح للخلايا العصبية للخروج من دون وقوع خسائر شريحة سامة. وبالتالي ، فإن التقنية تعمل بشكل أمثل في سن مبكرة بعد الولادة (P1 - 21) عندما يمكن جعل شرائح صحية بمواد أقل الدبقية / interstiatial مما هو موجود في شرائح الدماغ الكبار. في تجربتنا ، ومع ذلك ، وتحسين إعداد شريحة لبقاء الخلايا العصبية في الشريحة نفسها قد تكون عكسية لتقنية vibrodissociation. بينما نحن نستعد بشكل روتيني للشرائح في تسجيل الموقع باستخدام الباردة aCSF تعديل الذي تم استبداله السكروز لكثير من نا + كا 2 خارج الخلية ويمكن تحضير + والشرائح التي أعدت لvibrodissociation (مثل قطع) في aCSF لدينا تسجيل العادي. عندما تستعد لتسجيل شرائح من الخلايا العصبية الفردية في شرائح أنفسهم أيضا نضع الشرائح في aCSF الطبيعي بنحو 35 درجة مئوية بعد sectioning وتركهم ل30-60 دقيقة في هذه الحرارة قبل أن تعيدهم إلى درجة حرارة الغرفة. ومع ذلك ، يتم نقل شرائح أعدت للvibrodissociation فورا إلى درجة حرارة الغرفة بعد تشريح. هذه الإجراءات توفير عائدات أعلى من الخلايا العصبية السليمة vibrodissociation بعد ، ربما بسبب عدم وجود شركة النسيج الخلالي الذي يسمح الخلايا العصبية أكثر سهولة اهتزت فضفاض من الشريحة نفسها. نحن لم درست باستفاضة الظروف إعداد شريحة ، ونحصل على ما يكفي من الخلايا العصبية بشكل روتيني لتسجيل لدينا وتجارب التصوير في يوم معين. فمن الممكن أن يمكن إجراء تعديلات إضافية ، مثل التغييرات في سمك شريحة أو إجراءات preincubaton ، لزيادة الغلة من الخلايا العصبية السليمة. وقد حاول العلاج البروتيني خفيفة جدا في محاولة لزيادة الغلة الخلية والحصول على تقنية العمل في الحيوانات الاكبر سنا. ومع ذلك ، دائما العلاج حتى البروتيني خفيفة يبدو لتعطيل وظيفة المشبك. وهكذا ، في حين أن مجموعة من البروتيني والميكانيكية قد لا يزال تفارق يمكن العثور على العمل الذي لم يثبت الخلايا العصبية في الدماغ المقدم موثوق بها حتى الآن.
وينبغي أيضا أن يكون لاحظت العائد المنخفض نسبيا من الخلايا العصبية السليمة بعد vibrodissociation يعني أن التقنية مفيدة بشكل رئيسي لدراسة فرعية العصبية وفيرة ، والإسقاط الخلايا العصبية في المقام الأول. توافر GFP - معربا عن الفئران التي يمكن من خلالها مجموعات سكانية فرعية صغيرة الخلايا العصبية التي تم تحديدها بسهولة يزيد من فرصة لدراسة هذه الخلايا العصبية النادرة. ومع ذلك ، ما لم يمكن تحسين العائد الخلايا العصبية بشكل كبير من البيانات عن تراكم هذه الخلايا العصبية من المرجح أن يكون بطيئا نسبيا.
وقد أثبتت العديد من الخطوات لتكون حاسمة بالنسبة لنجاح التحميل من الخلايا العصبية مع الكالسيوم للاستشعار الأصباغ. يتم تنفيذ التعرض لAM - أسترته صبغ عند 37 درجة مئوية ، وأننا لم ننجح في محاولة لصبغ تحميل عند درجات حرارة منخفضة. وينبغي أن يكون الأمثل للتركيز الأصباغ اعتبار كل وقت التحميل ودرجة الحرارة منذ يبدو أن تركيز أعلى من تحميل وصبغ يقلل تركيز الكالسيوم في حبات قبل المشبكي. وقد لاحظنا أن تحميل مع تركيزات أعلى انخفاض وتيرة واتساع sIPSCs. عند تحميل الكالسيوم في محطات الاستشعار عن الصبغات من الخلايا العصبية قبل المشبكي vibrodissociated يجب أخذ الحيطة والحذر بسبب التخزين المؤقت قدرة حبات من قبل المشبكي الصغيرة قد تكون مختلفة عما كانت عليه في سوما وأحجام حبات ليست متسقة. تغسل الأطباق التي تحتوي على الخلايا العصبية مع HEPES - مخزنة حل الخارجية بعد تحميل وصباغة ، ووقت الشفاء بعد الغسيل أمر بالغ الأهمية. بالإضافة إلى ذلك ، لجعل ختم جيدة لتسجيل كامل الخلية ، يجب غسلها جيدا الخلايا للتخلص من جزيئات غير المنضوية الصبغة من الغشاء الخلوي الخارجي.
بالإضافة إلى استخدام الخلايا العصبية vibrodissociated للتصوير الخلايا الحية والكهربية ، ويمكن أيضا تقنيات immunocytochemical يمكن تطبيقها على هذه الخلايا 11،12. ويمكن بسهولة الخلايا الثابتة والملون مع مجموعة متنوعة من الأجسام المضادة ، وعلامات خلية أخرى. استخدام هذه الخلايا يوفر إعداد التصور نظيفة للتعبير البروتين في محطات قبل المشبكي GABAergic. استخدام الفئران التي تعبر عن البروتينات الفلورية تحت سيطرة المروجين محددة لGABAergic الخلايا العصبية يسمح للمحقق لتحديد محطات متشابك الفردية في إعداد وvibrodissociated (الشكل 1). قد علامات الفلورسنت التصوير من هذا النوع تسمح القياسات المورفولوجية في المحطات باستخدام الليزر القائمة على أحدث التقنيات والمجهري مثل STED (الميكروسكوب تحفيز استنفاد الانبعاث). التصور مع الأصباغ ذلك التقرير الدراجات حويصلة متشابك من الممكن أيضا مع هذا الإعداد. وصفت Akaike وزملاء العمل مع محطات GABAergic الصبغة styryl ، FM1 - 43 لتصور محطات في الخلايا الحية 4.
ينبغي أن يكون من الممكن أيضا لأداء وحيدة الخلية المنتسخة العكسية PCR RNA التعبير في ملف vibrodissociatedالخلايا العصبية. يتم تطبيق هذه التقنية بشكل روتيني إلى إنزيمي - نأت الخلايا العصبية والخلايا العصبية التي تزرع في المزارع الخلوية.
Disclosures
Acknowledgements
نود أن نعترف الدكاترة. يونيو بينغ تشو وكوياما سوسومو على المساعدة التي قدموها أثناء إعداد الأولي للتقنية ، والدكتور فيرونيكا الفاريز من أجل المساعدة في تنسيق مخطوطة مكتوبة. وقد تم تمويل هذه الدراسة من قبل شعبة البحوث السريرية وجماعية من NIAAA الطبية الحيوية.
Materials
| Name | Company | Catalog Number | Comments |
| بند | شركة | كتالوج # | تعليقات |
| تهتز القطاعة الأنسجة | لايكا مايكروسيستمز | VT1200S | |
| خلية الطبق الثقافة (35 ملم) | فالكون دينار بحريني | 353001 | |
| أطباق زجاجية القاع | Willco طبق | GWSB - 5040 - 3522 أو GWSB | سماكة الزجاج 0،16-0،19 مم للتصوير |
| كهرضغطية مناور | Exfo - بيرلي | LSS - 3000 | ويمكن أيضا استخدام التتابع ، الخ. |
| SD9 ساحة نبض محفز | العشب تكنولوجيز | SD9K | لتحريك تتلاعب كهرضغطية |
| تشريح المجسام | Heerbrugg البرية | TYP 374590 | ويمكن أيضا استخدام أي المجسام |
| لهب / براون micropipette مجتذب | سوتر الصك | P - 97 | |
| رقيقة الجدار الزجاجي الشعيرات الدموية | العالم آلات دقيقة | TW - 150F - 4 | لاللهب مختومة micropipette الزجاج وmicropipette التصحيح |
| ستة صمام نظم الإرواء قناة التحكم | نذير الآلات | VC - 6 أو VC - 6M | |
| نضح الخطوة السريعة | نذير الآلات | SF - 77B | |
| مجهر مقلوب مع 63x 20 أهداف | نيكون | TS200 Diaphot | |
| EMCCD الكاميرا | ANDOR التكنولوجيا | iXon EM + DU - 888 | |
| تثير الإضاءة الخفيفة المصدر الإسفار | EXFO الضوئيات شركة الحلول | X - سايت 120PC | |
| Fluo - 4 ، صباحا مؤشر الكالسيوم | المسابر الجزيئية | F14201 |
References
- Zhu, P. J., Lovinger, D. M. Ethanol potentiates gabaergic synaptic transmission in a postsynaptic neuron/synaptic bouton preparation from basolateral amygdala. J Neurophysiol. 96, 433-441 (2006).
- Zhu, P. J., Lovinger, D. M. Retrograde endocannabinoid signaling in a postsynaptic neuron/synaptic bouton preparation from basolateral amygdala. J Neurosci. 25, 6199-6207 (2005).
- Akaike, N., Moorhouse, A. J. Techniques: Applications of the nerve-bouton preparation in neuropharmacology. Trends Pharmacol Sci. 24, 44-47 (2003).
- Akaike, N., Murakami, N., Katsurabayashi, S., Jin, Y. H., Imazawa, T. Focal stimulation of single gabaergic presynaptic boutons on the rat hippocampal neuron. Neurosci Res. 42, 187-195 (2002).
- Ye, J. H., Wang, F., Krnjevic, K., Wang, W., Xiong, Z. G., Zhang, J. Presynaptic glycine receptors on gabaergic terminals facilitate discharge of dopaminergic neurons in ventral tegmental area. J Neurosci. 24, 8961-8974 (2004).
- Koyama, S., Matsumoto, N., Kubo, C., Akaike, N. Presynaptic 5-ht3 receptor-mediated modulation of synaptic gaba release in the mechanically dissociated rat amygdala neurons. J Physiol. 529, 373-383 (2000).
- Deng, C., Li, K. Y., Zhou, C., Ye, J. H. Ethanol enhances glutamate transmission by retrograde dopamine signaling in a postsynaptic neuron/synaptic bouton preparation from the ventral tegmental area. Neuropsychopharmacology. 34, 1233-1244 (2009).
- Murakami, N., Ishibashi, H., Katsurabayashi, S., Akaike, N. Calcium channel subtypes on single gabaergic presynaptic terminal projecting to rat hippocampal neurons. Brain Res. 951, 121-129 (2002).
- Zhu, P. J., Lovinger, D. M. Persistent synaptic activity produces long-lasting enhancement of endocannabinoid modulation and alters long-term synaptic plasticity. J Neurophysiol. 97, 4386-4389 (2007).
- Inada, H., Maejima, T., Nakahata, Y., Yamaguchi, J., Nabekura, J., Ishibashi, H. Endocannabinoids contribute to metabotropic glutamate receptor-mediated inhibition of gaba release onto hippocampal ca3 pyramidal neurons in an isolated neuron/bouton preparation. Neuroscience. 165, 1377-1389 (2010).
- Miesenbock, G., De Angelis, D. A., Rothman, J. E. Visualizing secretion and synaptic transmission with ph-sensitive green fluorescent proteins. Nature. 394, 192-195 (1998).
- Li, Z., Burrone, J., Tyler, W. J., Hartman, K. N., Albeanu, D. F., Murthy, V. N. Synaptic vesicle recycling studied in transgenic mice expressing synaptophluorin. Proc Natl Acad Sci U S A. 102, 6131-6136 (2005).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved