A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تحليل التدفق الخلوي للخلايا المناعية وفي الفئران Aortas
In This Article
Summary
تعرض هذه الورقة على تدفق الخلوي على أساس أسلوب التحقيق في تكوين المناعة في aortas. ورقة يوضح أيضا تقنية إضافية تسمح بدراسة البرانية المحيطة وجدار الوعاء الدموي بشكل منفصل. هذه الطريقة يفتح الاحتمالات لإجراء تحليلات phenotypical من الكريات البيض الأبهر وتطبيق المقايسات المناعية للدراسات عدة تصلب الشرايين.
Abstract
تصلب الشرايين هو عملية التهابات مزمنة من السفن المتوسطة الحجم والكبيرة التي يتميز تشكيل لويحات التي تتكون من خلايا رغوية ، وخلايا المناعة وخلايا العضلات الوعائية البطانية وسلس ، والصفائح الدموية ، المصفوفة خارج الخلية ، والدهون الأساسية الغنية مع واسعة النطاق ونخر تليف الأنسجة المحيطة بها ، ويشارك الأسلحة (1) الفطرية والتكيفية للاستجابة مناعية في التنمية ، وبدء واستمرار تصلب الشرايين. 2 و 3 وهناك مجموعة كبيرة من الأدلة على أن مجموعات فرعية مختلفة من الخلايا المناعية مثل الخلايا البلعمية الكبيرة ، شجيري الخلايا اللمفية تي ، وباء ، موجودة داخل aortas من الفئران صحية وتصلب الشرايين المعرضة - 4. بالإضافة إلى ذلك ، تم العثور على خلايا المناعة في البرانية الأبهر المحيطة الأمر الذي يوحي بدور هام في هذا النسيج من تصلب الشرايين. 2
لبعض الوقت ، كانت محدودة للكشف كمية من أنواع مختلفة من الخلايا المناعية ، وضعهم التنشيط والتكوين الخلوي داخل جدار الشريان الأبهر بواسطة RT - PCR وطرق المناعى لدراسة تصلب الشرايين. بذلت محاولات قليلة لتنفيذ التدفق الخلوي باستخدام aortas الإنسان ، وعدد من المشاكل ، مثل ارتفاع تألق ذاتي ، تم الإبلاغ عن 5،6. وهضم لويحات تصلب الشرايين مع الإنسان كولاجيناز 1 ، وجمعت الخلايا الحرة والملون لCD14 + / + CD11c لتسليط الضوء على الخلايا المشتقة من البلاعم الرغوة. في هذه الدراسة ، تم استخدام "وهمية" قناة لتجنب تلطيخ إيجابية كاذبة. 6 مواد نخرية المتراكمة أثناء عملية الهضم تؤدي إلى توافر كميات كبيرة من الحطام الذي يولد تألق ذاتي عالية في عينات الأبهر. لحل هذه المشكلة ، وقد اقترحت لجنة المراقبة السلبية والإيجابية ، ولكن يمكن تطبيقها فقط تلطيخ مزدوجة في هذه العينات. قمنا بتطوير التدفق الخلوي الجديد القائم على أسلوب 7 لتحليل تركيبة الخلايا المناعية وتميز التنشيط ، والانتشار ، والتمايز للخلايا المناعية في الشريان الأورطي صحية وتصلب الشرايين المعرضة لل. هذا الأسلوب يسمح للتحقيق في تكوين الخلايا المناعية للجدار الشريان الأبهر ويفتح احتمالات لاستخدام مجموعة واسعة من الطرق المناعية للتحقيقات جوانب المناعة من هذا المرض.
Protocol
1. عزلة aortas الفئران
مطلوب موافقة اللجنة المؤسسية IACUC الإجراء للعمل مع الفئران.
- إعداد برنامج تلفزيوني heparinzed بإضافة 1000 وحدة هيبارين الصوديوم إلى PBS 50 ملم وقلب الأنبوب إلى المزيج. يعد أنبوب جمع فارغة للدم والتي تحتوي على أنبوب جمع PBS لكل الأبهر التي سيتم جمعها. إبقاء جميع الأنابيب على الجليد.
- يعالج بالهيبارين حقنة للدم الرسم (0.1ml من 1000 هيبارين الصوديوم يو / مل) ، وإعداد الأدوات الجراحية (اثنين من أزواج من ملقط المنحني ، وزوج من مقص تشريح ، وزوج من microshears) ، ومرحلة تشريح للتشريح.
- الموت ببطء ماوس باستخدام غاز ثاني أكسيد الكربون في الغرفة التالية وافقت المعاهد الوطنية للصحة والمؤسسية سياسات اللجنة بشأن القتل الرحيم IACUC القوارض. التحقق من الفعالية وذلك قبل نقل الماوس إلى مرحلة تشريح.
- ينقع لفترة وجيزة الفأر مع الايثانول 70 ٪ وربط الماوس لمرحلة تشريح. سحب الدم من الماوس عبر ثقب في القلب.
- فتح تجاويف البطن والصدر. استخدام حقنة 10 مل مع إبرة ز 25 ، يروي تماما مع الأوعية الدموية PBS المحتوية على 2 ٪ من الهيبارين لإزالة الدم من الأوعية التي ثقب في القلب. تأكد من عدم وجود الدم في الأنسجة الأبهر. ينبغي أن يقوم على نضح ببطء مع قليل من الضغط لضمان أن جميع اللوحات في جدار الوعاء الدموي لا تزال سليمة.
- تشريح وإزالة الأجهزة الحشوية ، وأجهزة البولي التناسلي ، والحجاب الحاجز والطحال ، وترك الكلى والقلب ، والشريان الأورطي سليمة.
- تشريح بعناية الأنسجة الدهنية والغدد الليمفاوية شبه الأبهر بعيدا عن الشريان الأبهر ، وترك الأبهر والبرانية سليمة. جمع قوس الأبهر بأسره بما الأبهري ، الصعود ، تنازلي ، الصدر ، البطن والأجزاء. مكان الشريان الأورطي معزولة في أنبوب جمع مع برنامج تلفزيوني. خلال إجراء العزل ، في محاولة للحفاظ على رطوبة السفينة.
2. إعداد تعليق خلية واحدة
- إنشاء 1X أنزيم التفكك الأورطي الحل الأسهم (عدس) (125 U / مل كولاجيناز نوع الحادي عشر ، و 60 يو / مل نوع هيالورونيداز 1 ق ، 60 U / مل الدناز الأول ، و 450 نوع كولاجيناز يو / مل الأول ، في 2.5 مليليتر من برنامج تلفزيوني ، من تعديل غالكينا آخرون 7). جميع الأنزيمات هي من سيغما الدريخ. وضع حل انزيم الأسهم على الجليد.
- إزالة برنامج تلفزيوني من الأنبوب الذي يحتوي على مجموعة الأبهر. إضافة 2.5 مل من 1X عدس إلى كل الأبهر. قطع aortas الى قطع صغيرة لتسهيل عملية الهضم الأنزيمي أو مغادرة الأبهر كلها سليمة. لاحتضان aortas مع الحل انزيم 1X لمدة 1 ساعة في 37 درجة مئوية (أبطأ تهز اختيارية).
- بعد حضانة 1 ساعة ، وإعداد تعليق خلية واحدة من الشريان الأورطي هضمها بواسطة القص وaortas إربا وتمريرها من خلال مصفاة الى 70 ميكرومتر الخلية 5ml أنابيب البولي بروبلين FACS دينار بحريني (فالكون). بيليه الخلايا بواسطة الطرد المركزي (400xg ، 5 دقائق ، و 4 درجات مئوية).
- Resuspend الخلايا في 1ml من العازلة FACS (PBS تستكمل مع جيش صرب البوسنة 1 ٪ و 0.05 ٪ نان 3) وتحديد عدد الخلايا موجودة في الخلية تعليق الأورطي باستخدام التريبان الأزرق ، عدادة الكريات أ ، والمجهر الخفيفة. فإن مجموع عدد الخلايا التي تم الحصول عليها بعد عملية الهضم تعتمد على العمر والنظام الغذائي الماوس أو شدة تصلب الشرايين.
3. التدفق الخلوي تلطيخ
- تسمية عدد مناسب من أنابيب FACS جديدة. بصفة عامة ، ينبغي أن يكون التدفق الخلوي التجارب أنبوب تحكم غير الملون ، مجموعة من أنابيب لون واحد ، حسب مضان ناقص واحد والتحكم (FMO) 8 ، والضوابط المناسبة isotype ، ومجموعة من الأنابيب التجريبية. لأن هناك عدد محدود من الكريات البيض الأبهري يمكن أن تكون معزولة ، ويمكن استخدامها لأداء الطحال الكريات البيض واحدة تلطيخ السيطرة.
- نستخدم التدفق الخلوي معيار بروتوكول لخلية وصمة عار معلق الأبهر. لفترة وجيزة ، نقل مجموعة من الخلايا قسامة 0.5 1x10 6 من التعليق الخلية في أنبوب الأبهر FACS (ق). إضافة 1ml من FACS العازلة وبيليه الخلايا بواسطة الطرد المركزي. إزالة طاف من الخلايا بواسطة مكعبات الصب.
- إعداد التيسير والكوكتيلات حل كتلة الجسم المضاد للأنابيب التجريبية ، وأنابيب مضان ناقص واحد ، وأنابيب isotype. إضافة 100μl كتلة عازلة القدم في FACS (14.2μg/ml ، استنساخ 2.4G2) إلى كل من أنابيب ونفض الغبار الاصبع او دوامة برفق لresuspend الخلايا. احتضان هذه العينات لمدة 15-20 دقيقة في درجة حرارة الغرفة.
- إعداد تلوين الأجسام المضادة ، وتلطيخ isotype أو زجاجات FMO تلطيخ السيطرة. تحديد تركيز الأجسام المضادة الأمثل في تجارب المعايرة الخاص الأولية. في وجود كتلة أف سي ، إضافة الكوكتيلات الأضداد (100ul/0.5-1.0x10 6 خلايا) للأنابيب العينة. احتضان لمدة 20-30 دقيقة عند 4 في الظلام درجة مئوية.
- إضافة 1ml من العازلة FACS لكل أنبوب ، ودوامة لخلط وبيليه الخلايا بواسطة الطرد المركزي. كرر الإجراء مرة أخرى.
- صب وطاف وresuspendالخلايا في مكعبات من 300μl PFA 2 ٪. تشغيل العينات على تدفق عداد الكريات.
- يضاف نموذجيا لمكافحة CD45 الضد (مستضد الكريات البيض علامة المشتركة) لجميع العينات من أجل بوابة CD45 + الكريات البيض في وقت لاحق 7 بالإضافة إلى ذلك ، ينبغي استخدام CD45 FMO والضوابط isotype في البداية لوضع بوابة CD45 + الكريات البيض على النحو التالي : ملاحظة. CD45 يمكن التعبير تختلف بين الكريات البيض.
- ملاحظة : للكشف عن التعبير عن مستضدات منخفض الكثافة السطحية أو مستضدات الحدث منخفضة ، واستخدام "fluorochromes مشرق" مثل R - فيكوإيريترين (PE) أو Allophycocyanin (APC). بالإضافة ، يمكن الكشف عن الأحداث النادرة التي تجمع عدة aortas المتطابقة معا ، ولكن إذا تم استخدام أكثر من مليون خلية ، وينبغي زيادة كمية الأجسام المضادة المستخدمة في اختبار متناسب.
- ملاحظة : لضمان عدم وجود الحد الأدنى من التلوث بالدم في aortas معزولة ، وبالتالي في تعليق خلية الأبهري ، في بعض التجارب التي أجريت إضافية لتلطيخ TER - 119 ، 7 مستضد أعرب من قبل خلايا الدم الحمراء (RBC). عدد RBC لخلايا الدم البيضاء (WBC) في الدم حوالي 10x10 6 خلية / ميكرولتر إلى الخلية 8X10 3 / ميكرولتر. استنادا إلى التعبير عن TER - 119 في عينات الأبهري ، ويمكن حساب نسبة الدم المستمدة من خلايا الدم البيضاء في العينة. لدينا عادة أقل من 0.02 ٪ من الدم الناجم عن مكافحة حرائق آبار النفط في عينات الأبهر (Fig.1)
- ملاحظة : منذ العلاج الانزيم قد يؤثر على التعبير عن مستضدات السطحية ، وينبغي أن تحدد المقاومة في هضم أنزيم لمستضدات من الفائدة. باختصار ، هي العقدة الليمفاوية الطرفية المحتضنة (PLN) أو قطعة صغيرة من الطحال مع أو بدون إنزيم الكوكتيل لمدة 1 ساعة عند 37 درجة مئوية. بعد 1 ساعة ، ويتم تحديد التعبير عن مستضدات من قبل التدفق الخلوي. الكوكتيل انزيم له أي تأثير على المستضدات السطحية متعددة (Fig.2) 7. في بعض الحالات الأخرى ، أدى العلاج الانزيم في خسائر كبيرة في التعبير عن مستضد. ويمكن الالتفاف على هذه المشكلة باستخدام علامات الخلية البديلة.
- ملاحظة : لا يمكن أن يؤديها لايف / قتلى تلطيخ بقاء الخلية بعد الخطوة 4 إذا رغبت في ذلك. وعادة ما تستخدم لايف / الميت قابل للتثبيت طقم خلية الميت اللطخة (Invitrogen ، المسابر الجزيئية). لصبغ الخلايا مع صبغة لايف / الميت ، ايجاد حل لايف 1X / الميت بإضافة 1μl إعادة الصبغة الذائبة العيش / 1ml من القتلى في برنامج تلفزيوني ودوامة لالمزيج. إضافة 100-200 ميكرولتر من 1X صبغة لايف / الميت في العيش كوكتيل / ميتا ، واحد ، وعينات مراقبة FMO isotype. احتضان هذه العينات مع الصبغة في درجة حرارة الغرفة لمدة 10 دقيقة في الظلام. الأنبوب تحكم واحد لايف / الميت ينبغي المحتضنة عند 56 درجة مئوية في الظلام لمدة 10 دقيقة لقتل الخلايا عن طريق الصدمة الحرارية. غسل الخلايا مع 1 مل من خلايا وبيليه في برنامج تلفزيوني عن طريق الطرد المركزي. استئناف البروتوكول في الخطوة 5.
- ملاحظة : لتلوين بين الخلايا والخلايا المستضدات السيتوكينات متوافق مع هذا البروتوكول. باختصار ، يمكن إجراء تثبيت التلوين باستخدام الخلايا خلية / الكواشف permeabilization من Pharmingen دينار بحريني ، eBioscience ، أو المختبرات Caltag -- اعتمادا على مولدات المضادات في المصالح. لإصلاح وpermeabilize الخلايا للتلوين داخل الخلايا ، نفذ الخطوة التثبيت / permeabilization ، باتباع إرشادات الشركة المصنعة ، بعد الخطوة تلطيخ خارج الخلية (القسم 3 الخطوة 5). الخطوة التالية غسل داخل الخلايا ، واستئناف بروتوكول لدينا في الخطوة 6 (القسم 3 الخطوة 6).
4. تحليل التدفق الخلوي معزولة البرانية المحيطة وجدار الوعاء الدموي
كما يمكن أن الكريات البيض تهاجر إلى البرانية الأبهري ، وكذلك لويحات تصلب الشرايين داخل جدار الشريان الأبهر ، لدراسة الكريات البيض وبراني الأبهر بواسطة التدفق الخلوي تم وضع بروتوكول للعزل وأداء التدفق الخلوي على هذين الموقعين التشريحية. 9 لفترة وجيزة ، وقبل كل aortas يتم هضمها مع عدس (القسم 2 ، الخطوة 2) غير المهضوم جزئيا البرانية الأبهر وإزالتها من بقية السفينة. بمجرد إزالة البرانية وتوضع جانبا ، وهضم ما تبقى من الشريان الأورطي مع عدس لتحرير الكريات البيض من جدار الوعاء الدموي.
- الأبهر البرانية عزل بروتوكول
- بعد إعداد 1X عدس (القسم 2 الخطوة 1) ، وإعداد 2.5 مل / الأبهر من حل 1X البرانية الأورطي انزيم الهضم (AADES) (781.25 U كولاجيناز الثاني و14.0625 U إيلاستاز في برنامج تلفزيوني 2.5mls (رثينجتون كورب البيوكيميائية ، ليكوود بولاية نيو جيرسي )). 9 ضع محلول المخزون على الجليد حتى الاستخدام.
- إزالة برنامج تلفزيوني من الأنبوب الذي يحتوي على مجموعة الأبهر. إضافة 2.5 مل من 1X AADES لكل الأبهر. لا تقطع aortas الى قطع صغيرة. لاحتضان aortas مع انزيم 1X حل البرانية لمدة 10-20 دقيقة في 37 درجة مئوية.
- بعد الهضم 10-20 دقيقة ، ونقل الأورطى هضمها جزئيا من AADES 1X إلى طبق بتري مع برنامج تلفزيوني جديد. بعناية شديدة ، وذلك باستخدام اثنين من أزواج من ملقط المنحني ، قشر طبقة براني الاب بعيداام الشريان الأورطي كوحدة واحدة.
- ملاحظة : أوقات أطول يسهل الهضم لإزالة البرانية ، ولكن إذا هو البرانية الإفراط في هضم وسوف المسيل للدموع.
- عندما كان البرانية إزالتها بالكامل ، ونقل البرانية والأبهر لأنابيب FACS منفصلة. إضافة إلى برنامج تلفزيوني 1ml من الأنبوب البرانية ، ووضع أنبوب على الجليد. إضافة 2.5 مليليتر من 1X حل الأبهر انزيم التفكك إلى أنبوب الشريان الأورطي والشريان الأورطي احتضان لمدة 40 دقيقة عند 37 درجة مئوية.
- ملاحظة : لتسهيل عملية الهضم الأنزيمية ، ويمكن تقسيم الشريان الأورطي يصل الى أجزاء أصغر عند هذه النقطة.
- بعد هضم 40 دقيقة ، وضع أنبوب الأبهر على الجليد ، وإعداد تعليق خلية واحدة من الشريان الأورطي والبرانية بواسطة القص وaortas والبرانية ، وبصرف النظر تمريرها من خلال مصفاة الى 70 ميكرومتر الخلية 5ml أنابيب البولي بروبلين FACS دينار بحريني (فالكون). بيليه الخلايا بواسطة الطرد المركزي (400xg ، 5 دقائق ، و 4 درجات مئوية). العودة إلى القسم 4 الخطوة 2 واستئناف البروتوكول.
5. ممثل النتائج
هنا نطرح عددا من الشخصيات التي تظهر التدفق الخلوي تلطيخ لتحليل التركيب المناعي للaortas كله ، جدار الوعاء الدموي الأبهري والأبهر البرانية المحيطة بها. أولا ، علينا أن نظهر مؤامرة FACS ممثل تظهر ل- 119 TER تلطيخ على الدم الكامل وتعليق خلية معزولة الأبهر (الشكل 1). شكلت TER - 119 ايجابية خلايا الدم الحمراء لمدة 18 ٪ من الخلايا في خلية تعليق الأبهري ، والذي يشير إلى أن 0.014 ٪ فقط من الخلايا المعزولة من الايقاف الخلية الأبهر هي المستمدة من الدم. هذا هو تجربة هامة لمكافحة هذا يدل بوضوح على أن السفن هضمها ، ولكن ليس تعميم الدم المحيطي هي مصدر لمعظم الكريات البيض التي تم تحليلها في تعليق خلية الأبهر. بالإضافة إلى ذلك ، للتحقق من صحة هذه الطريقة ، قمنا بتقييم آثار الإنزيم كوكتيل الأبهر تفارق مستضدات على سطح خلية طحالية (الشكل 2). الكوكتيل انزيم ليس له أي آثار على التعبير عن مستضدات عدة ، بما في ذلك ، CD45 ، CD19 ، CD3 ، TCRαβ ، TCRγδ والعديد من المستضدات السطحية الأخرى 7.
وتستخدم CD45 تلطيخ بالتزامن مع صبغة الجدوى لايف / الميت والضوابط المناسبة لكشف isotype وشبه البوابة الرئيسية للسكان لاستبعاد الفائدة والحطام الخلوي أثناء التحليل. في الشريان الأورطي ، وكان يعيش Fig.3 CD45 + بوابات الكريات البيضاء لتحديد النسبة المئوية من الإنترفيرون Υ + الخلايا التائية داخل aortas المجمعة اثنين من الشباب APOE -- / -- الفئران. للتأكيد على براعة هذا الأسلوب ، وذلك باستخدام نظام النابضة التي قدمت في Fig.3 ، نقدم في تلطيخ Fig.4 الخلايا ممثل عن CD68 + + الضامة CD11b وIFNγ + + TCRαβ الخلايا اثنين من APOE -- / -- تغذية فئران الحمية الغربية لمدة 12 أسابيع. كما هو متوقع ، في تغذية النظام الغذائي الغربي APOE -- / -- aortas ، فإن الغالبية العظمى من الكريات البيض داخل الشريان الأورطي والضامة (40 ٪ + CD11b CD68 +) أو خلايا الدم النخاعي الأخرى (CD11b + CD68 منخفضة وCD11b + CD68). بالإضافة إلى ذلك ، TH1 الخلايا يشكلون الجزء الأكبر من الأبهر تسلل خلايا تي TCRαβ (Fig.4). كما أن النسبة الإجمالية لكريات الدم البيضاء والأبهر فرعية الكريات البيض يختلف باختلاف سن الماوس وشدة تصلب الشرايين ، ينبغي أن استراتيجية تبوب الأمثل بالنسبة لمعظم سكان الفائدة تحدد تجريبيا
لإثبات جدوى عزل البرانية الأبهر لتلطيخ التدفق الخلوي ، ونحن حضور ممثل CD45 + تلطيخ الكريات البيض للتعليق خلية الأبهر وبراني (الشكل رقم 5). لفترة وجيزة ، وثلاثة APOE عاما -- تم هضمها aortas الماوس والمجمعة معا كما هو موضح أعلاه (المادتان 2 و 4) -- /. تسلل الكريات البيض + CD45 تم اكتشافها في كل من البرانية (18 ٪ من التعليق الخلية) ، والشريان الأورطي المتبقية (11 ٪ من التعليق الخلية).
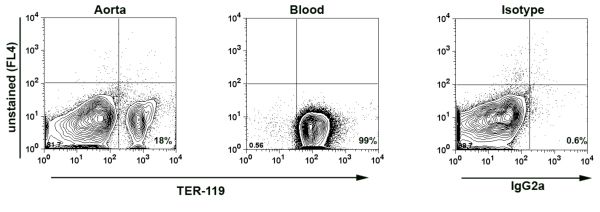
وكان perfused الشكل 1. TER - 119 تلطيخ في هضم الأبهر التعليق الخلية. الأورطي عن طريق ثقب القلب التي تحتوي على برنامج تلفزيوني مع الهيبارين 2 ٪. ثم تم هضمها الشريان الأورطي مع كوكتيل للانزيم 1 ساعة عند 37 درجة مئوية. تم صبغ الخلايا تعليق الأبهر وعينة الدم (كعنصر تحكم إيجابية) المضادة للTER - 119 - PE عبس وتحليلها بواسطة التدفق الخلوي. TER - 119 - إيجابية حساب خلايا الدم الحمراء لمدة 18 ٪ من جميع الخلايا في خلية تعليق الأبهر مشيرا إلى أن 0.014 ٪ فقط من جميع الكريات البيض معزولة عن aortas من المرجح أن يكون الدم الناجم عن الكريات البيض.

الشكل 2. انزيم كوكتيل العلاج ليس له أي آثار على CD45 (أعلى) أو CD19 (القاع) التعبير عن الخلايا الليمفاوية. معلقات الجوال من دون علاج (A ، B) وتعامل مع كوكتيل انزيم (C ، D) تم الحصول على LN ، وملطخة APC - Cy7 - CD45 مترافق المضادة للطائرات وAPC - مترافق MABS مكافحة CD19. (A ، C) والأرقام تمثل نسبة الكريات البيض + CD45 في بوابة R1. (B ، D) والأرقام تمثل نسبة الخلايا اللمفية CD45 + + / CD19. التشكيلات هي بوابات على الكريات البيض + CD45.
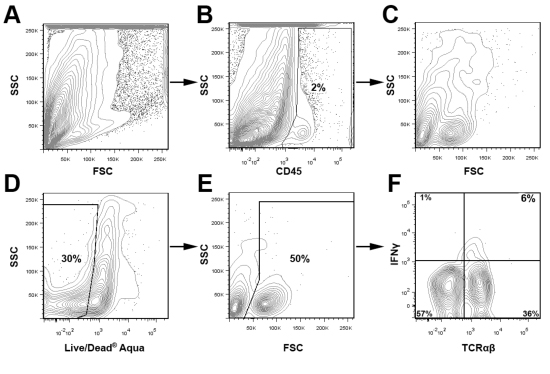
الشكل 3 عزلت استراتيجية المحاصرة لتحليل الكريات البيض الأبهر اثنان aortas ومجمعة من APOE عرضة تصلب الشرايين -- / -- أعدت الفئران والمعلقات الأبهر خلية كما هو موضح أعلاه. وكانت ملطخة الايقاف الخلية لCD45 (PerCP) ، TCRαβ (FITC) ، IFNγ (eFluor 450) ، وأكوا لايف / الميت ، وتحليلها باستخدام DXP Cytek 8 لون ترقية FACS Calibur دينار بحريني. باختصار ، كانت كريات الدم البيضاء + المغلقة CD45 (B) ، ومزيد من التحليل (CF). تمت إزالة الخلايا الميتة من التحليل القائم على تلطيخ أكوا لايف / الميت (D) والمؤامرات FSC (E). ثم تم فحص الكريات البيض الأبهر العيش لTCRαβ IFNγ والتعبير (F).
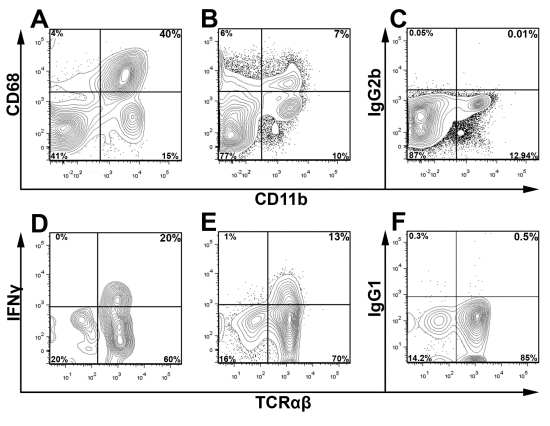
وأعدت تعليق خلية الرقم 4 لتلطيخ بين الخلايا والخلايا المستضدات السيتوكينات من APOE كله -- / -- الأبهر والطحال كما هو موضح. وكانت ملطخة الأبهر (A) والمعلقات الخلية الطحال (B ، C) لCD45 ، CD11b وCD68 أو التحكم به isotype دينار بحريني Cytofix / Cytoperm ™ كيت دينار بحريني (العلوم البيولوجية). وكانت خلايا الكريات البيضاء + المغلقة على CD45 ، وقد تم استبعاد الحطام على أساس الملامح مبعثر إلى الأمام والجانب. لتلطيخ IFNγ بين الخلايا ، والخلايا المستزرعة تعليق الأبهر والطحال لمدة خمس ساعات في RPMI 1640 تستكمل مع وقف غولجي ، سلطة النقد الفلسطينية ، وجيم Ionomycin ، كما سبق وصفها. بتحفيز 9 الأبهر واحد (D) والطحال (E ، F) وتعليق خلية ملون في وقت لاحق مع CD45 (PerCP) ، TCRαβ (FITC) ، CD3 (APC - Cy7) ، أكوا لايف الميت ، وIFNγ (eFluor 450 ، E) أو isotype (IgG1 - eF450 ، F). وكانت خلايا T (مدافع) بوابات من العيش CD45 + + CD3 الكريات البيض (CD45 + لايف / أكوا الميت) ودرست لTCRαβ وIFNγ.
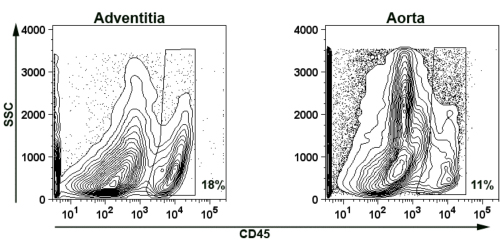
. الشكل 5 صورة ممثل معزولة البرانية الأبهر الأورطي الفئران وجدار الوعاء الدموي مؤامرة الممثل مواجهة التدفق الخلوي يدل على وجود خلايا CD45 + T في البرانية وجدار الشريان الأبهر من الذين تتراوح أعمارهم بين APOE -- / -- الفئران. محكمة أمن الدولة من جانب التشرذم. للقضاء على تألق ذاتي من الحطام والأنسجة نخرية ، ومؤامرات لبوابات FSC> 750. لتجنب تألق ذاتي إضافية من doublets كما أقيمت بوابات على النحو + CD45 في البوابات.
Discussion
هنا ، نقدم طريقة التدفق الخلوي قائم على التحقيق في تكوين الخلايا المناعية من aortas الفئران. الميزة الرئيسية لهذا الأسلوب هو القدرة على تحليل الخلايا المناعية الأبهر عند مستوى خلية واحدة ، وتميز الوضع تنشيط الكريات البيض الأبهر. لا يقتصر هذا الأسلوب لaortas الفئران ، ونحن...
Disclosures
Acknowledgements
وأيد هذا العمل من قبل المعاهد الوطنية للصحة منح : PO1 HL55798 (لكوالا لمبور) وجمعية القلب الأميركية للتنمية منح العلماء 0525532U (لمصر).
Materials
| Name | Company | Catalog Number | Comments |
| مادة | رقم كتالوج | شركة | |
| كولاجيناز الحادي عشر | C7657 | سيغما الدريخ | |
| هيالورونيداز | H3506 | سيغما الدريخ | |
| الدناز الأول ، من النوع 2 | D4527 | سيغما الدريخ | |
| أنا كولاجيناز | C0130 | سيغما الدريخ | |
| كولاجيناز الثاني | LS004174 | رثينجتون مؤسسة بيوكيميائية | |
| إيلاستاز | LS002292 | رثينجتون مؤسسة بيوكيميائية |
References
- Lusis, A. J. Atherosclerosis. Nature. 407, 233-2341 (2000).
- Galkina, E., Ley, K. Immune and inflammatory mechanisms of atherosclerosis. Annu Rev Immunol. 27, 165-197 (2009).
- Hansson, G. K., Libby, P. The immune response in atherosclerosis: a double-edged sword. Nat Rev Immunol. 6, 508-519 (2006).
- Galkina, E., Ley, K. Leukocyte influx in atherosclerosis. Curr Drug Targets. 812, 1239-1248 (2007).
- Bonanno, E., Mauriello, A., Partenzi, A., Anemona, L., Spagnoli, L. G. Flow cytometry analysis of atherosclerotic plaque cells from human carotids: a validation study. Cytometry. 39, 158-165 (2000).
- Liu-Wu, Y., Svenningsson, A., Stemme, S., Holm, J., Wiklund, O. Identification and analysis of macrophage-derived foam cells from human atherosclerotic lesions by using a "mock" FL3 channel in flow cytometry. Cytometry. 29, 155-164 (1997).
- Galkina, E., Kadl, A., Sanders, J., Varughese, D., Sarembock, I. J., Ley, K. Lymphocyte recruitment into the aortic wall before and during development of atherosclerosis is partially L-selectin dependent. J Exp Med. 203, 1273-1282 (2006).
- Tung, J. W., Parks, D. R., Moore, W. A., Herzenberg, L. A., Herzenberg, L. A. New approaches to fluorescence compensation and visualization of FACS data. Clin Immunol. 110, 277-283 (2004).
- Smith, E., Prasad, K. M., Butcher, M. Blockade of interleukin-17A results in reduced atherosclerosis in apolipoprotein E-deficient mice. Circulation. 121, 1746-1755 (2010).
- Eid, R. E., Rao, D. A., Zhou, J. Interleukin-17 and interferon-gamma are produced concomitantly by human coronary artery-infiltrating T cells and act synergistically on vascular smooth muscle cells. Circulation. 119, 1424-1432 (2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved