A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
ReAsH / فلاش الوسم وتحليل صورة البروتينات في خلايا الاستشعار Tetracysteine
In This Article
Summary
والأصباغ biarsenical الفلاش وReAsH خصيصا لربط الزخارف tetracysteine في البروتينات ، ويمكن تسمية انتقائي البروتينات في الخلايا الحية. مؤخرا تم استخدام هذه الاستراتيجية لتطوير أجهزة الاستشعار التوسيم لبروتين مختلفة التشكل أو الدول oligomeric. وصفنا نهج وضع العلامات وطرق لتحليل كمي ملزمة.
Abstract
البروتينات الفلورية والأصباغ وأدوات أساسية لدراسة توطين البروتين والاتجار بها وظيفة في الخلايا. في حين تم البروتينات الفلورية مثل البروتين مضان أخضر (GFP) المستخدمة على نطاق واسع باعتبارهم شركاء الانصهار للبروتينات لتتبع خصائص بروتين المصالح 1 ، والتطورات الأخيرة مع أصغر به تمكين وظائف جديدة من البروتينات التي يتعين بحثها في الخلايا مثل تغيير متعلق بتكوين والبروتين وتكوين الجمعيات 2 ، 3. نظام واحد ينطوي على سمة صغيرة عزر tetracysteine (CCXXCC) إدراج وراثيا في البروتين المستهدف ، والذي يربط biarsenical الأصباغ ، ReAsH (أحمر فلوري) وفلاش (الفلورية الخضراء) ، مع خصوصية عالية حتى في الخلايا الحية 2. نظام صبغ TC / biarsenical عروض قيود أقل بكثير الفراغية للبروتين المضيف من البروتينات الفلورية التي مكنت عدة مقاربات جديدة لقياس التغيير متعلق بتكوين والبروتين البروتين التفاعلات 4-7. نحن وضعت مؤخرا تطبيق الرواية من العلامات TC وأجهزة الاستشعار من oligomerization في الخلايا معربا عن huntingtin متحولة ، والتي عندما تحولت المجاميع في الخلايا العصبية في مرض هنتنغتون 7. وكان الموسومة Huntingtin مع اثنين من الأصباغ الفلورية ، واحدة بروتين فلوري لتتبع مكان البروتين ، والثاني علامة TC الوحيد الذي يربط الأصباغ biarsenical في مونومرات. وبالتالي ، تمكين تغييرات في colocalization بين البروتين والتفاعل صبغ biarsenical قليل وحدات غير مرئي بالمجهر المحتوى ليتم تعيينها مكانيا داخل الخلايا. هنا ، نحن تصف كيفية تسمية TC - الموسومة بروتينات تنصهر لبروتين فلوري (الكرز ، أو GFP CFP) مع فلاش أو ReAsH في خلايا الثدييات الحية وكيفية قياس مضان اللون اثنين (الكرز / فلاش ، CFP / فلاش أو GFP / تركيبات ReAsH).
Protocol
1. إعداد الخلايا لوصفها مع ReAsH / فلاش
- باستخدام معيار طرق زراعة الخلايا للخط الخلوي من الفائدة ، وتعد الثقافة من الخلايا الملتصقة مباشرة في شريحة التصوير الخلية الحية على استعداد لترنسفكأيشن.
- Transfect الخاص البلازميد التي تحتوي على الجين TC - الموسومة الفائدة وفقا لطريقة ترنسفكأيشن التي تختارها.
علما أنه من المهم استخدام الضوابط الإيجابية والسلبية لتقييم مدى ملزمة محددة لعلامات TC وتقييم لbleedthrough من مضان بين القنوات عند جمع micrographs مبائر. وبالتالي ، لونين (مثل فلاش / الكرز أو ReAsH / CFP أو تركيبات ReAsH / GFP) ، وضمان استعداد عينات للألوان واحد (مثل البروتين نيون وحدها أو إذا كان ذلك ممكنا بروتين TC - الموسومة منضمة إلى فلاش / ReAsH ولكن مع عدم وجود الفلورسنت البروتين)
- واحد إلى يومين بعد ترنسفكأيشن ، شطف الخلايا برفق مع 300 ميكرولتر استعد مسبقا (عند 37 درجة مئوية) HBSS.
- تزج الخلايا برفق مع فلاش ميكرومتر 1 (أو ReAsH) في 300 ميليلتر من HBSS prewarmed و 10 ميكرومتر 1،2 - ethanedithiol (بتوقيت شرق الولايات المتحدة).
فمن المهم أن نضيف بتوقيت شرق الولايات المتحدة لأول مرة أمام مضيفا فلاش / ReAsH وجعل العازلة فقط قبل إضافته إلى الخلايا. احتضان لمدة 30 دقيقة بالضبط في 37 درجة مئوية في نسيج الثقافة الحاضنة. في أوقات أطول تجربتنا الحضانة إلى زيادة كبيرة في مضان الخلفية. وينبغي أيضا أن يكون الأمثل بنيات جديدة لوصفها الوقت وفلاش / تركيز ReAsH (0،5-2 ميكرومتر).
- نضح بلطف الوسم حل من الخلايا ومن ثم استبدال HBSS prewarmed 300 + 250 ميكرومتر ميكرولتر 2،3 - dimercaptopropanol (BAL) لمدة 15 دقيقة عند 37 درجة مئوية.
- إزالة غسل حل عن طريق التطلع لطيف واستبدالها مع HBSS 300 prewarmed ميكرولتر.
بعد ذلك يغسل ، قد تكون ثابتة في الخلايا مع بارافورمالدهيد (15 دقيقة بمحلول 3.2 ٪) ، على الرغم من أننا وجدنا أن هذه الزيادات غير محددة صبغ مضان biarsenical. وبالتالي فإننا عادة صورة الخلايا الحية في درجة حرارة الغرفة. (لاحظ أن التثبيت من قبل الخلايا يمنع وضع العلامات biarsenical صبغة ملزمة.)
2. تصوير الخلايا على المجهر مبائر
- على المجهر مبائر ، إعداد المعلمات للتصوير fluorophores الفردية (أنظر الجدول 1) والتأكد من أن هناك bleedthrough ضئيلة بين القنوات. ويمكن تحقيق ذلك عن طريق فحص fluorophores الفردية (في عينات مراقبة) ضد كل إعداد اقتناء الفلورسنت مختلفة لمضان. ويمكن تعديل نطاق الطول الموجي يساعد على تقليل الانبعاثات bleedthrough (رغم أن هذا يمكن أن تقلل أيضا الإشارة / الضجيج).
- أيضا ضبط إعدادات مضخم بحيث مضان الأقصى في العينة لا تشبع كاشف. (ويمكن الكشف عن هذا باستخدام الإعداد Q - طرفية على مبائر ايكا SP2). مرة واحدة يتم تحديد أفضل إعدادات التصوير ، لا تغير أي منها بين العينات.
- الإعدادات الأخرى التي نستخدمها عادة (رغم أنه يمكن تحسين هذه) هي فحص معدل 200 هرتز ، وجمع المعدلات خط قطره 4 و 1 وحدة من الثقب إيري. ويمكن توسيع نطاق القطر الثقب إذا الإشارة / الضجيج هو المشكلة ، ولكن هذا قد يؤدي إلى فقدان بعض من التصوير.
- جمع الصور في شكل مبائر (أو أعلى) 12 بت إذا كان ذلك ممكنا. 12 بت تنسيق يلتقط أكبر مجموعة ديناميكية من القيم (0-4095) لكل بكسل كثافة من 8 بت (0-255). وهذا أمر مهم لضمان أن يتم تسجيل مجموعة أغنى البيانات ، الأمر الذي سيزيد من نوعية تحليل البيانات الكمية.
- جمع الصور للقناة بروتين فلوري (الكرز ، أو GFP CFP) ، وكذلك للقناة صبغ biarsenical (فلاش أو ReAsH) لجميع العينات.
3. تحليل البيانات
- ImageJ تثبيت البرنامج على جهاز الكمبيوتر الخاص بك 8. http://rsbweb.nih.gov/ij/
- تأكد من أن إصدار ImageJ والإضافات التالية :
- فتح ImageJ ، وإذا به نسخة أقدم من v1.32c ، انقر على الخيارات التالية للتمكن من فتح عدة صور في وقت واحد (والتي يمكن القيام به بواسطة الضغط باستمرار على زر التحكم في حين النقر على ملفات مختلفة) :
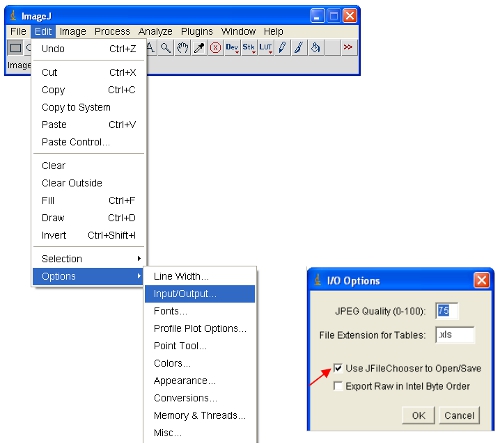
- فتح الصور من الاهتمام في ImageJ.
وسوف تحدد تلقائيا ImageJ شدة بكسل الحد الأقصى والحد الأدنى التي يتم عرضها على الشاشة لكل صورة على حدة. نظرا إلى أن صور مختلفة سيكون دكثافة بكسل ifferent ، وهذا يعني أن الصور المعروضة لا يمكن مقارنتها كما تراه. - لضمان فتح الصور كلها على نفس النطاق ، يمكنك تحديد فعليا العلوي والسفلي شدة بكسل ليتم عرضه (وهذا لن يتم تغيير محتوى البيانات الفعلية من الصور كما هو الحال في بعض البرامج الأخرى). يمكن تعيين هذه القيم ضمن القائمة التالية :
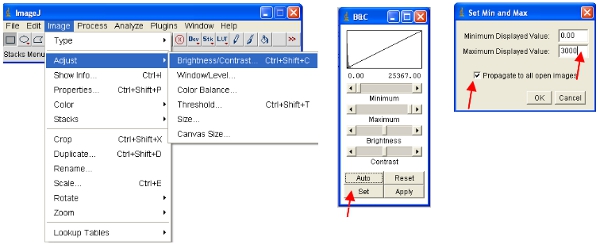
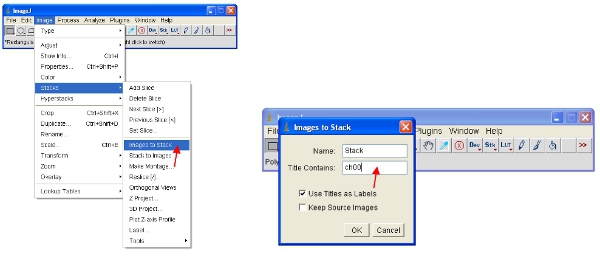
- نهج بديل يتمثل في العمل مع المداخن ، الأمر الذي يضع جميع الصور معا في ملف واحد ، وسوف النطاق تلقائيا (للعرض) جميع الصور في المكدس لنفس النطاق. أسهل طريقة للعمل مع البيانات لتحويل كل قناة إلى كومة. وبالتالي ، للقناة بروتين فلوري لتحويل جميع المكدس كما هو مبين. يمكنك بسهولة تحديد قناة واحدة عن طريق تكديس كل الصور التي تحتوي على الاسم الشائع (مثل "ch00") في العنوان.
- الآن تحويل جميع الصور مفتوحة ل8 بت لتحليلها. وهذا في الواقع إعادة مقياس مدى ينظر الى النطاق 0-255 (الذي يحدد 8 بت).
هام : لا تحفظ على مدى 12 بت الأصلي (أو أعلى) أو تنسيق ستفقد محتوى المعلومات. علما أن بعض حزم البرمجيات يمكن عرض فقط 8 بت صور حتى هذا الشكل هو مفيد لجعل الأرقام الخ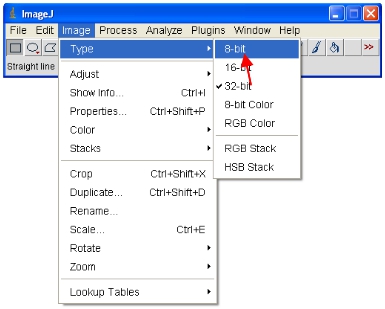
- حفظ نسخة في مجلد جديد يسمى "8 بت تحويل" باستخدام "حفظ ك..." الخيار.
- أسلوب واحد للنظر في مدى الربط صبغ biarsenical في صورة كله لإجراء ارتباط شدة بكسل المؤامرة. هذه المؤامرات قيمة كل بكسل في قناة واحدة بالنسبة لقيمة بكسل المناظرة في قناة الثانية. وبالتالي فإن موقف بكسل عالية في مضان CFP أيضا أن تكون عالية في مضان ReAsH إذا كان هناك ارتفاع ملزمة.
- بكسل لتحليل الترابط المشترك ، تأكد من ReAsH 8 بت والصور أزرق / GFP مفتوحة في ImageJ.
- فتح "خاسسرح صورة" المساعد على النحو المبين أدناه. حدد "Image1" كما المكدس ReAsH أو فلاش و "Image2" كما المكدس بروتين فلوري.
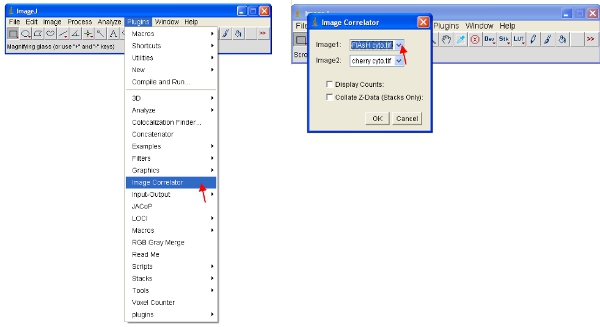
- قد يؤدي مكدس لا يتم عرض أية معلومات مفصلة -- وهذا أمر طبيعي. حفظ مكدس في مجلد جديد يسمى "Scatterplots" واعطائها نفس اسم الملف كما أنه يشير إلى نموذج (على سبيل المثال "مؤامرة ارتباط فلاش الكرز")
- لعرض البيانات ذات معنى يمكن أن تفعل واحد من خيارين. تحويل البيانات أولا بحيث يكون في شكل السجل. ثم إعادة مقياس البصر البيانات على النحو التالي :
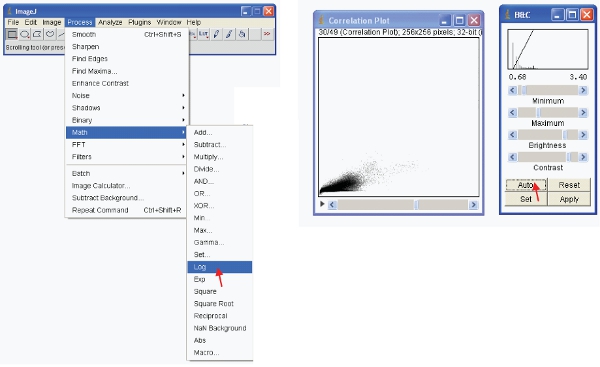
- بدلا من ذلك ، يمكنك إعادة مقياس البيانات بصريا فقط لاظهار القيم المنخفضة (على سبيل المثال 1-255) ، وعرض البيانات باستخدام طرفية خاصة. أحد طرفية (بحث لأعلى الجدول) يمثل الجدول من الألوان التي تم تعيينها إلى كل قيمة بكسل في صورة يمكن ، يمكن استخدام هذا النظام لتحديد pseudocolor للصورة ومفيد لتحديد خصائص معينة في صورة ما. لإنشاء فوق طرفية مخصصة على "تحرير طرفية" ، وجعل واحدة جديدة مثل تلك التي تظهر (ويمكن حفظ هذه واستخدامها في وقت لاحق).
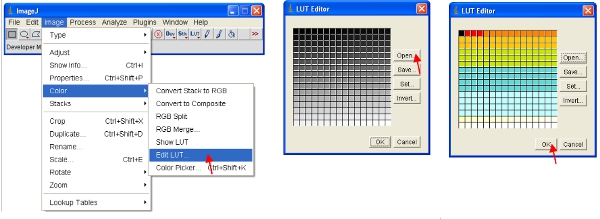
- تعيين نطاق السطوع / النقيض من 0-255 (كما هو موضح في الخطوة 13 أعلاه). الى "تأمين" صورة من أجل أن تظهر على الشاشة ، ويمكن تحويل الصورة إلى تنسيق RGB الذي يحفظ قيمة 8 بت لكل لون الأحمر والأخضر والأزرق في كل بكسل.
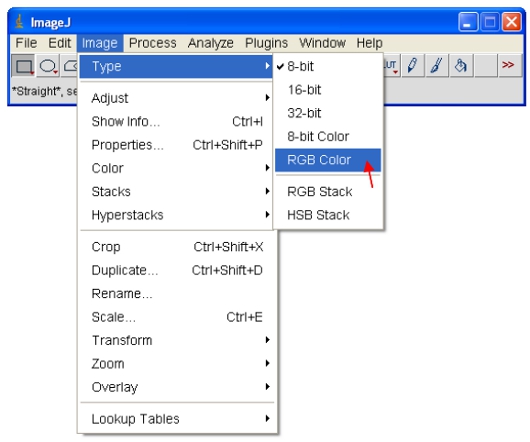
لنسخ ولصق الصور إلى برامج أخرى مفتوحة لأول مرة صور 8 بت أو 16 بت. كما هو موضح في الخطوة 14 أعلاه ، تعيين نظام الألوان طرفية للصورة. لCFP ، تعيين "سماوي" طرفية على النحو المبين أدناه...
- حدد الصورة ونسخه إلى الحافظة حدد...
4. ممثل النتائج :
نجاح الخلايا الوسم مع الأصباغ biarsenical يعتمد على معايير رئيسية قليلة. أولا ، توقيت وضع العلامات مع الأصباغ أمر بالغ الأهمية. لقد وجدنا أن تمديد فترات وضع العلامات (أكثر من 30 دقيقة) عن نتائج في مستوى عال من تلوين الخلفية غير محددة. الشكل 1 يبين نتيجة نموذجية لنموذج من النوع البري من جزء huntingtin (25Q) لتنصهر أزرق مشتق CFP تحتوي على علامة TC 7 كما هو موضح سابقا. وكان هذا النموذج الملون لمدة 30 دقيقة مع ReAsH وهناك الحد الأدنى من الخلفية في العينة التي تفتقر إلى سمة TC. لقد وجدنا أن الخلايا مع تحديد الخلفية إلى زيادة بارافورمالدهيد حين تحديد الميثانول مع ناسخ لمضان العلامة بروتين فلوري. وبالتالي أمكن لنا صورة الخلايا الحية. من المهم أن نلاحظ أيضا أن التثبيت قبللوضع العلامات مع الأصباغ biarsenical يمنع تجليدها ، ويفترض أن يعود إلى إدخال تعديلات على عزر TC.
آخر عاملا حاسما لنتائج متسقة وكثافة الخلايا. لقد وجدنا أنه من الأهمية بمكان لخلايا صورة التي يتم توزيعها بشكل فضفاض ، وأيضا أن التثاقل واسعة يمكن أن تؤدي إلى تلطيخ متفاوتة من الأصباغ biarsenical في خلايا مختلفة.
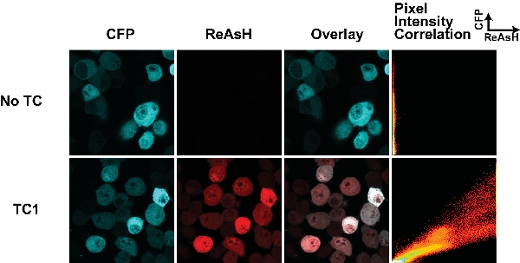
الشكل 1. Tetracysteine به وتلطيخ ReAsH في الخلايا الحية مع transfected huntingtin (exon1 - 25Q) - أزرق اندماج. وتقع العلامة TC عند تقاطع للانصهار huntingtin - أزرق (كما هو موضح في 7). العلاقة كثافة بكسل مؤامرة يمكن تقييم الاختلافات في ReAsH ملزم في جميع أنحاء الخلية ، ويمكن استخدامها لرسم خريطة التغييرات في ReAsH ملزمة بتكوين جزئي نتيجة لتغير أو تفاعلات يجند.
Discussion
نهج التعريب البروتين التسمية مع بروتين فلوري وخصائص متعلق بتكوين مع صبغة second تقدم إمكانات كبيرة لرسم الخرائط حيث التشكل مختلفة من بروتينات تتراكم في الخلايا والأحداث التي تغير ديناميات التشكل البروتين. وقد استخدم لأول مرة ReAsH / فلاش وجهاز استشعار في الخلية للطي البر...
Disclosures
الإعلان عن أي تضارب في المصالح.
Acknowledgements
وقد تم تمويل هذا العمل عن طريق منح لDMH وTDM (NHMRC منح المشاريع). DMH زميل Grimwade ، بتمويل من صندوق Miegunyah.
Materials
| Name | Company | Catalog Number | Comments |
| اسم الكاشف | شركة | رقم كتالوج | تعليقات |
|---|---|---|---|
| 8 - جيدا μ - الشرائح | Ibidi | 80826 | نجد هذه الشرائح الغرفة لتكون مفيدة بشكل خاص لزراعة الخلايا للتصوير. |
| TC - FLASH الثاني في الخلية Tetracysteine كشف العلامات كيت * * * مضان أخضر للخلية الحية التصوير | Invitrogen | T34561 (فلاش) أو T34562 (ReAsH) | |
| هانكس "محلول الملح المتوازن | Invitrogen | 14175-103 | |
| 2،3 - Dimercapto - 1 - بروبانول | سيغما الدريخ | D1129 - 5ML | |
| 1،2 - Ethanedithiol | سيغما الدريخ | 02390 - 25ML |
References
- Tsien, R. Y. The green fluorescent protein. Ann. Rev. Biochem. 67, 509-544 (1998).
- Griffin, B. A., Adams, S. R., Tsien, R. Y. Specific covalent labeling of recombinant protein molecules inside live cells. Science. 281, 269-2672 (1998).
- Uttamapinant, C. A fluorophore ligase for site-specific protein labeling inside living cells. Proc. Natl. Acad. Sci. USA. 107, 10914-10919 (2010).
- Ignatova, Z., Gierasch, L. M. Monitoring protein stability and aggregation in vivo by real-time fluorescent labeling. Proc. Natl. Acad. Sci. USA. 101, 523-528 (2004).
- Coleman, B. M. Conformational detection of prion protein with biarsenical labeling and FlAsH fluorescence. Biochem. Biophys. Res. Commun. 380, 564-568 (2009).
- Luedtke, N. W., Dexter, R. J., Fried, D. B., Schepartz, A. Surveying polypeptide and protein domain conformation and association with FlASH and ReAsH. Nat. Chem. Biol. 3, 779-784 (2007).
- Ramdzan, Y. M. Conformation sensors that distinguish monomeric proteins from oligomers in live cells. Chem. Biol. 17, 371-379 (2010).
- Abramoff, M. a. g. e. l. h. a. e. s., PJ, S. J. R. a. m. Image processing with ImageJ. Biophotonics International. 11, 36-42 (2004).
- Hearps, A. The biarsenical dye Lumio exhibits a reduced ability to specifically detect tetracysteine-containing proteins within live cells. J. Fluor. 17, 593-597 (2007).
- Adams, S. R. New biarsenical ligands and tetracysteine motifs for protein labeling in vitro and in vivo: Synthesis and biological applications. J. Am. Chem. Soc. 124, 6063-6076 (2002).
- Shaner, N. C., Steinbach, P. A., Tsien, R. Y. A guide to choosing fluorescent proteins. Nat. Meth. 2, 905-909 (2005).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved