Method Article
دراسة الهيكل الخلوي أكتين في الخلايا البطانية لايف تعرب عن GFP - أكتين
In This Article
Summary
التصوير المجهري للخلايا البطانية يعيش معربا عن GFP - الأكتين يسمح توصيف التغيرات الدينامية في الهياكل هيكل الخلية. على عكس التقنيات التي تستخدم عينات ثابتة ، وهذا الأسلوب يوفر تقييما مفصلا للتغيرات الزمنية في الهيكل الخلوي الأكتين في الخلايا نفسها قبل وأثناء وبعد مختلف المحفزات المادية والدوائية ، أو التهابات.
Abstract
بطانة الاوعية الدموية الدقيقة تلعب دورا هاما كحاجز منفذة بشكل انتقائي للسوائل والأملاح. منعطفات لاصق بين الخلايا البطانية تنظيم نفاذية البطانة ، والعديد من الدراسات بينت أهمية المساهمة في الهيكل الخلوي الأكتين لتحديد سلامة صلي 1-5. ويعتقد أن الحزام الأكتين القشرية إلى أن تكون مهمة للحفاظ على استقرار تقاطعات 1 ، 2 ، 4 ، 5. في المقابل ، يعتقد أن ألياف الأكتين الإجهاد لتوليد الجاذبية التوتر داخل الخلايا البطانية التي تضعف تقاطعات 2-5. وقد استند جزء كبير من هذه النظرية على الدراسات التي تعامل بها مع الخلايا البطانية وسطاء التهابات معروفة لزيادة نفاذية البطانية ، ثم وتحديد الخلايا ووضع العلامات F - الأكتين لمراقبة مجهرية. ومع ذلك ، فإن هذه الدراسات توفر فهم محدود جدا من دور الهيكل الخلوي الأكتين لأن الصور من الخلايا الثابتة الوحيدة في تقديم لقطاتالوقت مع عدم وجود معلومات حول ديناميات الهياكل الأكتين 5.
تعيش خلية التصوير يسمح بإدراج الطبيعة الديناميكية لالهيكل الخلوي الأكتين في دراسات لتحديد آليات البطانية سلامة الجدار. والميزة الرئيسية لهذا الأسلوب هو أنه يمكن تقييم أثر المحفزات التهابات مختلفة في هياكل الأكتين في الخلايا البطانية في نفس مجموعة من الخلايا الحية قبل وبعد العلاج ، وإزالة التحيز المحتملة التي قد تحدث عند مراقبة عينات ثابتة. وtransfected خلايا بطانة الوريد السري (HUVEC) مع GFP - β - الأكتين البلازميد ونمت لالتقاء coverslips على الزجاج. يتم التقاط الصور مرور الزمن من GFP - الأكتين في HUVEC متموجة قبل وبعد إضافة وسطاء التهابات التي تثير التغيرات التي تعتمد على الوقت في نزاهة حاجز غشائي. هذه الدراسات تمكن الملاحظة البصرية لتسلسل السائل من التغييرات في الهيكل الخلوي الأكتين التي تسهم في بطائنل خلل الحاجز والترميم.
نتائجنا تظهر باستمرار المحلية ، وتشكيل lamellipodia الأكتين الغنية ودوران في الخلايا البطانية. ويمكن أيضا تشكيل والحركة من ألياف الأكتين الإجهاد يمكن ملاحظتها. يمكن أن تكون موثقة تحليلا للتشكيل وتيرة دوران من lamellipodia المحلية ، قبل وبعد العلاج مع المثيرات التي يحلل kymograph التهابات. هذه الدراسات توفر معلومات هامة حول طبيعة ديناميكية الهيكل الخلوي الأكتين في الخلايا البطانية التي يمكن استخدامها لاكتشاف الآليات الجزيئية التي لم تحدد سابقا هامة للحفاظ على سلامة حاجز غشائي.
Protocol
1. ترنسفكأيشن من HUVEC مع GFP - أكتين
- ويمكن استخدام طرق مختلفة لtransfect HUVEC. مختبرنا يستخدم نظام Nucleofector (Lonza ، بازل سويسرا) المبينة أدناه. بشكل عام ، والعمل بسرعة من أجل تحسين السلامة والكفاءة ترنسفكأيشن الخلية. كل ترنسفكأيشن يتطلب 5 × 10 5 HUVEC التي سيتم على المصنف coverslips الزجاج اثنين (كورنينج رقم 1 ، 22 × 50 ملم). ويجمع Nucleofector electroporation والكواشف الكيميائية لtransfect DNA البلازميد ، وعادة ما يحقق كفاءة التعبير> 50 ٪. الكواشف الكيماوية ترنسفكأيشن هي وسيلة بديلة. وقد transfected مجموعة واحدة بنجاح الخلايا البطانية البقري مع GFP - الأكتين باستخدام كاشف GenePORTER 6. يوصف بروتوكول Nucleofector نستخدم أدناه.
- ويمكن استخدام Presterilized coverslips cultureware أو عادية ، اعتمادا على نوع الغرفة. لcoverslips الزجاج ، وتعقيم في غطاء السلامة البيولوجية عن طريق وضع لهم في لوحة الثقافة الطول 10تحتوي على ما يقرب من 5 مل من الايثانول 70 ٪ لمدة 2 دقيقة. اعتقالهما مع ملقط معقم والهواء الجاف بالانحناء لها ضد الجانب من لوحة ثقافة منفصلة.
- الجاف مرة واحدة ، ومكان كل ساترة خاصة بها في 10 سم لوحة الثقافة. ماصة a ميكرولتر 300 حبة من محلول الجيلاتين الدافئة (1.5 ٪ في 0.9 ٪ كلوريد الصوديوم) على مركز للساترة والسماح لها للوقوف لمدة 5 دقائق. ثم نضح. حفظ هذا الطلاء مصفوفة في الوسط ، من دون لمس الحواف ، وسوف تضمن أن المصنف الخلايا الكثيفة وسوف تحقق التقاء بسرعة.
- تعد واحدة microfuge 1.5 مل في أنبوب ترنسفكأيشن مع 500 ميكرولتر من وسائل الإعلام EGM2MV (Lonza) وتوضع جانبا في 37 درجة مئوية ، و 5 ٪ CO 2 الحاضنة.
- فصل HUVEC مع 0.25 ٪ التربسين - EDTA وجمع في أنبوب 15 مل المخروطية. عدد الخلايا. وهناك حاجة إلى 5 × 10 5 خلايا لكل ترنسفكأيشن. ضبط حجم الخلية تعليق للحصول على بيليه الذي سيحتوي 5 × 10 5 خلايا مضروبا في عدد من transfeالمراد تنفيذها ctions.
- الطرد المركزي تعليق خلية في اجهزة الطرد المركزي السريري في 5000 دورة في الدقيقة لمدة 3 دقائق في درجة حرارة الغرفة. نضح في طاف بواسطة أنبوب إمالة لإزالة وسائل الإعلام قدر الإمكان.
- Resuspend الكرية مع حلول Nucleofector Basic من HUVEC إما غشائي الخلايا الأولية أو Nucleofector كيت (Lonza). استخدام 100 ميكروليتر في 5 × 5 10 الخلايا. نظرا لسمية هذا الحل ، فإنه من المهم العمل بسرعة في حين علقت الخلايا في هذا الحل.
- إضافة ناقلات GFP - β - الأكتين البلازميد (0،2-2 ميكروغرام لكل 100 ميليلتر من تعليق Nucleofector) إلى نموذج ترنسفكأيشن. 0،2-2 ميكروغرام من الحمض النووي GFP - الأكتين البلازميد في 5 × 5 10 خلايا لكل ترنسفكأيشن.
- نقل 100 ميكرولتر من خلية إلى تعليق كوفيت Nucleofector. تغطية كفيت والاستفادة من عدد قليل من مرات لضمان وقف الخلية على طول الطريق إلى القاع.
- ضع كفيت في الفتحة الثانية Nucleofector كفيت وتشغيل الجهاز دesired electroporation البرنامج. نستخدم برنامج A - 034 لHUVEC.
- عودة إلى كفيت غطاء السلامة البيولوجية. تحقيق واحد من أنابيب microfuge من الحاضنة 37 درجة مئوية الذي يحتوي على 500 ميكرولتر من EGM2MV إلى غطاء محرك السيارة. باستخدام واحدة من نقل ماصات المنصوص عليها في عدة Nucleofector ، إضافة بلطف الدافئة 500 ميكرولتر من وسائل الإعلام إلى تعليق خلية في كفيت. نقل كل محتويات كفيت من الظهر إلى أنبوب microfuge ووضعه في الحاضنة لمدة 15 دقيقة. للسماح للخلايا للتعافي.
- كرر الخطوات من 9-11 حسب الحاجة إذا كان أكثر من الخلايا أن تكون transfected.
- يمكن المصنف microfuge أنبوب واحد تحتوي على 600 ميكرولتر من التعليق على اثنين HUVEC transfected coverslips. تحت غطاء محرك السيارة ومع micropipette 1000 ميكرولتر ، ماصة بلطف صعودا وهبوطا مرة واحدة لمزج التعليق ، ومن ثم وضع 300 ميكرولتر من التعليق مباشرة على ساترة الجيلاتين المغلفة. لا تدع تعليق تلمس حافة ساترة. في مكان ثاني 37 درجة مئوية / 5 2 ٪ حاضنة لل04/01 ساعة للسماح مرفق الخلية.
- بعد 1-4 ساعة ، تفقد الخلايا transfected لتأكيد لديهم تعلق على ساترة. ثم يضاف 10 مل من وسائل الإعلام EGM2MV ، والعودة إلى لوحة إلى 37 درجة مئوية / 5 ٪ CO 2 الحاضنة. ويمكن عادة GFP - الأكتين التعبير يتعين مراعاتها في غضون ساعات 4-8. وتجرى عادة في غضون 24-48 ساعة التجارب
2. إعداد غرفة التصوير الخلية الحية وسخان المرحلة
- بالنسبة لمعظم الدراسات لدينا ، وقد استخدمنا آلات وارنر فتح حمام الماس (RC22) وضعت في PH - 1 سخان المرحلة ، التي يغذيها نظام تدفق الجاذبية. ومع ذلك ، هناك عدة خيارات متاحة ليعيش مراحل التصوير الخلية ، بما في ذلك الغرف التي تتسع لأطباق الزجاج ثقافة القاع ، والغرف المفتوحة مقابل المغلقة ، ومختلف مجموعات سخان microincubator / موضوعية وكبيرة نظم الحاضنة. في نهاية المطاف ، فإن اختيار الغرفة تعتمد على عوامل بما في ذلك الحاجة للوصول إلى الحمام لإضافة عامل اختبار أو المخدرات ، وعرجسيكون هناك وسيلة تكون ثابتة أو تحت التدفق ، وطول التجربة. بالإضافة إلى ذلك ، أحيانا يمكن لعوامل مثل درجة الحرارة يسبب عدم الاستقرار الانجراف والتركيز ، ويمكن التقليل من أنظمة التحكم التي يمكن الحفاظ على درجة حرارة ثابتة وحمام الهدف.
- قسامة المتوسطة كافية للتجربة. نحن قسامة 50 مل من محلول ملحي الفسيولوجية الزلال (هذه الخدمات ؛ الجدول رقم 1) عن كل ساعة فإن تجربة الماضي.
- يمكن أن تكون إما استخدام نظام ضخ أو تدفق الجاذبية لتسليم المتوسطة إلى الدائرة. لنظامنا ، ونضيف إلى هذه الخدمات لنظام الجاذبية تدفق بسيطة بنيت من خط تدفق الوريد ، متصلة سخان مضمنة (وارنر صكوك نموذجية SH - 27A). نحن نطبق في تدفق ما يقرب من 40 مل / ساعة.
- إذا كان سيتم استخدام حمام وغرفة مفتوحة مثل بلدنا ، وتطبيق الشحوم فراغ إلى الحافة الخارجية على الجانب السفلي للحمام والماس مع قضيب من القطن ذات الرؤوس. المقبل ، نحصل على خلية واحدة مغطاة ساترة من الحاضنة ، ورفع بلطف باستخدام ملقط ساترة. Gentlذ تلمس المؤخر إلى kimwipe لامتصاص فائض المتوسطة مع الحفاظ على الجانب الخلية مغطاة الرطب. مع الخلايا مواجهة ، ومكان الحمام الماس خلال ساترة لتشكيل الغرفة.
- المكان بسرعة الى غرفة المدفأة المرحلة واليد تشديد المشابك على الحجرة. ومصدر القلق الرئيسي في هذه المرحلة هو احتمال أن الخلايا سوف تجف. ولذلك فمن المهم العمل بسرعة ، وعندما فعلت ، وعلى الفور ماصة ~. 1 مل من المتوسط الى داخل القاعة لمنع الخلايا من الجفاف
- قاعتنا يسمح للتدفق المطرد للمتوسط فوق الخلايا. فقط قبل ان يتحول في التدفق ، فمن المهم أن نعلق خرطوم فراغ لحاملها في الغرفة للسماح بخروج مستنبت الزائدة (هذه الخدمات). وينبغي أيضا المدفأة المضمنة وسخان الحمام على أن تتحول هذه النقطة (إلى 37 درجة مئوية). نظامنا كما تحقيقا الثرمستور لرصد درجة الحرارة ، والتي ينبغي أن تكون وضعت على حافة حوض الاستحمام.
- يمسح بعناية السفلي من التعاونverslip مع kimwipe غارقة مع EtOH 70 ٪ المتبقية لإزالة وسائل الاعلام EGM2MV وتراكم الملح. مسح للمرة الثانية مع kimwipe الجافة أو العدسة ورق.
- بعد أن تم تعيين ما يصل غرفة ، وتدفق على ، وكانت درجة الحرارة ثابتة عند 37 درجة مئوية ، وتسمح للخلايا لا يقل عن 30 دقيقة لضبط واستقرار قبل بدء التجربة.
- في حين ينتظر ، بدوره على جميع مكونات المجهر والتصوير الخلية الحية (مصابيح تصفية تحكم عجلة القيادة ، والكاميرا ، والكمبيوتر).
3. الحصول على البيانات مع المجهر والتصوير الخلية الحية
- الخلية الحية المجهري مختلف النظم المتاحة. نظامنا هو الكسوف نيكون TE - 2000U مع المكونات التالية :
- سوتر آلات امدا LS 300 W الاكسينون مصباح
- سوتر آلات امدا عجلة الإثارة 03/10 مع تصفية SmartShutter وS492 تصفية (D350 والمرشحات المثير S572 تتوفر أيضا لتطبيقات الأشعة فوق البنفسجية وRFP)
- مزدوج اللون باعث 2002bs (61 نيكون002m)
- CI خطة فلور الهدف DLL 10X ، NA 0.30 (نيكون MRH10100)
- خطة فلور ELWD الهدف DM 40X ، NA 0.60 (نيكون MRH08420)
- خطة آبو النفط 100X VC الهدف ، NA 1.40 (نيكون MRD01901)
- Photometrics CoolSNAP HQ2 الكاميرا ، 1392 X مجموعة التصوير 1040 ، 6.45 X 6.45 ميكرون بكسل
(روبر العلمية) - لدينا أيضا حزم البرمجيات اللذين يمكن أن تستخدم في الحصول على الصور. عناصر - AR نيكون 3.0 و 6.1 Metamorph.
- بعد عرض الخلايا وإيجاد مساحة مناسبة للدراسة ، وقفل مفتاح التركيز الخشنة وتحقق من إعدادات اقتناء البرمجيات بحيث :
- تم تعيين عجلة تصفية لتصفية S492 (المسمى "FITC" في التكوين لدينا)
- في برنامج شراء ، يتم تعيين الهدف لمطابقة التكبير المطلوب (ليس لدينا آلية المجهر ، ولكن هذا يحدد نسبة ميكرون / بكسل). أيضا التأكد من أن يتم تعيين عدسة optivar على المجهر لتكبير 1.0X. تعيين optivع قد لزيادة 1.5X التكبير ، ولكن على حساب فقدان كثافة الإشارة.
التكبير لاستخدامها يعتمد أهداف الدراسة. للحصول على أفضل من التفصيل ، فإن الهدف 100X مع الفتحة رقمية عالية توفير أفضل قرار المكانية وانتقال الإشارات. كما تم تزويد لدينا المجهر مع هدف طويل المسافة 40X العمل المعدة للتطبيق المختلفة التي تتطلب مسافة اضافية. ومع ذلك ، يمكن أن تكون مفيدة لهذا الهدف عندما نود أن نلاحظ عدة خلايا في وقت واحد ، ويعمل بشكل جيد للعرض العضية الحجم الهياكل ، ولكن بتكلفة فقدان القرار المكانية وكثافة الإشارة. لأية دراسة في شدة الإشارة التي هي نقطة النهاية ، أو لمزيد من تقنيات التصوير المتقدمة مثل رقطة مضان المجهري ، فمن المستحسن هدفا 100X. - يتم تعيين زمن التعرض الكاميرا بين 0،5-2 ثانية. هذا يعتمد على كثافة GFP - الأكتين في الخلايا. نحن عادة استخدام وقت التعرض ادنى حد ممكن لتجنب BLeaching من أكتين - GFP والسمية المحتملة للخلايا.
- لتحقيق أفضل قرار ، ينبغي تعيين Binning في 1 × 1 وكسب في 1. في بعض الحالات التي وضعناها binning إلى 2 × 2 للحد من التعرض الوقت ، ولكن هذا يقلل من دقة القياسات يمكننا أن نجعل على الأجسام المتحركة في الدراسة مرور الزمن.
- تكوين إعدادات الوقت الفاصل :
- اختيار مجلد لحفظ الصور الملتقطة واكتب اسم الملف.
- تعيين عدد من الصور والأوقات مدة الفاصل الزمني للتجربة. نحن عادة استخدام فاصل زمني 15 دقيقة إلى 1 ق بين الصور وتصل إلى 2 ساعة لمدة.
- تأكد من أن يتم تعيين مصراع نشطة لتكون مغلقة بين عمليات الاستحواذ.
- قبل البدء في الوقت الفاصل بين الحصول على الصور ، إطفاء الأنوار الغرفة والتقاط صورة واحدة للتحقق من الإعدادات.
- أيضا التقاط صورة brightfield. تأكد من تعيين المكثف للمرحلة المناسبة أو تصفية مدينة دبي للإنترنت. بدوره علىمصباح الهالوجين وجمع الصور. إيقاف مصابيح الهالوجين.
- العودة إلى الإعدادات "FITC" للتصوير مرور الزمن والتقاط صورة الاختبار.
- التقاط سلسلة مرور الزمن.
أثناء التجربة ، فمن المهم رصد الصور كما يتم الحصول عليها. في بعض الحالات قد تغييرات طفيفة في درجة الحرارة داخل غرفة تسبب الانجراف التركيز. ويمكن تجنب ذلك عن طريق تحسين تدفق وخطوط الفراغ بحيث يتم تدفق مطرد على مدى الخلايا. أيضا ، لا يمكن التقليل من حركة المرور في غرفة المجهر ، وإعادة توجيه المشاريع من السقف فتحات التهوية بعيدا عن مجهر تكون مفيدة. البديل الذي عملت بشكل جيد في تجربتنا هو استخدام من 37 درجة مئوية / 5 ٪ CO 2 غرف الحاضنة التي إحاطة مرحلة بأكملها وموضوعية. وتقتصر هذه الميزة توفر للخلايا الرصد بين عشية وضحاها أو أطول ، ولكن الوصول الى الخلايا.
إذا لزم الأمر ، وقفة اقتناء مرور الزمن وتركيز الصورة. أداء تركيز في أسرع وقت ممكن إلى تجنب تغيير الفاصل الزمني بين الصور. - وهناك بروتوكول نموذجي يتكون من 20-30 دقيقة من الصور الأساس قبل أن يضيف وكيل الاختبار تليها بنسبة 0.5 إلى 4 ساعات من التقاط صور إضافية. ويمكن أن يقتصر على طول التجربة photobleaching من GFP مع مرور الوقت ، وهذا هو السبب من المهم أن يختار أقصر وقت ممكن التعرض. قد يكون من المستحسن أيضا لتغيير الفاصل الزمني بين الصور الفاصل الزمني ل30-60 ق إذا كان المطلوب أطول الدراسة.
4. تحليل البيانات
- ويمكن استخدام حزم البرمجيات لتحليل عدة مجموعات الصور ، مثل عناصر شيكل ، Metamorph ، Slidebook وغيرها ونحن عادة إجراء تحليل صورتنا به المعاهد الوطنية للصحة ImageJ تمكين التحليل على أي جهاز كمبيوتر في مختبرنا أو في المنزل. الإصدارات التي نستخدمها هي :
MBF ImageJ ( http://www.macbiophotonics.ca/imagej/ )
فيجي (ط "الهدف =" _blank "> http://pacific.mpi-cbg.de/wiki/index.php/Fiji). - يمكن استخدامها لتحليل عمليات ImageJ ديناميكية كثيرة ، منها :
- تواتر نتوءات lamellipodia
- المسافة والوقت وسرعة نتوءات
- الأكتين حركة الألياف مع مرور الوقت
- في ImageJ ، وعندما تكون مجموعة الصور يفتح عدد شريحة / شرائح مجموع يتم عرضها في أعلى الزاوية اليسرى من النافذة ، جنبا إلى جنب مع اسم الملف ، وعدد من بكسل ، نوع الملف ، وحجم. شريط التمرير في أسفل Z يتوافق مع الوقت. بالإضافة إلى ذلك ، سوف يحوم المؤشر فوق صورة عرض س ، y ، و z موقع بكسل على الجزء السفلي من شريط الأدوات ImageJ.
- ويمكن دراسة Lamellipodia تبارز من خلال تحديد عدد من نتوءات جديدة مع مرور الوقت. يمكن القيام بذلك عن محيط الخلية بأكملها أو المنطقة المحددة. ويمكن أيضا هذا النوع من التحليل أن يؤديها في الخلايا ، مع تباين nonconfluent untransfected المرحلة المجهري أو مدينة دبي للإنترنت. ومع ذلك ، فإن استخدام خلايا معربا عن GFP - الأكتين يتيح تحليل monolayers متماد ، لا سيما عندما الخلايا التي تحتوي على وتفتقر GFP - الأكتين المجاورة لبعضها البعض.
- ويمكن تقدير المسافة Lamellipodia تبارز ، والمثابرة (الوقت) ، وسرعة من خلال تحليل (خط المسح) kymograph. رسم خط عمودي على حافة الخلية (وهذا هو أسهل إذا لم يكن هناك خلية مجاورة ، أو الخلية المجاورة لا يعبر عن GFP - أكتين). في ImageJ ، والضغط "/" سيتم إنشاء kymograph ، مع محور س يمثلون دistance والوقت الذي يمثل المحور الصادي (15 ق ل1 دقيقة لكل بكسل وفقا للمبادئ التوجيهية الفاصل الزمني أعلاه). ويمكن استخلاص عبر خطوط lamellipodia جاحظ وقياس أبعاد مربع (عن طريق الضغط على M في ImageJ). ويمكن بعد المسافة والوقت والسرعة يمكن حسابها.
- ويمكن أيضا حركة ألياف الإجهاد يمكن قياسه من خلال تحليل kymograph بطريقة مماثلة.
5. ممثل النتائج :
مع بروتوكول ترنسفكأيشن لدينا ، ونحن نرى عادة التعبير عن GFP - الأكتين في ما لا يقل عن 50 ٪ من HUVEC transfected ، وكثيرا ما يمكن العثور على مناطق حيث ساترة> 90 ٪ من HUVEC في المنطقة أعرب عن GFP - الأكتين. ويرد مثال على تجربة التصوير الخلية الحية مع HUVEC subconfluent معربا عن GFP - الأكتين في فيلم 1. عن هذه التجربة خاصة ، حصلت على صورة مرة واحدة في الدقيقة الواحدة. يمكن كما يمكن أن يرى في الفيلم ، GFP - الأكتين في HUVEC يتعين مراعاتها في جميع أنحاء السيتوبلازم ، وكذلك في البنية الخيطيةures والمحلية في lamellipodia جاحظ على طول حافة الخلية. واضح أيضا في الفيلم هو أن GFP - الأكتين التعبير ليست موحدة بين الخلايا. الخلايا الذي تم اختياره لدراسة وعادة ما يكون كافيا GFP - الأكتين الحالي لتصور مختلف الهياكل التي تحتوي على أكتين الخيطية. يمكن التعبير عن الخلايا مستويات عالية جدا من GFP - الأكتين يكون مشكلة بالنسبة للدراسة لأنه في هذه الخلايا هو عادة يصعب التمييز F - الأكتين هياكل من كمية عالية من G - الأكتين الحالي.
2 يبين الفيلم مثالا للسلوك HUVEC متموجة معربا عن GFP - الأكتين. مثل HUVEC subconflent ، كانت نشطة lamellipodia تشكيل ودوران على طول حدود الخلايا واضحة. ومع ذلك ، فإن هذه lamellipodia أعطى كثيرا ما تؤدي إلى غشاء الكشكشة ، مشيرا إلى بروز أقل كفاءة 7. هذا ربما يرجع إلى وجود الخلايا المجاورة عرقلة التحتية المجاورة. الألياف القشرية وألياف الأكتين الإجهاد واضحة أيضا في أفلام 1 و 2. على الرغم من أن الخلايا أننا سbserved ظل ثابتا ، والألياف الإجهاد مشابهة للألياف عرضية قوسية في الخلايا المهاجرة ، وتشكيل قرب حافة الخلية وتتحرك أفقيا في اتجاه مركز الخلية حيث تفكيك 8 و 9. وميزة إضافية الديناميكية التي لوحظت في هذه الخلايا تشكيل الهياكل التي توسعت حلقة الأكتين بتكثف ، الذي كان يسمى سابقا الأكتين السحب 10.
مثال على كيفية كميا المسافة ، والمثابرة ، وسرعة نتوءات خلية من هذه الصور الوقت الفاصل بين مجموعات باستخدام التحليل kymograph هو مبين في الشكل 1. 1A في الشكل ، يتم رسم خط عمودي واحد بكسل تقريبا إلى حافة الخلية لجيل من kymograph (الشكل 1B). في هذا kymograph ، يتم وضع المنطقة التي حددها خط عموديا مكدسة والصور من جميع أنحاء مرور الوقت أفقيا. أبحث عن من اليسار إلى اليمين في kymograph ، يتم تمثيل نتوءات كحركات التصاعدي في حافة الخلية. في الشكل 1C ، وكان خط سوبerimposed على حافة واحدة من هذه النتوءات ، وجمعت البيانات بكسل المرتبطة بهذا الخط ويظهر في نافذة النتائج في الجزء السفلي من اللوحة. يسمح هذا التحليل الكمي لديناميات تبارز ، ويمكن أيضا أن تستخدم لتقدير وتيرة بروز (عدد نتوءات / الساعة) في هذه المنطقة من الخلية.
ويرد مثال لتحليل حركة الألياف التوتر في الشكل 2. ألياف أكثر لاحظنا التوتر تشكلت بالقرب من محيط الخلية ، وتحركت في اتجاه مركز الخلية ، حيث تفكيكها في نهاية المطاف. ويمكن أيضا أن يكون هذا من خلال تحليل كمي kymograph. يتم رسم خط عمودي على حافة الخلية والألياف الإجهاد (الشكل 2A) ، ويتم إنشاء kymograph (الشكل 2B). ألياف التوتر تظهر على شكل خطوط متواصلة في مجال حشوية في kymograph ، غالبا ما يتحرك إلى الأسفل وإلى اليمين (في اتجاه مركز الخلية). أحيانا ألياف يصعب أن نرى في kymograph الأصلي ، ونحن في هذه الحالاتاستخدام قناع unsharp التصفية لزيادة حدة الصورة (الشكل 2C). يتم رسم خطوط على ألياف التوتر ويتم جمع البيانات باستخدام الدالة بكسل قياس (الشكل 2D). طريقة بديلة لجمع هذه البيانات لرسم خط من البداية الى النهاية من الألياف التوتر المحددة للحصول على منحدر متوسط المدة التي لوحظ الألياف (2E الشكل). يسمح هذا التحليل الكمي للحركة الألياف الضغط الوحشي ويمكن أن تستخدم أيضا لتحديد عدد من ألياف التوتر التي لوحظت في هذه المنطقة من الخلية.
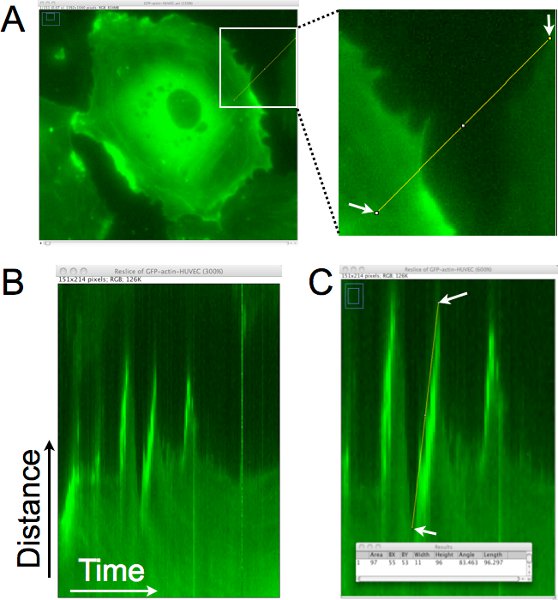
الشكل 1. تحليل Kymograph من حافة الخلية لتحديد المسافة تبارز ، والمثابرة ، وسرعة lamellipodia المحلية. A. يتم رسم خط عمودي واحد بكسل تقريبا إلى حافة الخلية. يتم استخراج هذه المنطقة من كل صورة من مرور الوقت لتعيين إنشاء المونتاج في المنطقة بمرور الوقت. باء. في اله الناتجة kymograph ، ومحور س يمثل الوقت ، والانتقال من اليسار إلى اليمين ، والمحور الصادي يظهر المسافة. ويمكن تقييم حركة حافة الخلية على مر الزمن في هذا kymograph ، وتحديد المناطق التي lamellipodia حافة الخلية ، وتتحرك نحو اليمين ، ويذهب إلى أعلى. C. يتم رسم خط على حافة الخلية التي تم تحديدها من قبل نتوء lamellipodium. ثم يتم الحصول على أبعاد المستطيل إحاطة عن الخط الذي رسمته (كما هو موضح في إطار فرضه). ويستخدم العرض لحساب الوقت نتوء أو المثابرة. يستخدم الارتفاع إلى حساب المسافة نتوء. يحسب بقسمة سرعة بروز ارتفاع العرض من قبل. في هذا المثال ، كانت المسافة صعودا 96 بكسل × 0.16125 ميكرون / بكسل = 15.5 ميكرون ، والوقت كان 11 بكسل × 1 مقدار / بكسل = 11 دقيقة. تم حساب السرعة ودقيقة μm/11 15.5. = 1.4 ميكرون / دقيقة.

Figure تحليل Kymograph 2. حركة ألياف الأكتين الإجهاد. A. يتم رسم خط عمودي واحد بكسل إلى حافة الخلية لتوليد kymograph باء. كما هو مبين في الشكل. 1 ، في kymograph الناتجة عن ذلك ، يمثل المحور x الوقت والمسافة المحور الصادي. ويلاحظ ألياف التوتر المستمر كخطوط في الخلية ، وغالبا ما يذهب إلى الأسفل وإلى اليمين (سهام) C. إلى تصور أفضل للألياف التوتر ، ويمكن استخدام قناع unsharp التصفية. في هذا المثال ، تم استخدام دائرة نصف قطرها 3 بكسل والوزن قناع 0.60 دال. ثم يتم رسم خطوط بكسل واحد على الألياف الإجهاد التي تم تحديدها ، وجمع البيانات. في هذه اللوحة تم رسمها ثلاثة أسطر ثم "حذف" تم الضغط لجعل الشرح الدائمة (الخط الأبيض) من مواقعها بعد كل قياس. E. بدلا من ذلك ، إذا كان المطلوب هو متوسط المسافة والوقت والسرعة من الألياف الإجهاد ، يمكن رسم خط من نقطة البداية والنهاية (الخط الأصفر) ، وبيانات عنص التي يمكن الحصول عليها (وأبرز في إطار النتائج). في هذا المثال ، تم إجراء قياسات الضغط على هذه الألياف لمدة 37 دقيقة إطارات × 1 الإطار /. = 37 دقيقة. المسافة المقطوعة خلال هذه الفترة الزمنية كانت 75 س الإطارات 0.16125 ميكرون / بكسل = 12.1 ميكرون. كانت سرعة الناتج الجانبي للألياف التوتر μm/37min 12.1 ميكرون = +0.33 / دقيقة. يتم تعيين قيمة موجبة للسرعة لألياف تتحرك باتجاه مركز الخلية ، وسلبية للألياف تتحرك باتجاه المحيط.
فيلم 1. مرور الزمن صور HUVEC يعيش معربا عن GFP - الأكتين. الفاصل الزمني بين الصور هو 1 دقيقة. جحوظ المحلية lamellipodia على طول محيط كامل من الخلايا. بالإضافة إلى ذلك ، انتقل التوتر ألياف عرضية قوسية أفقيا في اتجاه مركز للخلايا. تعاقدت الخلايا عندما أضيفت الثرومبين (1 يو / مل) إلى الحمام ، وقليلا من الخارج نتوءات lamellipodia مؤقتا لحوالي 10 دقيقة. بعد التعاقد مع الخلايا ، وتشكيل lamellipodia استئناف التداول (د) انقر هنا لمشاهدة الفيلم.
الفيلم 2. HUVEC مندمج معربا عن GFP - الأكتين ، قبل وبعد العلاج مع ثرومبين. يظهر الوقت المنقضي في أسفل الزاوية اليمنى كما دقائق : ثواني. الفاصل الزمني بين الصور هو 30 ثانية. وأضاف الثرومبين (1 يو / مل) بعد 45 دقيقة. الأساس الفترة. وتشمل فعاليات المشروح المحلية lamellipodia تشكيل ودوران (النصال قرب حواف الخلية ، 00:59 -- 37:29) ، الأكتين السحب (السهام ، 1:59 حتي 21:29) ، والفجوة في مفترق طرق ثلاثي الخلايا التي توسع بعد إضافة ثرومبين (السهم ، 62:30 -- 70:00). ألياف التوتر عرضية قوسية هي أيضا واضحة في العديد من الخلايا. عرض تشكيل خلايا نشطة ودوران lamellipodia المحلية على طول محيطاتها ، مع الكشكشة مما أدى إلى العديد من الغشاء. تسبب ثرومبين وقفة في تشكيل lamellipodia ودوران ، وظهور موجزا لبعض الثغرات الصغيرة بين الخلايا.https://www.jove.com/files/ftp_upload/3187/Movie2-confluentHUVEC.avi "> اضغط هنا لمشاهدة الفيلم.
Discussion
التصوير من GFP - الأكتين في الخلايا البطانية العيش يتيح تحليلا مفصلا لديناميات الهيكل الخلوي الأكتين استجابة لمحفزات للالتهابات. هذا الأسلوب قد يكون من المفيد أيضا للبناء على النتائج السابقة تبين إعادة تشكيل الهيكل الخلوي استجابة لقوى مادية مثل إجهاد القص 11. بالإضافة إلى ذلك ، هذا الأسلوب يسمح للتقييم مفصل للمساهمة الديناميات الأكتين هيكل الخلية لمختلف أنشطة الخلية البطانية ، بما في ذلك الهجرة ، والانقسام ، وتشكيل تقاطعات بين الخلايا وصلي النضج ، والحفاظ على وظيفة الحاجز.
في البيانات الواردة ، يمكن ملاحظة سلوك الهيكل الخلوي الأكتين البطانية قبل وبعد العلاج مع ثرومبين. وقد لوحظت lamellipodia المحلية على طول حواف الخلايا البطانية تشكيل وتراجع مع مرور الزمن في كل من الخلية monolayers nonconfluent ومتموجة. المعاملة مع توقف لفترة وجيزة ثرومبين lamellipodia شكلأوجه ودوران. ثرومبين تسبب أيضا في الخلايا لعقد بقليل ، وذلك بالاتفاق مع التقارير السابقة التي ثرومبين أسباب تشكيل ألياف الأكتين الإجهاد وزيادة حدة التوتر جابذ التنمية في الخلايا البطانية 12-14. ومع ذلك ، يعيش من الدراسات التصويرية مثل هذه الخلية ، ويمكن الآن منشأ ألياف الإجهاد يتم تحديدها. في HUVEC ، أكثر من ألياف التوتر تنشأ في محيط الخلايا وألياف تشبه قوس عرضية في الخلايا المهاجرة 8 و 9. آخر قوة من هذا الأسلوب أكثر من استخدام الخلايا الثابتة التي يمكن كميا في عدد من ألياف التوتر في الخلايا الفردية قبل وبعد العلاج الثرومبين ، والقضاء على التحيز في الاختيار بين المجموعات التجريبية.
مع هذا البروتوكول نقيم حركة ديناميكية من حافة الخلية وألياف الأكتين الإجهاد. لفهم ديناميات مونومر الأكتين في الخلايا البطانية ، وتقنيات أكثر تقدما مثل الانتعاش بعد مضان photobleaching (FRAP) أو مضان رقطة MICROSويمكن تطبيق نسخة (FSM) 15 ، 16. بالإضافة إلى ذلك ، لأنه قد الخلايا البطانية الاوعية الدموية الدقيقة تمثل أفضل نموذج من وظيفة الاوعية الدموية الدقيقة الحاجز ، والتحسين من البروتوكولات ترنسفكأيشن بفعالية للتعبير عن GFP - الأكتين في الخلايا البطانية الاوعية الدموية الدقيقة يمثل الاتجاه المستقبلي منطقية.
في الموجز ، والتصوير من الخلايا البطانية يعيش معربا عن GFP - الأكتين يمثل أداة قوية لتحديد كيفية الأكتين الخلية البطانية الهيكل الخلوي يستجيب لأنواع مختلفة من المحفزات. وسوف تستخدم الدراسات monolayers البطانية متكدسة بإحكام مساعدة في تحديد أدوار هياكل دينامية مثل الأكتين الغنية lamellipodia والعرضي ألياف الإجهاد في وظيفة حاجز قوس البطانية. بالإضافة إلى ذلك ، سوف يعيش التصوير خلية من الخلايا البطانية معربا عن GFP - الأكتين أو البروتينات الانصهار الأخرى التي تسمح التصور الهياكل التحت خلوية أخرى تقدم معلومات مفصلة spatiotemporal اللازمة لفهم الإشارات والآليات الهيكلية التي دetermine حاجز النزاهة.
Disclosures
الإعلان عن أي تضارب في المصالح.
Acknowledgements
وقدمت بسخاء البلازميد GFP - β - الأكتين من قبل الدكتور واين أور ، LSUHSC - S قسم علم الأمراض ، وتتضخم في مختبر الدكتور بيكي Worthylake ، LSUHSC - NO قسم الصيدلة. وأيد هذا العمل عن طريق المنح المقدمة من المعاهد الوطنية للصحة (P20 RR - 018766) ، وجمعية القلب الأميركية (05835386N).
Materials
| Name | Company | Catalog Number | Comments |
| 1. الجرس أسهم 5X | |||
| مادة كيميائية | شركة | كتالوج رقم | كمية |
| كلوريد الصوديوم | EMD | SX0420 - 3 | 35 ز |
| كلوريد البوتاسيوم | JT بيكر | 3040 | ز 1.75 |
| كلوريد الكالسيوم | سيغما | C - 3881 | ز 1.47 |
| كبريتات المغنيسيوم | سيغما | M - 9397 | ز 1.44 |
| معقمة الماء المصفى | N / A | N / A | جلب إلى 1 L |
| تصفية في زجاجات معقمة تعقيمها ومخازن في 4 درجات مئوية | |||
| 2. اجتماعات الأطراف العازلة | |||
| مادة كيميائية | شركة | كتالوج رقم | كمية |
| اجتماعات الأطراف | سيغما | M3183 | ز 125.6 |
| معقمة الماء المصفى | N / A | N / A | جلب إلى 1 L |
| تصفية في زجاجات معقمة تعقيمها ومخازن في 4 درجات مئوية | |||
| 3. ألبومين محلول الملح الفسيولوجي (هذه الخدمات) | |||
| مادة كيميائية | شركة | كتالوج رقم | كمية |
| قذف الأسهم (5X) | N / A | N / A | 200 مل |
| المماسح العازلة | N / A | N / A | 5 مل |
| فوسفات الصوديوم | سيغما | S - 9638 | 0،168 ز |
| البيروفات الصوديوم | سيغما | P5280 | ز 0.22 |
| الصوديوم EDTA الملح | سيغما | ED2SS | ز 0.0074 |
| جلوكوز | سيغما | G7528 | 0،901 ز |
| الزلال ، البقري | USB | 10856 | 10 ز |
| معقمة الماء المصفى | N / A | N / A | جلب إلى 1 L |
| ضبط درجة الحموضة إلى 7.4 في 37 درجة مئوية ، ثم التصفية في زجاجات معقمة تعقيمها وتخزينها في 4 درجات مئوية. | |||
| 4. 0.9 ٪ مالحة | |||
| مادة كيميائية | شركة | كتالوج رقم | كمية |
| كلوريد الصوديوم | EMD | SX0420 - 3 | 9 ز |
| معقمة الماء المصفى | N / A | N / A | جلب إلى 1 L |
| تصفية في زجاجات معقمة تعقيمها ومخازن في 4 درجات مئوية | |||
| 5. الحل الجيلاتين 1.5 ٪ | |||
| الجيلاتين من جلد الخنزير | سيغما | G2500 | 15 ز |
| 0.9 ٪ مالحة | N / A | N / A | جلب إلى 1 L |
| دافئة الحل ل37 درجة مئوية لإذابة الجيلاتين بما فيه الكفاية. في حين لا تزال دافئة ، في زجاجات معقمة تصفية تعقيمها وتخزينها في 4 درجات مئوية | |||
References
- Spindler, V., Schlegel, N., Waschke, J. Role of GTPases in control of microvascular permeability. Cardiovasc. Res. 87, 243-253 (2010).
- Wojciak-Stothard, B., Ridley, A. J. Rho GTPases and the regulation of endothelial permeability. Vascul. Pharmacol. 39, 187-199 (2002).
- Yuan, S. Y. Signal transduction pathways in enhanced microvascular permeability. Microcirculation. 7, 395-403 (2000).
- Birukov, K. G. Small GTPases in mechanosensitive regulation of endothelial barrier. Microvasc. Res. 77, 46-52 (2009).
- Duran, W. N., Sanchez, F. A., Breslin, J. W., Tuma, R. F., Duran, W. N., Ley, K. Microcirculatory Exchange Function. Handbook of Physiology: Microcirculation. , 81-124 (2008).
- Hu, Y. L., Chien, S. Dynamic motion of paxillin on actin filaments in living endothelial cells. Biochem. Biophys. Res. Commun. 357, 871-876 (2007).
- Borm, B., Requardt, R. P., Herzog, V., Kirfel, G. Membrane ruffles in cell migration: indicators of inefficient lamellipodia adhesion and compartments of actin filament reorganization. Exp. Cell. Res. 302, 83-95 (2005).
- Hotulainen, P., Lappalainen, P. Stress fibers are generated by two distinct actin assembly mechanisms in motile cells. J. Cell. Biol. 173, 383-394 (2006).
- Pellegrin, S., Mellor, H. Actin stress fibres. J. Cell. Sci. 120, 3491-3499 (2007).
- Ballestrem, C., Wehrle-Haller, B., Imhof, B. A. Actin dynamics in living mammalian cells. J. Cell. Sci. 111, 1649-1658 (1998).
- Helmke, B. P., Rosen, A. B., Davies, P. F. Mapping mechanical strain of an endogenous cytoskeletal network in living endothelial cells. Biophys. J. 84, 2691-2699 (2003).
- Birukova, A. A., Smurova, K., Birukov, K. G., Kaibuchi, K., Garcia, J. G., Verin, A. D. Role of Rho GTPases in thrombin-induced lung vascular endothelial cells barrier dysfunction. Microvasc. Res. 67, 64-77 (2004).
- van Nieuw Amerongen, G. P., van Delft, S., Vermeer, M. A., Collard, J. G., van Hinsbergh, V. W. Activation of RhoA by thrombin in endothelial hyperpermeability: role of Rho kinase and protein tyrosine kinases. Circ. Res. 87, 335-340 (2000).
- Moy, A. B., Blackwell, K., Kamath, A. Differential effects of histamine and thrombin on endothelial barrier function through actin-myosin tension. Am J Physiol Heart Circ Physiol. 282, H21-H29 (2002).
- Wittman, T., Littlefield, R., Waterman-Storer, C., Goldman, R. D., Spector, D. L. Fluorescent speckle microscopy of cytoskeletal dynamics in living cells. Live Cell Imaging: A Laboratory Manual. , 184-204 (2005).
- Rabut, G., Ellenberg, J., Goldman, R. D., Spector, D. L. Photobleaching techniques to study mobility and molecular dynamics of proteins in live cells: FRAP, iFRAP, and FLIP. Live Cell Imaging: A Laboratory Manual. , 101-126 (2005).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved