A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
A طريقة لوصفها الأوعية الدموية في الفئران الجنينية
In This Article
Summary
هذه المقالة طريقة لوصفها الجلد والأوعية الدموية الجنينية الغدة الصعترية.
Abstract
إنشاء شبكة الأوعية الدموية الوظيفية هو جزء أساسي من توالد الأعضاء، ومطلوب من أجل وظيفة الجهاز الأمثل. على سبيل المثال، في تشكيل الأوعية الدموية السليمة الغدة الصعترية والزخرفة أمر ضروري لدخول خلية توتية في الجهاز وناضجة الخلايا T-الخروج إلى المحيط. الترتيب المكاني للأوعية الدموية في الغدة الصعترية يعتمد على إشارات من المكروية المحلية، وهي الخلايا الظهارية الغدة الصعترية (TEC). التقارير الأخيرة تشير إلى أن العديد من تعطيل هذه النتائج في الغدة الصعترية إشارات عيوب الأوعية الدموية 1،2. وقد وصفت دراسات سابقة التقنيات المستخدمة لتسمية المواليد والأوعية الدموية الغدة الصعترية الكبار 1،2. نبين هنا تقنية لوصفها الأوعية الدموية في الغدة الصعترية الجنينية. هذا الأسلوب يجمع بين استخدام FITC-ديكستران أو غريفونيا (Bandeiraea) Simplicifolia I كتين (GSL 1 - isolectin B 4) حقن الوريد الوجه والجسم المضاد تلطيخ CD31 لتحديد الغدة الصعترية فاهياكل scular وPDGFR β-لتسمية الغدة الصعترية حول الأوعية اللحمة المتوسطة 3-5. وتقدم أيضا خيار استخدام cryosections أو أقسام vibratome. ويمكن استخدام هذا البروتوكول لتحديد العيوب الأوعية الدموية الغدة الصعترية، وهو أمر حاسم لتحديد أدوار جزيئات TEC المستمدة من الغدة الصعترية في الدم تشكيل السفينة. كأسلوب تصف الأوعية الدموية بأكملها، فإنه يمكن أيضا أن تستخدم لتحليل الشبكات الأوعية الدموية في عدة أعضاء وأنسجة الجنين بما في ذلك في جميع أنحاء الجلد والقلب 6-10.
Protocol
1. وصفت فلوريسئين ديكستران GSL I-B 4 isolectin حقن الوريد الوجه لتسمية الأوعية الدموية الجنينية
- إعداد FITC-ديكستران (50ug/mL) في الفوسفات مخزنة المالحة (PBS) أو GSL 1 - isolectin B 4 (20ug/200uL) في برنامج تلفزيوني في أنبوب إيبندورف 1.5mL ودافئة إلى 37 ° C. إضافة 100uL من الأسهم 1.25mM سريعة الأخضر / PBS في حل FITC-ديكستران (إجمالي حجم 1ML) و180uL من الأسهم 1.25mM سريعة الأخضر / PBS إلى ال 1 GSL - isolectin B 4 (مجموع حجم 200uL)، بحيث الحل هو الأزرق بوضوح.
- تشريح E14.5-E18.5 الأجنة وكيس المح معا، وترك ساق السقاء (الشريان والوريد السري) سليمة.
- نقل الأجنة إلى طبق بتري جديد (60 X 15 ملم) وتزج بهم في برنامج تلفزيوني في درجة حرارة الغرفة.
- وضع الجنين لتقديم وجهة نظر السهمي من الرأس / الوجه. استخدام ملقط تشريح الدقيقة لفهم بلطف الجنين في الرأس.
- باستخدام إبرة 30G، وضخ 50uL FITC-ديكستران (50ug/mL) أو GSL1 - isolectin B 4 (PBS 20ug في 200uL) في الوريد الوجه مشيرا الإبرة نحو الجزء الخلفي من الرأس.
- عندما الصبغة مرئيا في الوريد السري، وإزالة الإبرة وفصل الجنين من ساق السقائي (الشريان والوريد السري).
- بعد الحقن، والسماح الجنين على البقاء في PBS في درجة حرارة الغرفة لمدة 2-3 دقائق حتى الصبغة يدور في جميع أنحاء الجنين.
2. كامل جبل تحليل الأوعية الدموية الجلد
- بعد السماح الصبغة أن يعمم في جميع أنحاء الجنين، وإزالة الجلد عينات من مناطق في الأطراف والظهر والمعدة و، الخ. 8،9.
- غسل الجلد في عينة PBS الباردة، وإصلاح في PFA 4٪ / لمدة 2 ساعة PBS 8،9. يغسل 3 مرات لمدة 10 دقيقة في كل من القارورة واضحة 4mL مع 2mL الباردة PBS.
- المكان عينة الجلد على شريحة المجهر وإضافة 100 ميكرولتر من وسائل الإعلام إلى كل شريحة متزايدة والزجاج غطاء.
- تسمح الشرائح لتجف في منطقة التخزين الظلام.
- Proceed إلى الخطوة الباب "الحصول على صورة" 2.
3. متعددة الألوان والعلامات على الغدة الصعترية الأوعية الدموية والخلايا حول الأوعية القلبية لcryosections (متابعة من القسم 1، الخطوة 7)
- "فلاش تجميد 'الجنين كله في النيتروجين السائل. يمكن أن تكون الأجنة وتخزينها في -80 درجة مئوية حتى التحليل.
- بدلا من ذلك، من تشريح الغدة الصعترية، وشطف في 4 PBS C °، وإصلاح في 2mL امتصاص العرق 4٪ (PFA) / برنامج تلفزيوني لمدة 2 ساعة. يغسل 3 مرات لمدة 10 دقيقة في برنامج تلفزيوني الباردة، التوتة مكان في OCT، وتجميد وتخزين حتى استخدام في -80 ° C.
- لcryosectioning، وانتشار أكتوبر على 'وقف' قسم تحميل والجنين أو أجهزة تشريح / أنسجة لتقطيع.
- قطع الأنسجة المجمدة في البابين 10 ميكرومتر سميكة وجمع على الشرائح.
- إصلاح المقاطع في الأسيتون لمدة 5-10 دقائق. يغسل 3 مرات في TBS الباردة.
- منع 10٪ في المصل حمار / TBS في غرفة الرطوبة في درجة حرارة الغرفة.
- احتضان لمدة 1 ليلة وضحاها أقسام ساعة مع 100 ميكرولتر من الابتدائيالأجسام المضادة في غرفة الرطوبة في 4 درجات مئوية: في هذا المثال، فإننا نستخدم الفئران لمكافحة فأر CD31 (1:100) لالبطانة التسمية، والماعز المضادة للماوس PDGFR-β (1:100) لتسمية الخلايا حول الأوعية. ومن المفيد لتغطية الشرائح مع شرائط Parafilm خفض بشكل فردي لضمان أن ينتشر بشكل موحد في جميع أنحاء الجسم المضاد القسم.
- بعد الحضانة مع الأجسام المضادة الأولية، وغسل أقسام 3 مرات في TBS الباردة. احتضان مع 100 ميكرولتر من الأجسام المضادة الثانوية الحد الأدنى المناسب ل30 دقيقة.
- يغسل 3 مرات في TBS الباردة. إضافة 100 ميكرولتر من وسائل الإعلام إلى كل شريحة متزايدة والزجاج غطاء.
- تسمح الشرائح لتجف في منطقة التخزين الظلام.
- انتقل إلى قسم "الحصول على صورة".
4. متعددة الألوان وسم الأوعية الدموية والخلايا حول الأوعية الغدة الصعترية لأقسام vibratome (متابعة من القسم 1، الخطوة 7)
- تشريح من فصوص الغدة الصعترية من الجنين وشطف في برنامج تلفزيوني الباردة.
- إصلاح الغدة الصعترية في PFA 4٪ / PBS في درجة حرارة الغرفة لمدة 2 ساعةق.
- يغسل في برنامج تلفزيوني-X تريتون (0.15٪) 3 مرات، و10 دقائق التوتة مكان في خرطوشة من البلاستيك الصغيرة ويغرق في 4٪ انخفاض ذوبان الاغاروز / PBS (~ 4 ° C). يجب أن تكون على اتصال الغدة الصعترية مع الجزء السفلي من الخرطوشة.
- السماح لترسيخ الاغاروز على الجليد (3-5 دقائق). استخدام شفرة حلاقة لقطع الاغاروز الزائدة. إضافة الغراء إلى كتلة vibratome والالتزام عينة إلى كتلة.
- إضافة إلى حمام الباردة PBS المياه vibratome حتى يتم مغمورة العينة والنصل.
- تعيين السرعة والسعة (السعة العالية والسرعة المنخفضة المعتدلة مثالية للأقسام الغدة الصعترية لينة). ينبغي خفض السعة إذا أقسام تفريق بسبب التحريض الزائدة.
- خفض 50 أقسام ام.
- باستخدام فرشاة الرسام، وجمع المقاطع في صفيحة ميكروسكوبية 24 بشكل جيد في PBS الباردة.
- أقسام كتلة في 500 ميكرولتر من المصل حمار 10٪ في PBS-تريتون X (0.15٪) لمدة 30 دقيقة.
- احتضان لمدة 8 ساعات أقسام ليلة وضحاها مع الأجسام المضادة الأولية، مثل CD31 المضادة للطائرات والمضادة للPDGFR β-، في صفيحة ميكروسكوبية 24-غطت بشكل جيد.
- يغسل 3 مرات في PBS-تريتون X (0.15٪) على ما مجموعه 8 ساعات في C. ° 4
- أقسام كتلة في المصل حمار 10٪ في PBS-X تريتون (0.15٪) لمدة 30 دقيقة.
- احتضان لمدة 8 ساعات أقسام ليلة وضحاها في 4 درجات مئوية مع الأجسام المضادة الثانوية المناسبة.
- يغسل 3 مرات في PBS-X تريتون (0.15٪) على ما مجموعه 8 ساعات في C. ° 4
- إعادة الإصلاح في عينات PFA 4٪ / PBS لمدة 30 دقيقة على الجليد.
- يغسل 3 مرات في PBS-X تريتون (0.15٪) أكثر من 30 دقيقة على الجليد.
- يذوى عينات من خلال سلسلة متدرجة X MeOH / PBS-تريتون: 25٪ MeOH، MeOH 50٪، 75٪ MeOH، و 100٪ في MeOH 10 دقائق لكل خطوة. استبدال MeOH 100٪ مع MeOH جديدة بعد 10 دقائق، واحتضان لمدة 1 ساعة في درجة حرارة الغرفة.
- في وعاء زجاجي، مزيجا BABB (البنزيل الكحول: بنزوات البنزيل) في نسبة 1:2. الجمع بين BABB مع MeOH لتركيز النهائي من 50٪ وBABB MeOH 50٪. احتضان العينة في BABB: MeOH لمدة 10-15 دقيقة.
- نقل SAmple إلى وعاء زجاجي مع BABB 100٪ واحتضان لمدة 10-15 دقيقة أو حتى تطهيرها، في درجة حرارة الغرفة.
- ملء الشريحة الاكتئاب (0.7mm العمق) مع الطازجة BABB 100٪ وعينة نقل إلى الجانب. إضافة تغطية الزجاج (رقم 1.5) وختم مع 2-3 طبقات من طلاء الأظافر. تسمح طلاء الأظافر لتتصلب في الظلام في درجة حرارة الغرفة، ثم تخزين العينة في C. ° 4
ملاحظة: يجب الشرائح مختومة تماما قبل الحصول على الصور مبائر. وينبغي الحصول على صور داخل 12-24 ساعة، والأصباغ الفلورية يمكن أن تتلاشى في BABB. - انتقل إلى قسم "الحصول على صورة".
5. الصورة اكتساب
- صورة رقم 10 ميكرومتر المقاطع المجمدة مع المجهر متحد البؤر باستخدام خطة لامزيغ-20X/0.8 الهدف (512 X 512 بكسل) مع 488 - (FITC-dextran/GSL 1 - isolectin B 4)، 543 -، وخطوط الليزر 633-نانومتر.
- الحصول على مبائر Z-مقاطع من الجلد جبل كامل و 50 ميكرومتر الاغاروز جزءا لا يتجزأ من خطة أقسام باستخدام-Apochroma ر 10X/0.4 الهدف (512 X 512 بكسل) مع 488 - (FITC-dextran/GSL 1 - isolectin B 4)، 543 -، وخطوط الليزر 633-نانومتر. وينبغي جمع المسلسل Z-المقاطع بالتسلسل في ميكرون-1 لكل قناة منهما.
- إعادة المسلسل Z-المقاطع باستخدام زايس Axiovision 4.6 أو غيرها من البرامج تحليل الصور.
6. ممثل النتائج:
وضع العلامات كفاءة الأوعية الدموية الجنينية هو أمر حاسم لتقييم عيوب الأوعية الدموية في الفئران الجنينية. ويظهر الشكل 1 وضع العلامات المحددة للE16.5 الأوعية الدموية الغدة الصعترية (1A-B) وشارك في وضع العلامات مع CD31 (1B)، بالإضافة إلى تلطيخ من البطينين الأيمن والأيسر (1E-F) على التوالي. تم استخدام I-isolectin GSL B 4 بروتوكول للcryosections كما هو موضح في الأبواب 1 و 3 و 5 في هذه التجارب. جبل كامل وصفها للسفينة شبكة الدم على الجلد E16.5 الفئران، وذلك باستخدام بروتوكولات المبينة في القسمين 1 و 2، ويظهر الشكل 5 في 1C-D.
ntent ">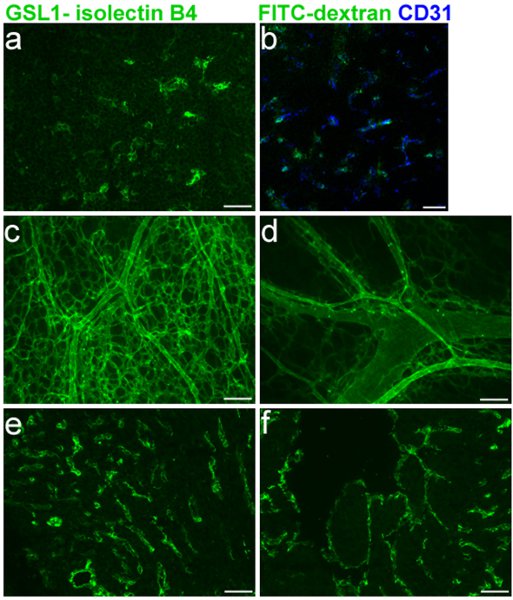
الشكل 1 أسطورة. FITC GSL I - isolectin B 4 حقن الوريد الوجه في أجنة الفئران E16.5. وCryosection. من الغدة الصعترية الجنينية بعد الحقن. ب. دمج من شارك في وضع العلامات CD31 مع B isolectin 4. ج. ود. الجامعة جبل من الجلد الجنينية حقن الأوعية الدموية التالية. ه. وو. Cryosection ه القلب الجنينية. (يمين البطين) و (البطين الأيسر) الحقن التالية.
Discussion
جبل كامل وPECAM 1-(CD31) على تلطيخ أقسام هي الأساليب التقليدية لوصفها الأوعية الدموية في الفئران الجنينية. هذه الأساليب تتطلب استخدام المناعي المباشر و / أو غير المباشرة، والمنظفات لpermeabilize الأنسجة الماوس. هذا يبرهن على أن تكون عملية في الوقت المناسب إلى حد ما. هنا، لقد است?...
Disclosures
الإعلان عن أي تضارب في المصالح.
Acknowledgements
وأيد هذا العمل من قبل أعداد منحة R01AI055001 وR01AI082127 من NIAID لإدارة الموارد الطبيعية وSREB جائزة الزمالة لأطروحة JLB.
Materials
| Name | Company | Catalog Number | Comments |
| اسم كاشف | شركة | كتالوج رقم | |
|---|---|---|---|
| FITC-ديكستران | سيجما | FD150S-1G | |
| فلوريسئين المسمى GSL 1 - B 4 isolectin | ناقلات المختبرات | FL-1201 | |
| سريع الأخضر | النائب Biomedicals | 195178 | |
| PFA | Fluka | 76240 | |
| المصل البقري الجنين | أتلانتا الحيوية | S11550 | |
| درجة الحرارة المثلى مجمع قطع (OCT | VWR | 25608-930 | |
| الأسيتون | JT بيكر | 9006-33 | |
| حمار المصل | جاكسون | 017-000-121 | |
| الفئران مكافحة CD31 الماوس، | BD Pharmingen | 558736 | |
| الماعز المضادة للماوس PDGFR-β | R & D أنظمة | AF1042 | |
| حمار مكافحة الفئران CD31 اليكسا 647 (إينفيتروجن) | Biolegend | 102516 | |
| حمار مكافحة الماعز اليكسا 594 (إينفيتروجن) | إينفيتروجن | A11058 | |
| تريتون X -100 | سيغما الدريخ | X-100 | |
| انخفاض ذوبان الاغاروز / PBS | سيغما الدريخ | A9414-25G | |
| الميثانول | فيشر العلمية | A413-4 | |
| البنزيل الكحول | أكروس العلمية | 148390010 | |
| بنزيل بنزوات | أكروس العلمية | 105860010 | |
| الاكتئاب الشرائح | فيشر العلمية | S175201 | |
| Fluorogel | علوم المجهر الإلكتروني | 17985-10 | |
| تغطية الزجاج (22X22) -1.5 | علميا الحراريةج | 152222 | |
| زايس LSM 510 مجهر متحد البؤر ميتا | زايس | ||
| ملقط تشريح الصغيرة | Roboz | RS-5135 | |
| Parafilm رقم OM992 | فيشر العلمية | 13-374-16 | |
| 12 و 24 microplates جيدا | دائمة الخضرة العلمية | 222-8044-01F | |
| شرائح المجهر Superfrost / بلس | فيشر العلمية | 12-550-15 | |
| 4mL قوارير واضحة | العلمية الوطنية | B7800-2 |
References
- Cuddihy, A. R. VEGF-mediated cross-talk within the neonatal murine thymus. Blood. 113, 2723-2731 (2009).
- Muller, S. M. Gene targeting of VEGF-A in thymus epithelium disrupts thymus blood vessel architecture. Proc. Natl. Acad. Sci. U. S. A. 102, 10587-10592 (2005).
- Muller, S. M. Neural crest origin of perivascular mesenchyme in the adult thymus. J. Immunol. 180, 5344-5351 (2008).
- Foster, K. Contribution of neural crest-derived cells in the embryonic and adult thymus. J. Immunol. 180, 3183-3189 (2008).
- Liu, C. Coordination between CCR7- and CCR9-mediated chemokine signals in prevascular fetal thymus colonization. Blood. 108, 2531-2539 (2006).
- Lavine, K. J. Fibroblast growth factor signals regulate a wave of Hedgehog activation that is essential for coronary vascular development. Genes Dev. 20, 1651-1666 (2006).
- Lavine, K. J., Kovacs, A., Ornitz, D. M. Hedgehog signaling is critical for maintenance of the adult coronary vasculature in mice. J. Clin Invest. 118, 2404-2414 (2008).
- Mukouyama, Y. S., Gerber, H. P., Ferrara, N., Gu, C., Anderson, D. J. Peripheral nerve-derived VEGF promotes arterial differentiation via neuropilin 1-mediated positive feedback. Development. 132, 941-952 (2005).
- Mukouyama, Y. S., Shin, D., Britsch, S., Taniguchi, M., Anderson, D. J. Sensory nerves determine the pattern of arterial differentiation and blood vessel branching in the skin. Cell. 109, 693-705 (2002).
- Murphy, P. A. Endothelial Notch4 signaling induces hallmarks of brain arteriovenous malformations in mice. Proc. Natl. Acad. Sci. U. S. A. 105, 10901-10906 (2008).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved