A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
بأسعار معقولة باستخدام صفائف الصمام لتحفيز الخلايا العصبية ، صور
In This Article
Summary
ويمكن التلاعب بها الكبار المولد معربا عن الخلايا العصبية في التحضيرات ChR2 شريحة الكهربية من أجل دراسة مساهمتها في وظيفة الدارات العصبية الشمية.
Abstract
وقد سمح معيار الكهربية شريحة الباحثين للبحث في المكونات الفردية للدوائر العصبية من خلال تسجيل الاستجابات الكهربائية للخلايا واحد ردا على 1،2 التلاعب الكهربائية أو الدوائية. مع اختراع وسائل للسيطرة على الخلايا العصبية الموجهة بصريا وراثيا (optogenetics) ، قام الباحثون الآن إلى مستوى غير مسبوق من السيطرة على مجموعات معينة من الخلايا العصبية في إعداد شريحة القياسية. على وجه الخصوص ، حساس channelrhodopsin - 2 (ChR2) يسمح للباحثين لتنشيط الخلايا العصبية مع 3،4 الخفيفة. من خلال الجمع بين معايرة دقيقة من الصمام المستندة ضوئي من ChR2 مع شريحة الكهربية القياسية ، ونحن قادرون على تحقيق مع بمزيد من التفصيل دور الكبار المولد interneurons في البصلة الشمية ، تتابع المركزي الأول للنظام حاسة الشم. استخدام التعبير الفيروسية ChR2 - YFP تحديدا في البالغين المولودين في الخلايا العصبية ، نستطيع السيطرة بشكل انتقائي الشباب البالغين المولودين في الخلايا العصبية في الوسط من قديمةد الخلايا العصبية الناضجة. سيطرتنا بصري يستخدم نظام الصمام بسيطة وغير مكلفة ، ونظهر كيف يمكن معايرة هذا النظام لفهم كيف يمكن لحاجة الكثير من الضوء لاستحضار التشويك نشاط الخلايا العصبية في واحدة. وبالتالي ، لا يمكن ومضات قصيرة من الضوء الأزرق التحكم عن بعد في نمط اطلاق ChR2 - transduced خلايا الوليد.
Protocol
1. معايرة البصرية : السلطة LED قياس
- نعلق مجموعة أدى إلى غرفة التبريد المبردة بنشاط مروحة ويلصق هذا الصمام aparatus / غرفة التبريد لعدسة الموازاة.
- استبدال المصابيح المستخدمة في إنارة LED مع brightfield / heatsink / فان / جهاز العدسة. يجب أن يكون هذا الجهاز في وضع بعناية بحيث شعاع موازى LED يسافر على طول مسار بصري مباشرة نحو العدسة المكثف. تأكد يرتكز بشكل صحيح heatsink / فان على أرض الواقع للنظام الموحد.
- محرك الصفيف LED مع إمدادات الطاقة التي يمكن أن تقدم سريع والبقول مربع من الحالية. ويمكن السيطرة على هذا التيار الكهربائي بواسطة نبضة TTL 5V مصدرها مولد النبض.
- مركز شعاع موازى على طول مسار ضوء المعرفة بين الحجاب الحاجز الميدانية وعدسة المكثف. من الناحية المثالية ، فإن شعاع الصمام قليلا فعم الحجاب الحاجز فتح المجال كاملا. عادة ، فإن شعاع اشد على اياديكم موازى الصمام لسد هذه الفتحة أقل ، وسوف تنتج موره السلطة على حساب التوحيد. في الإعداد لدينا زدنا ضوء التوحيد عن طريق اختيار العدسة التي من المتوقع الموازاة صورة موسعة قليلا من مجموعة LED في طائرتها المتقارن في الحجاب الحاجز consenser.
- تحقيق كولر الإضاءة من خلال التركيز المكثف بحيث يتم التركيز على صورة الحجاب الحاجز الميدان (الحجاب الحاجز الأقرب إلى مصدر الضوء) على الغرفة شريحة (الشكل 1). ويمكن لأنسجة رقيقة من الورق عدسة بمثابة شاشة عرض لتصور صورة مركزة للحجاب الميدانية في أعماق أخرى.
- حفر سلسلة من الثقوب في الإطارات المعروفة في مادة معتمة. مكان واحد من هذه الثقوب الصغيرة على جهاز استشعار للمتر الطاقة الضوئية. وضع السلطة متر على المسرح العينات ومركز السلطة متر فوق الصورة مركزة للحجاب الحقل بمجرد تحريك العداد السلطة حتى أنه يعطي قراءة الحد الأقصى. اللاحقه المقياس السلطة في هذا المنصب.
- فتح الكامل لجميع الفتحات (الحجاب الحاجز وaperatureحقل الحجاب الحاجز). تحرك بشكل منهجي تعلق شريحة الغرفة / القوة النسبية للمتر lightpath البصرية وحساب الطاقة الضوئية من التوحيد في المنطقة المضاءة. بناء مؤامرة التوحيد للنظام الخاص بك. إذا المجهر هو صحيح الإعداد مع إضاءة كوهلر محورها التركيز على الهدف ، ينبغي أن تكون الطاقة القصوى مباشرة تحت هذا الهدف ، والمناطق خارج هذا التركيز الآن يجب أن تتلقى كمية معروفة من السلطة وفقا للمؤامرة التوحيد.
- لكل حجم الثقب ، وبناء منحنى مستوى الطاقة الضوئية مقابل مساحة الثقب. وذلك بضبط المدخلات الحالية لمجموعة الصمام ، وينتج هذا المنحنى في عدة مستويات من الطاقة وكل منحنى من حساب السلطة في MM2. إذا كانت مجموعة LED لاستخدامه للبصريات التصحيح ، تأكد من أن أعرض العناصر البصرية الضرورية لترميم (المكثفات ، والثقوب والمرشحات) لتعرف كم تبث تحت ضوء إنارة التصحيح.
- التقليب في السلطة متر للمواجهة موضوعية ، وحساب شدة الإضاءة في 470nm عندما يتم تشغيل مصباح الزئبق.
- إضافة شريحة ناري في الغرفة ، وإعادة بناء منحنيات معيار لتحديد قوة الضوء التي تنتقل عن طريق نثر أنسجة المخ.
2. تشريح الإجرائية والكهربية
جزء : إعداد شريحة
- تخدير (60 ملغ / كغ والكيتامين زيلازين 2mg/kg) وقطع رأس الماوس. تشريح الدماغ في السائل الدماغي الشوكي الاصطناعي (ACSF في ملي : 124 كلوريد الصوديوم ، 3 بوكل ، 1.3 MgSO 4 و 26 NaHCO 3 ، 1.25 NaHPO 4 و 20 الجلوكوز ، 2 CaCl 2 ؛ ~ 310mOsm ، ودرجة الحموضة 7.4 عندما انفجر بمزيج من O2 أكسيد الكربون بنسبة 95 ٪ و 5 ٪ 5،1 2) ، مع الحرص على عدم إتلاف بصيلات الشم. فصل نصفي الكرة الأرضية ومكان على السطح مع آغار بطني حتى مع حافة واحدة (لمقاطع أفقية).
- الغراء آغار والسطح الظهري من كل نصف الكرة القشرية إلى vibratome تشوك ، وملء ببطء مع حمام بارد كالثلج ACSF. شريحة من السطح البطني في 300 ميكرون أقسام ، كل قسم لنقل حرارة (34-36 درجة مئوية) وACSF الاوكسيجين ، مما يسمح لهم باسترداد عن 30-45 دقيقة.
الجزء باء : قطع تصحيح القياس من العتبة إلى سبايك
- بعد إحضار الشرائح إلى درجة حرارة الغرفة لمدة 30 دقيقة ، ومكان بلطف شريحة في غرفة تسجيل لغرفة تحت المجهر نضح المستمر ACSF الاوكسيجين.
خطر تحفيز الخلايا العصبية المفرطة ChR2 المصابة ، ويمكن تأكيد وجود EYFP - ChR2 تحت epifluorescence (الشكل 2A) - سحب أقطاب الزجاج على مجتذب ماصة (سوتر P - 97). ملء هذا القطب مع ACSF. عند وضعها في الحمام ACSF ينبغي أن يكون بين طرف المقاومة MOhms 70-10.
- تحت إضاءة الفلورسنت ، وتحديد موقع في شريحة صحية ChR2 - EYFP عصبون مع التشكل ناضجة. أيضا تحديد موقع هذه الخلايا العصبية سوما تحت البصريات الترقيع.
- مع الضغط الايجابي ضوء مرت غيض الكهربائي ، وانخفاض القطب التصحيح نحو الخلايا العصبية التي تم تحديدها في نيون. عندما يتم الاتصال الغشاء ، والإفراج بسرعة وتطبيق الضغط الايجابي على كمية صغيرة من الشفط وجيزة من خلال التلميح. وينبغي بذل ختم GIGA أوم بين غشاء البلازما والجدران من القطب التصحيح.
- حتى إذا لم يتم تشكيل جيغا الختم ، إذا كان القطب قريب بما فيه الكفاية لنشاط الخلايا العصبية فلوري التشويك ينبغي قياس إمكانات إنتاج الحقل المحلي. تنشيط الخلايا العصبية في هذا ChR2 التي تومض جرعات مختلفة من الضوء. لأن الخفيف الجرعة هي وظيفة كل من السلطة الصمام والمدة ، وكيفية حساب الكثير من الضوء الضروري استحضار إمكانات العمل في قوى متعددة وفترات (الشكل 2B). نلاحظ أيضا كم التشويك يحدث تحت إضاءة مصباح الزئبق.
3. ممثل النتائج :
على المجهر لدينا (أوليمبوس BX51WI) ، الصمام لدينا هو طن 2 تمشيا مع فتحات عدسة والمكثف ، وبالتالي الحفاظ على lightpath الأصلي للمصنع تركيب مصباح القوس. عن طريق إغلاق كل من الميدان والحجاب الحاجز الحجاب الحاجز aperature ، يمكننا تحقيق brightfield النقيض كافية للتسجيلات التصحيح المشبك (الشكل 1B). مع جميع أغشية مفتوحة بالكامل علينا أن نفضح شريحة إلى السلطة ضوء الحد الأقصى لتفعيل channelrhodopsin (الشكل 1A). على المجهر لدينا ، هذا التكوين التصحيح ينتج ضوء الكثافة أن نحو ثلاثة أوامر من حجم أقل من الحد الأقصى لكثافة الحقل الكامل (4.1 μW / مم 2 ميغاواط مقابل 6،88 / مم 2).
نرى العلامات قوية من البالغين المولودين في الحبيبية البصلة الشمية وperiglomerular أسابيع الخلايا العصبية بعد الإصابة lentiviral ترحيل neuroblasts في تيار الهجرة منقاري (الشكل 2A) وتسجيل فضفاضة التصحيح من احد الكبار المولد ChR2 - EYFP معربا عن الخلية الحبيبية يشير إلى أن لتحفيز مللي 5 في المأثورأم السلطة (6،88 ميغاواط / مم 2) كافية لاستحضار التشويك (الشكل 2B). منذ مستوى التعبير تختلف بين الخلايا ، فإن كمية الضوء الذي يمر على عتبة ارتفاع تختلف ، وينبغي أن يوصف إحصائيا لكل نوع من الخلايا في المصالح.
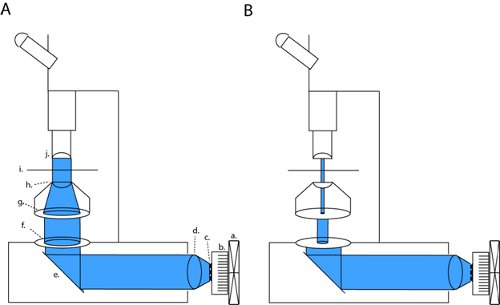
الشكل 1. الصمام الإعداد لمجموعة كاملة حقل ضوئي والتصحيح ، المشبك الكهربية شريحة. لتنشيط channelrhodopsin (ChR2) ونحن مشروع شعاع موازى من خلال فتحات خلفية مفتوحة والبصريات المكثف (أ). يمكن تغيير هذا التكوين في البصريات الترقيع عالية التباين عن طريق إغلاق الحاجز بالكامل الميدانية وتحوير عرض الحجاب الحاجز الحقل (ب). المختصرات : (أ) مروحة ، خافض الحرارة ب ، ج مجموعة LED ، د عدسة الموازاة ، مرآة ه ، F. حجاب الميدان ، ز غشاء الفتحة ، ح عدسة المكثف ، ط ساmple المرحلة ، ي موضوعية.
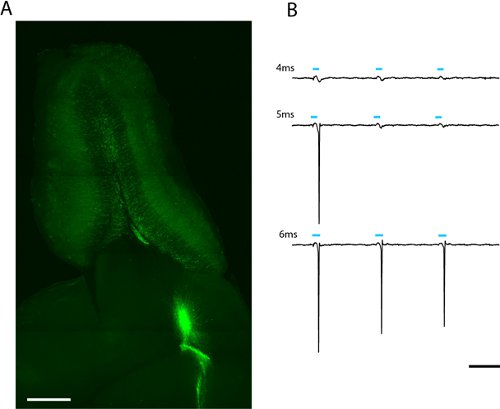
الشكل 2. صورة شريحة أفقية 300μm من البصلة الشمية لالمشبك التصحيح وضوئي كامل الحقل (أ). ويمكن رؤية المصابين Lentivirally الخلايا الحبيبية البالغين المولودين في التعبير عن ChR2 - EYFP يشع من جوهر البصلة الشمية. يمكن العثور على الخفيف الجرعة المطلوبة لاستحضار ارتفاعه عن طريق زيادة مدة فلاش LED (ب). وكان الحد الأدنى لهذه الخلية الحبيبية 5ms الكامل في كثافة LED (2.43mW/mm 2). النطاق في (أ) = 500μm ، في نطاق 50ms = (ب).
Discussion
وقد شهدت السنوات الأخيرة انفجارا في شعبية أدوات optogenetic للبحوث علم الأعصاب 6. نتيجة لذلك ، من المهم بصورة متزايدة لخفض الحواجز لدخول المختبرات الراغبة في البدء في استخدام هذه الأدوات الجديدة. هنا ونحن تصف كيفية إجراء التعديل التحديثي بسيطة ومنخفضة التكلفة ومعاي...
Disclosures
الإعلان عن أي تضارب في المصالح.
Acknowledgements
وأيد هذا العمل من قبل شركة التأمين على الحياة "AG2R - LA - مونديال" ، مدرسة قصر العلوم العصبية في باريس (ENP) ، والوكالة الوطنية للبحوث دي لا "ANR - 09 - NEUR - 004" في إطار نيورون إيرانيت " "من FP7 البرنامج من قبل المفوضية الأوروبية ومؤسسة باستور. وأيد سيباستيان فاغنر من قبل مؤسسة يتين ممثل.
Materials
| Name | Company | Catalog Number | Comments |
| Ketamine | Imalgène 1000 | 100 mg/ml | |
| Xylazine | Rompun | 2% | |
| NaCl | Sigma-Aldrich | S5886 | &nbps; |
| KCl | Sigma-Aldrich | P5405 | |
| MgSO4 | Sigma-Aldrich | M1880 | |
| NaHCO3 | Sigma-Aldrich | S5761 | |
| NaHPO4 | Sigma-Aldrich | S5011 | |
| Glucose | Sigma-Aldrich | G7021 | |
| CaCl2 | Sigma-Aldrich | C7902 | |
| Agarose | Sigma-Aldrich | A9539 | |
| Pipette Puller | Sutter Instrument Co. | P-97 | |
| Glass Capillaries | Harvard Apparatus | GC150T-10 | 1.5 mm O.D./1.17 mm I.D. |
| LED array | Bridgelux | BXRA-C2000 | |
| Collimating lens | Thorlabs Inc. | LEDC1 | 40 mm beam diameter |
| Power supply | A1W Electronik | HKO2800 | 2.8 amp |
| Optical power meter | Thorlabs Inc. | PM 100 | |
| Heatsink | Thermaltake | A1838 | Silent Boost K8 |
| Fan | Thermaltake | A1838 | Silent Boost K8 |
| Vibratome | Leica Microsystems | VT1200S |
References
- Nissant, A. Adult neurogenesis promotes synaptic plasticity in the olfactory bulb. Nature Neuroscience. 12, 728-730 (2009).
- Apicella, A. Pyramidal Cells in Piriform Cortex Receive Convergent Input from Distinct Olfactory Bulb Glomeruli. Journal of Neuroscience. 30, 14255-14260 (2010).
- Boyden, E. S. genetically targeted optical control of neural activity. Nature. 8, 1263-1263 (2005).
- Bardy, C. where new inhibitory neurons release neurotransmitters in the adult olfactory bulb. The Journal of Neuroscience. 30, 17023-17034 (2010).
- Grubb, M. S. Functional maturation of the first synapse in olfaction: development and adult neurogenesis. The Journal of neuroscience. 28, 2919-2932 (2008).
- Zhang, F. Circuit-breakers: optical technologies for probing neural signals and systems. Nature reviews. Neuroscience. 8, 577-581 (2007).
- Grossman, N. Multi-site optical excitation using ChR2 and micro-LED array. Journal of neural engineering. 7, 16004-16004 (2010).
- Dhawale, A. K. Non-redundant odor coding by sister mitral cells revealed by light addressable glomeruli in the mouse. Nature neuroscience. 13, 1404-1412 (2010).
- Weick, J. P. Functional control of transplantable human ESC-derived neurons via optogenetic targeting. Stem cells. 28, 2008-2016 (2010).
- Toni, N. Neurons born in the adult dentate gyrus form functional synapses with target cells. Nature Neuroscience. 11, 901-907 (2008).
- Grubb, M. S., Burrone, J. Channelrhodopsin-2 Localised to the Axon Initial Segment. PLoS ONE. 5, e13761-e13761 .
- Tye, K. M. Amygdala circuitry mediating reversible and bidirectional control of anxiety. Nature. 471, 358-362 (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved