A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
بروتوكولات لتلقيح المهبل وجمع العينات في النموذج التجريبي للماوس المبيضات المهبل
In This Article
Summary
مفتاح التقنيات المستخدمة في تقييم المبيضات المهبل في نموذج حيواني التجريبية. وسوف تسمح الأساليب جمع العينات السريع لمفاوي من المهبل وتجفيف الغدد الليمفاوية أسفل الظهر. هذه التقنيات يمكن أن تؤدي إلى نماذج الماوس من الأمراض الأخرى في المسالك التناسلية للإناث أقل.
Abstract
الفرجية المهبلية المبيضات (VVC) ، التي تسببها الأنواع المبيضات ، هو عدوى فطرية لانخفاض المسالك التناسلية للإناث الذي يؤثر على ما يقرب من 75 ٪ من النساء الأصحاء خلال سنوات الإنجاب 18،32-34. وتشمل العوامل المؤهبة استخدام المضادات الحيوية ، والسكري غير المنضبط واضطراب في مستويات الهورمونات التناسلية بسبب الحمل ، وحبوب منع الحمل أو العلاج بالهرمونات البديلة 33،34. VVC المتكررة (RVVC) ، على النحو المحدد ثلاثة أو أكثر من نوبات سنويا ، ويصيب 5 منفصلة إلى 8 ٪ من النساء مع عدم وجود عوامل مؤهبة 33.
وقد تم إنشاء نموذج الفأر VVC التجريبية واستخدامها لدراسة والمرضية المخاطية استجابة المضيف ل3،4،11،16،17،19،21،25،37 المبيضات. كما تم توظيف هذا النموذج لاختبار العلاجات المضادة للفطريات محتملة في الجسم الحي 13،24. نموذج يتطلب أن يكون الحفاظ على الحيوانات في حالة pseudoestrus لتختارimal المبيضات الاستعمار / 6،14،23 العدوى. في ظل هذه الظروف ، لن يكون تلقيح الحيوانات الفطرية المهبلية للكشف العبء لمدة أسابيع أو شهور. دراسات سابقة تظهر موازية عالية للغاية بين النموذج الحيواني والعدوى البشرية بالنسبة إلى الخصائص المناعية والفسيولوجية 3،16،21. الخلافات ، ولكن ، وتشمل عدم وجود المبيضات المهبلي والنباتات الطبيعية ودرجة الحموضة المهبلية محايدة في الفئران.
هنا ، علينا أن نظهر سلسلة من الطرق الرئيسية في الفأر نموذج المهبل والتي تشمل التلقيح المهبلي ، وجمع عينات من المهبل السريع ، وتقييم عبء الفطرية المهبلية ، والتحضيرات لاستخراج الأنسجة الخلوية / العزلة. ويعقب ذلك من خلال نتائج ممثلة لمكونات السائل غسل المهبل ، وعبء الفطرية ، وتجفيف المحاصيل الكريات البيض العقدة اللمفية. مع استخدام مواد التخدير ، ويمكن جمع عينات غسيل عند نقاط زمنية متعددة على نفس الفئران لتقييم الطولي للالعدوى / الاستعمار. وعلاوة على ذلك ، فإن هذا النموذج يتطلب أية عوامل مناعة لبدء العدوى ، والسماح للدراسات مناعية في ظل ظروف محددة المضيفة. أخيرا ، عرض نموذج وأسلوب كل هنا يمكن أن يحتمل أن يؤدي إلى استخدام منهجيات لدراسة الأمراض المعدية الأخرى لانخفاض المسالك التناسلية للإناث (البكتيرية والطفيلية والفيروسية) ، ومنها دفاعات المضيف المحلي أو النظامية.
Protocol
1. التلقيح المهبلي مع المبيضات البيض
- قبل ثلاثة أيام من التلقيح ، في حين أن تقييد الحيوان لكشف البطن ، وضخ 100 ميكرولتر من زيت السمسم يحتوي على 0،1-0،5 ملغ من استراديول β - تحت الجلد في أسفل البطن. دفع إبرة حوالي 5 إلى 10 مم الوحشي على الجلد للحد من التسرب من موقع الحقن.
الادارة تحت الجلد من هرمون الاستروجين في أسفل البطن هو الأمثل في هذا النموذج نظرا لقربها من الجهاز التناسلي. قد تختلف الجرعات الفعالة من قبل سلالات الفأر ، الأعمار أو مشتقات الاستروجين. في الدراسات السابقة باستخدام CBA - J (H - 2 κ) ، C3H/HeN (H - 2 κ) ، C57BL / 6 (H - 2 ب) ، BALB / ج (H - 2 د) ، ديسيبل / 2 (H - 2 د) ، SJL (H - 2 ق) في الفئران 6-8 أسابيع من العمر ، تم العثور على 0.1 ميكروليتر mg/100 فعالة يتضح من انخفاض سماكة الجدار المهبلي ، والمخاط المهبليزيادة الظهارية النزع الخلية. الفئران التي عولجت أعلاه مع تركيز الاستروجين في هذا المعرض بما يتفق مع الاستعمار المهبلية المبيضات. للتلقيح في الفئران من سلالات أخرى ، والأعمار ، وأوصت الدراسة التجريبية لضمان فعالية هرمون الاستروجين في ظل الظروف المعدلة وزيادة جرعة الاستروجين إذا لزم الأمر.
وينبغي إعداد الحل الاستروجين جديدة في كل مرة في اليوم من الحقن. لضمان الذوبان الكامل لهرمون الاستروجين في زيت السمسم ، ومزيج دقيق الحل باستخدام خلاط دوامة والحرارة بشكل متقطع عند 37 درجة مئوية. تكرار الحقن أسبوعيا طوال فترة الدراسة. - لتحضير اللقاح ، إضافة loopful جيم. albicans blastoconidia من إعداد فرعية الأخيرة على سابورو ، دكستروز أجار (SDA) في 10 مل من مرق فيتون - ببتون تستكمل مع السكر بنسبة 0.1 ٪. احتضان ثقافة مرق إلى مرحلة ثابتة لمدة 18 ساعة عند 25 درجة مئوية في حمام مائي تهتز.
- بعد الحضانة ، وجمع اله ثقافة مرق في أنبوب 15 مل المخروطية والطرد المركزي بنحو 800 x ج لمدة 5 دقائق. يغسل مرتين مع بيليه في برنامج تلفزيوني العقيمة.
- تعداد blastoconidia قابلة للحياة على عدادة الكريات بالاستبعاد التريبان صبغة زرقاء. ضبط تركيز خلية إلى 2.5 × 10 6 / مل (أو إلى التركيز المطلوب لقيحة) في برنامج تلفزيوني العقيمة.
- لتحقيق الاستقرار في الماوس ، الاستمرار على قاعدة الذيل مع اثنين من الأصابع ورفع الورك حتى الصعودي الذي يواجه الفتحة المهبلية نحوك (الشكل 1A). وهو مثالي إذا تم وضع الماوس على سطح مستو المبشور (مثلا أعلى القفص) بحيث يمكن أن توفر الماوس المقاومة ضد ضبط النفس الذيل.
- ماصة 20 ميكروليتر (أو الصوت المطلوب لا يتجاوز 20 ميكرولتر) من تعليق اللقاح عن طريق إدراج غيض ماصة حوالي 5 ملم عمق تجويف المهبل (الشكل 1B). إكمال هذه الخطوة بأسرع وقت ممكن وبلطف للحد من ضيق في الماوس.
2. المهبلية lavages
- القتل الرحيم التالية (أو تخدير) ، حالعمر الماوس الهابط من قاعدة الذيل مع اثنين من الأصابع بحيث تصبح فتحة المهبل عرضة للخطر.
- غسل تجويف المهبل عن طريق إدخال 100 ميكروليتر من PBS العقيمة مع تطلعات والانفعالات المتكررة مع طرف ماصة. يجوز للطرف ماصة انسداد مع الخلايا. إذا كان هذا يحدث ، موزعة على الخلايا ومواصلة عرقلة lavaging مع PBS المتبقية في المهبل. جمع السائل في أنبوب غسيل microcentrifuge.
- بدلا من ذلك ، يمكن إجراء lavages المهبلية على الفئران مع تخدير تخدير نشوق isoflurane. لهذا ، تعرض الفئران لتبخيرها isoflurane حتى يتم مخدرا تماما انهم (~ 30 ثانية). الاستمرار على الفئران الانحدار من خلال قاعدة الذيل وغسل بلطف تجويف المهبل باستخدام 50 ميكرولتر من برنامج تلفزيوني العقيمة. تأكد لتجنب التحريض قاسية مع طرف ماصة للتقليل من الصدمة إلى المهبل أثناء هذا الإجراء. وينبغي أن الفئران مخدرا على التعافي من التخدير في غضون 30 ثانية من التعرض للهواء المحيط.
Isofluraneيمكن تبخيرها باستخدام المرذاذ isoflurane وO 2 (المفضل) أو نظام الهبوط القياسي غرفة مغلقة من دون مخدر نظام المرذاذ (يتطلب مراقبة وثيقة للحيوان في حين مخدرا لتجنب ضيق التنفس).
وينبغي على الفئران lavages المهبلية تخدير يكون الأسلوب المفضل لعينات غسيل طولية على الفئران نفسها. lavaging متتالية لا تؤثر على تقييم عبء الفطرية مع مرور الوقت 41.
- الرطب ليشن الاستعدادات ، ونقل 10 ميكرولتر من غسل السائل على شريحة زجاجية ومراقبة في التكبير 400 1000x بواسطة المجهر الضوئي. بالإضافة إلى ذلك ، يمكن ملطخة الكسور الخلوي للغسيل السائل لدراسة الخلية وmorphologies النووية. الاستعدادات لطاخة ، ونقل 10 ميكروليتر من السائل على شريحة غسل الزجاج وانتشار بلطف باستخدام الجدار الخارجي من طرف ماصة. الحفاظ على عينات مسحة مع تثبيتي CytoPrep وصمة بواسطة تقنية بابانيكولاو القياسية (مسحة عنق الرحم). نلاحظ في التكبير × 400 بواسطة المجهر الضوئي.
3. الكمي لعبء الفطرية المهبلية
- في الجولة 96 لوحة القاع جيدا ، ونقل السائل في واحدة غسل جيدا في الصف العلوي و 180 ميكروليتر من PBS العقيمة في آبار 5 التالية من هذا العمود (أسفل لوحة).
- جعل 01:10 التخفيفات المتسلسلة لغسل السائل المهبلي عن طريق نقل 20 ميكروليتر من السائل إلى البئر التالي في العمود. مزيج دقيق من قبل التطلع المتكرر قبل كل عملية تحويل. لا يمكن أن يؤديها التخفيفات المتسلسلة لتصل الى 12 عينات غسيل (صف واحد أفقي كامل) في وقت واحد باستخدام ماصة 12 قناة.
- بدءا من أدنى التخفيف ، ونقل 10 ميكروليتر من العينة على سابورو ، دكستروز أجار (SDA). لا يمكن أن يؤديها الطلاء لمدة تصل إلى 36 في 1 العينات باستخدام لوحة SDA أعدت في أطباق بتري مربع مع الشبكة والأقنية تباعد ماصة للتعديل.
- تعداد الوحدات تشكيل مستعمرة (CFUs) بعد الحضانة عند 34 درجة مئوية وأو 48 ساعة.
4. الأنسجة المهبلية استخراج
- بعد إجراء غسيل المهبل ، وضع الماوس الموت الرحيم على ظهرها ، وإغراق المنطقة في الفخذ مع الايثانول 70 ٪. باستخدام زوج من الملقط ، رفع فوهة البول حتى التصاعدي أن فتحة المهبل يصبح عرضة للخطر.
- اضافة الى وجود زوج من ملقط المنحني في تجويف المهبل وتحديد عنق الرحم. مع الحفاظ على قبضة قوية مع ملقط ، استخراج عنق الرحم من خلال تجويف المهبل (الشكل 2A - C).
- استئصال المهبل عند قاعدة الفتحة المهبلية وعنق الرحم ثم أخرج من المهبل مع مقص جراحي. نضع في اعتبارنا أن الأنسجة المهبلية ملتف (ظهارة الداخلية جانب من المهبل يتعرض الخارج). يمكن أن تكون الأنسجة إما مقلوب جانبيا للحفاظ على التوجه الأصلي للمهبل أو فتحها في ورقة من خلال جعل شق الجانبية.
ويمكن استخدام الأنسجة المهبلية رفعه : 1) بعد استخراج الخلايا اللمفاوية الكولاجnase الهضم (~ 1 × 10 4 / الماوس) 40 ، 2) خلايا الظهارية الهضم العزلة dispase التالية (~ 5 × 10 4 / الماوس) 28 ، 3) الاستعدادات البارافين المجمد أو جزءا لا يتجزأ من أجل تحليل النسيجي 25.
5. قطني الختان العقدة اللمفية
- بعد إجراء غسيل المهبل ، وضع الماوس الموت الرحيم على ظهرها وتشبع البطن مع الايثانول 70 ٪. جعل شق الوحشي بدءا من أسفل البطن في الصدر وكشف الأعضاء الداخلية. باستخدام زوج من الملقط في كلتا اليدين ، نقل الأمعاء بحيث الصعودي الذي الأوعية الدموية المركزية تصبح مرئية.
- تحديد موقع الوريد الأجوف السفلي والشريان الأورطي البطني. عادة ، يمكن التعرف على زوج من الغدد الليمفاوية المجاورة لالقطنية الشريان الأورطي في البطن ، وتقع في منتصف المسافة تقريبا بين منشأ الشرايين الكلوية والحرقفي المشترك 39. يمكن أن تكون هذه العقد الليمفاوية حاليا بصريا من الأنسجة الدهنية من النسيج المرنوأخف وزنا واكثر في كامد اللون بالمقارنة مع الأنسجة الدهنية (الشكل 3). هذه العقد اللمفاوية هي أكبر بشكل ملحوظ في الحيوانات المصابة مقارنة مع الحيوانات uninoculated.
- استئصال الغدد الليمفاوية عن طريق وضع microforceps تحت عقدة ثم سحب ما يصل بلطف لفصل من الأنسجة المحيطة.
6. عزل الخلايا اللمفاوية وحيدة الخلية في المعلقات
- نقل الغدد الليمفاوية على شاشة سلكية العقيمة (حوالي 3 × 3 سم 2 في الحجم) وضعت داخل طبق بتري معقمة تحتوي على زجاج ~ 10 مل من محلول هانكس "الملح المتوازن (HBSS) (الشكل 4).
- مع طبق بتري تميل قليلا ، اضغط على الغدد الليمفاوية ضد الشاشة مع حقنة رأس المكبس. تأكد لكسر جميع الغدد الليمفاوية بحيث محتويات الخلوية من العقد تمر عبر الشاشة في حين أن المكونات غير الخلوية من العقد (أي الأغشية ، سدى ، والدهون) لا تزال على الشاشة.
- باستخدام نفس الغواص والمحاقن ، ونضح رانه HBSS الخلايا التي تحتوي على. غسل الشاشة مع ~ HBSS 5 مل وجمع السائل المتبقي في أنبوب 15 مل المخروطية.
- الطرد المركزي بنحو 800 x ج لمدة 10 دقيقة. نضح أي الترسبات الدهنية في الجزء العلوي من السوائل مع ماصة قبل التخلص من السوائل. غسل الخلية بيليه ثلاث مرات مع HBSS. Resuspend على بيليه في 1 مل من HBSS وخلايا قابلة للحياة من خلال تعداد الاستبعاد التريبان صبغة زرقاء.
7. ممثل النتائج :
كسور الخلوية السائل غسل المهبل من الفئران التي تستمر 4 أيام> تلقيح وعادة ما تتألف من المبيضات ، ويخترق الخلايا الظهارية الخلوية (الشكل 5). بواسطة الرطب يشن المجهر ، ويمكن التعرف بصريا المبيضات بسبب وجود خيوط وكذلك الخميرة (الشكل 5A). يمكن ملطخة الاستعدادات مسحة من السائل غسل المهبل بواسطة تقنية بابانيكولاو لفحص الخلايا الظهارية والكريات البيض التسلل ، والتي من الخلايا الرئيسية هي العدلات التي حددها nucle الثلاثيفصوص ع (الشكل 5B). تم الكشف عن عدد قليل جدا من العدلات ، إن وجدت ، في الفئران uninoculated (الشكل 5C) 41.
ويظهر مثال من عبء الفطرية المهبلية في الشكل 6. تستزرع غسل السائل المهبلي جمعها في نقاط زمنية محددة لتعداد CFU الشكل (6A). استعمار المهبل / المبيضات العدوى استمرت لعدة أسابيع في الفئران المعالجة الاستروجين تلقيح (الشكل 6B) ، في حين فشل لإنشاء المبيضات المهبلية الاستعمار في غير الاستروجين علاج الفئران الملقحة (الشكل 6C). الاستروجين علاج الفئران uninoculated تبقى سلبية على المبيضات طوال الوقت (لا تظهر البيانات). بالإضافة ، يمكن أن يؤديها lavages المهبلي إما مرة واحدة على الفئران منفصلة في كل نقطة زمنية أو طوليا في نفس الفئران تحت التخدير.
العقد اللمفية القطنية هي الغدد الليمفاوية الأولية تجفيف الجهاز التناسلي والموقع الأكثر ملاءمة لتقييم الاستجابات المناعية الجهازية لتحد المهبلية. N OTE أن هذه الغدد الليمفاوية قد تصبح الموسع في الفئران الملقحة في حين أنها تظهر عادة صغيرة جدا في الفئران uninoculated. المستردة الخلوية الكريات البيض عادة ما تتراوح بين 8 × 10 5 الماوس / uninoculated إلى 5 × 10 6 الماوس / تلقيح. بالإضافة إلى الغدد الليمفاوية أسفل الظهر ، ويمكن أيضا الغدد الليمفاوية الأربية ، والمأبضية المساريقي استخدامها.
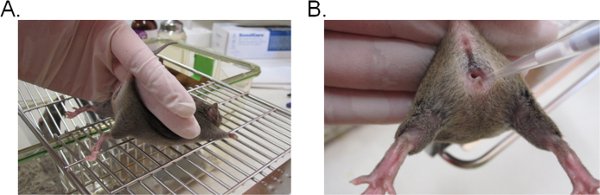
الشكل 1. التلقيح المهبلي مع المبيضات. أ) الماوس مقيدة للتلقيح. يتم وضع الماوس على إدراج سلك القفص واحتجزتهم في قاعدة الذيل ، صعودا طفيفا لرفع الساقين وفضح الفتحة المهبلية. يمكن أن تستقر في الورك من الفأر مع اليد نفسها التي تحاول مقاومة ضبط النفس الذيل. ب) مقدمة من اللقاح في تجويف المهبل. يتم إدراج بلطف تلميح ماصة حوالي 5 ملم عمق تجويف المهبل. وتودع ثم قيحة التعليق.
الحمار = "jove_content"> 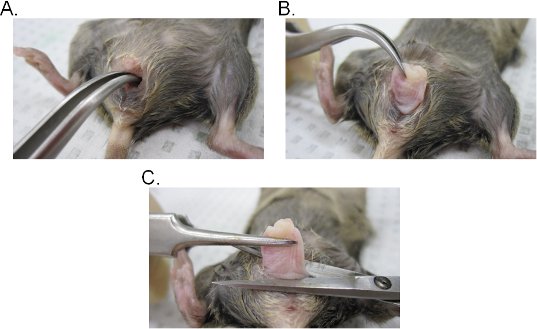
الشكل 2. المهبلي استخراج الأنسجة. AB) استخلاص عنق الرحم. يقع عنق الرحم بالملقط المنحنية ويتعرض الخارج من خلال تجويف المهبل. مرة واحدة للخروج من جوف المهبل ، ويتم سحب مزيد من عنق الرحم إلى الخارج للكشف تماما عن المهبل. C) استخلاص المهبل. واستئصاله من المهبل الفرج مع المقص. فصل مرة واحدة ، وإزالة عنق الرحم من المهبل.

الشكل 3 : تحديد الغدد الليمفاوية أسفل الظهر. يشار إلى مكان الغدد الليمفاوية أسفل الظهر بين الأجهزة المحيطة / الأوعية الدموية في منطقة الحوض. والشريان الأورطي ، في البطن. (ب) والمثانة البولية. C ، الشريان الحرقفي المشترك. أنا والأمعاء. L ، والكبد. R ، المستقيم. S والطحال. U ، الرحم.

الشكل 4 ، والغدد الليمفاوية أسفل الظهر وضعت على شاشة شبكة الأسلاك. ويتم تجميع الغدد الليمفاوية على الشاشة وضعها في طبق بتري مع HBSS. يتم الضغط على الغدد الليمفاوية ضد الشاشة مع المكبس للحصول على حقنة في الخلايا اللمفاوية وحيدة الخلية تعليق.
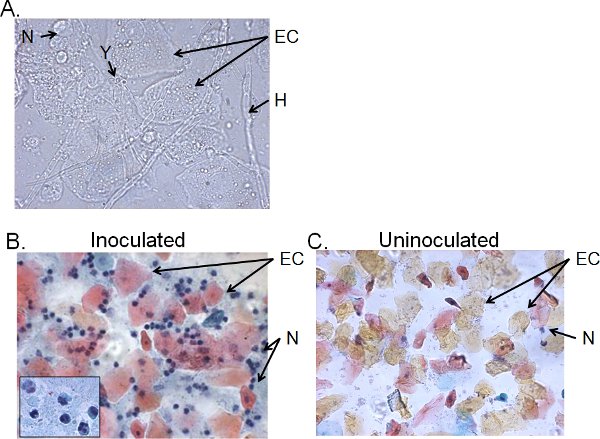
الشكل 5. كسور الخلوية السائل غسل المهبل من الفئران الملقحة. جمعت الاستعدادات A) ويت جبل وباء) مسحة عنق الرحم لعينات غسيل المهبل 4 أيام بعد التلقيح وجيم) من الفئران uninoculated. وتظهر الصور في 1000 × (A) أو 400 × (B ، C) التكبير. إدراج في باء يظهر التشكل النووية العدلات مهبلية في 1000 ×. المبيضات الخميرة (ص) وخيطان (H) ، والخلايا الظهارية (EC) وneutrohils (N) هي المشار إليها.
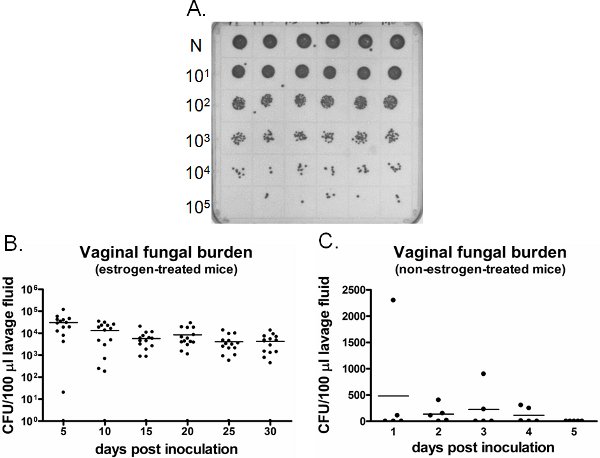
الشكل 6. كشفايون من عبء الفطرية المهبلية. أ) الممثل جيم المستعمرات albicans نمت على طبق من حزب العمل الديمقراطي. وكانت العينات المخففة متسلسل أنيق غسيل (N) من الفئران الملقحة six مختلفة (الصف العلوي) ، ومثقف لتعداد CFU. B) الكمي لعبء الفطرية المهبلية الاستروجين في المعاملة وC) الاستروجين الفئران غير المعالجة. وجرى تقييم CFU/100 ميكرولتر من السوائل من الفئران الملقحة غسيل على النقاط الزمنية المشار إليها.
Discussion
وقد تم إنشاء نموذج الفأر تجريبية من المهبل والمبيضات تستخدم تاريخيا على مدى العقود القليلة الماضية لدراسة المخاطية استجابة المضيف لالمبيضات وكذلك لاختبار العلاجات المضادة للفطريات 3،4،11،13،16،17،19،21،24 ، 25،37. قدم البروتوكولات تتضمن هنا أقل كفاءة وسائل...
Disclosures
الإعلان عن أي تضارب في المصالح.
Acknowledgements
وأيد هذا العمل من قبل R01 AI32556 (المعدية ، المعهد الوطني للصحة). وأيد أيضا هذا العمل في جزء من ولاية لويزيانا الجنوبية واللقاحات مركز ولاية لويزيانا معهد بحوث الأمراض المعدية التي يرعاها المجلس ولاية لويزيانا من الحكام.
Materials
| اسم الكاشف | شركة | فهرس العدد | تعليقات |
| الإناث CBA / J الفئران | مختبرات نهر تشارلز | 01C38 | 5-6 أسابيع من العمر |
| المبيضة البيضاء (3153A) | الوطنية مجموعة من الفطريات الممرضة ، والمملكة المتحدة | NCPF3153 | |
| زيت السمسم | سيغما الدريخ | S3547 | ليس من الضروري أن يكون ما قبل تعقيمها قبل استخدامها |
| Β استراديول - 17 - فاليرات | سيغما الدريخ | E1631 | 0.1 - 0.5mg في زيت السمسم |
| ببتون فيتون | بيكتون ديكنسون | 211906 | الملحق مع الجلوكوز 0.1 ٪ |
| التريبان الأزرق الحل | سيغما الدريخ | T8154 | |
| أغار سابورو الدكستروز | بيكتون ديكinson | 211584 | |
| النوع الرابع كولاجيناز | سيغما الدريخ | C5138 | 0.25 ٪ |
| Dispase | Invitrogen | 17105-041 | 1.7 U / مل |
| شاشات سلكية | TWP | 060X060S0065W36T | رقم 60 سلكية ، غير القابل للصدأ |
| هانكس "محلول ملحي متوازن | Invitrogen | 24020-117 | |
| CytoPrep تثبيتي | فيشر العلمية | 12-570-10 | يحفظ الشرائح مسحة |
| بابانيكولاو صمة EA - 65 | EMD كيماويات | 7054X - 85 | |
| بابانيكولاو صمة OG - 6 | EMD كيماويات | 7052X - 85 | |
| الهيماتوكسيلين الشب هاريس | EMD كيماويات | 638A - 85 | |
| Isoflurane | باكستر للرعاية الصحية | NDC 10019-773-60 | تستخدم مع المرذاذ isoflurane أو في نظام مغلق قطرة مخدر الغرفة |
References
- Abraham, M. C. Inducible immunity to Trichomonas vaginalis in a mouse model of vaginal infection. Infect. Immun. 64, 3571-3571 (1996).
- Black, C. A. Major histocompatibility haplotype does not impact the course of experimentally induced murine vaginal candidiasis. Lab. Anim. Sci. 49 (6), 668-668 (1999).
- Black, C. A. Acute neutropenia decreases inflammation associated with murine vaginal candidiasis but has no effect on the course of infection. Inf. Immun. 66, 1273-1273 (1998).
- Black, C. A. Increased severity of Candida vaginitis in BALB/c nu/nu mice versus the parent strain is not abrogated by adoptive transfer of T cell enriched lymphocytes. J. Reprod. Immunol. 45, 1-1 (1999).
- Buchannan, D. L. Role of stromal and epithelial estrogen receptors in vaginal epithelial proliferation, stratification, and cornification. Endocrinology. 139 (10), 4345-4345 (1998).
- Clemons, K. V. Genetic susceptibility of mice to Candida albicans vaginitis correlates with host estrogen sensitivity. Infect. Immun. 72, 4878-4878 (2004).
- Conrady, C. D., Halford, W. P., Carr, D. J. Loss of the type I interferon pathway increases vulnerability of mice to genital Herpes simplex virus 2 infection. J. Virol. 85 (4), 1625-1625 (2011).
- Cunha, G. R., Cooke, P. S., Kurita, T. Role of estromal-epithelial interaction in hormonal responses. Arch Histol Cytol. 67 (5), 417-417 (2004).
- Enjalbert, B. A multifunctional, synthetic Caussia princeps luciferase reporter for live imaging of Candida albicans infections. 77 (11), 4847-4847 (2009).
- Feinen, B. Critical role of Th17 responses in a murine model of Neisseria gonorrhoeae genital infection. Mucosal Immunol. 3 (3), 312-312 (2010).
- Fidel, P. L. Distinct protective host defenses against oral and vaginal candidiasis. Med. Mycol. 40, 359-359 (2002).
- Fidel, P. L. An intravaginal live Candida challenge in humans leads to new hypotheses for the immunopathogenesis of vulvovaginal candidiasis. Infect. Immun. 72, 2939-2939 (2004).
- Fidel, P. L., Cutright, J. L., Sobel, J. D. Efficacy of D0870 treatment of experimental Candida vaginitis. Antimicrob. Agents. Chemother. 41, 1455-1455 (1997).
- Fidel, P. L., Cutright, J. L., Steele, C. Effects of Reproductive hormones on experimental vaginal candidiasis. Infect. Immun. 68, 651-651 (2000).
- Fidel, P. L. A murine model of Candida glabrata vaginitis. J. Inf. Dis. 173, 425-425 (1996).
- Fidel, P. L. Analysis of vaginal cell populations during experimental vaginal candidiasis. Inf. Immun. 67, 3135-3135 (1999).
- Fidel, P. L., Lynch, M. E., Sobel, J. D. Candida-specific cell-mediated immunity is demonstrable in mice with experimental vaginal candidiasis. Infect. Immun. 61, 1990-1990 (1993).
- Fidel, P. L., Sobel, J. D. Immunopathogenesis of recurrent vulvovaginal candidiasis. Clin. Microbiol. Rev. 9. 9, 335-335 (1996).
- Fidel, P. L., Sobel, J. D., Zak, O., Sande, M. . Murine Models of Candida Vaginal Infections, In Experimental models in antimicrobial chemotherapy. , 741-748 (1999).
- Fidel, P. L., Vazquez, J. A., Sobel, J. D. Candida glabrata: Review of epidemiology, pathogenesis, and clinical disease with comparison to C. albicans. Clin. Microbiol. Rev. 12, 80-80 (1999).
- Fulurija, A., Ashman, R. B., Papadimitriou, J. M. Neutrophil depletion increases susceptibility to systemic and vaginal candidiasis in mice, and reveals differences between brain and kidney in mechanisms of host resistance. Microbiology. 142, 3487-3487 (1996).
- Gill, N. NK cells require type I IFN receptor for antiviral responses during genital HSV-2 infection. Cell Immunol. 269 (1), 29-29 (2011).
- Hamad, M., Abu-Elteen, K. H., Ghaleb, M. Estrogen-dependent induction of persistent vaginal candidosis in naive mice. Cell. Immunol. 47 (7), 304-304 (2004).
- Hamad, M. Utility of the oestrogen-dependent vaginal candidosis murine model in evaluating the efficacy of various therapies against vaginal Candida albicans infection. Mycoses. 49 (2), 104-104 (2006).
- LeBlanc, D. M., Barousse, M. M., Fidel, P. L. A role for dendritic cells in immunoregulation during experimental vaginal candidiasis. Infect. Immun. 74, 3213-3213 (2006).
- McGrory, T., Garber, G. E. Mouse intravaginal infection with Trichomonas vaginalis and role of Lactobacillus acidophilus in sustaining infection. Infect. Immun. 60, 2375-2379 (1992).
- Naglik, J. R., Fidel, P. L., Odds, F. C. Animal models of mucosal Candida infection. FEMS. Microbiol. Lett. 283 (2), 129-129 (2008).
- Nomanbhoy, F. Vaginal and oral epithelial cell anti-Candida activity. Inf. Immun. 70, 7081-7081 (2002).
- Pietrella, D. A beta-glucan-conjugate vaccine and anti-beta-glucan antibodies are effective against murine vaginal candidiasis as assessed by a novel in vivo imaging technique. Vaccine. 28 (7), 1717-1717 (2010).
- Redondo-Lopez, V., Cook, R. N., Sobel, J. D. Emerging role of Lactobacilli in the control and maintenance of the vaginal bacterial microflora. Rev Infect Dis. 12 (5), 856-856 (1990).
- Saavedra, M. Local production of chemokines during experimental vaginal candidiasis. Inf. Immun. 67, 5820-5820 (1999).
- Sobel, J. D. Pathogenesis and epidemiology of vulvovaginal candidiasis. Ann. N. Y. Acad. Sci. 544, 547-547 (1988).
- Sobel, J. D. Pathogenesis and treatment of recurrent vulvovaginal candidiasis. Clin. Infect. Dis. 14, S148-S153 (1992).
- Sobel, J. D. Vulvovaginal candidiasis: Epidemiologic, diagnostic, and therapeutic considerations. Am. J. Obstet. Gynecol. 178 (2), 203-203 (1998).
- Song, W. Local and humoral immune responses against primary and repeat Neisseria gonorrhoeae genital tract infections of 17β-estradiol-treated mice. Vaccine. 26, 5741-5741 (2008).
- Taylor, B. N. In vivo virulence of Candida albicans isolates causing mucosal infections in people infected with the human immunodeficiency virus. J. Infect. Dis. 182, 955-955 (2000).
- Taylor, B. N., Saavedra, M., Fidel, P. L. Local Th1/Th2 cytokine production during experimental vaginal candidiasis. Med. Mycol. 38, 419-419 (2000).
- Tirabassi, R. S. A mucosal vaccination approach for herpes simplex virus type 2. Vaccine. 29 (5), 1090-1090 (2011).
- Broeck, W. V. a. n. d. e. n., Derore, A., Simoens, P. Anatomy and nomenclature of murine lymph nodes: descriptive and nomenclatory standardization in BALB/cAnNCrl mice. J. Immunol. Methods. 312 (1-2), 12-12 (2006).
- Wormley, F. L., Chaiban, J., Fidel, P. L. Cell adhesion molecule and lymphocyte activation marker expression during experimental vaginal candidiasis. J. Immunol. Methods. 69, 5072-5072 (2001).
- Yano, J. Epithelial cell-derived S100 calcium-binding proteins as key mediators in the hallmark acute neutrophil response during Candida vaginitis. Infect. Immun. 78 (12), 5126-5126 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved