A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
الإنتاجية العالية للبروتينات غشاء البلورة باستخدام أسلوب Bicelle Lipidic
In This Article
Summary
Bicelles هي مزيج الدهن / مزدوج الألفة التي تحافظ على بروتينات غشاء (النواب) في طبقة ثنائية المادة الدهنية ولكن فريد السلوك المرحلة التي تسهل سرعة عالية الفحص بواسطة الروبوتات التبلور. وقد أنتجت هذه التقنية بنجاح في عدد من هياكل عالية الدقة من مصادر حقيقية النواة وبدائية. هذا الفيديو يصف بروتوكولات لتوليد الخليط bicelle lipidic ، وإدماج النواب في خليط bicelle ، وإقامة المحاكمات التبلور (يدويا وكذلك آليا) ، والحصاد بلورات من المتوسط.
Abstract
Membrane proteins (MPs) play a critical role in many physiological processes such as pumping specific molecules across the otherwise impermeable membrane bilayer that surrounds all cells and organelles. Alterations in the function of MPs result in many human diseases and disorders; thus, an intricate understanding of their structures remains a critical objective for biological research. However, structure determination of MPs remains a significant challenge often stemming from their hydrophobicity.
MPs have substantial hydrophobic regions embedded within the bilayer. Detergents are frequently used to solubilize these proteins from the bilayer generating a protein-detergent micelle that can then be manipulated in a similar manner as soluble proteins. Traditionally, crystallization trials proceed using a protein-detergent mixture, but they often resist crystallization or produce crystals of poor quality. These problems arise due to the detergent′s inability to adequately mimic the bilayer resulting in poor stability and heterogeneity. In addition, the detergent shields the hydrophobic surface of the MP reducing the surface area available for crystal contacts. To circumvent these drawbacks MPs can be crystallized in lipidic media, which more closely simulates their endogenous environment, and has recently become a de novo technique for MP crystallization.
Lipidic cubic phase (LCP) is a three-dimensional lipid bilayer penetrated by an interconnected system of aqueous channels1. Although monoolein is the lipid of choice, related lipids such as monopalmitolein and monovaccenin have also been used to make LCP2. MPs are incorporated into the LCP where they diffuse in three dimensions and feed crystal nuclei. A great advantage of the LCP is that the protein remains in a more native environment, but the method has a number of technical disadvantages including high viscosity (requiring specialized apparatuses) and difficulties in crystal visualization and manipulation3,4. Because of these technical difficulties, we utilized another lipidic medium for crystallization-bicelles5,6 (Figure 1). Bicelles are lipid/amphiphile mixtures formed by blending a phosphatidylcholine lipid (DMPC) with an amphiphile (CHAPSO) or a short-chain lipid (DHPC). Within each bicelle disc, the lipid molecules generate a bilayer while the amphiphile molecules line the apolar edges providing beneficial properties of both bilayers and detergents. Importantly, below their transition temperature, protein-bicelle mixtures have a reduced viscosity and are manipulated in a similar manner as detergent-solubilized MPs, making bicelles compatible with crystallization robots.
Bicelles have been successfully used to crystallize several membrane proteins5,7-11 (Table 1). This growing collection of proteins demonstrates the versatility of bicelles for crystallizing both alpha helical and beta sheet MPs from prokaryotic and eukaryotic sources. Because of these successes and the simplicity of high-throughput implementation, bicelles should be part of every membrane protein crystallographer′s arsenal. In this video, we describe the bicelle methodology and provide a step-by-step protocol for setting up high-throughput crystallization trials of purified MPs using standard robotics.
Protocol
وتتألف Bicelle التبلور القائم على أربع خطوات أساسية (الشكل 2) : أ) إعداد وتشكيل الدهون bicelle : خليط مزدوج الألفة ؛ ب) إدماج تنقية البروتين في المتوسط bicelle ؛ الثالث) المحاكمات التبلور (يدويا أو آليا) و) رابعا التصور ، وتجميد استخراج الكريستال. يتم وصف هذه الخطوات بالتفصيل أدناه
1. إعداد Bicelles
يمكن Bicelles النموذج في مجموعة متنوعة من الدهون : تركيبات مزدوج الألفة وأكثر من مجموعة واسعة من التركيزات. ولذلك ، فإن الشروط التي أوصت بها تركيبة القائمة الأولية بشأن الناجحة السابقة (الجدول 1). الخليط هو أنجح DMPC : صياغة bicelle CHAPSO ، والتي يمكن شراؤها إما تجاريا باسم صيغة جاهزة للاستخدام خلط (انظر الجدول أدناه من الكواشف) أو معدة في المختبر كما هو موضح. لهذا التمرين سوف نستعد 1 مل من 35 ٪ DMPC : خليط CHAPSO في نسبة لا المولي 2.8:1.
- زن من أصل 0،26 ز DMPC (السيد 677.9 غرام / مول) ، 0.09 ز CHAPSO (السيد 630.9 غرام / مول) ، وإضافة الماء منزوع الأيونات إلى وحدة تخزين النهائي للمل 1.0.
- يمكن أن تختلف النسبة المئوية bicelle بين 10 ٪ -40 ٪ مع DMPC : نسبة تتراوح بين رحى CHAPSO 2.6-3.0:1 (الجدول 1).
- ملاحظة : كلما زاد تركيز bicelle أكثر صعوبة حل الدهون مما أدى إلى ارتفاع اللزوجة حل. ومع ذلك ، يمكن صياغة bicelle تتركز يكون من المفيد عند تركيز منخفض البروتين.
- تذويب الدهون للحصول على حل متجانسة يتطلب جهدا كبيرا ، مما يجعل هذه الخطوة الأكثر استهلاكا للوقت في أسلوب bicelle. دورة من خلال الخطوات التالية حتى DMPC مختلطة تماما :
- دافئة الخليط إلى ~ 40 درجة مئوية باستخدام حمام مائي أو حاضنة ان ودوامة لمدة دقيقة 1 ~.
- ملاحظة : كما يتم تنفيذ أكثر من دورة ، وسوف يؤدي ارتفاع درجة حرارة الخليط في يخدع مثل هلامsistency مما يجعل من الصعب دوامة.
- تبريد الخليط على الجليد ودوامة لبضع دقائق. التبريد يساعد على تسييل الحل مما يسهل الدوامة.
- ملاحظة : كما يتم تنفيذ المزيد من الدورات ، وهذا الخليط قد يصبح غائما على التبريد.
- كرر الخطوات المذكورة أعلاه (1.2.1 و 1.2.2) حتى يذوب تماما الدهون.
- ملاحظة : هذه العملية قد تستغرق عدة ساعات. يشار Bicelle تشكيل لتغييرات في سلوك المرحلة من DMPC : صياغة CHAPSO. عند الانتهاء ، سوف يكون هناك مزيج هلام واضحة عند أو فوق درجة حرارة الغرفة وسائل لزج على الجليد.
- دافئة الخليط إلى ~ 40 درجة مئوية باستخدام حمام مائي أو حاضنة ان ودوامة لمدة دقيقة 1 ~.
- الخليط bicelle الآن جاهزة للاستخدام ، ويمكن الاحتفاظ بها في -20 درجة مئوية لمدة طويلة الأجل تخزين (تصل إلى 5 سنوات). نظرا لخطر التحلل من فسفوليبيد رئيس المجموعة ، فإنه ليس من المستحسن لتخزين bicelles في درجة حرارة الغرفة لفترات طويلة.
2. إدراج البروتين إلى bicelles
تبلورت معظم الهياكل النائب في الحصول عليها من bicelles DMPC : CHAPSO bicelle تركيز تتراوح بين 2 إلى 8 ٪ باستخدام تركيز البروتين من 8 إلى 12 ملغ / مل (الجدول 1). إذا كان ذلك ممكنا ، ينبغي استخدام شاشات الأولية لهذه المبادئ التوجيهية ، ويمكن فحص تركيزات إضافية في المرحلة التحسين. بالمقارنة مع الأسلوب LCP ، مع دمج البروتين bicelles هي عملية بسيطة (الشكل 3) ، والذي ينبغي القيام به في اليوم نفسه الذي تبلور المحاكمات.
- ذوبان الجليد في DMPC : CHAPSO bicelle الخليط في درجة حرارة الغرفة حتى يتغير المرحلة إلى هلام واضحة.
- ملاحظة : متعددة يذوب التجميد لن يؤثر على سلوك bicelle.
- ضع الخليط على الجليد لتسييله ودوامة لفترة وجيزة لإعادة تأسيس مرحلة bicelle متجانسة. عند وضعه على الجليد قد تصبح خليط غائما.
- الابام على هذه النقطة ، والحفاظ على مزيج من البروتين وتنقيته bicelle على الجليد. هذا وسوف تبقي bicelle في المرحلة السائلة مما يجعلها قابلة للpipetting.
- إضافة إلى خليط من البروتين bicelle المنظفات - solubilized المنقى في نسبة (V / V) 1:4.
- على سبيل المثال : يتم الحصول على 100 ميكروليتر البروتين bicelle الخليط عن طريق خلط البروتين 80 ميكرولتر مع 20 bicelle ميكرولتر. إذا كان تركيز البروتين هو 15 ملغ / مل وتركيز bicelle 35 ٪ ، وهذا يعطي مزيج من البروتين bicelle المدمجة مع تركيز البروتين من 12 ملغ / مل وتركيز bicelle من 7 ٪.
- المزيج بلطف بواسطة pipetting محتويات صعودا وهبوطا حتى يصبح الحل واضحة ومتجانسة.
- ملاحظة : إذا لم تظهر فقاعات ، تدور بسرعة (30-60 ثانية ، 13000 دورة في الدقيقة ، 4 درجات مئوية) مع جهاز للطرد المركزي يمكن أن تساعد على الطاولة إزالتها.
- احتضان الخليط على الثلج لمدة 30 دقيقة على الأقل من أجل تعزيز إدماج كامل للكثافة البروتينس bicelles. خليط من البروتين bicelle جاهز الآن للمحاكمات التبلور.
3. إقامة محاكمات تبلور
غيرها من تقنيات بلورة الدهون مثل LCP تتطلب معدات متخصصة بسبب اللزوجة العالية والمتوسطة ، ولكن السلوك مرحلة فريدة من bicelles تصاريح التنفيذ فعليا في أي شكل بما في ذلك بلورة معيار الروبوتات (الشكل 3). ويمكن إجراء التجارب عليها في بلورة إما شنقا أو الجلوس تنسيقات قطرة باستخدام معيار شاشات متاحة تجاريا.
- إذا كان إعداد صواني يدويا أو باستخدام الروبوت التبلور ، والحفاظ على مزيج من البروتين bicelle على الجليد. هذا وسوف تبقي البرد خليط من البروتين bicelle والتأكد من أن اللزوجة من الحل هو الحد الأدنى.
- دليل المحاكمات البلورة -- استخدام ماصة القياسية ، ويمكن أن تكون مختلطة المزيج البروتين bicelle مع الحل في الخزان بنفس الطريقة التي تؤدي عادةإد لبروتينات قابلة للذوبان أو الغشاء solubilized المنظفات.
- ملاحظة : حافظ على خليط من البروتين bicelle على الجليد خلال المحاكمات.
- المحاكمات البلورة الروبوتية -- لدينا مصممة خصيصا لهذه المحاكمات الروبوت تبلور البعوض ، ولكن من حيث المبدأ (نفس الاحتياطات التالية) تقنية ينبغي أن تكون متوافقة مع جميع الروبوتات التبلور. والنصائح التالية تأكد من أن خليط من البروتين bicelle تبقى باردة وpipetted بدقة بواسطة الروبوت :
- Precool لوحة عقد مزيج البروتين bicelle بوضعه على الجليد.
- ماصة الخليط البروتين bicelle في لوحة ويستمر للحفاظ على لوحة على الجليد. وينبغي أن يكون هذا الطبق العنصر الأخير للذهاب على الروبوت قبل البدء في تشغيلها.
- انشاء درج الخزان والأغطية تبلور على منصة 3 و 5 على التوالي ، من الروبوت البعوض.
- مكان لوحة تحتوي على البروتين bicelle الخليط على منصة 4الروبوت من البعوض. ويؤكد هذا الخليط البروتين bicelle هو آخر من يتم انتقاؤها من قبل الروبوت ويتم تحريرها على الفور.
- لمنع التدفئة وزيادة اللزوجة ، لا تخلط الخزان مع خليط من البروتين bicelle.
- عند تنفيذ شاشات متعددة ، والعودة فورا لوحة bicelle البروتين إلى الثلج لتبريد حالما يتم الانتهاء من تشغيله.
- كما يمكن اختيار لبلورة التجارب التقليدية : انخفاض حجم ونسبة (الخزان البروتين). على سبيل المثال ، يمكن تعيين التجارب الأولية الكريستال باستخدام الروبوت البعوض ما يصل به 0،25 البروتين ميكرولتر : خليط bicelle زائد 0،25 الخزان ميكرولتر.
- احتضان التجارب الكريستال في غرفة عند 20 درجة مئوية. درجة الحرارة عرضا جيدا والمعلمة الأمثل لأن السلوك مرحلة bicelles تعتمد درجة الحرارة.
- ارتفاع درجات الحرارة يحفز المرحلة صفاحي 12 (الشكل 1) ، والذي لديه ميزة لتنظيم مرحلة ما قبلالبروتين في الطبقات. درجات الحرارة أقل من 20 ° إن يتم فحص C ، ولكن يجب أن لا يذهب أقل من 4 درجات مئوية منذ ذلك قد يتسبب في الدهون لتترسب على مدى فترات طويلة من الزمن.
- في بنفس الطريقة التقليدية بلورة التجارب ، ينبغي رصد المحاكمات bicelle على أساس منتظم لظهور ونمو الكريستال. نوصي للتحقق الصواني على شارع 1 و 3 اليوم الثالث بعد الإعداد تليها التفتيش الأسبوعية.
- ويمكن القيام به من الكريستال الأمثل الأساليب المستخدمة بصورة روتينية لبلورات المنظفات تقوم الشبكة بما في ذلك الفحص والفرز المضافة ، وتغيير درجات الحرارة وما إلى ذلك بالإضافة إلى ذلك ، والنسبة المئوية bicelle البروتين : يمكن أن تختلف bicelle النسبة. وعلاوة على ذلك ، يمكن مخدر bicelles مع الدهون الخاصة التي قد تكون ضرورية لاستقرار البروتين أو وظيفة.
4. التصور ، وتجميد استخراج الكريستال
منذ محاكمات الكريستال مع خليط من البروتين bicelle يملك اللزوجة مماثلة لالبروتين قطرات المنظفات ، والتصور واستخراج الكريستال أمر روتيني ، ونفذت مثل التقليدية المنبثقة مجموعة.
- التصور : وعلى النقيض من وسائل الإعلام التي غالبا ما يتطلب LCP عالية الجودة تحت الضوء الإضاءة الطبيعية والاستقطاب للكشف عن وضوح الشمس ، لا يعرقل التصور بواسطة bicelles. يمكن أن تكون ملونة وكذلك عديم اللون قطرات الكريستال بروتين تحليلها بسهولة باستخدام المجاهر القياسية ومطلوب أي معدات خاصة.
- Bicelles ، مثل وسائل الإعلام lipidic أخرى ، تميل إلى إنتاج نسبة عالية من ايجابيات كاذبة. مجهر الأشعة فوق البنفسجية يساعد كثيرا في التفريق البروتين من بلورات الملح (الشكل 4).
- استخراج والتجميد : استخراج كريستال وتجميد واضح ومباشر نسبيا ولا تحتاج إلى حل وسائل الإعلام bicelle المحيطة بها. بالإضافة إلى ذلك ، فإن المرحلة نفسها bicelle يوفر بعض الحماية من البرد المعتدل.
5. ممثل النتائج :
الإقليم الشمالي "> يستغرق عادة 2-3 أيام من أجل أن تظهر البلورات وحوالي اسبوع او اكثر لينموا إلى حجمها الأقصى ، وكان هذا هو الحال بالنسبة لقناة رودوبسين جرثومي والفأر التي تعتمد على الجهد أنيون 1 (mVDAC1) بلورات 4،8 . للحصول على بروتينات غشاء أخرى يمكن أن يستغرق أسابيع عدة للنمو وضوح الشمس ، ولذلك فمن المهم مواصلة رصد المحاكمات الكريستال تتجاوز الأسابيع الأولى.كما هو الحال مع وسائل الاعلام lipidic أخرى ، bicelles تميل إلى تشكيل الأشكال التي قد تبدو البلورية. كما لوحظ أنها تؤدي إلى ارتفاع نسبة الملح وبلورات المنظفات. ويمكن للأشعة فوق البنفسجية التي يكشف المجهر مضان التربتوفان تساعد كثيرا القضاء على هذه المنظمات غير البروتينية ايجابيات كاذبة. ويبين الشكل 4 أشكال الدهون والملح وبلورات البروتين كما تراه في الضوء المرئي والأشعة فوق البنفسجية للمساعدة في التمييز بين النتائج المختلفة التي يمكن ملاحظتها.
83fig1.jpg "/>
الشكل 1. Bicelle التخطيطي. وتتكون الدهون Bicelles لتشكيل جزيء طبقة ثنائية مثل DMPC (الأزرق) ، ومزدوج الألفة مثل CHAPSO (الأخضر) ، الذي يحمي حواف مسعور من طبقة ثنائية. كما يتم زيادة درجة الحرارة ، مثل قرص bicelles يخضع لعملية تحول في المرحلة 12 ورقة صفاحي مثقبة.
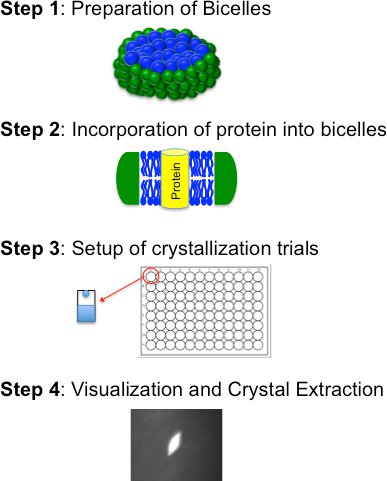
الشكل 2. مخطط انسيابي للأسلوب بلورة bicelle يحدد الخطوات الأساسية الأربعة.

الشكل 3. المحاكمات كريستال انشاء التخطيطي. يمكن تنقية البروتينات الغشاء المنظفات - solubilized مختلطة مباشرة مع bicelles على الثلج بواسطة pipetting ببساطة محتويات معا. بعد احتضان خليط من البروتين / bicelle على الجليد للمحاكمات تبلور ~ 30 دقيقة ،يمكن تعيين ما يصل به أي شكل بما في ذلك معيار الروبوتات.

الشكل 4. التصور المحاكمات الكريستال. صورة مرئية (لوحة أعلى) وصورة الأشعة فوق البنفسجية (اللوحة السفلية) من الإبرة على شكل بلورات (A) لوحظ في حالة الملح فقط. ويمكن الكشف عن أي مضان من البلورات ، وإشارة إيجابية كاذبة. (ب) شكلت رود على شكل الكريستال في حالة MPD. fluoresced البلورة ضعيف ولكن وجدت لتكون غير البروتينية باستخدام حيود الأشعة السينية. (ج) لاحظ كريستال حوالي أربعة أسابيع بعد إعداد المحاكمات. ومضان تحت ضوء الأشعة فوق البنفسجية القوية تؤكد ذلك هي عبارة عن بلورة البروتين.
| رقم | بروتين | مصدر | Bicelle صياغة | Concentrati البروتينفي | المنظفات 1 | القرار (أ) | مرجع |
| 1 | رودوبسين جرثومي 2 | الملحاء salinarum | 8 ٪ DMPC : CHAPSO (2.8:1) | 8 ملغ / مل | 2.0 | الفحام وباوي ، 2002 | |
| 8 ٪ DTPC : CHAPSO (3:1) | 8 ملغ / مل | 1.8 | الفحام وآخرون ، 2005 | ||||
| 2 | β2 مستقبلات الأدرينالية / المعقدة فاب | الإنسان العاقل | 8.3 ٪ DMPC : CHAPSO (3:1) | 10 ملغ / مل | DDM | 3.4/3.7 | راسموسين وآخرون ، 2007 |
| 3 | الجهد التي تعتمد على قناة أنيون 1 | Musculus موريشيوس | 7 ٪ DMPC : CHAPSO (2.8:1) | 12 ملغ / مل | LDAO | 2.3 | Ujwal وآخرون ، 2008 |
| 4 | Xanthorhodopsin | Salinibacter أحمر | 4.2 ٪ DMPC ، NM 5 ٪ | 4 ملغ / مل | DDM | 1.9 | Luecke وآخرون ، 2009 |
| 5 | المعيني البروتيني | كولاي | 2 ٪ DMPC : CHAPSO (2.6:1) | 9 ملغ / مل | Nonyl غلوكوزيد | 1.7 | Vinothkumar ، 2011 |
1 المنظفات المستخدمة لتنقية البروتين الغشاء
ويمكن تنفيذ 2 الدهون الأصلية من خلال الأغشية على تنقية الأرجواني
الجدول 1. ملخص تحل الظروف بلورة لهياكل البروتين غشاء bicelles به.
Access restricted. Please log in or start a trial to view this content.
Discussion
Bicelles هي فريدة من نوعها وسائل الإعلام التي تقدم lipidic الأصلي طبقة ثنائية مثل البيئة في حين تتصرف كما لو solubilized بواسطة المنظفات. هذه الخاصية يعطي bicelles ميزة واضحة اكثر من غيرها من أساليب بلورة الدهون على أساس أنه ليس هناك أي منحنى التعلم أو المعدات المتخصصة اللازمة لهذه ا?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
الإعلان عن أي تضارب في المصالح.
Acknowledgements
نود أن نشكر الدكاترة. جيمس باوي والفحام سالم لتقديم الخبرة الفنية والمشورة بشأن طريقة bicelle تل باز ، والدكتور لإجراء مناقشات مفيدة. نعترف لو دو لدعم التجريبية. راتشنا Ujwal ومصلحة مالية في MemX العلوم البيولوجية المحدودة ، التي ، مع ذلك ، لم تؤيد هذا العمل. وأيد هذا العمل في جزء من المنح المقدمة من المعاهد الوطنية للصحة (RO1 GM078844).
Access restricted. Please log in or start a trial to view this content.
Materials

References
- Landau, E. M., Rosenbusch, J. P. Lipidic cubic phases: A novel concept for the crystallization of membrane proteins. Proceedings of the National Academy of Sciences. 93, 14532-14535 (1996).
- Caffrey, M., Lyons, J., Smyth, T., Hart, D. J. Chapter 4 Monoacylglycerols: The Workhorse Lipids for Crystallizing Membrane Proteins in Mesophases. Current Topics in Membranes. 63, 83-108 (2009).
- Nollert, P., Landau, E. M. Enzymic release of crystals from lipidic cubic phases. Biochem. Soc. Trans. 26, 709-713 (1998).
- Cheng, A., Hummel, B., Qiu, H., Caffrey, M. A simple mechanical mixer for small viscous lipid-containing samples. Chem. Phys. Lipids. 95, 11-21 (1998).
- Faham, S., Bowie, J. U. Bicelle crystallization: a new method for crystallizing membrane proteins yields a monomeric bacteriorhodopsin structure. J. Mol. Biol. 316, 1-6 (2002).
- Faham, S., Ujwal, R., Abramson, J., Bowie, J. U. Chapter 5 Practical Aspects of Membrane Proteins Crystallization in Bicelles. Current Topics in Membranes. 63, 109-125 (2009).
- Faham, S. Crystallization of bacteriorhodopsin from bicelle formulations at room temperature. Protein Science. 14, 836-840 (2005).
- Luecke, H. Crystallographic structure of xanthorhodopsin, the light-driven proton pump with a dual chromophore. Proceedings of the National Academy of Sciences. 105, 16561-16565 (2008).
- Ujwal, R. The crystal structure of mouse VDAC1 at 2.3 Å resolution reveals mechanistic insights into metabolite gating. Proceedings of the National Academy of Sciences. 105, 17742-17747 (2008).
- Vinothkumar, K. R. Structure of rhomboid protease in a lipid environment. J. Mol. Biol. 407, 232-247 (2011).
- Rasmussen, S. G. F. Crystal structure of the human [bgr]2 adrenergic G-protein-coupled receptor. Nature. 450, 383-387 (2007).
- Prosser, R. S., Hwang, J. S., Vold, R. R. Magnetically aligned phospholipid bilayers with positive ordering: a new model membrane system. Biophys. J. 74, 2405-2418 (1998).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved