A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
رني ضربة قاضية بوساطة الجينات و
In This Article
Summary
في هذا البروتوكول ما جمعنا رني بوساطة إسكات الجينات مع في الجسم الحي فحص إدرار البول لدراسة آثار ضربة قاضية للجينات من لديه مصلحة في إفراز السائل البعوض.
Abstract
هذا الفيديو يشرح بروتوكول تقنية فعالة لضربة قاضية جين معين في حشرة وإجراء الاختبار الأحيائي رواية لقياس معدل الإفراز. ويمكن استخدام هذه الطريقة للحصول على فهم أفضل لعملية إدرار البول في الحشرات ويكون مفيدا بشكل خاص في دراسة إدرار البول في الدم والتغذية المفصليات التي تكون قادرة على حمل كميات كبيرة من السوائل في وجبة دم واحدة.
وقد تم تطوير هذا الجين رني ضربة قاضية بوساطة مقترنة في فحص إدرار البول المجراة من قبل مختبر هانسن إلى دراسة آثار رني بوساطة ضربة قاضية للجينات aquaporin على إدرار البول الزاعجة البعوض بعوض 1.
البروتوكول هو الإعداد في جزأين: أول مظاهرة يوضح كيفية بناء حقن البعوض جهاز بسيط، وكيفية تحضير وحقن الرنا المزدوج الجديلة في الصدر من البعوض لضربة قاضية الجينات [رني بوساطة. المظاهرة الثانية يوضح كيفية تحديدمعدلات إفراز في البعوض باستخدام الأحيائي في الجسم الحي.
Protocol
الجزء الأول - [رني ضربة قاضية بوساطة الجينات في البالغين البعوض الزاعجة المصرية. لمحة عامة تجربة انظر الشكل 1.
1. الرنا المزدوج الجديلة التجميعي
- توليف dsRNAs محددة ضد جينات dsRNAs الفائدة والسيطرة عليها. ملاحظة: نوصي الاشعال النامية لشظايا PCR في مجموعة من الأزواج الأساسية 300-500 التي تقع في "نهاية (2) وكدنا] محددة ومع تسلسل التمهيدي T7 تعلق في 5 'نهاية ال 3 (5'-TAC TAA GAC TCA CTA TAG GG-3 '). وينبغي تأكيد التفرد من شظايا بواسطة تحليل BLASTN 3.
- استخدام Ambion Megascript T7 النسخ عالية الإنتاجية كيت (Ambion، جدول الكواشف) التي تستخدم T7 بوليميريز الحمض النووي الريبي للتفاعل النسخ لتجميع الرنا المزدوج الجديلة. ملاحظة: الكواشف مماثلة ومستلزمات متوفرة في مكان آخر.
- لتنقية الرنا المزدوج الجديلة، يعجل مع كلوريد الليثيوم اتباع الإرشادات مع عدة Megascript.
- بعد purificatايون، حل بيليه الرنا المزدوج الجديلة في الماء المعقم. لضمان اللزوجة الكافية لmicroinjection، وينبغي تركيز الرنا المزدوج الجديلة لا تتجاوز 2 ميكروغرام / ميكروليتر.
2. حقن التحضير
- يمكن بناؤها بسيطة الدقيقة محقن باستخدام الأنابيب، ومقص، وإبرة معدنية، حقنة 1 مل، والبلاستيك 1 مل ماصة معلومات سرية (انظر الشكل 2). ينبغي قطع الأنابيب إلى 40 سم ~ في طول. بدلا من ذلك، يمكن استخدام 1 الجزئي الآلي حاقن مثل دروموند Nanojet الثاني 4.
- قطع رأس المحقنة (محور إبرة) في 2 مل علامة على نطاق وإزالة رأس الغطاس المطاط من المكبس.
- لكمة ثقب باستخدام إبرة معدنية في الرأس الغطاس المطاط ومكان رئيس المكبس المطاطي مرة أخرى في محور إبرة.
- وضع محور إبرة في واحدة من نهاية الأنابيب البلاستيكية ووضع 1 مل ماصة طرف في الطرف الآخر، والتي سيتم استخدامها بوصفها قطعة الفم (بدلا من ذلك، وهو 10 مل SYيمكن استخدامها لانتاج ringe ضغط الهواء اللازم للحقن).
- وضع إبرة زجاج الشعرية في حفرة في الرأس الغطاس المطاط وكسر رأس الإبرة من ذلك العرض هو كبيرة بما يكفي لسائل أن تتدفق من خلال. ملاحظة: الحجم الأمثل للطرف إبرة لابد من تحديد تجريبيا - إذا كان العرض من إبرة كبيرة جدا هذا سوف يؤدي إلى صدمة وفيات البعوض المعدل المرتفع، إذا كان عرض إبرة صغيرة جدا، سيكون من المستحيل على اختراق الهيكل الخارجي البعوض.
- غمر إبرة حقن في العينة الرنا المزدوج الجديلة المعدة واستخلاص عينة السائل في إبرة الحقن بواسطة امتصاص السائل مع قطعة الفم (أو حقنة). ملاحظة: هذه الخطوة هي نفسها بالنسبة لجميع الكواشف السائلة التي تحقن البعوض، بما في ذلك المخزن في برنامج تلفزيوني، والذي يستخدم في إدرار البول في الجسم الحي بروتوكول فحص (انظر أدناه).
3. جمع وتخدير البعوض
- جامعيتي البعوض مع الشافطة 1 بطارية تعمل بالطاقة إلى قارورة جمع. وضع قبعة على قارورة جمع ووضع قنينة على وسادة نظيفة CO 2 إلى تخدير البعوض. ملاحظة: بدلا من البعوض يمكن أن يكون تخدير على الجليد.
4. البعوض حقن
- فتح القارورة جمع ووضع البعوض مباشرة على لوحة CO 2 وانتظر حتى البعوض هي تخدير.
- تجاهل جميع الذكور.
- تصطف على البعوض على الجانب للسماح لتسهيل الوصول للحقن.
- الاستيلاء على البعوض بواسطة الأرجل أو أجنحة لتجنب الاصابة. يمكنك أيضا استخدام فرشاة الرسام غرامة أو ريشة للتلاعب البعوض.
- عندما تصبح مستعدة لحقن البعوض الأولى، دعم بلطف جانب واحد من الصدر مع ملقط وأدخل رأس الإبرة إلى الجانب الآخر من الصدر (الشكل 2). فمن الأفضل ليحقن في جزء رقيق للبشرة، وتجنب دفع إبرة إلىس في عمق الصدر.
- مرة واحدة على الإبرة في مكان، ضربة السائل داخل البعوض. ويمكن تحديد المبلغ المطلوب من خلال رصد الغضروف المفصلي السائل في إبرة. ويمكن تحديد عدد ملليمتر اللازمة لحجم معين عن طريق حساب حجم الاسطوانة من الإبرة زجاج الشعرية (πr 2 ساعة). المبلغ الفعلي الرنا المزدوج الجديلة التي عادة ما تستخدم للحقن هو 1 ميكروغرام.
- مرة واحدة يتم حقن السائل إلى البعوض، بعناية سحب الإبرة. إذا قطرات السائل كبير النماذج على الجزء الخارجي من القفص الصدري، ينبغي التخلص من البعوض. ثم كرر هذه العملية مع البعوض المقبل.
5. استعادة البعوض والتخزين
- بعد الحقن، ووضع البعوض في وعاء للتخزين. على سبيل المثال، اصطف 1 شمع نصف لتر كوب من الورق المقوى (كوب شوربة) بغطاء تأمين شبكات مع غطاء من الورق المقوى. غطاء لديه جزء قطع لشبكة تغطي التعرض. مرة واحدة كل شهرتوضع squitoes في الحاوية، ووضع حاوية في غرفة التحكم بيئيا للحضانة وتوفير البعوض مع مصدر المواد الغذائية، مثل كرات السكروز 20٪ من القطن المنقوعة وضعت على رأس تغطية شبكة. قبل تنفيذ فحص إدرار البول في الجسم الحي، حرمان البعوض حقن الرنا المزدوج الجديلة من مصدر للمياه لمدة 12 ساعة لتوحيد دولة ترطيب كل البعوض.
- لا يمكن للكفاءة من الجينات ضربة قاضية الرنا المزدوج الجديلة بوساطة يكون متغير. ويمكن إسكات الجينات تبدأ 1 يوم بعد الحقن وانها قد تستمر لمدة تصل إلى 6 أيام بعد الحقن 4. الوقت الأمثل لتحقيق أقصى قدر من الجينات ضربة قاضية لابد من تحديد تجريبيا عن كل الجينات المستخدمة. عموما، علينا أن ننتظر 3 أيام بعد حقن الرنا المزدوج الجديلة قبل أن نمضي.
الجزء الثاني - في فحص إدرار البول في الجسم الحي بعوض بالغ بعوض الزاعجة
ملاحظة: لقد تم تطوير هذا البروتوكول من قبل المؤلفين وتستخدم لرني بوساطة ضربة قاضية للبروتينات aquaporin في البعوض الحمى الصفراء الزاعجة المصرية 1. لتجنب التباين بين البعوض الفردية، ينبغي تحليل البعوض في المجموعتين. لأسباب فنية، ونحن نوصي مجموعات من 5 البعوض في العلاج - هناك كمية محدودة من الوقت لإجراء قياس الوزن لأول مرة أمام البعوض تبدأ في إفراز البول بعد الحقن.
6. جمع وتخدير البعوض
- قبل جمع من البعوض، وتسجيل الوزن من قارورة فارغة مع جمع قبعة باستخدام ميزان الدقة التحليلية. وسوف تستخدم هذه القارورة لجميع القياسات اللاحقة.
- جمع 5 إناث البعوض في قارورة جمع وزنه مع الشافطة. وضع قبعة على قارورة جمع والسماح لها الجلوس على منصة CO 2 لعدة ثوان لتخدير البعوض.
7. الأولية قياس الوزن
- تتخذ تيهو قياس الوزن الأولي للبعوض 5 عن طريق وضع قارورة تحتوي على جمع البعوض مع قبعة على ميزان دقيق.
- حساب وزن مجموعة من 5 البعوض عن طريق أخذ الوزن من البعوض والقارورة جمع مع قبعة وطرح وزن القارورة جمع فارغ مع قبعة.
- فتح القارورة جمع ووضع البعوض مباشرة على لوحة CO 2 بعد تسجيل الوزن من البعوض. إذا كان البعوض هي بداية لتستيقظ خلال قياسات الوزن، وتعيين قنينة على لوحة CO 2 لعدة ثوان قبل فتحه ووضع البعوض على لوحة.
8. حقن التحضير
- إعداد حاقن الدقيقة اتباع التعليمات الواردة في بروتوكول الجينات ضربة قاضية رني بوساطة.
- وضع إبرة زجاج الشعرية في محقن الصغيرة وكسر رأس الإبرة من ذلك العرض هو كبيرة بما يكفي لliqرمز المستخدم في التدفق من خلال.
- غمر إبرة في العازلة في برنامج تلفزيوني ورسم العازلة في إبرة الحقن، والمبلغ المطلوب لاستخدامها لهذا البروتوكول هو 1.25 ميكروليتر من PBS لكل البعوض. ملاحظة: هذا المبلغ يقلد متوسط كمية بلازما الدم التي يتم تناولها عن طريق أنثى البعوض 5.
9. البعوض حقن
- تصطف على البعوض للسماح لسهولة الوصول مع حاقن الصغرى.
- مرة واحدة على الإبرة في مكان، ضربة PBS عازلة داخل البعوض.
- مرة واحدة يتم حقن السائل داخل البعوض، قد تشكل قطيرة على خارج القفص الصدري. هذه قطرات لا بد من إزالة بعناية قبل الخطوة التالية.
- كرر هذه العملية مع حقن البعوضة المقبل. من ذوي الخبرة، وسوف بعوض معدل البقاء على قيد الحياة يكون بنسبة 100٪ تقريبا بعد الحقن.
10. وزن البعوض
- بعد الحقن، وضع بلطف على البعوض في قارورة جمعوقبعة. أخذ قياس الوزن الأول من البعوض 5 عن طريق وضع قارورة تحتوي على جمع البعوض مع قبعة على ميزان دقيق.
- حساب وزن مجموعة من 5 البعوض عن طريق أخذ الوزن من البعوض والقارورة جمع مع قبعة وطرح وزن القارورة جمع فارغ مع قبعة. ملاحظة: البعوض سوف تبدأ في إفراز البول في غضون 2 دقيقة بعد إزالة ثاني أكسيد الكربون من منصة التخدير 2، لذلك من المهم أن تتخذ قياس الوزن قبل أن تبدأ في إفراز.
- وضع البعوض في وعاء صغير، حيث ستبدأ في إفراز البول.
11. قياسات الوزن الثانية واللاحقة
ملاحظة: ينبغي أن تؤخذ قياسات الوزن من البعوض في 30 دقيقة فترات، ولكن يمكن تعديل هذه لفترات أقصر أو أطول اعتمادا على معدلات إفراز.
- بعد 30 دقيقة، وجمع جروبف من 5 البعوض مع الشافطة في قارورة جمع نفسه مع قبعة. أخذ قياس الوزن القادم من البعوض عن طريق وضع القارورة التي تحتوي على جمع البعوض مع قبعة على ميزان دقيق.
- بعد القياس، ووضع البعوض في حاوية القابضة نفسه للدقائق ال 30 القادمة.
- كرر هذه العملية لفترة من الوقت المطلوب.
12. تحديد نسبة البعوض الإفراز
- ويمكن حساب المبلغ الإجمالي من السوائل التي تم حقنها في مجموعة من 5 البعوض عن طريق طرح الوزن الأولي من البعوض من الوزن فورا بعد الحقن.
- ويمكن حساب كمية البول الذي يفرز من قبل مجموعة من البعوض عند نقطة زمنية محددة عن طريق طرح الوزن الأولي من البعوض من وزن البعوض في نقطة زمنية محددة.
- ويمكن حساب معدل إفراز عند نقطة زمنية محددة من قبل diviقرع كمية البول تفرز في هذه المرحلة الزمنية من المبلغ الإجمالي للحقن السائل (الجدول 1).
13. ممثل النتائج
وقد استخدمت رني ضربة قاضية بوساطة الجينات وفحص إدرار البول في الجسم الحي من قبل مختبر هانسن إلى دراسة آثار aquaporins في إدرار البول الزاعجة البعوض بعوض. خرج ثلاثة aquaporins أن يتم التعبير عنها في مالبيغي الزاعجة الأنابيب بعوض أسفل مع آثار كبيرة على معدلات إفراز مقارنة لمكافحة البعوض 1. ويبين الشكل 4 نتائج ممثل تجربة حيث تم استخدام فحص إدرار البول لمقارنة معدلات إفراز بين الزاعجة المصرية والخماسية الكيولكس عند درجات حرارة مختلفة.
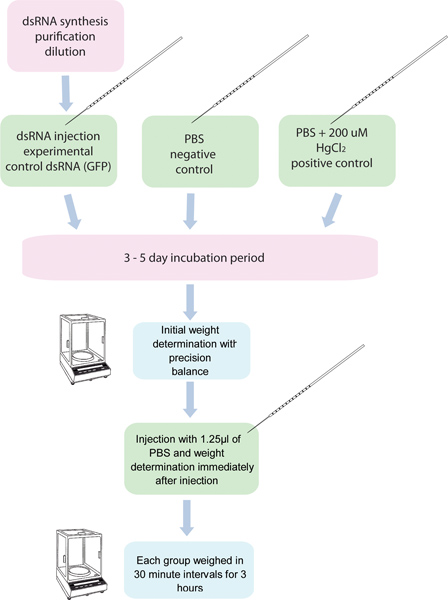
الشكل 1. مخطط لفحص رني / إدرار البول. 5 مجموعات من البعوض عصام 10يتم حقن الفصل مع الرنا المزدوج الجديلة لجين معين ويتم حقنها آخر خمس مجموعات من عشرة البعوض مع الرنا المزدوج الجديلة السيطرة. وتستخدم مجموعة أخرى من البعوض حقنوا 200 ميكرومتر HgCl 2 في برنامج تلفزيوني كعنصر تحكم إيجابية. يتم وزن هذه البعوض قبل الحقن، وبعد حقن في 30 دقيقة فترات لمدة 3 ساعات.
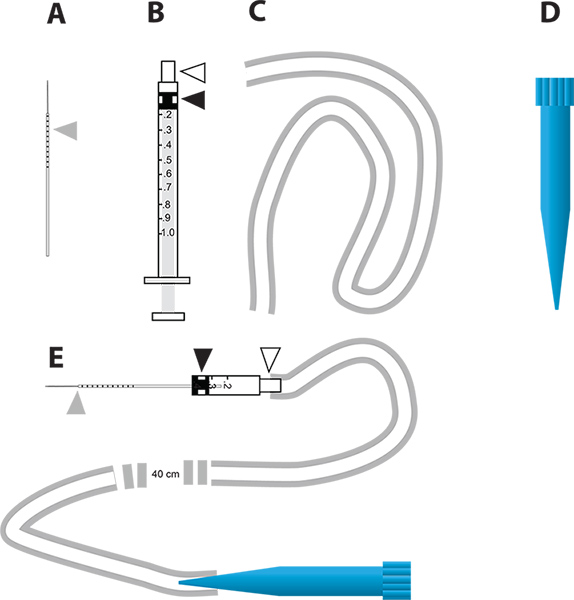
الشكل 2. بسيطة جهاز حقن الجزئي لضربة قاضية الجينات [رني بوساطة وفحص إدرار البول في الجسم الحي. أ. الإبر زجاج الشعرية المستخدمة للحقن. المثلث الرمادي يمثل زيادات ملليمتر رسمها على إبرة تشير إلى كمية حقن السائل داخل البعوض. تستخدم الحقنة ب 1 مل لبناء حاقن الصغرى. المثلث الأبيض يمثل محور إبرة والمثلث الأسود يمثل رأس الغطاس المطاط تعلق على الغواص في المحقنة. جيم وأنابيب تستخدم لنعلق على لسان حالحاقن. د 1 مل طرف ماصة للتصرف (نصيحة الأزرق) الذي يتم استخدامه كما الناطقة باسم جهاز microinjection. هاء الجهاز microinjection التي تضم أجزاء م. انقر هنا لعرض أكبر شخصية .
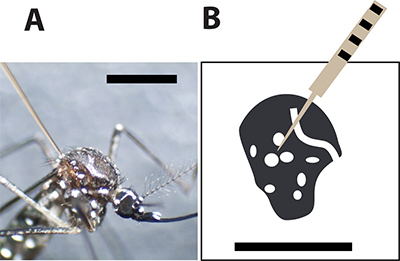
الشكل 3. أفضل موقع حقن البعوض. A. أنثى بعوضة الزاعجة المصرية حقن بإبرة زجاج الشعرية بين المقاييس الكبيرة على الصدر. شريط أسود يشير إلى 1 مم للمقارنة حجم. باء رسما لصدر أنثى البعوض وبقع بيضاء تمثل موازين بيضاء في الهيكل الخارجي البعوض. يجب أن إبرة حقن بيرس البعوضة بين بقع لتقليل معدل وفيات خلال الحقن.
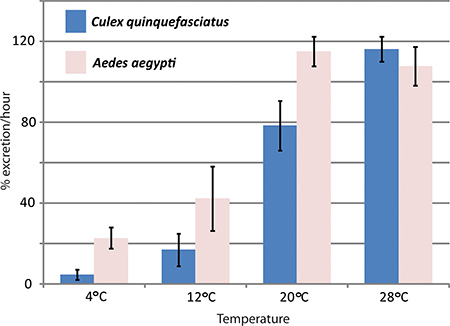
الشكل 4. الآثار المترتبة على درجات الحرارةتلح على الخماسية الكيولكس وإدرار البول بعوض الزاعجة. تم عمل فحص إدرار البول مع نوعين من البعوض، والزاعجة المصرية والخماسية الكيولكس، عند درجات حرارة مختلفة. ونظرا لمعدل إفراز خلال الساعة الأولى بعد الحقن في المئة.
| مجموعة | TARA (ز) | لا حقن (ز) | بعد الحقن (ز) | 1H آخر حقن (ز) | متوسط الوزن (ملغ) | كمية حقن (ميكرولتر) | تفرز كمية (ميكرولتر) | تفرز٪ |
| 1 | 7،5938 | 7،6057 | 7،6104 | 7،6096 | 2.38 | 0.94 | 0.16 | 17.0 |
| 2 | 7،8252 | 7،8349 | 7،8415 | 7،8403 | 1.94 | 1.32 | 0.24 | 18.2 |
| 3 | 7،8896 | 7،9026 | 7،9077 | 7،906 | 2.6 | 1.02 | 0.34 | 33.3 |
الجدول رقم 1. الزاعجة المصرية في نتائج فحص فيفو إدرار البول. البيانات الخام من فحص إدرار البول في الجسم الحي أداؤها مع أنثى بعوض الزاعجة البعوض في 4 درجات مئوية.
Discussion
وقد تم تطوير بروتوكول رني المستخدمة في المختبر من Raikhel الكسندر في جامعة ريفرسايد في كاليفورنيا 6،7 و هو مماثل لبروتوكول نشرته جارفر وDimopoulos 4. ويمكن استخدام المنهج التجريبي هو مبين في هذا البروتوكول الفيديو لدراسة الجينات المسؤولة عن إدرار البول حشرة في ال?...
Disclosures
ليس لدينا ما يكشف.
Acknowledgements
المؤلفان بالشكر فيكتوريا كاربنتر للتعليق لها حاسم من هذا البروتوكول.
Materials
| Name | Company | Catalog Number | Comments |
| اسم الكاشف أو معدات | شركة | فهرس العدد | تعليقات |
| MEGAscript T7 كيت عالية الإنتاجية | Ambion، المؤتمر الوطني العراقي. | AM1334 | |
| PBS العازلة | سيغما الدريخ | P4417 | |
| البلاستيك أنابيب | بائع محلي | خ | |
| 1 مل من البلاستيك ماصة معلومات سرية | VWR | 83007-376 | أزرق غيض |
| 1 مل حقنة | بيكتون، ديكنسون، وشركة | 309602 | |
| مقص | بائع محلي | ||
| إبرة معدنية | ولاية كارولينا البيولوجية | 654307 | الحجم 5 |
| تطير وسادة | جينيسي العلمية | 789060 | |
| بطارية تعمل بالطاقة الشافطة ث / جمع قارورة | UPMA مختبرات | IPMM 2000 | |
| ملقط طرف غرامة | الآلات الدقيقة العالم | 14095 | |
| الإبر زجاج الشعرية | الآلات الدقيقة العالم | 1B200-6 | |
| تشريح ستيريو المجهر | لايكا مايكروسيستمز | S6D | |
| التحليلية دقة التوازن | Mettler توليدو | AB54S | |
| سكر القصب | سيغما الدريخ | 84097 | |
| مشمع نصف لتر واحد كوب من الورق المقوى واصطف | بائع محلي | كوب حساء تصنيعها | |
| شبكة صافي | بائع محلي | البلاستيك ذبابة الشاش |
References
- Drake, L. L., et al. The Aquaporin gene family of the yellow fever mosquito, Aedes aegypti. PloS one. 5, e15578 (2010).
- Shepard, A. R., Jacobson, N., Clark, A. F. Importance of quantitative PCR primer location for short interfering RNA efficacy determination. Analytical biochemistry. 344, 287-288 (2005).
- Altschul, S. F., et al. Gapped BLAST and PSI-BLAST: a new generation of protein database search programs. Nucleic acids research. 25, 3389-3402 (1997).
- Garver, L., Dimopoulos, G. Protocol for RNAi Assays in Adult Mosquitoes (A. gambiae). J. Vis. Exp. (5), e230 (2007).
- Clements, A. N. Volume 1 Development, Nutrition, and Reproduction. The Biology of Mosquitoes. 2, (1992).
- Hansen, I. A., Attardo, G. M., Park, J. H., Peng, Q., Raikhel, A. S. Target of rapamycin-mediated amino acid signaling in mosquito anautogeny. Proceedings of the National Academy of Sciences of the United States of America. 101, 10626-10631 (2004).
- Hansen, I. A., Attardo, G. M., Roy, S. G., Raikhel, A. S. Target of rapamycin-dependent activation of S6 kinase is a central step in the transduction of nutritional signals during egg development in a mosquito. The Journal of biological chemistry. 280, 20565-20572 (2005).
- Pannabecker, T. Physiology of the Malpighian Tubule. Annual review of entomology. 40, 493-510 (1995).
- Dow, J. New insights into Malpighian tubule function from functional genomics. Comp Biochem Phys A. 150, S135 (2008).
- Dow, J. A. T. Insights into the Malpighian tubule from functional genomics. Journal of Experimental Biology. 212, 435-445 (2009).
- Lawson, D., et al. VectorBase: a data resource for invertebrate vector genomics. Nucleic acids research. 37, 583-587 (2009).
- Beyenbach, K. W. Transport mechanisms of diuresis in Malpighian tubules of insects. J. Exp. Biol. 206 (Pt 21), 3845-3856 (2003).
- Coast, G. M. Continuous recording of excretory water loss from Musca domestica using a flow-through humidity meter: hormonal control of diuresis. Journal of insect physiology. 50, 455-468 (2004).
- Kersch, C. N., Pietrantonio, P. V. Mosquito Aedes aegypti (L.) leucokinin receptor is critical for in vivo fluid excretion post blood feeding. FEBS letters. 585, 3507-3512 (2011).
- Hays, A. R., Raikhel, A. S. A novel protein produced by the vitellogenic fat body and accumulated in mosquito oocytes. Development Genes and Evolution. 199, 114-121 (1990).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved