A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
المنسدلة من كالمودولين ملزم البروتينات
In This Article
Summary
كالمودولين (CAM) المنسدلة مقايسة هو وسيلة فعالة لتحقيق التفاعل بين كام مع البروتينات المختلفة. يستخدم هذا الأسلوب CAM - sepharose الخرز لتحليل كفاءة والمحددة للكاميرا ملزم البروتينات. وهذا يوفر أداة مهمة لاستكشاف إشارات كاميرا في وظيفة الخلوية.
Abstract
الكالسيوم (كا 2 +) هو ايون حيويا في تنظيم وظيفة الخلوية من خلال مجموعة متنوعة من الآليات. الكثير من الكالسيوم 2 + هو بوساطة من خلال إشارات البروتين الكالسيوم الملزمة المعروفة 1،2 (CAM) كالمودولين. وتشارك CAM على مستويات متعددة في جميع العمليات الخلوية تقريبا ، بما في ذلك موت الخلايا المبرمج ، والتمثيل الغذائي ، على نحو سلس تقلص العضلات ، اللدونة متشابك والنمو العصبي ، والتهاب والاستجابة المناعية. وهناك عدد من البروتينات تساعد على تنظيم هذه المسارات من خلال تفاعلها مع كاميرا. كثير من هذه التفاعلات تعتمد على التشكل من كاميرا ، والتي تختلف اختلافا واضحا عندما منضما إلى الكالسيوم 2 + (كا 2 + - CAM) مقابل حالته + خالية كا 2 (ApoCaM) 3.
في حين أن معظم البروتينات الهدف ربط كا 2 + كام ، ربط بروتينات معينة فقط لApoCaM. كاميرا من خلال ربط بعض المجال الذكاء ، بما في ذلك neuromodulin 4 ، neurogranin (نغ) 5 ، وبعض myosins 7 ، 8 وظيفة بعد المشبكي ، وتقلص العضلات 9 ، على التوالي. قدرتها على ربط وإطلاق كاميرا في غياب أو وجود الكالسيوم 2 + لها دور محوري في وظيفتها. في المقابل ، ربط العديد من البروتينات فقط كا 2 + - CAM ، وتتطلب هذه ملزمة لتفعيلها. وتشمل الأمثلة على ضوء سلسلة الميوسين كيناز 10 ، كا 2 + / CAM التي تعتمد على كاينيسات (CaMKs) 11 وphosphatases (مثل الكالسينيورين (calcineurin)) 12 ، وإسبكترن كيناز 13 ، التي لديها مجموعة متنوعة من الآثار المباشرة والمصب 14.
الآثار المترتبة على هذه البروتينات الخلوية على وظيفة غالبا ما تعتمد على قدرتها على ربط كاميرا بطريقة تعتمد على الكالسيوم + 2. على سبيل المثال ، نحن اختبار مدى ملاءمة NG - CAM ملزمة في وظيفة متشابك وكيف تؤثر هذه الطفرات المختلفة ملزمة. ولدت لدينا يخدع نغ GFP الموسومةالبنية مع طفرات معينة في المجال الذكاء من شأنها أن تغير قدرة نغ لربط كاميرا بطريقة تعتمد على الكالسيوم + 2. وقدم دراسة هذه الطفرات المختلفة لنا نظرة كبيرة في عمليات هامة تشارك في وظيفة متشابك 8،15. ومع ذلك ، في مثل هذه الدراسات ، فمن الضروري أن تثبت أن البروتينات المتحورة والربط المتوقع تغييرها لكاميرا.
هنا ، نقدم طريقة لاختبار قدرة البروتينات لربط كاميرا في وجود أو عدم وجود الكالسيوم 2 + ، وذلك باستخدام وكناس CaMKII نغ كأمثلة. هذا الأسلوب هو شكل من أشكال التقارب اللوني ويشار إلى مقايسة المنسدلة CAM. ويستخدم CAM - Sepharose الخرز لاختبار البروتينات التي تربط لكاميرا وتأثير الكالسيوم 2 + على هذا الربط. حان الوقت أكثر من ذلك بكثير ويتطلب كفاءة وأقل من البروتين بالنسبة إلى العمود اللوني وفحوصات أخرى. تماما ، وهذا يوفر أداة قيمة لاستكشاف كا 2 + / CAM إشارات والبروتينات التي فيteract مع كاميرا.
Protocol
الرجوع إلى الشكل 1 لالتخطيطي الأساسي لبداية الإجراء مع جناسة. الوقت المقدر من إعداد مقتطفات من الخليوي الى شطف CAM متجهة البروتينات حوالي 6-7 ساعات.
1. إعداد الأنسجة
- حقن شرائح الحصين عضوي النمط مع فيروس يحتوي على البلازميد التعبير عن بروتين المؤتلف من الاهتمام (في هذا المثال ، الأخضر ببروتين (GFP) الموسومة نغ) والسماح للتعبير عن بروتين الأنسجة بين عشية وضحاها.
- ما يقرب من 12 إلى 18 ساعة بعد الحقن الفيروسي (اعتمادا على الوقت التعبير الفيروسية) ، وإعداد لجمع الأنسجة. إضافة 1mL العازلة تشريح (الجلوكوز 10MM ، 4mM بوكل ، NaHCO3 26mM ، والسكروز 233mM ، MgCl 5mM 2 ، 1MM CaCl 2 ، و 0.1 ٪ الفينول الحمراء ، بالغاز مع 5 ٪ CO 2 95 ٪ O 2) في طبق بتري. نقل الأنسجة المستنبتة / تضاف إلى صحن بتري وإضافة 2mL العازلة تشريح لادخال لغمر الأنسجة.
- جامعير نسيج عضوي النمط الحصين (بين 5 و شرائح 10) عن طريق كشط بلطف الأنسجة خالية من الغشاء إدراج باستخدام مشرط. على وجه التحديد إزالة منطقة معينة من الفائدة (على سبيل المثال CA1) هو أيضا خيار. نقل الأنسجة علقت لأنبوب microcentrifuge 1.5mL باستخدام ماصة باستير مقلوب.
- الطرد المركزي عينات في إطار التعاون الإقليمي ل1500 1 دقيقة لفصل الأنسجة العازلة من تشريح. إزالة بعناية طاف بواسطة الطموح. تأكد من عدم تعكير صفو بيليه.
- لكل شريحة المستخدمة ، إضافة 30-60 ميكرولتر من التجانس العازلة (150mM كلوريد الصوديوم ، 20mM تريس درجة الحموضة 7.5 ، DTT 1MM ، leupeptin 1μg/mL ، chemostatin 1μg/mL ، antipain 1μg/mL ، pepstatin 1μg/mL ، و 1 ٪ X تريتون -100) إلى الأنسجة والتجانس تماما مع مدقة.
- من أجل إزالة الأنقاض الخلوية ، وأجهزة الطرد المركزي لجناسة المتبقية في إطار التعاون الإقليمي 1100 لمدة 10 دقيقة وإزالتها بعناية طاف بواسطة الطموح وفي الوقت نفسه تجنب التلوث من بيليه.
- تأخذ 10 ٪ من طاف على عينة من المدخلات (نموذج 1). تخزين طاف المتبقية على الجليد خلال إعداد حبات CAM - sepharose للاستخدام في الخطوة 3.
ملاحظة : والأنسجة المستخدمة هنا هي شرائح الحصين عضوي النمط. ومع ذلك ، يمكن للمرء أن استخدام الخلايا العصبية أو فصل أي استنبات الخلايا النظام الأخرى. في مثل هذه الحالة ، يبدأ في الخطوة بعد جمع 1.4 النسيج الخاص بالطريقة المناسبة.
2. إعداد حبات لسحب أسفل
في التعامل مع الخرز ، وأنه من المهم لإنقاذ الخرز وتحقيق أقصى قدر من الكفاءة لردود الفعل من خلال منع تجفيف حبات من على جانبي الأنبوب. للقيام بذلك ، فمن الأفضل لتدوير أنابيب الخاص إلى جانبهم ، مما يتيح حل لحبات الرطب على جدران الأنبوب ، مباشرة قبل الطرد المركزي.
- لكل المنسدلة ، ماصة 400 ميكرولتر من الخرز كالمودولين - Sepharose علقت في أنبوب microcentrifuge 2 مل مع FLA نسبياتي أسفل إلى أقصى مساحة والتفاعل من الحلول الخاصة بك مع الخرز خلال حضانات الخاصة بك.
- الخرز الطرد المركزي في إطار التعاون الإقليمي 21000 لمدة 30 ثانية وإزالة بعناية طاف بواسطة الطموح. تأكد من عدم تعكير صفو الخرز.
- لغسل الخرز ، وإضافة 100 ميكرولتر من المنطقة العازلة التي تحتوي كل منها التجانس إما CaCl 2 مم 2 إلى تلك المستخدمة لالمنسدلة كا 2 + كام البروتينات ملزمة وEDTA 2 مم (أ + خالب المعروفة كا 2) ليهبطوا الخرز البروتينات ApoCaM ملزمة. اضغط بلطف أنبوب لاعادة تعليق الخرز والطرد المركزي في إطار التعاون الإقليمي ل1500 1 دقيقة. إزالة بعناية طاف بواسطة الشفط ، والتأكد من عدم تعكير صفو الخرز.
ملاحظة : للحصول على جميع الخطوات طموح ، فمن المستحسن استخدام ماصة الحافة التي لديها افتتاح غرامة (مثل هلام نصائح التحميل) للسماح إزالة حل دون إزالة الخرز.
3. CAM - sepharose ملزم للبروتينات
- انقسام طاف بك إلى شرطين تحتوي على حجم مساو. اعتمادا على حالتك ، وإضافة كمية مناسبة من CaCl 2 أو EDTA لطاف بك إلى تركيز 2 مم لكل منها.
- إضافة طاف خطوة من 1.7 إلى حبات غسلها في تجانس العازلة المقابلة. اضغط برفق لمزج أنبوب.
- احتضان العينات في درجة مئوية لمدة 3 ساعات 4 على شاكر. اعادة تعليق الخرز كل 30 دقيقة او نحو ذلك لزيادة كفاءة ملزمة.
- أنبوب الطرد المركزي التي تحتوي على عينات والخرز في RCF 1500 لمدة 3 دقائق.
- تأخذ 50μL من طاف على عينة من البروتين غير منضم (نموذج 2) وإزالة بعناية طاف المتبقية الطموح وتجاهل.
- تغسل حبات ثلاث مرات كما هو موضح في الخطوة 2.3 باستخدام 100μL العازلة من التجانس منها.
4. شطف
- إضافة 50μL العازلة من شطف (50mM تريس ، حمض الهيدروكلوريك درجة الحموضة 7.5 ، وكلوريد الصوديوم 150mM) يحتوي على شرط المعاكس (C 10MMدوري أبطال آسيا 2 أو EDTA 10MM) إلى الخرز. على سبيل المثال ، والعينات التي تم الالتزام به في المتجانس والتي تحتوي على الكالسيوم العازلة 2 + هي eluted في شطف العازلة التي تحتوي على EDTA والعكس بالعكس.
اختياري : الاحترار شطف المنطقة العازلة إلى 37 درجة مئوية قبل إضافة إلى الخرز قد تعزيز الغلة.
- احتضان حل مع الخرز في درجة حرارة الغرفة لمدة 30 دقيقة على شاكر. مزج الخرز بالنقر برفق الانبوب عن كل 5 دقائق.
- الخرز الطرد المركزي في 1500 لمدة 3 دقائق التعاون الإقليمي وإزالة بعناية 50μL من طاف للبروتين منضم (نموذج 3) بواسطة الطموح. تأكد من عدم تعكير صفو الخرز.
- إضافة البروتين المخزن التحميل لجميع العينات (أي جناسة ، غير منضم وملزمة البروتين وكذلك تلك التي لا تزال ملزمة للالخرز).
ملاحظة : للتعظيم شطف (وخصوصا في حالة عدم كفاءة شطف) ، إضافة 50μL من شطف العازلة المقابلة (على سبيل المثال تحتوي مضيفا EDTA BUFفر إلى حبات منضم في CaCl 2) على حبات قبل التدفئة عينات لمساعدة أزل أي بروتين ملزمة المتبقية وكرر الخطوات الموضحة في 4.3 لإزالة بروتينات ملزمة المتبقية.
5. SDS - PAGE وصمة عار الغربية
سلوك SDS - PAGE وتحليل باستخدام لطخة الغربية التي تحقق للبروتين اهتمامكم والتحقيق لبروتين معروف لربط كاميرا في حالة العكس كعنصر تحكم إيجابية.
6. ممثل النتائج
ويبين الشكل 2B مثال مقايسة CAM - المنسدلة اختبار ملزمة كاميرا GFP الموسومة نغ مقابل نغ الذاتية. للقيام بذلك ، وكان overexpressed GFP - NG في شرائح دينا الحصين عضوي النمط بين عشية وضحاها ، وكان النسيج المتجانس. والمحتضنة لجناسة مع CAM - sepharose حبات في وجود إما كا 2 + أو EDTA. مدخلات جناسة يبين أن أعرب عن GFP - NG بالإضافة إلى نج الذاتية والكالسيوم 2 + / CAM التي تعتمد على كيناز الثاني(كناس CaMKII). كما هو متوقع على أساس الربط المعروفة نغ الذاتية (موضح في الشكل 2A) ، GFP الموسومة كان eluted نغ في غياب الكالسيوم 2 + (EDTA بالبروتين) وغير منضم في وجود الكالسيوم 2 + (الشكل 2B) . في المقابل ، كان eluted السيطرة ، كناس CaMKII ، إلا في وجود الكالسيوم 2 + (بروتين ملزمة) وكان غير منضم في غيابها (EDTA). هذا يدل على أن حبات كاميرا كانت تعمل بشكل صحيح وelutions وكفاءة. الأهم من ذلك ، هذا يدل على أن GFP - NG بربط ApoCaM بطريقة مماثلة للنموذج الذاتية ، مما يوحي بأن العلامة GFP لم يغير من وظيفة لدينا البروتين المؤتلف.
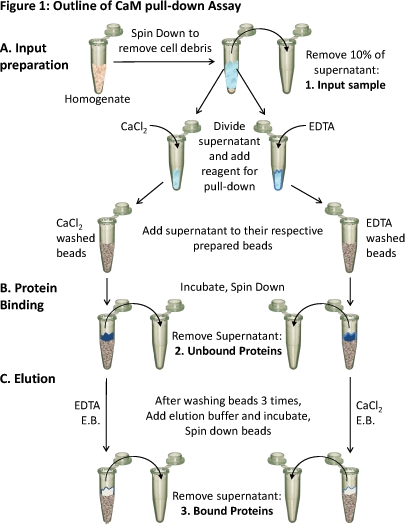
الشكل 1. الخطوط العريضة للكاميرا المنسدلة مقايسة
(A) هو نسج جناسة الأنسجة وصولا الى ازالة الحطام الخلوية. يؤخذ حوالي 10 ٪ من طاف على عينة من المدخلات (1). ينقسم طاف المتبقية بالتساوي على مختلفتضاف الشروط والكواشف المناسب (CaCl 2 أو EDTA) لاختبار ملزمة في هذه الظروف. يتم تحميل كل طاف (التي تحتوي على إما CaCl 2 أو EDTA) على حبات CAM - sepharose أعدت على التوالي و (ب) المحتضنة للسماح ملزمة. تتم إزالة البروتينات غير منضم (2) و (C) هي eluted البروتينات ملزمة (3) الخروج من الخرز باستخدام العازلة شطف (EB) يحتوي على العكس كما شرط الربط. ويمكن تحليلها لتكوين البروتين من هذه العينات الثلاث باستخدام بروتين SDS - PAGE والغربية لطخة تحليل.
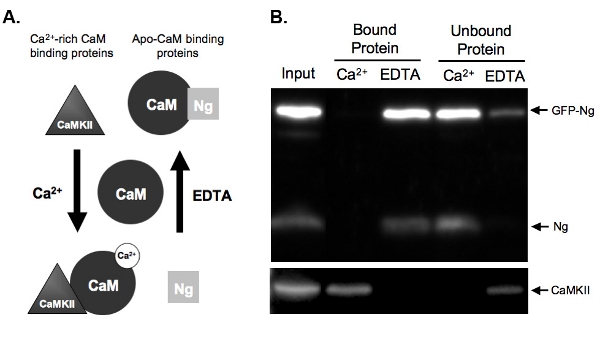
وتعطى الرقم 2. A.) تخطيطي للكا 2 + CAM ملزمة تعتمد على أمثلة وشطف في مقايسة المنسدلة من نوعين من البروتينات التي تربط كاميرا في كا 2 + التي تعتمد على الطريقة. Neurogranin (نغ) تمثل البروتينات التي تربط الاشتقاق كام وكناس CaMKII تمثل البروتينات التي تربط لكا 2 + الغنيةكاميرا. ويظهر في كاميرا حالته فصلها قبل الحضانة مع البروتينات جناسة. حضنت مرة واحدة في ظل ظروف من تركيزات عالية من الكالسيوم + 2 (2 ملم) أو في وجود الكالسيوم 2 + خالب ، EDTA (2 ملم) ، والبروتينات وربط كاميرا تبعا لذلك. نانوغرام بربط كاميرا في حالة EDTA كما أن هناك شيئا يذكر لولا كا 2 + الحاضر ، وسيكون eluted قبالة الخرز CAM - sepharose في وجود الكالسيوم 2 +. كناس CaMKII ، ومع ذلك ، ربط كاميرا في وجود كميات عالية من الكالسيوم 2 + وسوف تنأى مرة كان بالكلاب والكالسيوم 2 +.
ب) النتائج من كاميرا المثال المنسدلة مقايسة. هذا الرقم يدل على النتيجة النهائية المتوقعة من كام sepharose المنسدلة مع عينات للبحث نج وكناس CaMKII. كلا نج الذاتية وGFP NG - موجودة في ممرات للبروتينات ملزمة كاميرا في حضور EDTA. منضما لا نغ عندما يتم تحضين العينات مع كاميرا في وجود الكالسيوم 2 + ، مما يدل على أن Nز تلزم سوى الانفصال CAM. سيطرتنا إيجابية ، كناس CaMKII ، من ناحية أخرى ، يربط كاميرا فقط في وجود الكالسيوم 2 +.
Access restricted. Please log in or start a trial to view this content.
Discussion
البروتوكول شريطة يستخدم CAM - sepharose الخرز للتحقيق في كا 2 + الاعتماد على كاميرا ملزم البروتينات. العديد من البروتينات ربط كاميرا بطريقة تعتمد على الكالسيوم + 2. هذه التفاعلات هي ذات أهمية كبيرة نظرا لعدد CAM ملزم البروتينات ودورها الحيوي في العديد من مسارات الإ...
Access restricted. Please log in or start a trial to view this content.
Disclosures
الإعلان عن أي تضارب في المصالح.
Acknowledgements
فإن الكتاب أود أن أشكر تيفاني الكرز في مساعدتها في تحسين هذا البروتوكول. وقد تم تمويل هذا العمل عن طريق المعهد الوطني للشيخوخة (AG032320) ، وكذلك النهوض أكثر صحة ولاية ويسكونسن.
Access restricted. Please log in or start a trial to view this content.
Materials
| المنتج | شركة | فهرس العدد | تلاحظ |
| كالمودولين - Sepharose الخرز | جنرال إلكتريك للرعاية الصحية | 17-0529-01 | |
| المضادة للكناس CaMKII ألفا | سيغما الدريخ | C6974 | |
| مكافحة neurogranin | ميليبور | 07-425 | |
| نصائح هلام تحميل الماصة | الصياد | 02-707-138 | استخدامه لتطلع supernatants |
| أنابيب Microcentrifuge (2.0 مل) | الصياد | 05-408-146 | استخدام لجميع الخطوات التي تنطوي على كالمودولين - sepharose الخرز |
References
- Vincenzi, F. F. Calmodulin in the regulation of intracellular calcium. Proc. West Pharmacol Soc. 22, 289-294 (1979).
- Cheung, W. Y. Calmodulin plays a pivotal role in cellular regulation. Science. 207, 19-27 (1980).
- Zhang, M., Tanaka, T., Ikura, M. Calcium-induced conformational transition revealed by the solution structure of apo calmodulin. Nat. Struct. Biol. 2, 758-767 (1995).
- Alexander, K. A., Wakim, B. T., Doyle, G. S., Walsh, K. A., Storm, D. R. Identification and characterization of the calmodulin-binding domain of neuromodulin, a neurospecific calmodulin-binding protein. J. Biol. Chem. 263, 7544-7549 (1988).
- Huang, K. P., Huang, F. L., Chen, H. C. Characterization of a 7.5-kDa protein kinase C substrate (RC3 protein, neurogranin) from rat brain. Arch. Biochem. Biophys. 305, 570-580 (1993).
- Bahler, M., Rhoads, A. Calmodulin signaling via the IQ motif. FEBS Lett. 513, 107-113 (2002).
- Routtenberg, A. Protein kinase C activation leading to protein F1 phosphorylation may regulate synaptic plasticity by presynaptic terminal growth. Behav. Neural. Biol. 44, 186-200 (1985).
- Zhong, L., Cherry, T., Bies, C. E., Florence, M. A., Gerges, N. Z. Neurogranin enhances synaptic strength through its interaction with calmodulin. EMBO J. 28, 3027-3039 (2009).
- Needham, D. M. Myosin and adenosinetriphosphate in relation to muscle contraction. Biochim. Biophys. Acta. 4, 42-49 (1950).
- Hathaway, D. R., Adelstein, R. S. Human platelet myosin light chain kinase requires the calcium-binding protein calmodulin for activity. Proc. Natl. Acad. Sci. U.S.A. 76, 1653-1657 (1979).
- Fukunaga, K., Yamamoto, H., Matsui, K., Higashi, K., Miyamoto, E. Purification and characterization of a Ca2+- and calmodulin-dependent protein kinase from rat brain. J. Neurochem. 39, 1607-1617 (1982).
- Yang, S. D., Tallant, E. A., Cheung, W. Y. Calcineurin is a calmodulin-dependent protein phosphatase. Biochem. Biophys. Res. Commun. 106, 1419-1425 (1982).
- Huestis, W. H., Nelson, M. J., Ferrell, J. E. J. Calmodulin-dependent spectrin kinase activity in human erythrocytes. Prog. Clin. Biol. Res. 56, 137-155 (1981).
- Yamniuk, A. P., Vogel, H. J. Calmodulin's flexibility allows for promiscuity in its interactions with target proteins and peptides. Mol. Biotechnol. 27, 33-57 (2004).
- Zhong, L., Kaleka, K. S., Gerges, N. Z. Neurogranin phosphorylation fine-tunes long-term potentiation. Eur. J. Neurosci. 33, 244-250 (2011).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved