A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
بناء هيدروجيل الكولاجين لتسليم الشيتوزان الجذعية المجهرية الخلية محملة
In This Article
Summary
وهناك عقبة رئيسية في العلاج بالخلايا الجذعية الحالية هو تحديد الطريقة الأكثر فعالية لإيصال هذه الخلايا إلى أنسجة المضيف. هنا، نحن تصف طريقة تسليم الشيتوزان مقرها تتسم بالكفاءة والبساطة في الأسلوب، في الوقت الذي تسمح الخلايا الجذعية الدهنية المشتقة للحفاظ على multipotency بهم.
Abstract
وقد تبين أن الخلايا الجذعية Multipotent أن تكون مفيدة للغاية في مجال الطب التجديدي 1-3. ومع ذلك، من اجل استخدام هذه الخلايا بشكل فعال من أجل تجديد الأنسجة، لا بد من اتخاذ عدد من المتغيرات في الاعتبار. هذه المتغيرات ما يلي: إجمالي حجم والمساحة السطحية للموقع غرس، والخواص الميكانيكية للأنسجة والأنسجة المكروية، والذي يتضمن كمية من الأوعية الدموية ومكونات المصفوفة خارج الخلية. ولذلك، يجب أن المواد المستخدمة لتقديم هذه الخلايا يكون حيويا مع التركيب الكيميائي المحددة مع الحفاظ على القوة الميكانيكية الذي يحاكي الأنسجة المضيف. ويجب أيضا أن تكون هذه المواد قابلة للاختراق على الأوكسجين والمواد المغذية لتوفير المكروية مواتية للخلايا لنعلق وتتكاثر. ويمكن الشيتوزان، وهو السكاريد الموجبة مع توافق مع الحياة ممتازة، وكيميائيا بسهولة تعديل ولها قابلية عالية للربط مع لجنة الهدنة العسكرية في الجسم الحيromolecules 4-5. الشيتوزان يحاكي جزء جلايكان من المصفوفة خارج الخلية، مما مكنها من العمل بوصفها ركيزة للهجرة الخلية، التصاق والانتشار. في هذه الدراسة نستخدم الشيتوزان في شكل المجهرية لتسليم الخلايا الجذعية الدهنية المشتقة من (ASC) في بناء الكولاجين ثلاثي الأبعاد سقالة 6. كان مصمما مثاليا الخلية إلى microsphere نسبة فيما يتعلق فترة حضانة وكثافة الخلية لتحقيق الحد الأقصى لعدد الخلايا التي يمكن تحميلها. مرة واحدة على المصنف ASC والمجهرية الشيتوزان (CSM)، التي هي جزء لا يتجزأ في سقالة الكولاجين ويمكن الحفاظ على الثقافة في لفترات طويلة. وخلاصة القول، فإن هذه الدراسة توفر طريقة لتقديم بالتحديد خلايا جذعية في غضون 3 سقالة بيولوجية الأبعاد.
Protocol
1. عزل الخلايا الدهنية المستمدة من الجذعية (ASC)
ملاحظة: تم تنفيذ كافة الإجراءات في درجة حرارة الغرفة ما لم يذكر خلاف ذلك.
- عزل الدهنية الفئران محيط بالكلية وبربخي وتغسل بمحلول معقم هانك والملح مخزنة (HBSS) التي تحتوي على 1٪ الجنين مصل بقري (FBS) كما هو موضح سابقا 6.
- فرم الأنسجة ونقل 1-2 غرام في 25 مل من HBSS FBS تحتوي على 1٪ في أنبوب 50 مل و الطرد المركزي في 500 غ لمدة 8 دقائق في درجة حرارة الغرفة.
- جمع الأنسجة الدهنية التعويم الحر لطبقة ونقل إلى 125 مل دورق مخروطي وعلاج مع 25 مل من كولاجيناز من النوع الثاني (200 يو / مل) في HBSS لمدة 45 دقيقة عند 37 درجة مئوية على مدار شاكر (125 دورة في الدقيقة).
- إزالة بعناية جزء السائل (أقل من النفط والطبقة الدهنية) وتصفية بالتتابع من خلال مرشح نايلون شبكة 100 ميكرون و 70 ميكرون. منبذة الراشح في 500 غ لمدة 10 دقيقة في درجة حرارة الغرفة، ونضح supernatanتي، ويغسل بيليه مرتين مع HBSS 25 مل.
- Resuspend وبيليه الخلية في 50 مل من متوسط النمو (MesenPRO RS متوسطة بصل) تستكمل مع الملحق MesenPRO النمو RS، مضاد حيوي، مضاد فطري (100 يو / مل من مجموعة البنسلين، 100 ميكروغرام / مل سلفات الستربتومايسين، و 0.25 ميكروغرام / مل باء الامفوتريسين) ، و 2 مم L-الجلوتامين والخلايا الماصة الى 2 T75 قوارير (25 مل / قارورة).
- ثقافة ASC في حاضنة 5٪ CO 2 مرطب عند 37 درجة مئوية (2-4 الممر تستخدم ASC لجميع التجارب).
2. إعداد الشيتوزان المجهرية (CSM)
ملاحظة: تم تنفيذ كافة الإجراءات في درجة حرارة الغرفة ما لم يذكر خلاف ذلك.
- وتعد CSM بواسطة عملية استحلاب الماء في النفط جنبا إلى جنب مع تقنية تقوصر الأيونية باستخدام بروتوكول لدينا 6 السابقة. استحلب محلول مائي من الشيتوزان (6 مل من الشيتوزان ث / ت 3٪ في حامض الخليك 0.5 م) في 100 مل من زيت خليط مرحلة تتكون من فول الصوياالنفط، N-الأوكتانول (1:2 V / V) و 5٪ صوربيتان-أحادية أوليئات (SPAN 80) مستحلب، وذلك باستخدام النفقات العامة (1700 دورة في الدقيقة)، والتحريك المغناطيسي (1000 دورة في الدقيقة) في وقت واحد، في اتجاهين متعاكسين. هذا الأسلوب المزدوج لخلط يضمن أن المذيلات تشكلت في وقت مبكر قبل عبر ربط يحدث يمكن أن تبقى في حل وليس تترسب في القاع. وعلاوة على ذلك، وتحريك شريط المغناطيسي يساعد في اجتثاث تجميع الشيتوزان خلال تشكيل micelle وrigidization.
- يحرك باستمرار الخليط لمدة ما يقرب من 1 ساعة حتى يتم الحصول على المياه مستقر في والنفط المستحلب. يبدأ يشابك الأيونية مع إضافة 1.5 مل من 1 هيدروكسيد ث / V٪ البوتاسيوم في N-الأوكتانول كل 15 دقيقة لمدة 4 ساعات (24 مجموع مل).
- بعد الانتهاء من رد فعل يشابك، صب ببطء في المرحلة النفطية في CSM التي تحتوي على خليط وإضافة فورا المجالات إلى 100 مل من الاسيتون. غسل المجالات مع الأسيتون حتى يتم ازالتها بالكامل للمرحلة النفط.
- تجفيف المجالات تعافى في مجفف فراغ والشرجyze دون مزيد من المعالجة. تم تحديد الجسيمات CSM متوسط الحجم، ومساحة لكل مليغرام وحجم وحدة مكعب باستخدام الجسيمات محلل حجم.
- لتجارب لاحقة، وغسل CSM ثلاث مرات بماء معقم لإزالة الأملاح المتبقية وتعقيم مع الكحول المطلق.
3. تحديد عدد من المجموعات الأمينية الحرة في CSM
ملاحظة: تم تنفيذ كافة الإجراءات في درجة حرارة الغرفة ما لم يذكر خلاف ذلك.
- تحديد عدد من المجموعات الأمينية الحرة موجودة في CSM بعد يشابك الأيونية باستخدام benzenesulfonic trinitro فحص الحمض (TNBS) من Bubins وOfner 7. احتضان 5 ملغ من المجهرية مع 1 مل من محلول TNBS 0.5٪ في أنبوب مل زجاج 50 لمدة 4 ساعات في 40 درجة مئوية، ويتحلل مع اضافة 3 مل من حمض الهيدروكلوريك في 6N درجة مئوية 60 لل2H.
- تبريد عينات لدرجة حرارة الغرفة، واستخراج TNBS مجانا عن طريق إضافة 5 مل من الماء منزوع الأيونات و 10 مل من اثيلالأثير.
- تدفئة قسامة 5 مل من المرحلة المائية إلى 40 درجة مئوية في حمام مائي لمدة 15 دقيقة حتى يتبخر أي الأثير المتبقية، وبارد لدرجة حرارة الغرفة، وتمييع مع 15 مل من الماء.
- قياس الامتصاصية في 345 نانومتر مع الطيف باستخدام TNBS حل بدون الشيتوزان كما فارغة والشيتوزان وتستخدم لإعداد CSM لتحديد العدد الإجمالي للجماعات الأمينية. ويقدر عدد المجموعات الأمينية الحرة المجلس الأعلى للقضاء بالنسبة لالشيتوزان.
4. التحميل ASC في CSM
ملاحظة: تم تنفيذ كافة الإجراءات في درجة حرارة الغرفة ما لم يذكر خلاف ذلك.
- تتوازن 5 ملغ من CSM تعقيمها من قسم 2.5 في HBSS العقيمة بين عشية وضحاها وإضافة إلى حجم المسام 8 ميكرون إدراج غشاء لوحة ثقافة (24 لوحة جيد).
- بعد CSM استقروا على الغشاء، نضح بعناية HBSS وإضافة 300 ميكرولتر من متوسط النمو الى الداخل من إدراج وميكرولتر 700 من وسائط النمو إلى عشرةه خارج إدراج.
- Resuspend ASC في تركيز مناسب (1 × 10 4 من 4 x 10 4) في 200 ميليلتر من متوسط النمو والبذور على CSM داخل ثقافة إدراج لوحة. الحجم النهائي من المتوسط في ادخال ثقافة، بعد البذر، هو 500 ميكروليتر.
- احتضان المصنف ASC في CSM لمدة 24 ساعة في حاضنة 5٪ CO 2 مرطب عند 37 درجة مئوية.
5. تحديد النسبة المئوية لشركة ASC، وبقاء الخلية في CSM
ملاحظة: تم تنفيذ كافة الإجراءات في درجة حرارة الغرفة ما لم يذكر خلاف ذلك.
- بعد مرور فترة الحضانة، وجمع CSM ASC محملة في أنبوب معقم microcentrifuge 1.5 مل من دون إزعاج الخلايا التي هاجرت في غشاء إدراج.
- إزالة المتوسطة المتبقية وإضافة 250 ميكرولتر من متوسط نمو جديدة للأنبوب.
- إلى كل أنبوب إضافة 25 MTT ميكرولتر [3 - (4،5-dimethylthiozole-2-يل) -2،5-diphenyltetrazolium بروميد]حل (5 ملغ / مل)، واحتضان لمدة 4 ساعات في حاضنة 5٪ CO 2 مرطب عند 37 درجة مئوية.
- بعد مرور فترة الحضانة، وإزالة المتوسطة، إضافة 250 ميكرولتر من سلفوكسيد ثنائي ميثيل، ودوامة الخليط لمدة 2-5 دقيقة إلى ذوبان مجمع formazan.
- أجهزة الطرد المركزي في CSM في ز س 2700 لمدة 5 دقائق، وتحديد قياس الامتصاصية طاف في 570 نانومتر باستخدام 630 نانومتر كمرجع.
- تحديد عدد الخلايا المرتبطة CSM نسبة إلى قيمة الامتصاصية التي تم الحصول عليها من أرقام معروفة من ASC قابلة للحياة.
6. تميز ASC-CSM جزءا لا يتجزأ من الكولاجين جل
ملاحظة: تم تنفيذ كافة الإجراءات في درجة حرارة الغرفة ما لم يذكر خلاف ذلك.
- مزيج ASC محملة CSM (5 ملغ تحتوي ≈ 2 × 10 4 خلايا) مع الكولاجين من النوع 1 (7.5 ملغ / مل) المستخرج من وتر ذيل فأر وفقا لطريقة بورنستاين (8) وfibrillate بعد تعديل الرقم الهيدروجيني إلى 6.8 باستخدام 2 N هيدروكسيد الصوديوم.
- إضافة لييفاتي الكولاجين ASC-CSM الخليط إلى طبق من ذهب 12-جيدا واحتضان لمدة 30 دقيقة في حاضنة في 5٪ CO 2 مرطب عند 37 درجة مئوية.
- بعد الرجفان كاملة، واحتضان والمواد الهلامية الكولاجين ASC-CSM لمدة تصل إلى 14 يوما في حاضنة 5٪ CO 2 مرطب على 37 درجة مئوية.
- وقد لوحظت إطلاق والهجرة من الخلايا من CSM في هلام باستخدام تقنيات الفحص المجهري القياسية.
7. ممثل النتائج
في هذه الدراسة، وقد وضعنا استراتيجية في المختبر لتسليم الخلايا الجذعية من المجهرية الشيتوزان (CSM) الى الكولاجين هلام سقالة. وأعدت CSM التي يسهل اختراقها من حجم موحد (175-225 ميكرون في القطر) وتكوينها وتستخدم ناقلات الخلية (الشكل 2). على احتضان ASC مع CSM، الخلايا تعلق بتركيز 2 × cells/5mg 4 10 من CSM. وكانت هذه الخلايا قادرة على الانتشار على مدى microsphere، في حين تمتد أرجل كاذبة خيطيةفي الشقوق التي يسهل اختراقها من microsphere (الشكل 3). مرة واحدة كانت مختلطة CSM الخلية محملة مع هلام الكولاجين، والخلايا بدأت على الفور هاجروا إلى المواد الهلامية (الشكل 4).
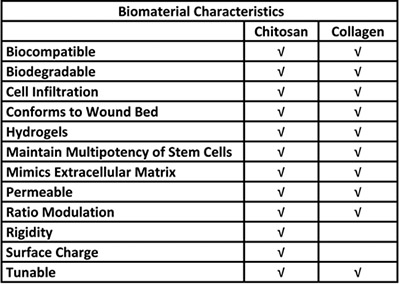
الجدول رقم 1. المزايا البيولوجية لاستخدام الشيتوزان والكولاجين في تسليم نظام الخلايا الجذعية.
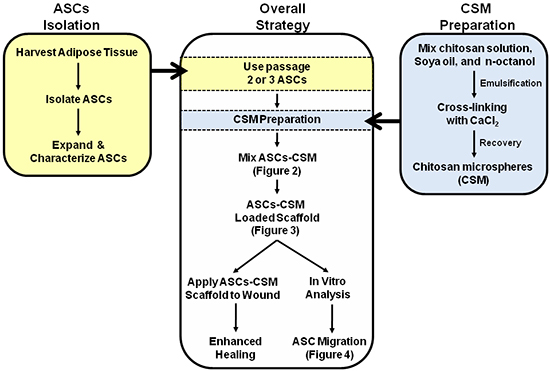
الشكل 1. تخطيطي تصور استراتيجية شاملة لاستخدام مزدوج من ASC-CSM السقالات الكولاجين المحملة. أرقام 2 و 3 و 4 هي مشروحة في التخطيطي للمساعدة في تفسير الصور.
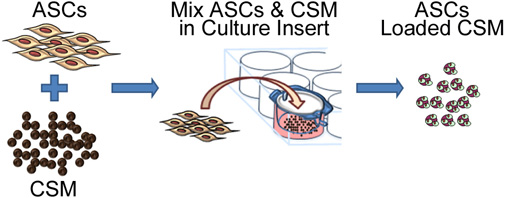
الشكل 2. تمثيل تخطيطي يصور عملية البذر الخلايا الجذعية على المجهرية الشيتوزان. وبروكوفاق سطيف ويشمل التعاون مع زراعة ASC CSM في 8 - ميكرومتر غشاء حجم المسام ثقافة إدراج لوحة. بعد 24 ساعة، ويتم إزالة المجهرية من إدراج ونحن على استعداد لتضمين في مصفوفة مادة بيولوجية.
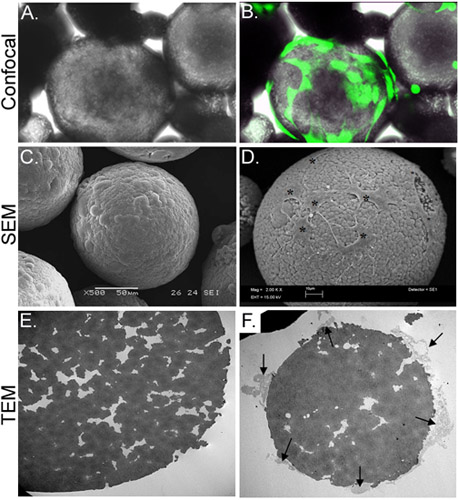
الشكل 3. الخصائص المورفولوجية لCSM-محملة ASC. لوحة ليصور صورة مجهرية ضوء ASC محملة CSM، في حين أن لوحة (ب) يظهر نفس الحقل من مشاهدة فرضه مع صورة حصلت عليها مضان المجهري متحد البؤر. تم تحميلها مسبقا مع ASC AM calcein (الخضراء). لوحة C يصور صورة من صورة SEM من microsphere المفرغة، في حين أن لوحة D يعرض الخلايا تحميلها على microsphere (النجمة). صورة TEM E في لوحة يظهر المقطع العرضي لmicrosphere المفرغة. ويقع عدد كبير من المسام والشقوق في جميع أنحاء microsphere. لوحة F يظهر microsphere عبر مقطوع مع خلايا (الأسهم) المرفق وتمديد أرجل كاذبة خيطية في لجنة المساواة العرقيةالرذائل. تكبير الأصلي: A & B = 70X، C = 500x، D = 2000 X؛ E & F = 2500 س.

الشكل 4. هجرة من ASC من CSM في سقالة الكولاجين ثلاثي الأبعاد. لوحات ألف وباء تصوير CSM مع الخلايا المهاجرة بعيدا عن microsphere في مصفوفة والكولاجين في اليوم 3 (A السهام، و). لوحة B يظهر ثقافة مماثلة بعد 12 يوما. انتقال المجهر الإلكتروني (تيم) وصفت الصور في C، D، و E. الأستريسك في C و D تظهر microsphere التي كانت عبر مقطوع مع الخلايا المهاجرة بعيدا عن microsphere (سهام). ويصور تضخم أعلى من التطوير لوحة في لوحة E، ويظهر أرجل كاذبة خيطية الخلية التابعة لييفات الكولاجين (الشكل). التكبير الأصلي: A & B = 100X، C و D = 6000 X؛ E = 20000 س، أقحم = 150000 س.
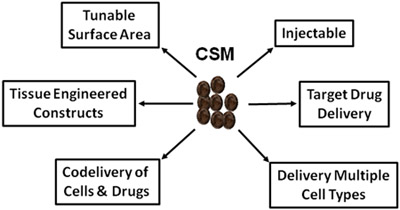
الشكل 5.تصور تخطيطي للاستخدامات واسعة من CSM في الطب التجديدي، وتقديم الأدوية.
Access restricted. Please log in or start a trial to view this content.
Discussion
وهناك عقبة رئيسية في العلاج بالخلايا الجذعية والقائم على تطوير أساليب فعالة لإيصال الخلايا إلى المناطق المحددة للإصلاح. نظرا لتقلب المريض إلى المريض، ونوع الأنسجة، وحجم الاصابة وعمق، ويجب أن تحدد منهجية للخلايا الجذعية تسليم على أساس كل حالة على حدة. على الرغم من ت?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
لا المصالح المتنافسة المالية موجودة.
براءة الذمة
آراء أو التأكيدات الواردة في هذه الوثيقة هي وجهات نظر خاصة من كتاب ولا يمكن تفسيره بأنه مسؤول أو يعكس وجهات النظر من وزارة الدفاع أو الحكومة الأمريكية. الكتاب هم من العاملين في حكومة الولايات المتحدة، وأعدت هذا العمل كجزء من واجباتهم الرسمية. وأيد كل العمل الذي قامت به الولايات المتحدة للبحوث الطبية للقوات المسلحة وقيادة العتاد. وقد أجريت هذه الدراسة في إطار بروتوكول مراجعتها والموافقة عليها من قبل الولايات المتحدة للبحوث الطبية للقوات المسلحة والعتاد مجلس قيادة مراجعة المؤسسية، وفقا للبروتوكول المعتمد.
Acknowledgements
ويدعم منطقة دبي للتعهيد عن طريق منحة من منح المؤسسة جنيف. كان مدعوما من قبل SN منحة زمالة ما بعد الدكتوراه في الهندسة من بيتسبرغ مبادرة الأنسجة.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| اسم كاشف / معدات | شركة | فهرس العدد | تعليقات |
| هانكس BalancedSalt الحل (HBSS) | Gibco | 14175 | الاستهلاكية |
| الأبقار مصل الجنين | Hyclone | SH30071.03 | الاستهلاكية |
| كولاجيناز النوع الثاني | سيغما الدريخ | C6685 | الاستهلاكية |
| 70 ميكرومتر النايلون سلكية فلتر | العلوم البيولوجية دينار بحريني | 352350 | الاستهلاكية |
| 100 ميكرومتر النايلون سلكية فلتر | العلوم البيولوجية دينار بحريني | 352360 | الاستهلاكية |
| MesenPRO النظام نمو متوسطة | إينفيتروجن | 12746-012 | الاستهلاكية |
| L-الجلوتامين | Gibco | 25030 | الاستهلاكية |
| T75 قارورة زراعة الأنسجة | العلوم البيولوجية دينار بحريني | 137787 | الاستهلاكية |
| الشيتوزان | سيغما الدريخ | 448869 | الاستهلاكية |
| حمض الخليك | سيغما الدريخ | 320099 | الاستهلاكية |
| N-أوكتانول | العضوية Acros | 150630025 | الاستهلاكية |
| صوربيتان-أحادي أوليئات | سيغما الدريخ | S6760 | الاستهلاكية |
| هيدروكسيد البوتاسيوم | سيغما الدريخ | P1767 | الاستهلاكية |
| الأسيتون | فيشر العلمية | L-4859 | الاستهلاكية |
| الإيثانول | سيغما الدريخ | 270741 | الاستهلاكية |
| Trinitro Benzenesulfonic حمض | سيغما الدريخ | P2297 | الاستهلاكية |
| حامض الهيدروكلوريك | سيغما الدريخ | 320331 | الاستهلاكية |
| إثيل الأثير | سيغما الدريخ | 472-484 | الاستهلاكية |
| 8 ميكرون إدراج اللوحة زراعة الأنسجة | العلوم البيولوجية دينار بحريني | 353097 | الاستهلاكية |
| أنابيب Microcentrifuge 1.5 مل | الصياد | 05-408-129 | الاستهلاكية |
| MTT الكاشف | إينفيتروجن | M6494 | الاستهلاكية |
| ثنائي ميثيل سلفوكسيد | سيغما الدريخ | D8779 | الاستهلاكية |
| Qtracker خلية كيت وصفها (Q تعقب 655) | الجزيئية تحقيقات | Q2502PMP | الاستهلاكية |
| اكتب 1 الكولاجين | Travigen | 3447-020-01 | الاستهلاكية |
| هيدروكسيد الصوديوم | سيغما الدريخ | S8045 | الاستهلاكية |
| 12-حسنا لوحات نسيج الثقافة | العلوم البيولوجية دينار بحريني | 353043 | الاستهلاكية |
| نبذ | إيبندورف | 5417R | معدات |
| شاكر المداري | نيو برونزويك Scienctific | C24 | معدات |
| مرطب حاضنة ثاني أكسيد الكربون مع الهواء-5 2٪ | الحرارية العلمية | نموذج 370 | معدات |
| فوق النمام | IKA | Visc6000 | معدات |
| النمام المغناطيسي | كورنينج | PC-210 | معدات |
| فراغ المجفف | - | - | معدات |
| حجم الجسيمات محلل | مالفيرن | STP2000 Spraytec | معدات |
| ماء الحمام | فيشر العلمية | Isotemp210 | معدات |
| طيفي | بيكمان | بيكمان كولتر الطيف DU800UV/Visible | معدات |
| دوامة | Diagger | 3030a | معدات |
| Microplate قارئ | الجزيئية الأجهزة | SpectraMax M2 | معدات |
| ضوء / الإسفار مجهر | أوليمبوس | IX71 | معدات |
| متحد البؤر المجهر | أوليمبوس | FV-500 ليزر متحد البؤر المجهر | معدات |
| المجهر الإلكتروني | كارل زايس هيئة التصنيع العسكريroImaging | 435 ليو نائب الرئيس | معدات |
| انتقال الكترون المجهر | JEOL | JEOL 1230 | معدات |
References
- Krampera, M. Mesenchymal stem cells for bone, cartilage, tendon and skeletal muscle repair. Bone. 39, 678-683 (2006).
- Patrick, C. W. Tissue engineering strategies for adipose tissue repair. Anat. Rec. 263, 361-366 (2001).
- Pountos, I., Giannoudis, P. V. Biology of mesenchymal stem cells. Injury. 36, Suppl 3. S8-S12 (2005).
- Kim, I. Y. Chitosan and its derivatives for tissue engineering applications. Biotechnol. Adv. 26, 1-21 (2008).
- Shi, C. Therapeutic potential of chitosan and its derivatives in regenerative medicine. J. Surg. Res. 133, 185-192 (2006).
- Natesan, S. Adipose-derived stem cell delivery into collagen gels using chitosan microspheres. Tissue Eng. Part. A. 16, 1369-1384 (2010).
- Bubnis, W. A., Ofner, C. M. 3rd The determination of epsilon-amino groups in soluble and poorly soluble proteinaceous materials by a spectrophotometric method using trinitrobenzenesulfonic acid. Anal. Biochem. 207, 129-133 (1992).
- Bornstein, M. B. Reconstituted rattail collagen used as substrate for tissue cultures on coverslips in Maximow slides and roller tubes. Lab Invest. 7, 134-137 (1958).
- Benoit, D. S. Integrin-linked kinase production prevents anoikis in human mesenchymal stem cells. J. Biomed. Mater. Res. A. 81, 259-268 (2007).
- Nuttelman, C. R., Tripodi, M. C., Anseth, K. S. Synthetic hydrogel niches that promote hMSC viability. Matrix Biol. 24, 208-218 (2005).
- Shanmuganathan, S. Preparation and characterization of chitosan microspheres for doxycycline delivery. Carbohydr. Polym. 73, 201-211 (2008).
- Haque, T., Chen, H., Ouyang, W., Martoni, C., Lawuyi, B., Urbanska, A., Prakash, S. Investigation of a new microcapsule membrane combining alginate, chitosan, polyethylene glycol and poly-L-lysine for cell transplantation applications. Int. J. Artif. Organs. 28, 631-637 (2005).
- Goren, A., Dahan, N., Goren, E., Baruch, L., Machluf, M. Encapsulated human mesenchymal stem cells: a unique hypoimmunogenic platform for long-term cellular therapy. FASEB J. 24, 22-31 (2010).
- Zielinski, B. A., Aebischer, P. Chitosan as a matrix for mammalian cell encapsulation. Biomaterials. 15, 1049-1056 (1994).
- Girandon, L., Kregar-Velikonja, N., Božikov, K., Barliç, A. In vitro Models for Adipose Tissue Engineering with Adipose-Derived Stem Cells Using Different Scaffolds of Natural Origin. Folia Biol. (Praha). 57, 47-56 (2011).
- Baruch, L., Machluf, M. Alginate-chitosan complex coacervation for cell encapsulation: effect on mechanical properties and on long-term viability. Biopolymers. 82, 570-579 (2006).
- Wei, Y., Gong, K., Zheng, Z., Wang, A., Ao, Q., Gong, Y., Zhang, X. Chitosan/silk fibroin-based tissue-engineered graft seeded with adipose-derived stem cells enhances nerve regeneration in a rat model. J. Mater. Sci. Mater. Med. , (2011).
- Wang, Q., Jamal, S., Detamore, M. S., Berkland, C. PLGA-chitosan/PLGA-alginate nanoparticle blends as biodegradable colloidal gels for seeding human umbilical cord mesenchymal stem cells. J. Biomed. Mater. Res. A. 96, 520-527 (2011).
- Alves da Silva, M. L., Martins, A., Costa-Pinto, A. R., Correlo, V. M., Sol, P., Bhattacharya, M., Faria, S., Reis, R. L., Neves, N. M. Chondrogenic differentiation of human bone marrow mesenchymal stem cells in chitosan-based scaffolds using a flow-perfusion bioreactor. J. Tissue Eng. Regen. Med. , (2010).
- Kang, Y. M., Lee, B. N., Ko, J. H., Kim, G. H., Kang, K. N., Kim da, Y., Kim, J. H., Park, Y. H., Chun, H. J., Kim, C. H., Kim, M. S. In vivo biocompatibility study of electrospun chitosan microfiber for tissue engineering. Int. J. Mol. Sci. 11, 4140-4148 (2010).
- Bozkurt, G., Mothe, A. J., Zahir, T., Kim, H., Shoichet, M. S., Tator, C. H. Chitosan channels containing spinal cord-derived stem/progenitor cells for repair of subacute spinal cord injury in the rat. Neurosurgery. 67, 1733-1744 (2010).
- Leipzig, N. D., Wylie, R. G., Kim, H., Shoichet, M. S. Differentiation of neural stem cells in three-dimensional growth factor-immobilized chitosan hydrogel scaffolds. Biomaterials. 32, 57-64 (2011).
- Altman, A. M., Gupta, V., RÃos, C. N., Alt, E. U., Mathur, A. B. Adhesion, migration and mechanics of human adipose-tissue-derived stem cells on silk fibroin-chitosan matrix. Acta Biomater. 6, 1388-1397 (2010).
- Altman, A. M., Yan, Y., Matthias, N., Bai, X., Rios, C., Mathur, A. B., Song, Y. H., Alt, E. U. IFATS collection: Human adipose-derived stem cells seeded on a silk fibroin-chitosan scaffold enhance wound repair in a murine soft tissue injury model. Stem Cells. 27, 250-258 (2009).
- Machado, C. B., Ventura, J. M., Lemos, A. F., Ferreira, J. M., Leite, M. F., Goes, A. M. 3D chitosan-gelatin-chondroitin porous scaffold improves osteogenic differentiation of mesenchymal stem cells. Biomed. Mater. 2, 124-131 (2007).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved