A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تحريض الطعم ضد المضيف المرض و
In This Article
Summary
الفئران زرع نخاع العظام هو أسلوب يستخدم على نطاق واسع لدراسة آليات المناعية التي تحكم الطعم ضد المضيف المرض لدى البشر. القدرة على رصد أنماط الاتجار خلية T في الجسم الحي يسمح لتحليل مفصل للوضع وإدامة استجابات الخلايا T خلال الطعم ضد المضيف المرض.
Abstract
الطعم ضد المضيف المرض (GVHD) هو الحد الحاجز لاستخدام واسعة من زرع نخاع العظم كعلاج العلاجية لمجموعة متنوعة من أوجه القصور الدم. ويتسبب GVHD بواسطة الخلايا T الناضجة alloreactive موجودة في العظام الكسب غير المشروع نخاع التي غرست في المتلقي وتسبب تلفا للأعضاء المضيف. ومع ذلك، في الفئران، يجب إضافة خلايا T حتى العظم نخاع أن يسبب اللقاح GVHD. على الرغم من القيام بأعمال مكثفة لوصف T اضافة رد زرع الخلايا، bioluminescent تكنولوجيا التصوير هو وسيلة غير عدوانية لرصد أنماط الاتجار T خلية في الجسم الحي.
بعد التشعيع قاتلة، تزرع الفئران المتلقية مع خلايا نخاع العظام وsplenocytes الفئران من الجهات المانحة. يتم تضمين مجموعات فرعية من الخلايا T L2G85.B6 (الفئران المعدلة وراثيا التي تعبر عن وسيفيراز جوهري) في عملية الزرع. عن طريق زرع الخلايا مجموعات فرعية معينة فقط T، واحد قادر على تتبع مجموعات فرعية محددة الخلايا T في الجسم الحي،واستنادا إلى موقعها وتطوير الفرضيات فيما يتعلق بدور مجموعات فرعية محددة الخلايا T في تعزيز GVHD في نقاط زمنية مختلفة. في فترات محددة سلفا زرع آخر، وتصوير الفئران المتلقية باستخدام كاميرا CCD Xenogen IVIS. يمكن كميا شدة الضوء باستخدام برنامج السكن لتوليد صورة صورة زائفة الألوان يعتمد على كثافة الفوتون (أحمر = كثافة عالية، البنفسجي = منخفض الكثافة).
بين 4-7 أيام آخر زرع والفئران المتلقية تبدأ تظهر علامات سريرية للGVHD. وضعت كوك وآخرون. 1 (أ) لنظام التسجيل quantitate تطور المرض استنادا إلى الفراء نسيج المتلقي الفئران وسلامة الجلد، والنشاط، وفقدان الوزن، والموقف. وسجل الفئران يوميا، والموت الرحيم عندما تصبح المحتضرة. الفئران المتلقية أصبحت تحتضر عموما 20-30 زرع آخر أيام.
نماذج الفئران هي أدوات قيمة لدراسة علم المناعة من GVHD. زرع الخلايا بشكل انتقائي خاص T مجموعات فرعية آلأدنى مستوى لتحديد دقيق لأدوار كل مجموعة فرعية يلعب. غير جراحية تتبع استجابات الخلايا T في الجسم الحي يضيف طبقة أخرى ذات قيمة للنماذج GVHD الفئران.
Protocol
1. قاتلة تشعيع
- وضع ما يصل إلى 10 في الفئران المتلقية قفص microisolator متوافق مع irradiator لاستخدامه.
- أشرق في 2 جرعات متساوية تلخيص الجرعة الإجمالية (الجرعة الإجمالية = 9 CGY للمستلمين BALB.B). يجب أن يكون تشعيع الثانية بعد 3 ساعة الأولى. ينبغي حقن تحدث بين 4-6 ساعة بعد التشعيع النهائي. أشرق في الفئران إما المصدر أو خدمات العملاء 137 RS2، 000 irradiator.
- بعد الجرعة الإشعاعية 2 الفئران المتجر، في قفص بالماء المحمض microisolator حتى وقت الزرع.
2. خلية طحالية إعداد
- الموت ببطء الماوس واحد المانحة وفقا لمبادئ توجيهية المؤسسية. كل جهة مانحة تعطي عموما 75x10 6 - 6 splenocytes 125x10. باستخدام مجموعات تنقية CD8، كل الماوس ينتج عادة 6x10 6 - 6 CD8 الخلايا 12x10 T.
- إزالة الطحال من خلال جعل شق عمودي أولا سم 2 2 سم من خط الوسط الحق مباشرةتحت القفص الصدري. قطع طريق الفراء والجلد والأغشية والحشوية.
- إزالة الطحال وخلق واحدة عن طريق وضع تعليق خلية الطحال في 40 شاشة شبكة ميكرولتر في طبق بتري مع RPMI 1640 بنسبة 5٪ FBS. استخدام المكبس حقنة لتحطيم الطحال حتى يتم تمرير الطحال بأكمله من خلال شاشة شبكة.
- كرر هذه العملية لكل وWT المانحة L2G85.B6. جمع كل WT تعليق خلية واحدة في أنبوب مخروطي الشكل 1-50 مل، وجمع كل L2G85.B6 تعليق خلية واحدة في أنبوب مخروطي 50 مل منفصلة.
- أجهزة الطرد المركزي في 1200 دورة في الدقيقة الخلايا لمدة 10 دقيقة في 4 درجات مئوية. إعادة تعليق الكريات في 1640 RPMI مع FBS 5٪ والخلايا العد.
3. نخاع العظم إعداد
- إزالة الجلد من أحد أطرافه الخلفية للماوس المانحة.
- قطع بعناية بعيدا عن الأنسجة العضلية أكبر قدر ممكن من عظم الفخذ والساق / الشظية.
- إزالة أطرافهم هند عن طريق قطع عظم الفخذ بعيدا في مفصل الورك. قطع مخلب الخلفية أسفل الساق / الشظية تقاطع. وينبغي بذل كل التخفيضات العظام باستخدام مقص قوي.
- إزالة بعناية أي نوع من الأنسجة العضلية المتبقية. قطع الساق، وجدت قليلا نسبيا نخاع العظم في الساق ولا يستحق كل هذا الجهد.
- وضع أطرافهم هند في عملية الباردة RPMI 1640 FBS وتكرار 5٪ مع أطرافهم هند الثانية. ينبغي لكل الماوس العائد بين 20x10 6 - 40x10 6 خلايا نخاع العظام.
4. إزالة نخاع العظم
- إزالة أحد أطرافه الخلفية من وسائل الاعلام ومكان في صحن بيتري كبيرة مع كمية صغيرة من وسائل الاعلام الباردة (~ 1 مل).
- قطع بعيدا مفصل الركبة. باستخدام حقنة (المجلد> 5 مل)، إدراج إبرة تحت الجلد في الساق وخفض حقنة حتى تتم إزالة جميع المواد الحمراء من الداخل من الساق. كرر العملية مع عظم الفخذ. تجاهل العظام المتبقية خالية من نخاع العظام. كرر العملية مع الطرف هند الثانية.
- إنشاء خلية واحدة تعليق وسائل الاعلام pipetting تحتوي على نخاع العظم في طبق بتري كبير واستخدام المكبس حقنة و 40 ميكرولتر شبكة الشاشة. ماصة تعليق خلية واحدة في أنبوب 50 مل المخروطية والحفاظ على الجليد.
5. CD3 استنفاد
وهناك مجموعة متنوعة من الطرق لاستنزاف خلايا + CD3 من نخاع العظام. مختبرنا يستخدم عدة أدلى بها بيوتيك Miltenyi (CD3-البيوتين - 130-093-021). تستنفد خلايا + CD3 من نخاع العظام بعد بروتوكول الشركة المصنعة. من الآن فصاعدا سوف المخزن المؤقت لمجموعات Miltenyi أن يسمى MACS العازلة (2 ملم EDTA، 0.5٪ BSA في برنامج تلفزيوني، ودرجة الحموضة 7.2).
- غسل الخلايا بواسطة الطرد المركزي splenocytes وخلايا نخاع العظام في 1200 دورة في الدقيقة لمدة 10 دقيقة في 4 درجات مئوية وعدد الخلايا.
- إزالة طاف ALL. إعادة تعليق خلايا نخاع العظم في 100 ميكرولتر من 10 ملايين الخلايا في نخاع العظم الاحتياطي MACS.
- تواصل مع نضوب باستخدام CD3 بتصنيع 'البروتوكول.
- غسل CD3 نخاع العظام والخلايا المنضب 3 مرات في برنامج تلفزيوني العقيمة. عدد CD3 المنضب خلايا نخاع العظم و resuspend في حجم مناسب لحقن الخلايا 10 7.
الحمار = "jove_title"> 6. L2G85.B6 CD8 + T خلية تنقية
وهناك مجموعة متنوعة من الطرق لتنقية الخلايا CD8 T من L2G85.B6 الفئران. أيضا، هناك عدة طرق لاستنزاف خلايا CD8 T من الجهات المانحة خلية طحالية WT. مختبرنا يستخدم مجموعات من بيوتيك Miltenyi (CD8 استنفاد - 130-049-401، CD8 تنقية - 130-095-236).
- إعادة تعليق بيليه WT في 90 ميكرولتر العازلة MACS في الخلايا 7 10. تواصل مع الخلية CD8 T استنزاف وفقا لتصنيع "البروتوكول (CD8 استنفاد - 130-049-401).
- إعادة تعليق بيليه L2G85.B6 في 40 ميكرولتر العازلة MACS في الخلايا 7 10. تواصل مع الخلية CD8 T تنقية وفقا لتصنيع "البروتوكول (CD8 تنقية - 130-095-236).
- عد كل خلية السكان ويغسل كل السكان 3 مرات مع برنامج تلفزيوني العقيمة. إعادة تعليق كل السكان في حجم مناسب لحقن 18x10 6 WT (CD8 المنضب) و 6 splenocytes 2X10 L2G85.B6 تنقية الخلايا CD8 T.
7. حقن إعداد
- الجمع بين 10 7 CD3 نخاع العظم الخلايا المنضب، 18x10 6 splenocytes WT (CD8 المنضب)، و2X10 L2G85.B6 6 خلايا CD8 T تنقيته في أنبوب microcentrifuge. يغسل مع PBS العقيمة و resuspend في 300 ميكرولتر.
- حقن الخلايا في إعداد الوريد ذيل الفئران المتلقية. وينبغي أن يتم الحقن باستخدام الإبر قياس 28.
- الفئران في قفص متجر بالماء المحمض microisolator. الفئران باستخدام نقاط يوميا نظام التسجيل التسجيل GVHD التي وضعها كوك وآخرون 1.
8. Bioluminescent التصوير
- ستة أيام زرع آخر، وضخ الفئران المتلقية مع 4 ملغ D-وسيفيرين. السماح لوسيفيرين 5 دقائق لتتفاعل مع وسيفيراز.
- تخدير الماوس في غرفة isoflurane من تصوير تلألؤ بيولوجي والمتلقين الصورة لمدة 5 دقائق مع binning الصغيرة. وهذا خلق على صورة عالية الدقة في حين جمع كأحداث أكبر عدد ممكن.
- تحليل البيانات باستخدام المعيشةصورة البرنامج. يمكن تغيير حجم الصورة الزائفة لونا لتحقيق أفضل النتائج. ومع ذلك، لا بد من أن يتم استخدام نفس النطاق عبر التجارب.
- يمكن إنشاء مناطق السكن الفائدة باستخدام برامج الصور والابتعاثية ضوء يمكن كميا عن طريق حساب تدفق (الفوتونات / ثانية) المنبعثة من كل منطقة من الفائدة.
9. ممثل النتائج
حوالي 7-10 يوما زرع آخر، يبدأ الفئران تظهر عليها علامات سريرية لGVHD. الفئران غذر تظهر بسبب عدم وجود الاستمالة. وسوف تبدأ أيضا المتلقين لانقاص وزنه بين 7-10 أيام آخر زرع. والنشاط والموقف من الفئران المتلقية تبقى عادية نسبيا حتى اليوم ما يقرب من زرع آخر 12-14. سوف عشرات GVHD التراكمي زيادة مطردة خلال أول 2-3 أسابيع زرع آخر (الشكل 1A). مسار المرض متغير جدا بين الفئران، ولكن يجب أن نستسلم المستفيدين بشكل موحد على GVHD بواسطة د 30-40AYS آخر زرع (1B الشكل).
ويبين الشكل 2 الفئران التي تم تصويرها المتلقي 6 أيام آخر زرع. شبه الملونة النطاق معارض مختلفة الابتعاثية ضوء في جميع أنحاء الجسم مع شدة الضوء المنبعثة أعلى في الطحال والأمعاء و. CD8 T تراكم الخلايا في الأمعاء يتسق مع النتائج السابقة 6. يمكن وضع الفئران في قفص المتلقي العودة إلى microisolator يمكن تصوير عند نقطة وقت لاحق أو الموت الرحيم لتصوير الجسم الحي السابقين.
| معايير | الصف 0 | الصف 1 | الصف 2 |
| فقدان الوزن (wkly.) | <10٪ | > 10٪ - <25٪ | > 25٪ |
| وضع | طبيعي | Hunching فقط في بقية | hunching عدة؛ يضعف movemeNT |
| نشاط | طبيعي | خفيفة الى معتدلة الانخفاض في النشاط | ثابتة ما لم حفز |
| الفراء نسيج | طبيعي | خفيفة الى معتدلة الإزعاج | شديدة الإزعاج / الاستمالة الفقراء |
| الجلد الملمس | طبيعي | تقشر الكفوف / الذيل | واضحة في مناطق الجلد المعري |
الجدول 1. تطوير كوك وآخرون هذا النظام التسجيل في 1996 1. وينبغي أن سجل الفئران يوميا على كل معيار من المعايير على اليمين. يتم إعطاء كل الماوس على درجة من 0-2 لكل المعايير والدرجة الكلية هي مجموع درجات كل فرد.

الشكل 1. تم زرع قاتل BALB.B المشع مع العظام 7 10خلايا نخاع وحدها أو مع 18x10 6 splenocytes CD8 T الخلية WT المنضب و 6 2X10 تنقية الخلايا CD8 T L2G85.B6. A) البيانات السريرية نقاط من المستفيدين من نخاع العظام وحدها أو مع خلية T CD8 المنضب splenocytes WT وتنقيته L2G85.B6 CD8 خلايا T. ب) بيانات المستفيدين من بقاء نخاع العظام وحدها أو مع CD8 T الخلية المنضب splenocytes WT وتنقيته L2G85.B6 CD8 خلايا T. اضغط هنا لمشاهدتها بشكل اكبر شخصية .
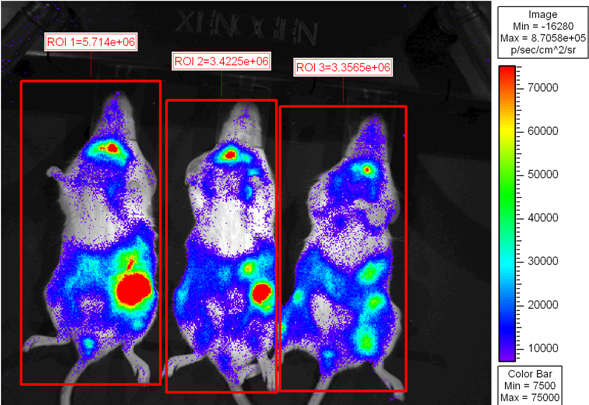
تم زرع الشكل 2. الفئران المعرضة للإشعاع قاتل مع BALB.B 10 7 خلايا نخاع العظام وحدها أو مع 18x10 6 splenocytes CD8 T الخلية WT المنضب و 6 2X10 تنقية الخلايا CD8 T L2G85.B6. تم حقن المتلقين مع 4 ملغ D-وسيفيرين عن طريق الحقن داخل الصفاق وتم تصويرها باستخدام IVIS Xenogen لمدة 5 دقائق في binning الصغيرة. PSوتظهر الصور الملونة eudo حيث يمثل الأرجواني والأحمر كثافة منخفضة يمثل ووضعت الأقاليم كثافة عالية من الاهتمام في جميع أنحاء كامل الماوس وتدفق الإجمالي (الفوتونات / ثانية) وكميا.
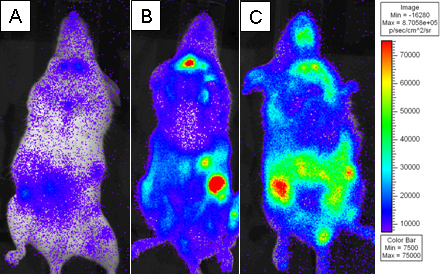
تم زرع الشكل 3. الفئران المعرضة للإشعاع قاتل مع BALB.B 10 7 خلايا نخاع العظام وحدها أو مع 18x10 6 splenocytes CD8 T الخلية WT المنضب و 6 2X10 تنقية الخلايا CD8 T L2G85.B6. تم حقن المتلقين مع 4 ملغ D-وسيفيرين عن طريق الحقن داخل الصفاق وتم تصويرها باستخدام IVIS Xenogen لمدة 5 دقائق في binning الصغيرة. وتظهر الصور الملونة الزائفة حيث يمثل الأرجواني والأحمر كثافة منخفضة يمثل كثافة عالية. تم تصوير في يوم المتلقين) 4، B) يوم 6، وC) نقل يوم آخر 8.
Discussion
بروتوكول لإحداث GVHD في الفئران المقدمة هنا يمثل نموذجا ذات الصلة سريريا من GVHD الفئران. أنشئت أصلا من قبل بيرغر وآخرون في عام 1994، وC57BL / 6 إلى مزيج سلالة BALB.B هو MHC-المتطابقة، مع معدل وفيات GVHD بوساطة CD4 التابعة، CD8 T المستجيبات 2، تتشابه بشكل كبير مع السيناريو السر...
Disclosures
الإعلان عن أي تضارب في المصالح.
Acknowledgements
اننا مدينون لGaughan أليس وانغ جينغ جياو-المعلقة التي الدعم التقني والمدخلات الفكرية، والدعم المعنوي كان لهم دور فعال في تحريك هذه الدراسات في المستقبل. وقدم الدعم لهذه الدراسات من قبل المعاهد الوطنية للصحة منح AI036532 لجاه.
Materials
| Name | Company | Catalog Number | Comments |
| اسم الكاشف | شركة | كتالوج رقم | تعليقات |
| RPMI 1640 | إينفيتروجن | 12633-012 | |
| الجنين مصل العجل | إينفيتروجن | 10439016 | |
| 40 ميكرومتر مصفاة الخلية | BD العلوم البيولوجية | 352340 | |
| CD3e-البيوتين | Miltenyi التكنولوجيا الحيوية | 130-093-021 | |
| مكافحة البيوتين Microbeads | Miltenyi التكنولوجيا الحيوية | 130-091-147 | |
| CD8a Microbeads | Miltenyi التكنولوجيا الحيوية | 130-049-401 | تستخدم الخلايا CD8 في استنزاف T من الطحال. |
| CD8a كوكتيل تنقية الجسم المضاد | Miltenyi التكنولوجيا الحيوية | 130-095-236 | تستخدم في تنقيةCD8 خلايا T من الطحال. |
| D-وسيفيرين | الفرجار العلوم الحياتية | 122796 |
References
- Cooke, K. R. An experimental model of idiopathic pneumonia syndrome after bone marrow transplantation: The roles of minor H antigens and endotoxin. Blood. 88, 3230-3239 (1996).
- Berger, M. T cell subsets involved in lethal graft-versus-host disease directed to immunodominant minor histocompatibility antigens. Transplantation. 57, 1095-1102 (1994).
- Nimer, S. D. Selective depletion of CD8+ cells for prevention of graft-versus-host disease after bone marrowtransplantation. A randomized controlled trial. Transplantation. 57, 82-87 (1994).
- Korngold, R., Sprent, J. Surface markers of T cells causing lethal graft-vs-host disease to class I vs class II H-2 differences. Journal of Immunology. 135, 3004-3010 (1985).
- Cao, Y. A. Molecular imaging using labeled donor tissues reveals patterns of engraftment, rejection, and survival in transplantation. Transplantation. 80, 134-139 (2005).
- Asady, R. E. l. TGF-{beta}-dependent CD103 expression by CD8(+) T cells promotes selective destruction of the host intestinal epithelium during graft-versus-host disease. J. Exp. Med. 201, 1647-1657 (2005).
- Larson, R. S., Springer, T. A. Structure and function of leukocyte integrins. Immunol Rev. 114, 181-217 (1990).
- Karecla, P. I. Recognition of E-cadherin on epithelial cells by the mucosal T cell integrin alpha M290 beta 7 (alpha E beta 7). Eur. J. Immunol. 25, 852-856 (1995).
- Cepek, K. L. Adhesion between epithelial cells and T lymphocytes mediated by E-cadherin and the alpha E beta 7 integrin. Nature. 372, 190-193 (1994).
- Malarkannan, S. The molecular and functional characterization of a dominant minor H antigen, H60. J. Immunol. 161, 3501-3509 (1998).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved