A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
إلى الوراء الإرواء وملء الأوعية الدموية التاجية الفأر كما التحضير للتصوير المقطعي بالكمبيوتر مايكرو
In This Article
Summary
تصور من الأوعية التاجية أمر بالغ الأهمية لتعزيز فهمنا لأمراض القلب والأوعية الدموية. نحن هنا وصف طريقة لperfusing الأوعية الدموية التاجية الفئران مع ظليل للأشعة مطاط السيليكون (Microfil)، تحضيرا للالدقيقة المحسوبة التصوير (μCT) التصوير المقطعي.
Abstract
تصور من الأوعية الدموية تزداد أهمية لفهم كثير من الحالات المرضية المختلفة. في حين أن العديد من التقنيات المتبعة لتصوير الأوعية الدموية، قليلة هي قادرة على تصور شبكة الأوعية الدموية ككل في حين تمتد إلى قرار يتضمن 1،2 السفن الصغيرة. بالإضافة إلى ذلك، العديد من تقنيات الصب الأوعية الدموية تدمير الأنسجة المحيطة بها، ومنع مزيد من التحليل للعينة 3-5. أسلوب واحد والتي تلتف حول هذه القضايا الصغيرة التصوير المقطعي (μCT). يمكن μCT التصوير تفحص بدقة <10 ميكرون، قادر على انتاج اعادة البناء 3D لشبكة الأوعية الدموية، ويترك الأنسجة السليمة للتحليل لاحقة (على سبيل المثال، الأنسجة وقياس الأشكال) 6-11. ومع ذلك، السفن التصوير بواسطة أساليب السابقين μCT فيفو يتطلب أن يكون ملء السفن مع مجمع ظليل للأشعة. على هذا النحو، تمثيل دقيق من الأوعية الدموية التي تنتجها التصوير μCT مرهونموثوق بها وكاملة ملء الأوعية. في هذا البروتوكول، وصفنا أسلوبا لملء الأوعية التاجية الماوس في التحضير لتصوير μCT.
وجود اثنين من التقنيات السائد لملء الأوعية الدموية في الشريان التاجي: في الجسم الحي عن طريق نضح إقناء؛ إدخال القنية ورجعية من الشريان الأبهر (أو فرع قبالة قوس الأبهر) 12-14، أو المجراة سابقا عن طريق نظام نضح Langendorff 15-17. هنا نحن تصف في الشريان الأورطي فيفو طريقة إقناء؛ إدخال القنية التي تم تصميمها خصيصا لضمان ملء جميع السفن. نستخدم ظليل للأشعة منخفضة اللزوجة مركب يسمى Microfil التي يمكن أن يروي من خلال أصغر السفن لملء جميع الشعيرات الدموية، وكذلك كلا الجانبين الشرياني والوريدي في شبكة الأوعية الدموية. وperfused السفن مع العازلة باستخدام نظام نضح الضغط، وشغل بعد ذلك مع Microfil. للتأكد من أن Microfil يملأ المراكب الصغيرة أعلى مقاومة، ونحن ligate فروع كبيرة emanatinز من الشريان الأورطي، والذي يحول Microfil في الشرايين التاجية. تعبئة مرة واحدة كاملة، لمنع طبيعة مرونة من أنسجة القلب من الضغط Microfil من بعض السفن، ونحن ligate الوصول الرئيسية مخارج الأوعية الدموية فورا بعد ملء. ولذلك، تم تحسين تقنية لدينا ملء كاملة والاحتفاظ بها إلى أقصى حد من وكيل تعبئة، مما يتيح تصور للشبكة كاملة الأوعية الدموية التاجية - الشرايين، والشعيرات الدموية، والأوردة على حد سواء.
Protocol
1. الاستعدادات قبل انطلاق
- ملء كل جانب من الضغط جهاز نضح مع عازلة عائي (4mg / L الببافرين + 1G / L الأدينوساين في برنامج تلفزيوني)، أو لامتصاص العرق 4٪ (منهاج العمل) في برنامج تلفزيوني، على التوالي.
- تحضير حقنة الأنسولين 1/2cc (مع 29G تعلق بشكل دائم ½ "إبرة) عن طريق ملئه مع 0.1 مل من 1:100 الهيبارين (5000U/ml الأوراق المالية)، والانحناء الإبرة إلى زاوية ~ 120 درجة مع شطبة تصل. هل نفسه مع حقنة 1 مل (بإبرة 26G "½) مليئة 0.3 مل بوكل حل المشبعة.
2. كشف القلب والشريان الأورطي cannulating
- تخدير الماوس باستخدام مخدر لكم الاختيار. (ونحن نستخدم جرعة زائدة من خليط الكيتامين / زيلازين: حقن IP من الكيتامين مغ / كغ 130 و 8.8 ملغم / كغم من زيلازين في المياه المالحة)
- دبوس الماوس تخدير على علبة تشريح، بطني حتى الجانب. فتح تجويف البطن مع شق خط الوسط وسحب الجلدللكشف عن الأجهزة. تحرك الأمعاء إلى جانب واحد لفضح منطقة من الوريد الأجوف الخلفي (PVC).
- حقن محلول الهيبارين في بولي كلوريد الفينيل. كما يمكنك استخراج إبرة، تغطية ثقب إبرة مع قضيب من القطن ذات الرؤوس لمنع تسرب وأنه عقد لبضع ثوان حتى جلطات جدار بولي كلوريد الفينيل والأختام. الانتظار 2-3 دقائق للهيبارين لتفريق طوال الدورة الدموية الماوس.
- تشريح الحجاب الحاجز والقفص الصدري حتى تتمكن من مراقبة قلب ينبض. حقن ببطء بوكل حل في PVC حتى الاعتقالات القلب.
- إزالة جميع الأجهزة أسفل الحجاب الحاجز واستئصال جزء الخلفي من الماوس، وترك المنطقة الأمامية من الحجاب الحاجز سليمة. إزالة الحجاب الحاجز، والحرص على لقطع البلاستيك بالقرب من الحجاب الحاجز وبالتالي فإن الجزء القريب إلى القلب من السهل تحديد موقع في الخطوات اللاحقة.
- تحديد نهاية قطع من الشريان الأورطي. مكان واحد طول فترة طويلة من 6-0 خياطة الحرير مضفر تحت الشريان الأورطي بضعة ملليمترات الأمامي جيئة وذهابام نهاية القطع بحيث يتم مضاعفة خياطة مرة أخرى على نفسه. قطع هذا يعد خياطة في النصف حتى أن هناك 2 قطعة من الخيط تحت الشريان الأورطي. إدراج angiocatheter في نهاية قطع من الشريان الأبهر (الشكل 1A، B) وربط كل الخيوط مع عقدة مزدوجة لعقد angiocatheter في مكان ومنع أي خلفية الضغط داخل الشريان الأورطي من تسرب.
3. نضح وحقن Microfil
- ربط angiocatheter لضغوط جهاز نضح (الشكل رقم 2) والبدء في perfusing الأوعية العازلة مع عائي (الشكل 1C) عن طريق ضخ جهاز نضح لضغط القيادة من 100-110 مم زئبق. مضاعفة التحقق من أن المخزن المؤقت perfusing من خلال الشرايين التاجية عن طريق ضمان وسائل الخروج من PVC. تواصل يروي ما لا يقل عن 3 دقائق أو حتى السائل الخروج من PVC واضح. (متابعة الخطوات المقبلة في حين perfusing.)
- تشريح الأضلاع والظهر دبوس (أو إزالة) القفص الصدري لكشف القلب. تعرض مرة واحدة، يكون كاليفورنياreful عدم السماح للقلب تجف من خلال الضغط على قطرات من عازلة على القلب من قطعة عازلة غارقة من الشاش. ازالة الغدة الصعترية لفضح قوس الأبهر. Ligate على ثلاثة فروع رئيسية الأورطي باستخدام 6-0 خياطة الحرير مضفر لضمان السوائل يتم تحويل عن طريق الشرايين التاجية وليس من خلال هذه أكبر والأوعية مقاومة منخفضة (الشكل 1D).
- يروي القلب مع مثبت لمدة 15 دقيقة، ثم شطف مع توسع الأوعية العازلة ما لا يقل عن 2 دقيقة. وفي الوقت نفسه، على حد سواء الأمامية ligate الوريد الأجوف لمنع Microfil من تسرب للقلب بعد حقن (الشكل 1E). مكان الغرز حول بولي كلوريد الفينيل والشريان الأورطي ولكن لا تشديد لهم حتى بعد تعبئة.
- إعداد Microfil (كما هو محدد في جدول الكواشف) وتحميله في حقنة 1 مل. ملء علبة تشريح مع ما يكفي من المياه لتغطية القسطرة (وذلك لمنع دخول من فقاعات الهواء عند التبديل من أنابيب التروية إلى الحقنة Microfil). قطع وكالة اسوشييتد برس نضحparatus من القسطرة وتوصيل حقنة Microfil المعدة.
- حقن Microfil في الشريان الأورطي حتى شغل جيد من الشرايين التاجية هو واضح (التين 1F، 3A): الشرايين ستملأ أولا، ثم في Microfil سوف "سفك" في الشعيرات الدموية كما الإحمرار النسيج مع لون Microfil. مرة واحدة على الجانب الوريدي، وطبيعة مسعور من Microfil يسبب أن يظهر في البداية على المجالات مستقل لأنه يخرج من السفن الصغيرة. تواصل ضخ Microfil حتى عمود المستمر يملأ الأوردة. وسوف ملء كامل يكون واضحا عندما Microfil مستمر داخل الأوعية، وأنها تخرج عن طريق خ.
- بعد تعبئة كاملة، وسرعان ما شد الخيوط التي وضعت سابقا حول بولي كلوريد الفينيل والشريان الأورطي إلى منع الطبيعة المرنة للأنسجة القلب من الضغط على Microfil من السفن.
- تغطية القلب مع الشاش الرطب (ينقع بالماء من علبة تشريح) لمنع تجفيف للخروج، والسماح لها الجلوس لمدة ما يقرب من 1 ساعة في درجة حرارة الغرفة حتى Microfil وبلمرة. تجنب أي ضغوط خارجية على القلب خلال عملية البلمرة، مثل رفع أو تحول القلب في محاولة للحصول على وجهة نظر في وقت مبكر من السفن شغلها في الجزء الخلفي من القلب. قد يكون هذا الضغط Microfil من بعض السفن الى منطقة أكثر مرونة من القلب، مما تسبب في كسر في Microfil.
- إزالة القلب ومرحلة ما بعد اصلاحها في PFA 4٪ بين عشية وضحاها في 4 درجات مئوية. ثم تخزين في الايثانول 70٪ في 4 درجة مئوية. والأوعية الدموية في القلب هو الآن على استعداد لتصوير μCT.
4. ممثل النتائج
والسفن التي perfused بشكل فعال من قبل Microfil لها مستمرة، غير منقطعة طوال Microfil السفن (الشكل 3A). ويمكن الحكم على مدى ملء الأوعية التاجية بواسطة العين؛ تقع epicardially عروق 18 عاما، ويمكن ملاحظتها بسهولة (الشكل 3A، رأس السهم)؛ الشرايين،والتي هي أكثر intramyocardial 18، واضحة أيضا من خلال سطح القلب (الشكل 3A، السهم). شغل شعري واضح أيضا، وأنسجة القلب لديها كثافة عالية جدا من الشعيرات الدموية، وبالتالي، عندما التعبئة الشعيرات الدموية، والأنسجة القلبية والاحمرار مع لون Microfil (الشكل 3A، نجمة). وبالتالي، فإن أي شبكات الأوعية الدموية التي فشلت في ملء يكون ملحوظا نظرا لعدم وجود Microfil (الشكل 3B، C).
انقطاعات في Microfil (العلامات النجمية في الشكل 3B) غالبا ما تظهر بسبب طبيعة مسعور من Microfil سيجعلها العقد إلى نفسه وتسبب في "فواصل" داخل الأوعية شغلها. ويمكن تخفيض هذه "الراحة" في حال المحافظة على الضغط داخل الأوعية الدموية من خلال السليم التعادل العرضية لنقاط الخروج الأوعية الدموية من القلب. يمكن أن يكون سبب الانقطاع غيرها من فقاعات الهواء داخل microfil. لمنع دخول الهواء وتأكد الغارقة تماما angiocatheter في الماء عند التبديل من وكالة اسوشييتد برس نضح paratus إلى الحقنة Microfil. إذا تم إدخال أية فقاعة هواء، ويمكن في كثير من الأحيان يمكن إزالته ببساطة من خلال الاستمرار في نضح Microfil حتى يتم دفع الفقاعة من خلال والخروج من الأوعية التاجية.
قد شبكات الأوعية الدموية لا تملأ تماما إذا تم حظر جزء من السرير الوعائي (الشكل 3B، السهم). بينما الهيبارين يحول دون تشكيل جلطات الدم، قد انسداد في بعض الأحيان لا تزال تحدث بسبب التروية الهيبارين غير مكتملة قبل بدء هذا الإجراء، أو بسبب عوامل أخرى غير معروفة. إذا انسداد يحدث، لا يوجد، على حد علمنا، لا توجد طريقة لطرد انسداد لاستكمال ملء الأوعية الدموية. ويمكن ملء ناقصة تؤدي أيضا إذا تم استخدام الضغط قليلا جدا أثناء التعبئة، كما لن Microfil يضطر إلى أسرة على جميع الأوعية الدموية والشبكات الشعرية (الشكل 3C). على العكس، يمكن أن يسبب الكثير من الضغط على الشعيرات الدموية إلى انفجار ويتسرب Microfil في الأنسجة المحيطة بها (الشكل 3D).
files/ftp_upload/3740/3740fig1.jpg "ALT =" الشكل 1 "/>
الشكل 1. نظرة عامة على خطة نضح Microfil. (أ) قطع الشريان الأورطي، وبولي كلوريد الفينيل وعلى مستوى ما يقرب من الحجاب الحاجز. (ب) ومقنى الشريان الأبهر الصاعد مع angiocatheter. (ج) perfused العازلة توسع الأوعية عن طريق السفن، مدفوعا ضغط جهاز نضح (وليس في الصورة)، في حين أن (D) و تربط الفروع الرئيسية الثلاثة قبالة قوس الأبهر. (ه) perfused PFA 4٪ عن طريق الشرايين التاجية في حين و تربط كلا الأمامي CAVAS الوريد. (F) عن طريق حقنة، وperfused Microfil من خلال الشرايين التاجية حتى لوحظ أن تخرج من PVC.
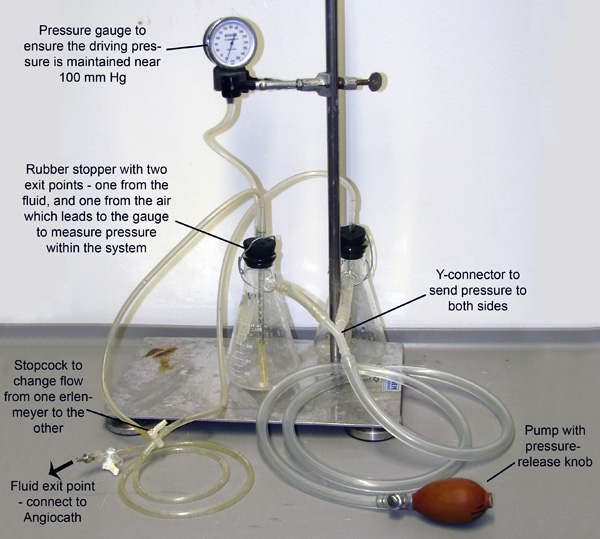
الشكل 2. جهاز نضح. وانضم اثنان من قوارير مخروطي، كل مليئة العازلة توسع الأوعية أو 4٪ PFA، وضغط من خلال أنابيب متصلة جنبيه الخاصة بهم. هذا النظام هو الضغط من خلال ضخ دليل لليرتبط بصلة، ومقياس الضغط إلى واحد من قوارير للسماح للمراقبة والمحافظة على ضغط. تمديد أنابيب صغيرة من خلال سدادات المطاط ونزولا الى السائل في كل دورق. الضغط الدخول من مضخات جنبيه السائل من كل قارورة من هذه الأنابيب الصغيرة. أنابيب ثم دمج في محبس والذي يسمح فقط لتدفق السوائل من قارورة في وقت واحد.
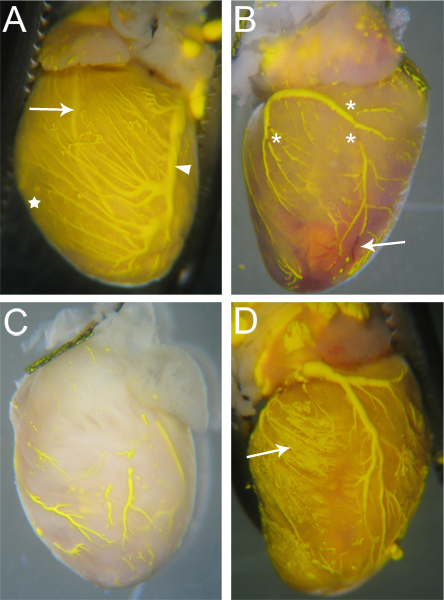
الشكل 3. عينة قلوب Microfilled. (أ) أن السفن التي يتم تعبئتها بشكل جيد لديها قليل (إن وجد) فواصل في Microfil، وأنسجة القلب ستكون مشوبة لون Microfil بسبب الشعيرات الدموية شغل (نجم، ومقارنة مع C). كلا الشرايين (السهم - اليسار تنازلي الشريان الأمامي) والأوردة (رأس السهم - الوريد التاجي الأيسر) واضحة من خلال سطح القلب. (ب) وقلب مع فواصل في microfil (النجمة)، فضلا عن انسداد في بعض الأوعية التي منعت هيئة التصنيع العسكري الكاملrofil الاختراق. منعت السفن لا تزال حمراء (السهم)، كما لم يتم مسح الدم من خلال عملية نضح. (ج) وقلب مع السفن التي تم شغلها بشكل غير كامل. لاحظ النسيج لم تتخذ على اللون الأصفر للMicrofil، مما يدل على Microfil لم تخترق الشعيرات الدموية. (د) حيث قلب انفجار الشعيرات الدموية أثناء التعبئة، مما تسبب في Microfil إلى تسرب الى الأنسجة المحيطة بها (السهم).
Discussion
أنسجة القلب لديه الطلب مرتفع جدا الأيضية، ولذلك يحتاج الى امدادات ثابتة من المواد المغذية والأكسجين من الدم الذي ألقاه الأوعية الدموية التاجية. يمكن أن أمراض الأوعية التاجية، والتي تقلل وظيفة القلب بسبب تضيق وانسداد الأوعية، يؤدي إلى نقص الأكسجين ونقص تروية الأنسج...
Disclosures
وقد تم التعامل مع الفئران مع الأساليب التي وافق عليها رعاية الحيوانات المؤسسية واللجنة الاستفادة من جامعة واشنطن وفقا لدليل لرعاية واستخدام الحيوانات المخبرية الصادرة عن المعاهد الوطنية الأميركية للصحة (المعاهد الوطنية للصحة المنشور رقم 85-23، تنقيح عام 1996).
Acknowledgements
نشكر الدكتور كيلي ستيفنز للمحاكمات الأولى للبروتوكول، والدكتور مايكل سيمونز، والدكتور Hauch كيب، وأعضاء من كل من المختبرات من أجل مناقشة عامة.
هذا العمل هو الدعم من خلال المنح والمعاهد الوطنية للصحة HL087513 HL094374 P01.
Materials
| Name | Company | Catalog Number | Comments |
| اسم كاشف | شركة | فهرس العدد | تعليقات |
| 1 مل الحقن | بيكتون ديكنسون | BD-309602 | |
| محاقن الأنسولين 1/2cc مع الإبر ونصف 29G تعلق بشكل دائم " | بيكتون ديكنسون | BD-309306 | |
| 2 "س 2" منصات شاش | Med101store.com | SKU 2208 | |
| 24G ¾ "قسطرة Angiocath الرابع | بيكتون ديكنسون | BD-381112 | |
| 26G ½ الإبر مقياس " | ضامر "> بيكتون ديكنسون | BD-305111 | |
| الأدينوساين | سيغما | A9251 | 1G / لتر في برنامج تلفزيوني عن توسع الأوعية العازلة (مع الببافرين) |
| الملقط غريف الزاوية | أدوات العلم غرامة | 11052-10 | |
| القطن ذات الرؤوس تطبيقها: 6 "غير معقمة | الكاردينال الصحة | C15055-006 | |
| مقص جراحي المنحنية | أدوات العلم غرامة | 14085-09 | |
| تشريح المجسام ومصدر للضوء | نيكون | NA | NA |
| تشريح صينية، 11.5 × 7.5 بوصة | كول، Parmer | يو 10915-12 | مليئة القطران ليعلق أسفل الماوس |
| منحني الملقط غرامة | Aesculap | FD281R | تحتاج 2 |
| الهيبارين، 5000 يو / مل الأوراق المالية | APP الصيدلة ذ م م | NDC 63323-047-10 | 1:100 التخفيف في المياه |
| بوكل | الصياد | P217 | مشبع حل في H2O |
| Ketamin (Ketaset)، و 100 ملغ / مل الأوراق المالية | فورت دودج، أوفرلاند بارك، كانساس، الولايات المتحدة الأمريكية | NDC 0856-2013-01 | كما يخلط 130 وزن الجسم مغ / كغ، مع زيلازين في 0.9٪ قألين |
| Microfil | تدفق التقنية | MV-122 (الصفراء). خيارات الألوان الأخرى وتتوفر أيضا. | خلط 1:1 من حيث الوزن، مع 10٪ من حجم وكيل المعالجة. إعداد قبل الحقن، ودوامة لضمان أنها مختلطة بشكل جيد |
| غير معقمة خياطة: 6-0، مضفر الحرير | هارفارد جهاز | 723287 | |
| بابافيرين | شركة أمريكية ريجنت | NDC 0517-4010-01 | 4mg / لتر في برنامج تلفزيوني عن توسع الأوعية العازلة (مع الادينوساين) |
| بارافورمالدهيد | سيغما | P6148 | كما أعدت حل 4٪ |
| جهاز نضح | انظر الشكل 2 | ||
| ربيع مقص | أدوات العلم غرامة | 15018-10 | |
| زيلازين (Anased)، و 20 ملغ / GL الأوراق المالية | لويد مختبرات | ندى # 139-236 | كما خلط 8،8 من وزن الجسم مغ / كغ، مع Ketamin في المياه المالحة 0.9٪ |
References
- Couffinhal, T., Dufourcq, P., Barandon, L., Leroux, L., Duplaa, C. Mouse models to study angiogenesis in the context of cardiovascular diseases. Front. Biosci. 14, 3310-3325 (2009).
- Zagorchev, L., Mulligan-Kehoe, M. J. Molecular imaging of vessels in mouse models of disease. Eur. J. Radiol. 70, 305-311 (2009).
- Krucker, T., Lang, A., Meyer, E. P. New polyurethane-based material for vascular corrosion casting with improved physical and imaging characteristics. Microsc. Res. Tech. 69, 138-147 (2006).
- Murakami, T. Blood flow patterns in the rat pancreas: a simulative demonstration by injection replication and scanning electron microscopy. Microsc. Res. Tech. 37, 497-508 (1997).
- Icardo, J. M., Colvee, E. Origin and course of the coronary arteries in normal mice and in iv/iv mice. J. Anat. 199, 473-482 (2001).
- Beighley, P. E., Thomas, P. J., Jorgensen, S. M., Ritman, E. L. 3D architecture of myocardial microcirculation in intact rat heart: a study with micro-CT. Adv. Exp. Med. Biol. 430, 165-175 (1997).
- Bentley, M. D., Ortiz, M. C., Ritman, E. L., Romero, J. C. The use of microcomputed tomography to study microvasculature in small rodents. Am. J. Physiol. Regul. Integr. Comp. Physiol. 282, R1267-R1279 (2002).
- Jorgensen, S. M., Demirkaya, O., Ritman, E. L. Three-dimensional imaging of vasculature and parenchyma in intact rodent organs with X-ray micro-CT. Am. J. Physiol. 275, H1103-H1114 (1998).
- Marxen, M. MicroCT scanner performance and considerations for vascular specimen imaging. Med. Phys. 31, 305-313 (2004).
- Zagorchev, L. Micro computed tomography for vascular exploration. J. Angiogenes. Res. 2, 7-7 (2010).
- Heinzer, S. Hierarchical microimaging for multiscale analysis of large vascular networks. Neuroimage. 32, 626-636 (2006).
- Dedkov, E. I. Synectin/syndecan-4 regulate coronary arteriolar growth during development. Dev. Dyn. 236, 2004-2010 (2007).
- Gossl, M. Functional anatomy and hemodynamic characteristics of vasa vasorum in the walls of porcine coronary arteries. Anat. Rec. A. Discov. Mol. Cell. Evol. Biol. 272, 526-537 (2003).
- Rodriguez-Porcel, M. Altered myocardial microvascular 3D architecture in experimental hypercholesterolemia. Circulation. 102, 2028-2030 (2000).
- Bell, R. M., Mocanu, M. M., Yellon, D. M. Retrograde heart perfusion: The Langendorff technique of isolated heart perfusion. J. Mol. Cell. Cardiol. 50, 940-950 (2011).
- Skrzypiec-Spring, M., Grotthus, B., Szelag, A., Schulz, R. Isolated heart perfusion according to Langendorff---still viable in the new millennium. J. Pharmacol. Toxicol. Methods. 55, 113-126 (2007).
- Toyota, E. Vascular endothelial growth factor is required for coronary collateral growth in the rat. Circulation. 112, 2108-2113 (2005).
- Lavine, K. J., Long, F., Choi, K., Smith, C., Ornitz, D. M. Hedgehog signaling to distinct cell types differentially regulates coronary artery and vein development. Development. 135, 3161-3171 (2008).
- Cheema, A. N. Adventitial microvessel formation after coronary stenting and the effects of SU11218, a tyrosine kinase inhibitor. J. Am. Coll. Cardiol. 47, 1067-1075 (2006).
- Lametschwandtner, A., Lametschwandtner, U., Weiger, T. Scanning electron microscopy of vascular corrosion casts--technique and applications: updated review. Scanning Microsc. 4, 889-941 (1990).
- Schneider, P. Simultaneous 3D visualization and quantification of murine bone and bone vasculature using micro-computed tomography and vascular replica. Microsc. Res. Tech. 72, 690-701 (2009).
- Manelli, A., Sangiorgi, S., Binaghi, E., Raspanti, M. 3D analysis of SEM images of corrosion casting using adaptive stereo matching. Microscopy Research and Technique. 70, 350-354 (2007).
- Alanentalo, T. Tomographic molecular imaging and 3D quantification within adult mouse organs. Nat. Meth. 4, 31-33 (2007).
- Quintana, L., Sharpe, J. . Optical projection tomography of vertebrate embryo development. , 586-594 (2011).
- Walls, J. R., Coultas, L., Rossant, J., Henkelman, R. M. Three-Dimensional Analysis of Vascular Development in the Mouse Embryo. PLoS ONE. 3, e2853-e2853 (2008).
- Chalothorn, D., Clayton, J. A., Zhang, H., Pomp, D., Faber, J. E. Collateral density, remodeling, and VEGF-A expression differ widely between mouse strains. Physiol. Genomics. 30, 179-191 (2007).
- Behm, C. Z. Molecular Imaging of Endothelial Vascular Cell Adhesion Molecule-1 Expression and Inflammatory Cell Recruitment During Vasculogenesis and Ischemia-Mediated Arteriogenesis. Circulation. 117, 2902-2911 (2008).
- Carr, C. L., Lindner, J. R. Myocardial perfusion imaging with contrast echocardiography. Curr. Cardiol. Rep. 10, 233-239 (2008).
- Leong-Poi, H. Assessment of Endogenous and Therapeutic Arteriogenesis by Contrast Ultrasound Molecular Imaging of Integrin Expression. Circulation. 111, 3248-3254 (2005).
- Villanueva, F. S. Microbubbles Targeted to Intercellular Adhesion Molecule-1 Bind to Activated Coronary Artery Endothelial Cells. Circulation. 98, 1-5 (1998).
- Wei, K. Quantification of Myocardial Blood Flow With Ultrasound-Induced Destruction of Microbubbles Administered as a Constant Venous Infusion. Circulation. 97, 473-483 (1998).
- Beckmann, N., Stirnimann, R., Bochelen, D. High-Resolution Magnetic Resonance Angiography of the Mouse Brain: Application to Murine Focal Cerebral Ischemia Models. Journal of Magnetic Resonance. 140, 442-450 (1999).
- Kobayashi, H. 3D MR angiography of intratumoral vasculature using a novel macromolecular MR contrast agent. Magnetic Resonance in Medicine. 46, 579-585 (2001).
- Nezafat, R. B1-insensitive T2 preparation for improved coronary magnetic resonance angiography at 3 T. Magn. Reson. Med. 55, 858-864 (2006).
- Wagner, S., Helisch, A., Ziegelhoeffer, T., Bachmann, G., Schaper, W. Magnetic resonance angiography of collateral vessels in a murine femoral artery ligation model. NMR in Biomedicine. 17, 21-27 (2004).
- Cochet, H. In vivo MR angiography and velocity measurement in mice coronary arteries at 9.4 T: assessment of coronary flow velocity reserve. Radiology. , 254-441 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved