A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
الفئران نموذج من الربو المستحثة مسببات الحساسية
In This Article
Summary
نماذج الماوس التجريبية من الربو التحسسي تتيح إمكانات جديدة لدراسة مرض المرضية وتطوير علاجات جديدة. وتلائم هذه النماذج لقياس العوامل التي تحكم استجابة حساسية المناعة، والتهاب الشعب الهوائية، والفيزيولوجيا المرضية رئوي.
Abstract
الربو هو سبب رئيسي للمرض والوفاة، مما يؤثر على نحو 300 مليون شخص في جميع أنحاء العالم. 1 اكثر من 8٪ من سكان الولايات المتحدة مصاب بالربو، مع الانتشار المتزايد. 2 كما هو الحال مع غيرها من الأمراض، النماذج الحيوانية من مرض حساسية مجرى الهواء إلى حد كبير تسهيل فهم الفيزيولوجيا المرضية الكامنة، وتساعد في تحديد الأهداف العلاجية المحتملة، والسماح للاختبار قبل السريرية لعلاجات جديدة محتملة. وقد وضعت نماذج من مرض حساسية الشعب الهوائية في عدة أنواع من الحيوانات، ولكن نماذج الفئران هي جاذبية خاصة نظرا لانخفاض التكلفة وسهولة، والجهاز المناعي جيدا تتميز هذه الحيوانات. 3 توفر مجموعة متنوعة من السلالات المعدلة وراثيا يزيد من جاذبية من هذه النماذج. 4 ونحن هنا وصف نموذجين من الفئران مرض حساسية الشعب الهوائية، على حد سواء كما ovalbumin توظيف للمستضد. بعد توعية الأولية عن طريق الحقن داخل الصفاق، نموذج واحد delivالمتطلبات البيئية التحدي مستضد بالإرذاذ، والآخر عن طريق التسليم داخل الرغامى. ويقدم هذان الجهازان المزايا التكاملية، مع كل محاكاة السمات الرئيسية لمرض الربو الإنسان. 5
السمات الرئيسية لمرض الربو الحاد وتشمل استجابة مجرى الهواء مبالغ فيه للمنبهات مثل methacholine (مجرى الهواء فرط الاستجابة؛ AHR) ويوزينية الغنية التهاب الشعب الهوائية. وهذه هي أيضا آثار بارزة من التحدي حساسية في نماذجنا الفئران، 5،6 وصفنا لهم تقنيات لقياس وتقييم وبالتالي آثار التلاعب التجريبية. على وجه التحديد، وصفنا على حد سواء الغازية وغير الغازية 7-8 تقنيات لقياس فرط الاستجابة مجرى الهواء، فضلا عن أساليب تقييم تسلل من الخلايا الالتهابية في الشعب الهوائية والرئة. يتم جمع خلايا الشعب الهوائية التهاب القصبات بواسطة غسيل بينما يستخدم الرئة التشريح المرضي لتقييم علامات على وجود التهاب في جميع أنحاء الجهاز. هؤلاءتقنيات توفر أدوات قوية لدراسة مرض الربو في السبل التي لن يكون من الممكن في البشر.
Protocol
أولا توعية مسببات الحساسية والتحدي (انظر الشكل 1)
أ للحصول على التحدي داخل الرغامى
- لتوعية الأولية، حقن C57BL ذكرا أو أنثى / 6 أو BALB / ج الفئران (6-8 أسابيع من العمر) intraperitoneally في اليوم 0 ومرة أخرى في يوم 7 مع 20 ميكروغرام من ovalbumin (OVA؛ سيغما الدريخ، وسانت لويس، MO) مستحلب في 0.2 مل من الفوسفات معقم مخزنة المالحة (PBS) التي تحتوي على 2 ملغ من هيدروكسيد الألومنيوم (سيغما الدريخ) أو. مع 2 ملغ هيدروكسيد الألومنيوم في 0.2 مل من برنامج تلفزيوني العقيمة والسيطرة
- التحدي مع المستضد بالشكل المناسب (على سبيل المثال، في أيام 14 و 16 و 18 و 20). الإجراء التحدي التالي.
- تخدير الفأر مع حقنة (IP) داخل الصفاق من خليط من الكيتامين (90 ملغ / كلغ)، وزيلازين (10 ملغ / كلغ). ضمان الفأر هو تخدير كامل مدة لا تقل عن 10 دقيقة.
- زاوية سطح العملية على 45 درجة أو أكثر. الماوس مكان على سطح هذا الجانب حفظ بطني إلى أعلى ورأسه إلى أعلى.
- تي هوكhread تحت القواطع الأمامية لعقد رئيس الوراء. مستوى الكفوف مع بعضها البعض لضمان القصبة الهوائية هو مستقيم واستخدام شريط التسمية لعقد الساقين. نقع موقع الجراحية مع EtOH 70٪، ومسحة.
- تطبق bupivicaine (0.1 إلى 0.2 مل من محلول 0.25٪) موضعيا في موقع شق.
- ارتشف الجلد في الحلق مع ملقط والجذب نحو الخارج بلطف. جعل شق صغير عمودي مع مقص جراحي. تقليل حجم من شق.
- تحضير حقنة 1 مل مع 50 ميكرولتر من برنامج تلفزيوني أو OVA 0.1٪ في برنامج تلفزيوني وأدخله في ماصة المتكررة (Tridak السائر، تورينغتون، ط م). أخذ ماصة في يد واحدة واستخدام أخرى لعقد النسيج الخلفي مع ملاقط وفضح القصبة الهوائية.
- عقد المحقنة كما موازية للالقصبة الهوائية ممكن، من خلال ادخال ابرة جدار القصبة الهوائية وحقن الحل.
- الحفاظ على الماوس في حقن اتجاه عمودي التالية لإتاحة الوقت لإيجاد حل لتسوية في الرئتين.
- بلطف وثيق مع sterilely منطقة الجرحملاقط وختم مع خياطة.
- الماوس مكان القص إلى أسفل على وسادة التدفئة والسماح له لاسترداد حتى الإسعافية تماما. بعد الانتعاش، وعودة الماوس لهذا الحيوان للرعاية ومراقبة ذلك يوميا لعلامات تورم مصلي، التهاب أو عدوى، وتفزر الجرح حتى يلتئم الجرح تماما.
ب. للحصول على تحدي بالإرذاذ
- توعية الفئران في اليوم 0 عن طريق الحقن داخل الصفاق من 20 ميكروغرام من OVA (سيغما الدريخ) مستحلب في 0.2 مل من برنامج تلفزيوني العقيمة التي تحتوي على 2 ملغ من هيدروكسيد الألومنيوم (سيغما الدريخ) أو مع 2 ملغ هيدروكسيد الألومنيوم في 0.2 مل من برنامج تلفزيوني العقيمة والسيطرة .
- في اليوم 14، وتعزيز التوعية عن طريق الحقن الملكية الفكرية على النحو المبين أعلاه.
- في يوم 21، 22، 23، ال 24 و ال 25 بعد الأولي للتوعية، والفئران التحدي من خلال التعرض لمدة 30 دقيقة إلى مرذذ OVA 1٪ أو برنامج تلفزيوني وحدها تسليمها عن طريق البخاخات بالموجات فوق الصوتية (Buxco بحوث النظم، Wilmington، NC).
- الفئران مكان في الغرفة الرئيسية للWBP؛ التأقلم منهم داخل غرفة تخطيط التحجم مدة لا تقل عن 10 دقيقة.
- مكان 1 مل من OVA 0.1٪ في برنامج تلفزيوني العقيمة أو برنامج تلفزيوني العقيمة وحدها، كما هو موضح في الخطوات 4-6 أدناه، من خلال كأس البخاخات. Nebulize لمدة 30 دقيقة.
- إزالة غموض الكأس وتجاهل أي حل المتبقية.
- لا يمكن أن يؤديها إرذاذ على جميع الفئران في وقت واحد باستخدام غرفة إرذاذ.
II. تقرير من فرط الاستجابة لمجرى الهواء Methacholine
أ قياس نونينفاسيفي من فرط الاستجابة مجرى الهواء بواسطة كامل الجسم تخطيط التحجم (WBP؛ Buxco بحوث النظم، ويلمنجتون، NC)
- السماح للزجاجة methacholine مسحوق لتسخين إلى درجة حرارة الغرفة قبل فتح (methacholine هو استرطابي للغاية، وسوف تشكل كتل عديمة الفائدة إذا ما سمح لامتصاص الماء). إعداد 200 ملغ / مل حل الأوراق المالية في برنامج تلفزيوني العقيمة، ثم جعل المسلسل 2-أضعاف التخفيفات (على سبيل المثال، 100، 50، 25، 12.5 و 60.25 ملغ / مل). تبقى الحلول الباردة.
- إعداد المعدات على النحو التالي: ربط مدخل الرئيسي للWBP إلى البخاخات، والتحيز للتدفق مدخل إلى مضخة الهواء، وWBP منفذ إلى فخ باستخدام غاز ضيقة أنابيب مطاطية. نعلق محول الضغط على سد المنافذ من الغرف الرئيسية والمرجعية لWBP. ربط محول الضغط على المضخم مع الكابلات المقدمة، وربط المضخم إلى جهاز الكمبيوتر باستخدام بيانات محددة اقتناء بطاقة.
- معايرة المضخم استخدام البرنامج وفقا لتوصيات الشركة الصانعة.
- الفئران مكان في الغرفة الرئيسية للWBP؛ التأقلم منهم داخل غرفة تخطيط التحجم مدة لا تقل عن 10 دقيقة، ثم قراءات أساسية سجل (Penhbase) لمدة 3 دقائق.
- مكان 1 مل من برنامج تلفزيوني العقيمة في كأس البخاخات. Nebulize لمدة 2 دقيقة ثم مراقبة المتغيرات في الجهاز التنفسي للحصول على حد أدنى 6 إضافية خلال مرحلة التجفيف. إزالة غموض الكأس وتجاهل أي برنامج تلفزيوني المتبقية.
- مكان 1 مل من methacholine ملغ / مل 6،25 في كأس البخاخات وصEPEAT إرذاذ لمدة 2 دقيقة، بالإضافة إلى دورة الرصد 6 دقيقة.
- كرر قياس مع 12.5 و 50 و 25 و 100 ملغ / مل methacholine، باستخدام نفس الفترة إرذاذ 2 دقيقة و 6 دقائق دورة الرصد.
- إزالة الفئران من الدوائر وإعادتها إلى أقفاصها.
- عبوة البخاخات كوب مع 1 مل من برنامج تلفزيوني العقيمة وتشغيل آخر تسلسل تدفق الأنبوب.
- إيقاف تدفق الهواء، وتفكيك، والقضاء تنظيف جميع الغرف قبل تشغيل مجموعة ثانية من الحيوانات.
B. القياس الغازية من الاستجابة مجرى الهواء بواسطة الكمبيوتر التي تسيطر عليها جهاز التهوية (flexiVent؛ SCIREQ شركة، مونتريال، كندا)
- وزن الماوس وتخدير عن طريق الحقن (IP) داخل الصفاق من 60 ملغ لكل كيلوغرام هيئة الصوديوم الوزن بنتوباربيتال.
- بعد موقف مناسب، تخدير الفئران ventro-ظهريا لفتح القصبة الهوائية.
- تطهير جلد الرقبة مع الايثانول 70٪. تطبق bupivicaine (0.1 إلى 0.2 مل من محلول 0.25٪) موضعيا في أناncision موقع. شق وفتح جلد الرقبة. فصل عضلات الرقبة وفضح القصبة الهوائية.
- تقدم 1 - 2 ملم شق في القصبة الهوائية مع مقص غرامة (أن تكون على يقين بعدم قطع القصبة الهوائية)، وإدراج أنبوب القصبة الهوائية بحذر. ادراك التعادل خياطة حول القصبة الهوائية لمنع تسرب الهواء.
- وضع الماوس في الجسم غرفة مخطاط التحجم وتوصيل أنبوب القصبة الهوائية تضاف إلى جهاز التنفس الصناعي.
- بدء التهوية الميكانيكية. مجموعة مناسبة معدل التنفس وحجم المد والجزر / السكتة الدماغية (150 السكتات الدماغية / دقيقة وميكرولتر 200، على التوالي للماوس 20 ز). مما لا شك فيه أن الصدر يتحرك في التزامن مع جهاز التنفس الصناعي. إذا كان الماوس هو "القتال" مع التنفس الصناعي (الذاتي التنفس)، وضخ مزيد من مخدر وانتظر التزامن.
- بعد قياسات خط الأساس، والحفاظ على الفئران تحت التهوية خط الأساس لآخر 3 دقيقة، ثم أخذ في الثانية 2 مجموعة من القياسات مقاومة. وتستخدم هذه الثانية 2 مجموعة من قياسات خط الأساس لأحسبulate القيم الأساسية يعني.
- تقديم برنامج تلفزيوني أو methacholine (صحة الأم والطفل) التحديات (6.25 و 12.5 و 25 و 50 و 100 ملغ / مل) من خلال توجيه تدفق الشهيق من جهاز التنفس الصناعي عن طريق البخاخات بالموجات فوق الصوتية.
- بعد كل تحد مع صحة الأم والطفل (6.25 و 12.5 و 25 و 50 و 100 ملغ / مل)، عودة المكبس إلى إلقاء فاتو من 10 مل / كغ في 120 الأنفاس / دقيقة وأخذ قياسات مقاومة.
ثالثا. قياس التسرب الخلوي في المجال الجوي
ألف يؤدون الشعبى غسيل (بال)
- بعد قياس AHR، الموت ببطء الفئران مع CO 2، ووضع كل فأر على ظهرها على لوحة العمليات الجراحية.
- نقع في المنطقة مع EtOH 70٪.
- تبدأ في أسفل البطن، وقطع فتح تجويف البطن وازالة الجلد / العلوي في العضلات، وتتحرك صعودا باتجاه الأضلاع.
- مرة واحدة في الأضلاع واضحة، واستخدام المقص لثقب بعناية الحجاب الحاجز. وينبغي أن تنهار الرئتين بعيدا عن الحجاب الحاجز. يكون كاليفورنيا خاصةreful ليس لنيك في الرئتين أو القلب.
- قطع القفص الصدري للكشف تماما عن الرئتين / قلب (تجنب قطع أي الأوعية الدموية الرئيسية للحفاظ على الدم من ملء الموقع).
- باستخدام حقنة 1 مل مع إبرة قياس 27 (دينار بحريني الحقن، فرانكلين البحيرات، ونيو جيرسي)، ثقب البطينين في القلب وببطء وبعناية سحب الحقنة لجمع الدم. أن تحرص على تجنب انهيار القلب.
- جمع المصل من هذا الدم باستخدام بروتوكول قياسي. متجر في -70 درجة مئوية حتى استخدامها.
- قطع الجلد والنسيج من الحلق حتى يتم كشف القصبة الهوائية. ازالة الانسجة كاف للعمل بسهولة في هذا المجال (ومرة أخرى، وتجنب قطع أي الأوعية الدموية الرئيسية).
- باستخدام مقص المنحني، وقطع القصبة الهوائية تحت لتمهيد الطريق.
- تمرير وجهة الملقط المنحني تحت القصبة الهوائية وفهم في نهاية قطعة من الخيط. رسم خيوط الجروح تحت القصبة الهوائية.
- ربط فضفاضة نصف عقدة حول القصبة الهوائية، وانخفاض في الحلق.
- Carefقطع ully الشق، وتكون كافية من حيث الحجم بالنسبة للقنية، وفوق خيوط الجروح.
- إدراج بعناية قنية في حفرة وأسفل القصبة الهوائية بعد نقطة من خيوط الجروح. اضغط بلطف إلى الأمام حتى قنية يظهر فقط عند مدخل إلى الرئتين (بعيدا جدا: ثقب الرئتين؛ قصيرة جدا: انهيار القصبة الهوائية عند محاولة استرداد BAL).
- شد خيوط الجروح وعقدة كاملة لاغلاق القصبة الهوائية حول قنية.
- قفل محقنة (التي تحتوي على 1 مل PBS) على قنية، ثم اضغط بلطف السائل في الرئة. وينبغي أن فصوص الرئة تضخم بشكل فردي ببطء. لا تبالغ في التعبئة. لكامل نمت مل 0،9-1،0 الماوس هو الحد الأقصى المطلق. قد 0.8 مل يكون أكثر أمانا. قفل حقنة فضفاضة لقنية، وإلا فإنه من المحتمل أن تسبب أضرارا عند محاولة فك الارتباط.
- سحب السوائل من الرئتين. إذا واجه مقاومة (النسيج الانزلاق الى قنية)، اضغط قنية مزيد ببطء في الرئة، واستئناف إزالة. حاول أيضا تناوب قنية في مكان. إذا كان كل ELSه فشل سحب الطريق جزء قنية، والقصبة الهوائية هي أكثر عرضة للانهيار في هذه القضية.
- فصل حقنة من قنية، ودائع BAL السائل في وعاء، وكرر 2 مرات مع حل برنامج تلفزيوني جديد.
- الحفاظ على حل BAL على الجليد حتى نسج أسفل.
- استخدم السائل BAL والمصل لقياس إيج OVA محددة باستخدام الماوس المتاحة تجاريا إيج إليسا مجموعات (MD المنتجات الاحيائية، وسانت بول، مينيسوتا).
ب عد الخلايا وتحديد فروق
- أجهزة الطرد المركزي في بال السائل 5 دقائق في ~ غ × 600، 4 درجات مئوية.
- Resuspend لبيليه في برنامج تلفزيوني خلية بلطف والحفاظ على الجليد.
- تحميل عدادة الكريات نويباور القياسية في تعليق خلية المخفف والاعتماد على الخلايا.
- إزالة aliquots من 2 × 10 4 خلايا في 10-40 حجم ميكرولتر لcytospins. تمييع الخلايا إذا لزم الأمر.
- لcytospins، خلط 2 × 10 4 خلايا و 130 برنامج تلفزيوني و 10 ميكرولتر FBS ميكرولتر. إضافة خليط كامل الخلية إلى دوبلو cytospin قمع الطرد المركزي و10 دقيقة في 700 دورة في الدقيقة، وذلك باستخدام cytoslides مزدوجة للعينات مكررة.
- السماح للشرائح حتى يجف في درجة حرارة الغرفة لمدة 1 ساعة قبل التلوين.
- وصمة عار على الشرائح باستخدام الفرق السريع وصمة عار (سيمنز، ونيوارك، DE).
رابعا. ممثل النتائج
الإفراط في انقباض الشعب الهوائية بعد المحفزات استفزازي هو سمة بارزة من سمات الربو السريرية. ونحن تصف طريقتين لقياس مثل فرط الاستجابة لمجرى الهواء لدى الفئران methacholine OVA-توعية وتحدى: كامل الجسم تخطيط التحجم (الشكل 2)، والتذبذب القسري باستخدام نظام flexiVent (الشكل 3). كلا طرق إثبات أن التوعية OVA والتحدي ينتج فرط الاستجابة مجرى الهواء لدى الفئران.
يوزينية الغنية التهاب الشعب الهوائية هو ميزة أخرى بارزة في كل من الربو والحساسية السريرية مرض مجرى الهواء لدى الفئران. كما هو مبين في الشكل (4) ، وتوعية OVA وتحد بشكل كبير يزيد من عدد الخلايا التي يمكن استردادها من الشعب الهوائية من قبل BAL. عدد الحمضات، وإلى حد أقل، وخصوصا زيادة العدلات.
الأدلة تشير إلى أن مرض حساسية الشعب الهوائية ينتج عن الإفراط في إنتاج الأجسام المضادة لمستضدات توعية. التوعية والتحدي مع OVA باستخدام البروتوكولات وصفنا يزيد من مستويات إيج في كل من المصل وسائل BAL من الفئران التي عولجت (الشكل 5).
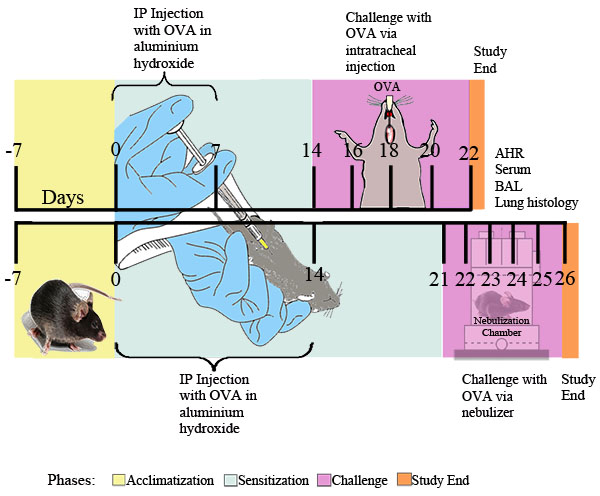
الشكل 1. وكان مخطط تجريبي للOVA الناجم عن الحساسية والربو. الفئران توعية الملكية الفكرية مرتين مع 20 ميكروغرام من OVA مستحلب في 2 ملغ من هيدروكسيد الألومنيوم في 0.2 مل من برنامج تلفزيوني العقيمة، أو 2 ملغ من هيدروكسيد الألومنيوم في 0.2 مل من وحده في برنامج تلفزيوني العقيمة، ثم في نقاط الوقت الذي يحدده هو التحدي مع 0.1٪ OVA أو العقيمة الحل في برنامج تلفزيوني أو من قبل السابقين يوميا posure لمدة 30 دقيقة إلى مرذذ OVA 1٪ في برنامج تلفزيوني أو برنامج تلفزيوني القى وحده عن طريق البخاخات بالموجات فوق الصوتية (Buxco). أربع وعشرين ساعة بعد التعرض OVA النهائي، وتم تحديد مجرى الاستجابة. بعد ذلك، تم جمع السائل BAL، عينات من الدم، وخلايا سرطان الرئة، وأنسجة لمزيد من التحليل.
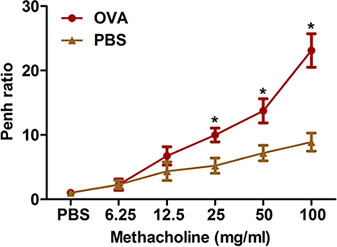
الشكل 2. وكانت الفئران تقييم حساسية التي يسببها فرط الاستجابة مجرى الهواء بطريقة موسع. (ن = 4/group) توعية وتحدى مع OVA. أربع وعشرين ساعة بعد التحدي الأخير، تم تحديد مجرى الهواء لفرط الاستجابة methacholine استنشاق باستخدام كامل الجسم تخطيط التحجم كما هو موضح في البروتوكول. تم تحديد بنوم، وأعربت عن مثل نسبة بنه (متوسط بنوم على مدى فترة زمنية 8 دقيقة مع methacholine مقسوما على بنوم المتوسط على مدى الفترة من 8 دقائق مع PBS). *، P <0.05 مقابل برنامج تلفزيوني.
iles/ftp_upload/3771/3771fig3.jpg "/>
الشكل 3. وكانت الفئران تقييم حساسية التي يسببها فرط الاستجابة مجرى الهواء باستخدام أسلوب الغازية (التذبذب القسري). (ن = 4/group) توعية وتحدى مع OVA. أربع وعشرين ساعة بعد التحدي الأخير، تم تحديد مجرى الهواء فرط الاستجابة إلى زيادة تركيزات methacholine المستنشق من التذبذب القسري (flexiVent) الأسلوب كما هو موضح في البروتوكول. ومقاومة مجرى الهواء، B) ج) مرانية الرئة. *، P <0.05 مقابل برنامج تلفزيوني.
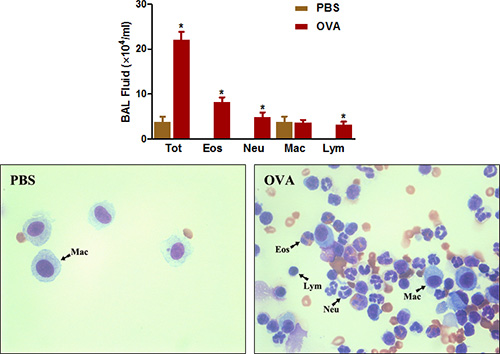
الشكل 4. وكانت BAL عدد خلايا السائل. الفئران (ن = 4/group) توعية وتحدى مع OVA. أربع وعشرين ساعة بعد التحدي الأخير، (أعلى) وقد تم جمع الخلايا بال واحصي مجموع الخلايا كما هو موضح في البروتوكول. (القاع) وكانت الشرائح Cytospin صrepared وملطخة الفرق السريع. TOT = مجموع الخلايا؛ إيوس = الحمضات؛ نوي = العدلات؛ ماك = الضامة؛ الصفوة = الخلايا اللمفية. *، P <0.05 مقابل برنامج تلفزيوني.
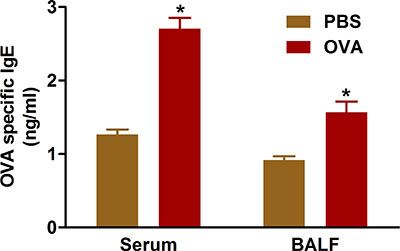
الشكل 5. OVA محددة فريق الخبراء الحكومي الدولي. وكانت الفئران (ن = 4/group) توعية وتحدى مع OVA. أربع وعشرين ساعة بعد التحدي الأخير، وقد تم قياس إيج في بال وسائل في مصل الدم من الدم التي تم جمعها بواسطة ثقب في القلب كما هو موضح في البروتوكول. *، P <0.05 مقابل برنامج تلفزيوني.
Discussion
النماذج الحيوانية لمرض حساسية الشعب الهوائية التي توفر أدوات مهمة للدراسات ذات الصلة الربو السريرية. وقد تم تطوير عدد من نماذج مختلفة، وتوظيف أنواع مختلفة ومولدات المضادات. الماوس، وهي الأنواع مختبر جذابة وتستخدم في كثير من الأحيان، كما يقدم عددا من المزايا لنماذج ...
Disclosures
وأجريت التجارب على الحيوانات وفقا للمبادئ التوجيهية واللوائح التي وضعتها اللجنة اتلانتا IACUC VAMC تحت بروتوكول # V010-10.
Acknowledgements
وأيد هذا العمل من قبل المعاهد الوطنية للصحة جرانت HL093196 (RCR) وأتلانتا ومؤسسة بحوث التربية والتعليم (عارف).
Materials
| Name | Company | Catalog Number | Comments |
| اسم المادة | شركة | فهرس العدد | تعليقات |
| Ovalbumin | سيغما الدريخ سانت لويس، MO | A5503 | |
| هيدروكسيد الألومنيوم | سيغما الدريخ | 239186 | |
| أسيتيل β-ميثيل كلوريد | سيغما الدريخ | A2251 | |
| بنتوباربيتال ملح الصوديوم | سيغما الدريخ | P3761 | |
| كل هيئة تخطيط التحجم (WBP) نظام | Buxco بحوث النظم ويلمينغتون، نورث كارولاينا | http://www.buxco.com | |
| FlexiVent | SCIREQ، المؤتمر الوطني العراقي. مونتريال، كندا | http://www.scireq.com | |
| ضوء المجهر | لايكا مايكروسيستمز، وشركة جاموس غروف، IL | ||
| Cytospin 4 | الحرارية العلمية أشفيل نورث كارولاينا | ||
| فرق السريع وصمة عار | شركة سيمنز نيوارك، DE | B4132-1A | |
| تكرار ماصة | Tridak تورينغتون، ط م | STP4001-0025 |
References
- Braman, S. S. The global burden of asthma. Chest. 130, 4S-12S (2006).
- Akinbami, L. J., Mooman, J. E., Liu, X. Asthma Prevalence, Health Care Use, and Mortality: 2005-2009. National Health Statistics Reports. 32, 2005-2009 (2011).
- Bates, J. H., Rincon, M., Irvin, C. G. Animal models of asthma. Am. J. Physiol. Lung. Cell. Mol. Physiol. 297, 401-410 (2009).
- Drazen, J. M., Finn, P. W., De Sanctis, G. T. Mouse models of airway responsiveness: physiological basis of observed outcomes and analysis of selected examples using these outcome indicators. Annu. Rev. Physiol. 61, 593-625 (1999).
- Epstein, M. M. Do mouse models of allergic asthma mimic clinical disease. Int. Arch. Allergy Immunol. 133, 84-100 (2004).
- Blyth, D. I., Pedrick, M. S., Savage, T. J., Hessel, E. M., Fattah, D. Lung inflammation and epithelial changes in a murine model of atopic asthma. Am. J. Respir. Cell Mol. Biol. 14, 425-438 (1996).
- Martin, T. R., Gerard, N. P., Galli, S. J., Drazen, J. M. Pulmonary responses to bronchoconstrictor agonists in the mouse. J. Appl. Physiol. 64, 2318-2323 (1988).
- Hamelmann, E. Noninvasive measurement of airway responsiveness in allergic mice using barometric plethysmography. Am. J. Respir. Crit. Care Med. 156, 766-775 (1997).
- Gelfand, E. W. Pro: mice are a good model of human airway disease. Am. J. Respir. Crit. Care Med. 166, 5-8 (2002).
- Shapiro, S. D. Animal models of asthma: Pro: Allergic avoidance of animal (model[s]) is not an option. Am. J. Respir. Crit. Care Med. 174, 1171-1173 (2006).
- Zosky, G. R. Ovalbumin-sensitized mice are good models for airway hyperresponsiveness but not acute physiological responses to allergen inhalation. Clin. Exp. Allergy. 38, 829-838 (2008).
- Nials, A. T., Uddin, S. Mouse models of allergic asthma: acute and chronic allergen challenge. Dis. Model. Mech. 1, 213-220 (2008).
- Wenzel, S., Holgate, S. T. The mouse trap: It still yields few answers in asthma. Am. J. Respir. Crit. Care Med. 174, 1173-1178 (2006).
- Rayamajhi, M. Non-surgical Intratracheal Instillation of Mice with Analysis of Lungs and Lung Draining Lymph Nodes by Flow Cytometry. J. Vis. Exp. (51), e2702 (2011).
- Swedin, L. Comparison of aerosol and intranasal challenge in a mouse model of allergic airway inflammation and hyperresponsiveness. Int. Arch. Allergy Immunol. 153, 249-258 (2010).
- Gueders, M. M. Mouse models of asthma: a comparison between C57BL/6 and BALB/c strains regarding bronchial responsiveness, inflammation, and cytokine production. Inflamm. Res. 58, 845-854 (2009).
- Zhu, W., Gilmour, M. I. Comparison of allergic lung disease in three mouse strains after systemic or mucosal sensitization with ovalbumin antigen. Immunogenetics. 61, 199-207 (2009).
- Flandre, T. D., Leroy, P. L., Desmecht, D. J. Effect of somatic growth, strain, and sex on double-chamber plethysmographic respiratory function values in healthy mice. J. Appl. Physiol. 94, 1129-1136 (2003).
- Hoymann, H. G. Invasive and noninvasive lung function measurements in rodents. J. Pharmacol. Toxicol. Methods. 55, 16-26 (2007).
- Chong, B. T., Agrawal, D. K., Romero, F. A., Townley, R. G. Measurement of bronchoconstriction using whole-body plethysmograph: comparison of freely moving versus restrained guinea pigs. J. Pharmacol. Toxicol. Methods. 39, 163-168 (1998).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved