A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
نمو المتفطرة السلية الأغشية الحيوية
In This Article
Summary
المتفطرة السلية تشكل الأغشية الحيوية المخدرات متسامح عندما تربيتها في ظروف معينة. نحن هنا وصف أساليب لزراعة M. الأغشية الحيوية والسل، وتحديد وتيرة صوامد المخدرات متسامح. وهذه البروتوكولات أن تكون مفيدة لمزيد من الدراسات في آليات التسامح المخدرات في م. مرض السل.
Abstract
المتفطرة السلية، وكيل خاص بأسباب الأمراض من مرض السل البشري، لديه قدرة غير عادية على البقاء على قيد الحياة ضد الضغوط البيئية بما فيها المضادات الحيوية. على الرغم من تحمل الإجهاد من م. مرض السل هو واحد من المساهمين على الأرجح إلى العلاج الكيميائي لمدة 6 أشهر طويلة من مرض السل 1، والآليات الجزيئية الكامنة وراء هذا النمط الظاهري مميزة من مسببات المرض لا تزال غير واضحة. لقد تطورت الأنواع الجرثومية العديد من البقاء على قيد الحياة في البيئات المجهدة عن طريق تجميع الذاتي في السطح، ودرجة عالية من التنظيم المرفقة، وهياكل مصفوفة مغلفة تسمى الأغشية الحيوية 2-4. النمو في المجتمعات ويبدو أن استراتيجية البقاء على قيد الحياة المفضل للميكروبات، ويتحقق من خلال المكونات الجينية التي تنظم مرفق السطح، والاتصالات بين الخلايا، وتجميع المواد البوليمرية خارج الخلية (EPS) 5،6. ومما يسهل على الأرجح إلى التسامح الإجهاد البيئي من قبل العائد على السهم، وربما من قبل physiological التكيف من عصيات الفردية لmicroenvironments غير متجانسة ضمن بنية معقدة من الأغشية الحيوية 7.
في سلسلة من الأوراق الأخيرة التي أنشأنا م. والسل، واللخنية المتفطرة لديها ميل قوي للنمو في هياكل متعددة الخلايا المنظمة، ودعا الأغشية الحيوية، والتي يمكن أن تحمل أكثر من 50 أضعاف الحد الأدنى من تركيز المثبطة من الأدوية المضادة للسل الإيزونيازيد والريفامبيسين 8-10. م. مرض السل، ولكن يتطلب يثير الاهتمام والفضول شروط محددة لتشكيل الأغشية الحيوية الناضجة، في نسبة معينة من فراغ الرأس 9:01: وسائل الإعلام، فضلا عن تبادل محدود من الهواء مع الغلاف الجوي 9. ربما يمكن أن متطلبات الظروف البيئية المتخصصة أن ترتبط إلى حقيقة أن م. مرض السل هو الممرض تلزم الإنسان، وبالتالي تكيفت مع البيئات الأنسجة. في هذا المنشور نظهر طرق زراعة M. مرض السلالأغشية الحيوية في زجاجة، وشكل لوحة 12-جيد، وهو مناسب للدراسات البكتريولوجية وكذلك الوراثية. وقد وصفت نحن على بروتوكول لسلالة ضعيفة من م. والسل، ومولودية 2 7000، مع الحذف في مواضع اثنين، panCD وRD1، التي تعتبر بالغة الأهمية للنمو في الجسم الحي من 9 الممرض. ويمكن استخدامها بأمان هذه السلالة في احتواء BSL-2 لفهم البيولوجيا الأساسية للمرض السل الممرض وبالتالي تجنب شرط وجود مرفق BSL-3 باهظة الثمن. ويمكن تمديد هذا الأسلوب، بعد إجراء التعديلات المناسبة في وسائل الإعلام، أن ينمو بيوفيلم من الأنواع الأخرى بالمتفطرات زروع.
وعموما، فإن بروتوكول موحد للاستزراع الأغشية الحيوية بالمتفطرات مساعدة المحققين المهتمين بدراسة الخصائص الأساسية مرونة من متفطرات. وبالإضافة إلى ذلك، فإن طريقة واضحة وموجزة من الأغشية الحيوية بالمتفطرات متزايد يساعد أيضا في الجرد السريرية والدوائيةestigators لاختبار مدى فعالية دواء المحتملة.
Protocol
1. تزايد الأغشية الحيوية من M. مرض السل في زجاجة المسمار 250ml الاتحاد توج
- وسائل الاعلام التحضير: ذوب 0.5g من KH 2 PO 4، 0.5g من MgSO 4، 4G من الهليونين-L، 2G من حامض الستريك، 0.05g من سيترات الأمونيوم الحديديك، 60mL من الجلسرين في 900mL من الماء. ضبط درجة الحموضة إلى 7.0 مع هيدروكسيد الصوديوم. الأوتوكلاف، باردة وفقط قبل بدء التجربة، إضافة ZnSO معقم 4 إلى تركيز النهائي من 0.1٪ ث / v منذ مولودية 2 7000 هو عوني التغذي بانتوثينات هذه السلالة يتطلب أيضا حامض البانتوثينيك في 10μg/mL من تركيز نهائي.
ملاحظة: هذا هو تكوين معيار وسائل الإعلام Sauton لاستخدامها لمرض السل م. ومع ذلك، يمكن إذا لزم الأمر أيضا وسائل الإعلام المتخصصة الأخرى يمكن استخدامها للأنواع الأخرى بالمتفطرات.
- اللقاح إعداد: م. تنمو مرض السل في 7H9OADC مع 0.05٪ توين-80 لمدة أسبوع، أو OD 600 بنسبة 0.7 إلى 1.0. وطبقا لتقديراتويمكن استخدامها مباشرة كما lture اللقاح حتى التخفيف 1:100.
- الاستغناء عن وسائل الإعلام 25mL Sauton لزجاجة المسمار البوليسترين توج 250ml الاتحاد (كورنينج). إضافة 250μl من اللقاح على المدى المتوسط، وكأب الزجاجة بإحكام جدا ووضعه دون عائق في حاضنة مرطب 37 درجة مئوية لمدة 3 أسابيع. مراقبة زجاجة مرة واحدة كل يوم للتأكد من عدم وجود تلوث.
- في نهاية الأسبوع الثالث، وتخفيف الحد الأقصى من القمقم للسماح للمزيد من النمو من م. مرض السل في واجهة. إذا لم يتم تخفيف الغطاء في هذه المرحلة ثم فإن تركيز الاكسجين في حاوية تؤخر تحقيق المزيد من النمو من البكتيريا.
2. نمو م. الأغشية الحيوية السل في 12-جيدا لوحات
- تعد وسائل الإعلام واللقاح من مولودية 2 7000 كما هو موضح في المقاطع A1 و A2.
- مزيج من وسائل الإعلام مع 60mL 600μl من اللقاح. الاستغناء 4.5mL من الخليط في كل بئر من لوحة. تغطية لوحة مع غطاء. التفاف لوحة عدة مرات مع parafilm. احتضان لوحة دون عائق في حاضنة مرطب على 37 درجة مئوية لمدة 5 أسابيع.
3. تحديد وتيرة صوامد المخدرات متسامح في م. السل الأغشية الحيوية
- تنمو م. والأغشية الحيوية مرض السل في شكل 12-جيدا كما هو موضح في الفرع باء يستغرق ذلك ما مجموعه نحو أسبوعين-5.
- مرة واحدة ونضجت الأغشية الحيوية (بعد 5 أسابيع من حضانة) حقن اختيارك للمضادات الحيوية في تركيز المطلوب في وسائل الاعلام تحت الأغشية الحيوية باستخدام microtip في ماصة.
ملاحظة: إن حجم وسائل الاعلام تحت pellicles يقلل إلى حوالي 3.0mL. لذا يجب أن المحققين وفقا لذلك حساب كمية من المخدرات.
- دوامة لوحة بلطف بحيث تنتشر تماما المضادات الحيوية على المدى المتوسط. لتحقيق نتائج يعتد بها إحصائيا، حقن عنتيبيأذني في أربعة آبار. في موازاة ذلك، حقن نفس الحجم من المذيب الذي تم حله في المضادات الحيوية في الآبار الأربعة الأخرى، وترك الماضي أربع آبار من لوحة لم يمسها. تغطية لوحة مع غطاء ووضع طبقات جديدة من parafilm حول اللوحة. وضعها مرة أخرى في الحاضنة لمدة الوقت المطلوب.
- في نهاية الحضانة، وفتح لوحة وإضافة توين-80 للتركيز النهائي من 0.1٪ (حجم / حجم) في كل من الآبار. دوامة لوحة كاملة بلطف لتشتيت موحد للمنظفات. احتضان لوحة في درجة حرارة الغرفة لمدة 15 دقيقة. مزيج من كل محتوى جيد مع عدة مرات ماصة بحيث يمكن أن المحتوى كله بشكل موحد على نقل أنبوب مخروطي 15mL.
- تدور باستمرار على محتوى أنبوب في 4000rpm لمدة 10 دقائق في درجة حرارة الغرفة. Resuspend لبيليه في 5ml من عازلة غسيل الطازجة (PBS مع الجلسرين بنسبة 10٪ و 0.05٪ توين-80). تكرار الغسيل ثلاث مرات. Resuspend لبيليه في 5ml من غسل العازلة. يبقيه على الكرسي الهزاز لسvernight في 4 درجات مئوية.
ملاحظة: على الرغم من أن وضعت أصلا لدرجة حرارة منخفضة اللخنية M. (للحد من نموها خلال تشتت)، ويستخدم لمرض السل م وكذلك، لا يمكن على الأرجح الأنواع بطيئة النمو أن هزت في درجة حرارة الغرفة دون أي تأثير على النتيجة. يمكن أن تعصف في درجة حرارة الغرفة يكون ضروريا إذا كان يعمل في BSL-3 المرفق.
- إعداد محقنة معقمة مزودة microtip (2-200μl) عن طريق خفض نهايته واسع إلى الحجم المناسب، من المناسب أن الحقنة والتغليف مع parafilm. تمرير مضمون كامل للأنبوب عن طريق حقنة طرف المجهزة، وجمع في أنابيب 1 15mL الطازجة. كرر هذه الخطوة 5 إلى 6 مرات حتى كنت مراقبة وقف متجانسة إلى حد ما.
- إعداد التخفيفات التسلسلي للتعليق على لوحة والتخفيفات في لوحة 7H11OADC لتحديد عدد من المستعمرات قابلة للتطبيق في كل بئر. احتضان لوحات لمدة ثلاثة أسابيع في الحاضنة 37 درجة مئوية. تحديد الترددقبرصي من صوامد في عدد السكان بيوفيلم عن طريق حساب نسبة من عدد من المستعمرات التي تم الحصول عليها في المضادات الحيوية المعالجة لتلك التي حصلنا عليها في مذيب لوحات المعالجة.
4. ممثل النتائج
عندما تربيتها في زجاجة، والنمو من م. ويمكن رؤية مرض السل في قاعدة الزجاجة بحلول نهاية الأسبوع الأول. في نهاية الأسبوع الثاني، يمكن أن ينظر نمو غير مكتمل من البكتيريا في الهواء واجهة وسائل الإعلام، على الرغم من النمو في الهواء واجهة وسائل الإعلام مرئيا دائما في نهاية الأسبوع الثالث (الشكل 1A). في هذا الوقت لوحظ أيضا المرفق من البكتيريا على جدار الوعاء. من هذه النقطة وصاعدا نمو ثقافة يحدث في المقام الأول على واجهة الهواء وسائل الاعلام. السائل تحت سطح نمو واضح. عادة، وهيكل نضوج بحلول نهاية الأسبوع الخامس (الشكل 1B). إذا الحضانة لفترات طويلة، وسوف تبدأ في الهياكل تنزل الى قاع الإناء. يثير الاهتمام والفضول،تشديد الحد الأقصى حتى نهاية الأسبوع الثالث هو خطوة هامة في هذه العملية، وذلك لأسباب غير معروفة زجاجة فضفاض وتوج يؤخر بشكل كبير الشروع في النمو على واجهة 9.
في شكل 12-جيدا، وينظر إلى بيوفيلم قوي في الهواء واجهة وسائل الإعلام في كل من الآبار في نهاية خمسة اسابيع (الشكل 2A). إذا لم يتم لف لوحات تماما بعد ذلك لوحظ الفرق نمو بيوفيلم. في أسوأ الحالات، يمكن أن مهمة وسائل الإعلام تبخر المماطلة في نمو البكتيريا (الشكل 2B). وبالتالي، التفاف من لوحة من الضروري على حد سواء لمنع التبخر وكذلك لتوفير البيئة لتشكيل بيوفيلم (انظر الفقرة السابقة).
عدد عصيات قادرة على البقاء في الأغشية الحيوية يحدد مع هذا الأسلوب هو تكرار للغاية. استجابة من M. السل الأغشية الحيوية يختلف مع طبيعة من المضادات الحيوية. للحصول على المضادات الحيوية للجراثيم مثل الريفامبيسين، وفقدان القدرة على الاستمرار في أعقاب bipha كذا اتجاه 9. الانحدار السريع في جدوى خلال الأيام الثلاثة أو الأربعة الأولى، تليها مرحلة المستمرة التي نسبة مئوية صغيرة من السكان ما زالت المتمردة تماما للمضادات الحيوية بغض النظر عن تركيز المضادات الحيوية أو وقت التعرض. ويبين الشكل 3 عدد عصيات قادرة على البقاء في الأغشية الحيوية ناضجة بعد التعرض لمدة 7 أيام على 50μg/mL (50 مرات أعلى من MIC) من الريفامبيسين.

رقم 1A. ظهور في وقت مبكر من م. عصيات السل في الهواء واجهة وسائل الإعلام من البكتيريا بعد 3 أسابيع من الحضانة.

نضجت الشكل 1B. الأغشية الحيوية من م. مرض السل في الهواء واجهة وسائل الإعلام بعد خمسة أسابيع من الحضانة.
820/3820fig2A.jpg "/>
2A الرقم 5 أسابيع الأغشية الحيوية القديمة م. السل نمت في شكل جيد 12.
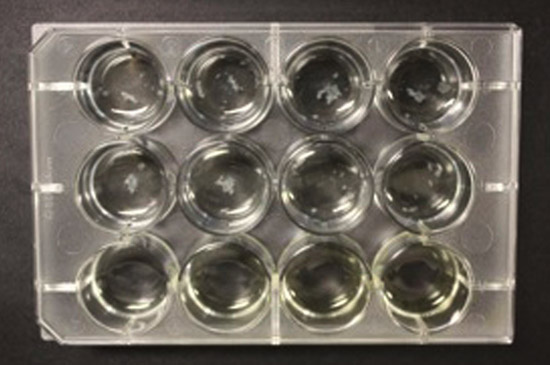
2B شخصية. محاولة فاشلة لتنمو M. الأغشية الحيوية السل في 12 لوحة من دون parafilm جيدا.
الشكل 3. مؤامرة ممثل تبين تواتر صوامد المخدرات متسامح في م. السل الأغشية الحيوية التي تزرع في 12-جيدا شكل والمعرضين لل50μg/mL من الريفامبيسين لمدة سبعة أيام.
Discussion
الدرن (السل)، والناجمة عن الإصابة بمرض السل المتفطرة، لا يزال يشكل خطرا كبيرا على الصحة العامة العالمية. وتشير التقديرات إلى ما يقرب من ثلث سكان العالم مصابون بهذا المرض asymptomatically من قبل الممرض، ونحو 9 ملايين حالة جديدة تظهر في عيادة في كل عام مع أعراض مرض السل الن...
Disclosures
ليس لدينا ما يكشف.
Acknowledgements
تم تنفيذ العمل بدعم مالي من المعهد الوطني للصحة والجمعية الأمريكية لأمراض الرئة.
Materials
| Name | Company | Catalog Number | Comments |
| Incubator | VWR international | Model # 1923/25 | |
| Polystyrene culture bottles | Fisher Scientific | 03-374-300 | |
| 12-well tissue culture plate | VWR international | 62406-165 | |
| 50-mL conical tubes | VWR international | 89039-660 | |
| Rocker | Thermo Fisher Scientific, Inc. | 57019-662 | |
| Chromatographic refrigerator | VWR international | 55702-520 | |
| petri dish | VWR international | 25384-342 | |
| KH2PO4 (monobasic) | EMD Millipore | PX1565-1 | |
| MgSO4 | Fisher Scientific | M65-500 | |
| L-asparagine | Sigma-Aldrich | A4284-100G | |
| citric acid | Sigma-Aldrich | C1857-100G | |
| ferric ammonium citrate | Sigma-Aldrich | F5879-100G | |
| glycerol | EMD Millipore | GX0185-5 | |
| NaOH | Sigma-Aldrich | S8045-500G | |
| ZnSO4 | Sigma-Aldrich | Z4750-500G | |
| D-pantothenic acid | Sigma-Aldrich | P2250-25G | |
| Difco Middlebrook 7H9 Broth | BD Biosciences | 271310 | |
| Middlebrook OADC Enrichment | BBL | 212351 | |
| Tween-80 | Fisher Scientific | T164-500 | |
| 250mL storage bottle | Corning | 430281 | |
| 12 well plates | Falcon BD | 353043 | |
| rifampicin | Sigma-Aldrich | R3501-1G | |
| methanol | JT Baker | 9070-05 | |
| 10mlLsyringe | BD Biosciences | 301604 | |
| 1-200μL pipet tips | VWR international | 89079-458 | |
| parafilm M | VWR international | PM-996 | |
| 15mL centrifuge tube | Greiner Bio-One | 188-285 | |
| Difco Mycobacteria 7H11 Agar | BD Biosciences | 283810 | |
| NaCl | Fisher Scientific | BP358-1 | |
| KCl | Sigma-Aldrich | P9333-500G | |
| Na2HPO4 (dibasic) | Sigma-Aldrich | S0876-500G |
References
- Saltini, C. Chemotherapy and diagnosis of tuberculosis. Respir. Med. 100, 2085-2097 (2006).
- Hall-Stoodley, L., Stoodley, P. Biofilm formation and dispersal and the transmission of human pathogens. Trends Microbiol. 13, 7-10 (2005).
- Costerton, J. W., Stewart, P. S., Greenberg, E. P. Bacterial biofilms: a common cause of persistent infections. Science. 284, 1318-1322 (1999).
- Blankenship, J. R., Mitchell, A. P. How to build a biofilm: a fungal perspective. Curr Opin Microbiol. 9, 588-594 (2006).
- Henke, J. M., Bassler, B. L. Bacterial social engagements. Trends Cell Biol. 14, 648-656 (2004).
- Kolter, R., Losick, R. One for all and all for one. Science. 280, 226-227 (1998).
- Branda, S. S., Vik, S., Friedman, L., Kolter, R. Biofilms: the matrix revisited. Trends Microbiol. 13, 20-26 (2005).
- Ojha, A. GroEL1: a dedicated chaperone involved in mycolic acid biosynthesis during biofilm formation in mycobacteria. Cell. 123, 861-873 (2005).
- Ojha, A. K. Growth of Mycobacterium tuberculosis biofilms containing free mycolic acids and harbouring drug-tolerant bacteria. Mol. Microbiol. 69, 164-174 (2008).
- Ojha, A. K., Trivelli, X., Guerardel, Y., Kremer, L., Hatfull, G. F. Enzymatic hydrolysis of trehalose dimycolate releases free mycolic acids during mycobacterial growth in biofilms. J. Biol. Chem. 285, 17380-17389 (2010).
- Dye, C., Lonnroth, K., Jaramillo, E., Williams, B. G., Raviglione, M. Trends in tuberculosis incidence and their determinants in 134 countries. Bull World Health Organ. 87, 683-691 (2009).
- Jindani, A., Dore, C. J., Mitchison, D. A. Bactericidal and sterilizing activities of antituberculosis drugs during the first 14 days. Am. J. Respir. Crit. Care Med. 167, 1348-1354 (2003).
- Carter, G., Wu, M., Drummond, D. C., Bermudez, L. E. Characterization of biofilm formation by clinical isolates of Mycobacterium avium. J. Med. Microbiol. 52, 747-752 (2003).
- Hall-Stoodley, L., Lappin-Scott, H. Biofilm formation by the rapidly growing mycobacterial species Mycobacterium fortuitum. FEMS Microbiol. Lett. 168, 77-84 (1998).
- Alibaud, L. Temperature-dependent regulation of mycolic acid cyclopropanation in saprophytic mycobacteria: role of the Mycobacterium smegmatis 1351 gene (MSMEG_1351) in CIS-cyclopropanation of alpha-mycolates. J. Biol. Chem. 285, 21698-21707 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved