A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
الكشف microRNA في أورام البروستات بواسطة PCR الوقت الحقيقي الكمية (qPCR)
In This Article
Summary
الكمية بوليميريز سلسلة من ردود الفعل في الوقت الحقيقي (qPCR) هو وسيلة سريعة وحساسة للتحقيق في مستويات التعبير عن مختلف microRNA (ميرنا) الجزيئات في عينات الورم. ويمكن استخدام هذا التعبير أسلوب مئات من جزيئات ميرنا مختلفة يتم تضخيمها، كميا، وتحليلها من القالب نفسه [كدنا].
Abstract
MicroRNAs (miRNAs) are single-stranded, 18–24 nucleotide long, non-coding RNA molecules. They are involved in virtually every cellular process including development1, apoptosis2, and cell cycle regulation3. MiRNAs are estimated to regulate the expression of 30% to 90% of human genes4 by binding to their target messenger RNAs (mRNAs)5. Widespread dysregulation of miRNAs has been reported in various diseases and cancer subtypes6. Due to their prevalence and unique structure, these small molecules are likely to be the next generation of biomarkers, therapeutic agents and/or targets.
Methods used to investigate miRNA expression include SYBR green I dye- based as well as Taqman-probe based qPCR. If miRNAs are to be effectively used in the clinical setting, it is imperative that their detection in fresh and/or archived clinical samples be accurate, reproducible, and specific. qPCR has been widely used for validating expression of miRNAs in whole genome analyses such as microarray studies7. The samples used in this protocol were from patients who underwent radical prostatectomy for clinically localized prostate cancer; however other tissues and cell lines can be substituted in. Prostate specimens were snap-frozen in liquid nitrogen after resection. Clinical variables and follow-up information for each patient were collected for subsequent analysis8.
Quantification of miRNA levels in prostate tumor samples. The main steps in qPCR analysis of tumors are: Total RNA extraction, cDNA synthesis, and detection of qPCR products using miRNA-specific primers. Total RNA, which includes mRNA, miRNA, and other small RNAs were extracted from specimens using TRIzol reagent. Qiagen's miScript System was used to synthesize cDNA and perform qPCR (Figure 1). Endogenous miRNAs are not polyadenylated, therefore during the reverse transcription process, a poly(A) polymerase polyadenylates the miRNA. The miRNA is used as a template to synthesize cDNA using oligo-dT and Reverse Transcriptase. A universal tag sequence on the 5' end of oligo-dT primers facilitates the amplification of cDNA in the PCR step. PCR product amplification is detected by the level of fluorescence emitted by SYBR Green, a dye which intercalates into double stranded DNA. Specific miRNA primers, along with a Universal Primer that binds to the universal tag sequence will amplify specific miRNA sequences.
The miScript Primer Assays are available for over a thousand human-specific miRNAs, and hundreds of murine-specific miRNAs. Relative quantification method was used here to quantify the expression of miRNAs. To correct for variability amongst different samples, expression levels of a target miRNA is normalized to the expression levels of a reference gene. The choice of a gene on which to normalize the expression of targets is critical in relative quantification method of analysis. Examples of reference genes typically used in this capacity are the small RNAs RNU6B, RNU44, and RNU48 as they are considered to be stably expressed across most samples. In this protocol, RNU6B is used as the reference gene.
Protocol
1. البروستاتا جمع العينات
- جمع عينات من البروستاتا في وقت استئصال البروستاتا. توجه العينة باستخدام معالم التشريحية. ورسمت على البروستاتا والحويصلات المنوية على النحو التالي: حق أخضر الجانب، جانب اليسار الزرقاء.
- يتم أخذ القسم الوسطي عشوائية عرضية من البروستاتا عمودي على سطح المستقيم، مجمدة في النيتروجين السائل، وتخزينها في -80 درجة مئوية 9.
- شرائح من العينات المخزنة المصورة، الموجهة (الأمامية، الخلفية، اليمين واليسار)، quadrisected. يتم قطع المقاطع باستخدام ناظم البرد.
- وملطخة المقاطع مع H & E، واستعرض من قبل الطبيب الشرعي لتحديد وترسيم المناطق ورم مقابل طبيعي على الشرائح ملون وصورة المقابلة. وتستخدم المناطق ملحوظ كدليل للإشارة إلى المناطق التي لاستخراج أنسجة الورم من الذي سيتم استخراج الحمض النووي الريبي في الخطوات اللاحقة.
2. عزل الحمض النووي الريبي الإجمالية، بما فيها ميرنا، من العينات
- عينات من مكان البروستات المجمدة على الجليد الجافة ويشير الى صورة المرسومة، قطع جزء صغير من الورم البروستات (ما بين 50 الى 100 ملغ).
- تجانس الأنسجة السرطانية في البروستات 1 مل من الكاشف TRIzol. وتعتمد الكميات في الخطوات التالية على استعمال 1 مل من الكاشف TRIzol.
ملاحظة: نحن هنا قد استخدمت الكاشف TRIzol لاستخراج الحمض النووي الريبي، ويمكن أيضا مجموعات أخرى إلا أن عزل الحمض النووي الريبي الصغيرة التي تحتوي على الحمض النووي الريبي مجموع استخدامها.
- احتضان العينات المتجانس لمدة 5 دقائق في درجة حرارة الغرفة.
- إضافة 0.2 مل من الكلوروفورم إلى العينات وهزة بقوة لمدة 15 ثانية. احتضان العينات لمدة 3 دقائق في درجة حرارة الغرفة، ثم أجهزة الطرد المركزي في 12000 XG لمدة 15 دقيقة في 4 درجات مئوية.
- نقل عديم اللون المرحلة المائية العليا لأنابيب جديدة، وإضافة 0.5 مل من الكحول الآيزوبروبيل.احتضان العينات لمدة 10 دقائق في درجة حرارة الغرفة، ثم أجهزة الطرد المركزي في 12000 XG لمدة 10 دقائق في 4 درجات مئوية.
- بعناية نضح طاف من دون إزعاج بيليه الذي يحتوي على الحمض النووي الريبي. غسل بيليه RNA مع 1 مل من الإيثانول بنسبة 75٪. دوامة العينة وإعادة الرواسب عن طريق الطرد المركزي لمدة 5 دقائق في XG 7500 في 4 درجات مئوية.
- نضح بعناية وطاف والجافة وبيليه الحمض النووي الريبي لمدة 5-10 دقائق، والتأكد من الحمض النووي الريبي بيليه لم يجف تماما. في Nuclease خالية من المياه الملائمة لحجم بيليه إعادة حل. قياس تركيز الحمض النووي الريبي باستخدام مقياس الطيف الضوئي 1000 NanoDrop (الامتصاصية التدبير في 260 نانومتر و 280).
- التحقق من جودة وسلامة عينات الحمض النووي الريبي باستخدام اجيلنت Bioanalyzer.
3. عكس نسخ من الحمض النووي الريبي
- تم إجراء النسخ العكسي من الحمض النووي الريبي باستخدام miScript كيت النسخ العكسي وفقا لتعليمات الشركة الصانعة (QIAGEN). هذه المجموعة تضمعكس المنتسخة و(A) بوليميريز بولي. والواق RT miScript تشمل المغنيسيوم 2 +، dNTPs، بنسبة ضئيلة من DT الاشعال، والبادئات العشوائية.
- استخدام ما بين 10 و ص 1 ميكروغرام من الحمض النووي الريبي لتجميع [كدنا]. في حالة استخدام أكثر من 1 ميكروغرام من الحمض النووي الريبي، توسيع نطاق رد الفعل خطيا إلى حجم مناسب.
- إعداد مزيج الرئيسي الذي يحتوي على 5X miScript RT العازلة (4 ميكرولتر)، miScript ميكس النسخ العكسي (1 ميكرولتر)، والمياه ريبونوكلياز خالية لجلب ردود الفعل على الحجم النهائي من 20 ميكرولتر. وتشمل أيضا الحمض النووي الريبي قالب (حتى 1 ميكروغرام) في مزيج الرئيسي.
- احتضان هذه العينات لمدة 60 دقيقة في درجة حرارة 37 مئوية تليها مباشرة عن طريق حضانة لمدة 5 دقائق عند 95 درجة مئوية. لا يمكن أن يؤديها هذه الخطوة في جهاز PCR، تسخين كتلة، أو ماء الاستحمام. Thermocyclers هي الطريقة الأنسب والأكثر دقة. تخزين [كدنا] على الجليد على المدى القصير، و -20 درجة مئوية لمدة التخزين على المدى الطويل.
4. توليد منحنى قياسي
- قبل experiment مع miRNAs الهدف، يتم إنشاء منحنى قياسي باستخدام cDNAs تركيزات المعروفة ضد نقاط العبور (اف ب) (الشكل 2).
- إعداد سلسلة من التخفيفات من 2 أضعاف و 10 ضعفا، و 50 أضعاف، أضعاف-250، و 1250 أضعاف [كدنا] الأصلي للنموذج الذي هو معروف لدينا تعبير كبير من الجينات اهتمامك.
- تشغيل PCR على النحو المحدد في المادة 5 "في الوقت الحقيقي PCR للكشف عن ميرنا"، مع التعديل الذي كدنا] في التخفيفات المسلسل ليس تخفيف ثابت 40X.
- لتحليل باستخدام البرمجيات RelQuant (روش) لإنشاء منحنى المعيار الخاص بك.
ملاحظة: يجب إنشاء منحنى جديد موحدة لكل جينة من الفائدة.
5. في الوقت الحقيقي PCR للكشف من ميرنا
- تم تنفيذ حقيقي PCR الوقت لmiRNAs باستخدام miScript SYBR الأخضر PCR كيت والفحص التمهيدي miScript وفقا لتعليمات الشركة الصانعة (QIAGEN). إعداد مزيج رئيسية تحتوي على2X QuantiTect SYBR الأخضر ميكس ماستر PCR، 10X miScript التمهيدي العالمي، 10X الفحص التمهيدي miScript، والمياه ريبونوكلياز خالية. إعداد مزيج الرئيسي لحجم رد فعل 20 ميكرولتر.
- والفحص التمهيدي هو محدد لميرنا من الفائدة. الى 10x إعادة الفحص التمهيدي miScript، منبذة القارورة لفترة وجيزة، وإضافة 550 ميكروليتر TE العازلة، ودرجة الحموضة 8.0. دوامة القارورة لفترة وجيزة لخلط والشعائل قسامة إلى أصغر وحدات التخزين، وتخزينها عند درجة حرارة -20 درجة مئوية. ويلزم اثنان الاشعال: الاشعال للجينات الهدف وهذا الجين هو مرجع RNU6B usedas الجين مرجع.
- يخفف من [كدنا] aliquots اضافية 40X وتخزين عند درجة حرارة -20 درجة مئوية.
- [كدنا] بمثابة قالب لPCR. استخدام 2 ميكرولتر من [كدنا] المخفف 40X والاستغناء إلى 20 ميكروليتر ضوء cycler الشعيرات الدموية (روش).
- إضافة 18 ميكرولتر من مزيج الرئيسي إلى كل شعري، وأجهزة الطرد المركزي باستخدام محول الشعرية.
- وضع الشعيرات الدموية في cycler في الوقت الحقيقي القائم الشعرية، مثل LightCycler 3.5 نظام PCR في الوقت الحقيقي مع شكل دائري 32-الشعرية.
- تشغيل البرنامج الدراجات PCR على النحو التالي:
لتفعيل البوليميراز HotStarTaq التي هي في 2X QuantiTect SYBR الأخضر ميكس ماستر PCR، قبل احتضان عند 95 درجة مئوية لمدة 15 دقيقة.
تليها 50 دورة من:
تمسخ، 15 ثانية و 94 درجة مئوية؛
الصلب، 30 ثانية و 55 درجة مئوية؛
تمديد، 30 ثانية، و 70 درجة مئوية. - اختيار عينة ليكون تدريج، وتعيين قيمته هدف تطبيع إلى 1. قارن التعبير النسبية لميرنا في جميع العينات الأخرى إلى تدريج.
ملاحظة: ضمن دراسة، وينبغي استخدام نفس العينة معايرة للحفاظ على اتساق النتائج.
6. تحليل البيانات
- وصفت منحنيات التضخيم لردود الفعل PCR بالرسوم والصور وعدديا بواسطة الجزيئية الكيميائية الحيوية LightCycler إصدار برامج 3.5 (روش). قياس ردود الفعل في علامة التبويب "الكمي"، وهوالثانية وتصدير البيانات إلى ملف نصي.
- استيراد البيانات إلى برنامج التحليل RelQuant (روش) لتوليد نتائج القياس الكمي. استيراد ملفات منفصلة عن الجينات المستهدفة، والجينات المرجعية، والبيانات منحنى القياسية.
- تحديد موقف من المعاير لكل من الهدف والجينات مرجع. أيضا تحديد المواقف من العينات. وأعرب عن البيانات كهدف للرجوع نسبة من عينات مختلفة مقسوما على نسبة إشارة إلى هدف للتدريج. يستخدم منحنى معيار ولدت من قبل لميرنا وخاصة الجينات التدبير المنزلي كمعيار مرجعي لاستقراء البيانات الكمية للأهداف ميرنا تركيزات غير معروف.
- ثلاث نسخ مكررة من تحليل العينات كمجموعة ويعني يحسب تركيزات والانحرافات المعيارية من ثلاث نسخ. إذا كان أحد triplicates غير متناسقة مع بقية المجموعة، سوف يتم استبعاده من قبل البرنامج.
7. ممثل النتائج
<ويرد ف الطبقة = "jove_content"> مثال لتحليل qPCR على عينات من البروستاتا في الشكل 3. وصفت النتائج عدديا، وكذلك بالرسوم والصور. الرسوم البيانية التي تبين مستويات التعبير عن الجينات إشارة، U6، تبدأ التضخيم الهائل في حوالي 20 دورة، في حين أن التعبير عن الجينات المستهدفة، ومير 98، وأظهرت تأخر ما يقرب من التضخيم في دورة 25. وقد تم تصدير البيانات من هذه التجربة في ملف نص وتحليلها بواسطة برنامج التحليل RelQuant. يتم تحديد المواقف من الشعيرات الدموية التي تحتوي على تدريج والعينات. الشكل 4 يوضح كيف يتم تعيين تدريج لكي تكون 1، والتعبير عن عينات أخرى بالنسبة للتدريج.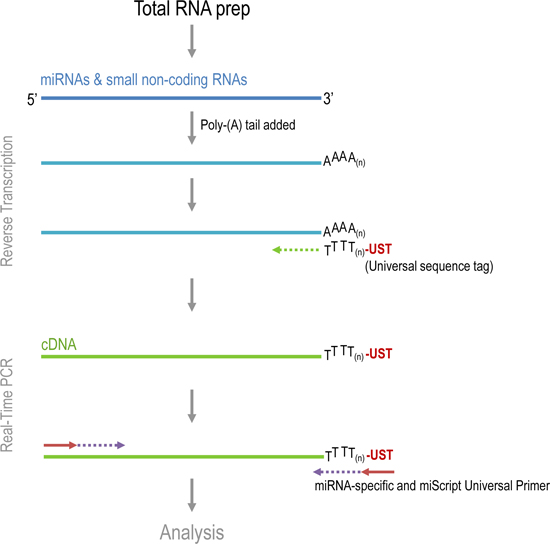
الشكل 1. الخطوات المختلفة في miScript العكسية النسخ والاسترداد في الوقت الحقيقي.

الشكل 2. يتم إنشاء منحنى قياسي باستخدام سلسلة من التخفيفات من 2 أضعاف و 10 ضعفا، و 50 أضعاف، أضعاف-250، و 1250 أضعاف العينة الأصلي [كدنا].

الشكل 3. روش LightCycler الكيميائية الحيوية الجزيئية برامج يظهر المعلومات الكاملة من التجربة بالرسوم والصور والنص من قبل. وتظهر زيادة كمية التضخيم PCR في الوقت الحقيقي والمؤامرات في مضان من عينات مختلفة.

وتم قياس كمية الشكل 4. البيانات باستخدام برامج التحليل RelQuant LightCycler. عادة، ثلاثة مكررات من عينات يتم تحليلها كمجموعة والعينات التي تنتج يتم استبعاد نتائج غير متناسقة بشكل واضح ويعني يحسب تركيزات والانحرافات المعيارية من ثلاث نسخ.
Access restricted. Please log in or start a trial to view this content.
Discussion
وقد تم التعبير عن الشاذة من بعض miRNAs وجدت على الدوام في أورام البروستات بالمقارنة مع الأنسجة الطبيعية 10، والذين وردت أسماؤهم بعض هذه miRNAs كعوامل محتملة علاجية جديدة ضد سرطان البروستاتا 11. لذلك نجد أن مستويات التعبير المنحرف من miRNAs تكون مفيدة المؤشرات الحيو...
Access restricted. Please log in or start a trial to view this content.
Disclosures
الإعلان عن أي تضارب في المصالح.
Acknowledgements
وقد تم تمويل هذا العمل من قبل المعهد الكندي لابحاث السرطان في المجتمع، لا تمنح. 019038.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| اسم كاشف | شركة | فهرس العدد | |
| TRIzol الكاشف | إينفيتروجن | 15596 | |
| miScript كيت النسخ العكسي | QIAGEN | 218061 | |
| فحوصات التمهيدي miScript | QIAGEN | تجربة محددة | |
| miScript SYBR الأخضر PCR كيت | QIAGEN | 218073 | |
| LightCycler 3.5 نظام PCR في الوقت الحقيقي | روش | ||
| ضوء Cycler الأوعية الشعرية | روش | 04929292001 | |
| NanoDrop 1000 طيفي | الحرارية العلمية | 2538 | |
| اجيلنت 2100 Bioanalyzer | G2943CA |
References
- Reinhart, B. J. MicroRNAs in plants. Genes Dev. 16, 1616-1616 (2002).
- Xu, P. The Drosophila microRNA Mir-14 suppresses cell death and is required for normal fat metabolism. Curr. Biol. 13, 790(2003).
- Bueno, M. J., Perez, deC. astro, I,, Malumbres, M. Control of cell proliferation pathways by microRNAs. Cell Cycle. 7, 3143-3143 (2008).
- Friedman, R. C. Most mammalian mRNAs are conserved targets of microRNAs. Genome Res. 19, 92(2009).
- Bartel, D. P. MicroRNAs: genomics, biogenesis, mechanism, and function. Cell. 116, 281-281 (2004).
- Croce, C. M. Causes and consequences of microRNA dysregulation in cancer. Nat. Rev. Genet. 10, 704(2009).
- Coppola, V., De, M. R., Bonci, D. MicroRNAs and prostate cancer. Endocr. Relat. Cancer. 17, 1-1 (2010).
- Gordanpour, A. miR-221 Is down-regulated in TMPRSS2:ERG fusion-positive prostate cancer. Anticancer Res. 31, 403-403 (2011).
- Nam, R. K. Expression of the TMPRSS2:ERG fusion gene predicts cancer recurrence after surgery for localised prostate cancer. Br. J. Cancer. 97, 1690(2007).
- Ambs, S. Genomic profiling of microRNA and messenger RNA reveals deregulated microRNA expression in prostate cancer. Cancer Res. 68, 6162(2008).
- Liu, C. The microRNA miR-34a inhibits prostate cancer stem cells and metastasis by directly repressing CD44. Nat. Med. 17, 211(2011).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved