A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
في الفحص المختبري التخليص الظهارية النماذج أن الخطوات في وقت مبكر من الإنبثاث سرطان المبيض
In This Article
Summary
الفحص تخليص الظهارية وصفها هنا يستفيد من خلايا fluorescently المسمى والوقت الفاصل بين الفحص المجهري لتصور فيديو وكميا قياس التفاعلات بين الأجسام الشبه الكروية سرطان المبيض المتعددة الخلايا الظهارية وmonolayers الخلية. طرازا هذا الفحص الخطوات في وقت مبكر من ورم خبيث سرطان المبيض.
Abstract
Ovarian cancer is the fifth leading cause of cancer related deaths in the United States1. Despite a positive initial response to therapies, 70 to 90 percent of women with ovarian cancer develop new metastases, and the recurrence is often fatal2. It is, therefore, necessary to understand how secondary metastases arise in order to develop better treatments for intermediate and late stage ovarian cancer. Ovarian cancer metastasis occurs when malignant cells detach from the primary tumor site and disseminate throughout the peritoneal cavity. The disseminated cells can form multicellular clusters, or spheroids, that will either remain unattached, or implant onto organs within the peritoneal cavity3 (Figure 1, Movie 1).
All of the organs within the peritoneal cavity are lined with a single, continuous, layer of mesothelial cells4-6 (Figure 2). However, mesothelial cells are absent from underneath peritoneal tumor masses, as revealed by electron micrograph studies of excised human tumor tissue sections3,5-7 (Figure 2). This suggests that mesothelial cells are excluded from underneath the tumor mass by an unknown process.
Previous in vitro experiments demonstrated that primary ovarian cancer cells attach more efficiently to extracellular matrix than to mesothelial cells8, and more recent studies showed that primary peritoneal mesothelial cells actually provide a barrier to ovarian cancer cell adhesion and invasion (as compared to adhesion and invasion on substrates that were not covered with mesothelial cells)9,10. This would suggest that mesothelial cells act as a barrier against ovarian cancer metastasis. The cellular and molecular mechanisms by which ovarian cancer cells breach this barrier, and exclude the mesothelium have, until recently, remained unknown.
Here we describe the methodology for an in vitro assay that models the interaction between ovarian cancer cell spheroids and mesothelial cells in vivo (Figure 3, Movie 2). Our protocol was adapted from previously described methods for analyzing ovarian tumor cell interactions with mesothelial monolayers8-16, and was first described in a report showing that ovarian tumor cells utilize an integrin –dependent activation of myosin and traction force to promote the exclusion of the mesothelial cells from under a tumor spheroid17. This model takes advantage of time-lapse fluorescence microscopy to monitor the two cell populations in real time, providing spatial and temporal information on the interaction. The ovarian cancer cells express red fluorescent protein (RFP) while the mesothelial cells express green fluorescent protein (GFP). RFP-expressing ovarian cancer cell spheroids attach to the GFP-expressing mesothelial monolayer. The spheroids spread, invade, and force the mesothelial cells aside creating a hole in the monolayer. This hole is visualized as the negative space (black) in the GFP image. The area of the hole can then be measured to quantitatively analyze differences in clearance activity between control and experimental populations of ovarian cancer and/ or mesothelial cells. This assay requires only a small number of ovarian cancer cells (100 cells per spheroid X 20-30 spheroids per condition), so it is feasible to perform this assay using precious primary tumor cell samples. Furthermore, this assay can be easily adapted for high throughput screening.
Protocol
1. المبيض خلية سرطان تشكيل الجسم الشبه الكروي
- تستزرع طلب تقديم العروض في التعبير عن خلايا سرطان المبيض في قاعدة متوسطة 10٪ (ثقافة الخلية المخصصة المتوسطة التي تحتوي على خليط 50:50 من 199 وMCDB105، المعطل الجنين بنسبة 10٪ مصل بقري و 1٪ من ركلة جزاء، بكتيريا). للتعبير عن طلب تقديم العروض في غير المسماة خلايا سرطان المبيض، transfect الخلايا مع طلب تقديم العروض 1 تحتوي على البلازميد وحدد لخلايا معربا عن طلب تقديم العروض. بدلا من ذلك، يمكن استخدام النواقل الفيروسية للتعبير عن عابر البروتينات الفلورية، أو خلايا يمكن أن تكون مرحلة ما قبل احتضان مع أحمر فلوري خلية تعقب صبغ (إينفيتروجن).
- قبل تشكيل الأجسام الشبه الكروية من سرطان المبيض، فمن الضروري أن تعد منخفضة التصاق 96 ثقافة أسفل جولة جيد أطباق. لإنتاج لوحات الثقافة المنخفضة التصاق، يضاف 30μl بولي HEMA (6mg هيدروكسي إيثيل ميثاكريليت في 1 95٪ EtOH مل) إلى حل كل بئر من 96 طبق كورنينج جيدا ثقافة الخلية. يتم تحضين لوحات 96 بشكل جيد في 37 درجة مئوية غير مرطب حاضنة لتتبخر والايثانول، لeaving فيلما من HEMA بولي في كل بئر. هذا الفيلم بولي HEMA يمنع الخلايا من الالتصاق على قاع البئر، مما اضطر الخلايا لتنمو في تعليق 18. [بدلا من ذلك، يمكن استخدام منخفضة للغاية لوحات ثقافة (موضوع متعدد الصفحات كورنينج) بدلا من بولي HEMA الأطباق المغلفة.]
- بعد مستعدون للثقافة التصاق منخفضة لوحات، ويعرض للتريبسين طبق من ذهب من خلايا سرطان المبيض، بيليه الخلايا في جهاز للطرد المركزي منضدية (هيراوس) عند 900 إطار التعاون الإقليمي لمدة 3 دقائق، ونضح وطاف في قاعدة متوسطة 10٪ إعادة تعليق.
- عد الخلايا باستخدام عدادة الكريات.
- ضبط تركيز مثل هذه الخلايا أن هناك 100 خلية لكل 50μl من قاعدة متوسطة 10٪.
- إضافة 50μl لتعليق الخلية المخففة علقت بشكل موحد على كل بئر من ال 96 جيدا بولي HEMA طبق ثقافة المغلفة.
- احتضان لوحة 96 بشكل جيد في 37 درجة مئوية خلية حاضنة الثقافة لمدة 16 ساعة (وينبغي زيادة هذه الكمية من الوقت أو ينقص تبعا لمقدار الوقت الذي يستغرقهخط خلية معينة لتشكيل الأجسام الشبه الكروية المتعددة الخلايا أو الظروف التجريبية المطلوبة) للسماح للخلايا سرطان المبيض إلى كتلة معا، وتشكيل كروي واحد متعددة الخلايا في كل بئر. يمكن لبعض الخلايا السرطانية الخضوع لموت الخلايا المبرمج خلال هذه الفترة، لذلك من المهم أن تختار وقتا قبل استحثاث موت الخلايا المبرمج.
2. تكوين خلايا الظهارية أحادي الطبقة
- في خلية غطاء محرك السيارة والثقافة، وقبل معطف الآبار من 6 جيدا طبق ماتيك الزجاج أسفل مع فبرونيكتين بإضافة 2mL من فبرونيكتين 5μg / مل حل PBS إلى كل بئر من صحن وحضانة في درجة حرارة الغرفة لمدة 30 دقيقة. جودة البصري للقيعان من الزجاج في أطباق ماتيك تسمح عالية الدقة التصوير المجهري.
- تستزرع GFP، معربا عن الخلايا الظهارية في قاعدة متوسطة 10٪. يعرض للتريبسين لوحة من الخلايا الظهارية، وتدور باستمرار في جهاز للطرد المركزي منضدية (هيراوس) في 900RPM لمدة 3 دقائق، نضح طاف، ومتوسطة في قاعدة 10٪ إعادة تعليق. ووالخلايا الظهارية استخدمت هنا تعبير بالفعل GFP عندما تم الحصول عليها، ولكن يمكن أن تنتج الخلايا الظهارية غير المسماة التي transfecting مع GFP 1 تحتوي على البلازميد [كدنا]، أو preincubating الخلايا في خلية أخضر فلوري تعقب صبغ (إينفيتروجن).
- بعد حضانة فبرونيكتين لمدة 30 دقيقة (في الخطوة 2.1)، وغسل الآبار الطبق ماتيك مع PBS 2mL.
- نضح في برنامج تلفزيوني وصفيحة 6 5 X10 الخلية الظهارية لكل بئر في كل بئر من صحن ماتيك 6 جيدا. احتضان الطبق ماتيك في 37 درجة مئوية خلية حاضنة الثقافة بين عشية وضحاها للسماح للخلايا الظهارية لتعلقها على طبق وتشكيل أحادي الطبقة.
3. الظهارية الفحص خلية التخليص
- استخدام الماصة لجمع الأجسام الشبه الكروية بسرطان المبيض من 96 لوحة بولي HEMA جيد المغلفة.
- نضح في المتوسط من بئر واحدة من طبق ماتيك 6 جيدا أحادي الطبقة التي تحتوي على الخلية الظهارية. يغسل مرة واحدة مع برنامج تلفزيوني 2mL. إضافة كافة الأجسام الشبه الكروية من ص 96 جيدفي وقت متأخر لبئر واحدة من طبق ماتيك (~ 3X عدد الأجسام الشبه الكروية التي سوف يتم تصويرها لحساب هبوط الأجسام الشبه الكروية على جزء من الطبق الذي لا يمكن تصويرها).
- وضع طبق ماتيك على مرحلة مجهر مضان مقلوب widefield قادرة على أداء الوقت الفاصل بين التصوير لمدة 8 ساعات على الأقل. استخدم مرحلة الآلية في مناصب متعددة في صورة طبق، مع العديد من الأحداث إقحام كروي، في تجربة واحدة. نستخدم TI-E نيكون مقلوب الميكانيكية Widefield الإسفار الوقت الفاصل بين مجهر المتكاملة مع نظام مثالي التركيز وانخفاض [20X-0.75 الفتحة العددية (NA)] التكبير الفرق NA / تدخل النقيض (DIC) علم البصريات، وtransilluminator الهالوجين نيكون مع 0،52 NA لمسافات طويلة العمل (LWD) مكثف، نيكون سريع (<100 ميلي ثانية واحدة التبديل الوقت) الإثارة وانبعاث المرشحات (GFP تحويلة 480/40، إم 525/50، RFP-mCherry تحويلة 575/50 إم 640/50)، سوتر تنتقل بسرعة ومسار ضوء إيقاف الذكية epifluorescenceتبرد النسب، وخطي ترميز نيكون مرحلة الآلية، وهاماماتسو ORCA-AG المسؤول عن جهاز الديناميكي (اتفاقية مكافحة التصحر) وكاميرا، وحضانة مجهر مبنية خصيصا مع غرفة التحكم 2 درجة الحرارة وثاني أكسيد الكربون، ونيكون شيكل-AR عناصر برنامج الإصدار 3، و TMC طاولة الاهتزاز العزلة.
- فإن الأجسام الشبه الكروية خلية سرطان المبيض تترسب في القاع من صحن ونعلق على أحادي الطبقة الخلية الظهارية. جمع GFP، طلب تقديم العروض والصور من المرحلة 20 + كروي / أحادي الطبقة التفاعلات، كل 10 دقائق، لمدة 8 ساعات.
- فإن سرطان المبيض خلية الأجسام الشبه الكروية طلب تقديم العروض، معربا عن غزو في أحادي الطبقة GFP في التعبير عن الخلية الظهارية خلق ثقب في أحادي الطبقة. بعد 8 ساعات، قياس أحجام الثقوب عن طريق تتبع الثقوب السوداء في الصور GFP باستخدام عناصر البرنامج (أو برامج أخرى مناسبة مثل J الصورة). تطبيع حجم ثقب في حجم كروي الأولية من خلال تقسيم حجم ثقب في 8 ساعات بواسطة حجم كروي في الصورة المقابلة طلب تقديم العروض في الساعة صفر. في هذا السابقينوافرة، وقد تم قياس فقط في حجم ثقب مرة واحدة، ولكن يمكن قياسه عدة مرات في كافة مراحل التجربة ثماني ساعات لفهم أفضل للديناميات إقحام.
4. ممثل النتائج
في هذا المثال، قارنا القدرة تخليص الظهارية من OVCA433 الأجسام الشبه الكروية المبيض خلية سرطان أن يكون التعبير الموهن من تالين-1 للسيطرة على OVCA433 الأجسام الشبه الكروية. وأضيفت OVCA433 الأجسام الشبه الكروية من كل مجموعة إلى صحن ماتيك التي تحتوي على ZT monolayers الخلية الظهارية. تم تصوير ستة الأجسام الشبه الكروية من كل مجموعة في كل 10 دقائق لمدة ثماني ساعات (الشكل 4، الفيلم 3، فيلم 4). وتم قياس الثقوب التي تنتج في أحادي الطبقة من الأجسام الشبه الكروية ونشر وبلغ متوسط ست وظائف من كل مجموعة. الشكل 4 يوضح أن منطقة المتوسط التي أنشأتها إزالة الأجسام الشبه الكروية تالين ضربة قاضية 1 هو أقل بكثير من متوسط المساحة التي أوجدتها سيطرة الأجسام الشبه الكروية، مما يوحي بأن هناك حاجة لإزالة تالين الظهارية بواسطة OVCA433 الأجسام الشبه الكروية سرطان المبيض.
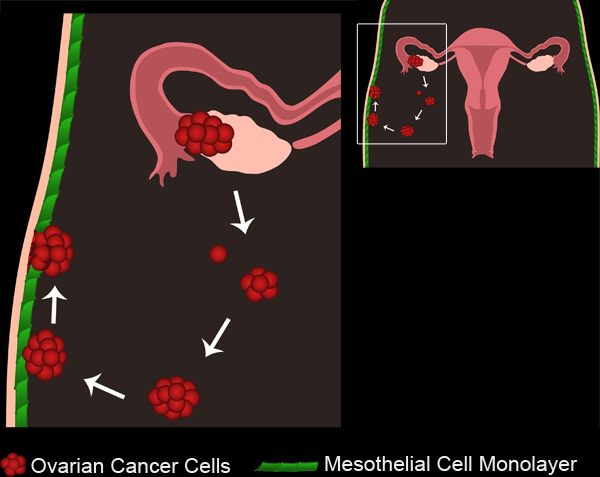
الشكل 1. المبيض الإنبثاث السرطان. أورام المبيض الأساسي تطوير إما من المبيض الظهارة السطحية أو قناة فالوب. الخلايا السرطانية / مجموعات قطع من الورم الرئيسي، وجمع في التجويف البريتوني. ويمكن بعد ذلك الخلايا السرطانية تجميعها لتشكيل الأجسام الشبه الكروية المتعددة الخلايا. الأجسام الشبه الكروية نعلق بعد ذلك إلى الخلية الظهارية المبطنة monolayers التجويف البريتوني. وتستبعد الخلايا الظهارية من تحت كروي سرطان المبيض المرفقة، والسماح للالأجسام الشبه الكروية للوصول إلى الغشاء القاعدي الأساسي.
فيلم سرطان المبيض 1. الإنبثاث. انقر هنا لعرض الفيلم .
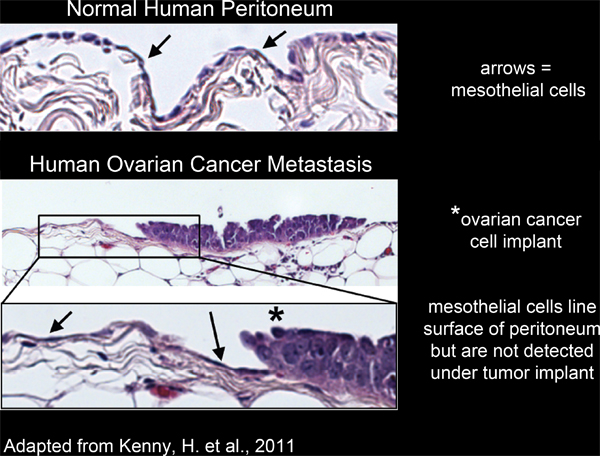
الشكل 2. خط الخلايا الظهارية سطح النسيج البريتوني الإنسان ومستبعدون من عملية زرع المبيض تحت الخلايا السرطانية.
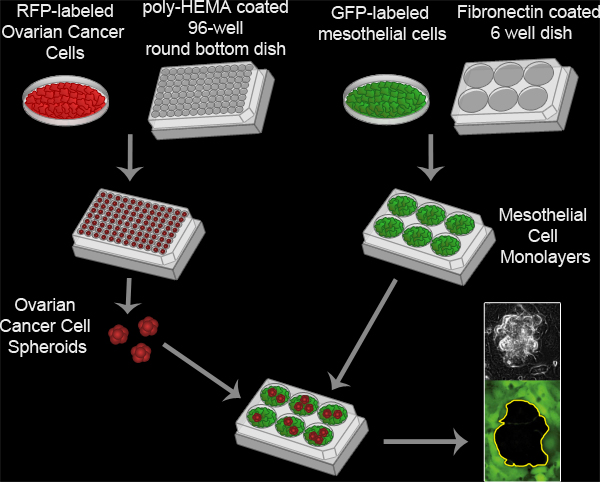
الشكل 3. الظهارية الفحص التخليص. وتتشكل الأجسام الشبه الكروية سرطان المبيض بواسطة احتضان 100 طلب تقديم العروض في التعبير عن خلايا سرطان المبيض لكل بئر في بولي HEMA مطلي 96 جولة جيدا قاع طبق ثقافة في 37 درجة مئوية لمدة 16 ساعة. بولي HEMA يمنع الخلايا من الالتصاق على طبق ثقافة، والسماح للخلايا البقاء في التعليق والالتزام بعضها البعض لتشكيل كتلة واحدة لكل بئر. وتعد الخلايا الظهارية monolayers بواسطة الطلاء 6x10 5 خلايا الظهارية لكل بئر في فبرونيكتين المغلفة 6 ماتيك طبق بشكل جيد واحتضان لوحة عند 37 درجة مئوية لمدة 16 ساعة. ثم يتم نقل الأجسام الشبه الكروية على طبق ماتيك مع أحادي الطبقة الظهارية والتقط السكان الخلية 2 كل 10 دقائق لمدة 8 ساعات باستخدام TI-E نيكون أناnverted الميكانيكية Widefield الإسفار الوقت الفاصل بين المجهر والبرمجيات عناصر.
فيلم 2. الظهارية الفحص التخليص. انقر هنا لعرض الفيلم .
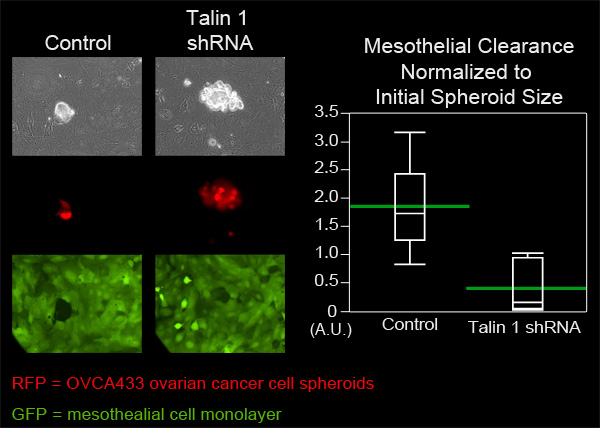
الشكل 4. التوهين من التعبير 1 في تالين OVCA433 الأجسام الشبه الكروية الظهارية يقلل قدرة التطهير. وسمح OVCA433 الأجسام الشبه الكروية (الحمراء) مع وبدون التعبير الموهن من تالين 1 إلى نعلق على وغزو إلى أحادي الطبقة الظهارية 1 ZT (الخضراء). والتقط سكان الخلية 2 كل 10 دقائق لمدة 8 ساعات باستخدام TI-E نيكون مقلوب الميكانيكية Widefield الإسفار الوقت الفاصل بين المجهر والبرمجيات العناصر. ويبين الرسم البياني أن تالين 1 توهينانخفاضات كبيرة في تخليص الخلية الظهارية (مؤامرة Quantile مع أشرطة خضراء على وسائل).
فيلم 3. التحكم OVCA433 الأجسام الشبه الكروية (الحمراء) في غزو أحادي الطبقة الظهارية (الخضراء). انقر هنا لعرض الفيلم .
فيلم 4. التوهين من التعبير 1 في تالين OVCA433 الأجسام الشبه الكروية (الحمراء) يقلل الظهارية (الخضراء) قدرة التطهير. انقر هنا لعرض الفيلم .
Discussion
في "الفحص التخليص الظهارية" المعروضة هنا يستخدم الوقت الفاصل بين المجهري لرصد تفاعلات الأجسام الشبه الكروية سرطان المبيض المتعددة الخلايا والخلايا الظهارية monolayers، في رائعة من التفصيل المكاني والزماني. سابقا، كانت عدة مجموعات تستخدم 8-14 المقايسات نقطة ال...
Disclosures
ليس لدينا ما يكشف.
Acknowledgements
نود أن نشكر التصوير نيكون المركز في كلية الطب بجامعة هارفارد، ووترز على وجه التحديد جينيفر، لارا Petrak والسلمون ويندي، لتدريب واستخدام المجاهر timelapse بهم. ونود أيضا أن نشكر روزا نج وبيسير أكيم لإجراء مناقشات ذات قيمة. وأيد هذا العمل من قبل المعاهد الوطنية للصحة جرانت 5695837 (إلى م. Iwanicki) وGM064346 إلى JSB، عن طريق منحة من ميريام والدكتور شيلدون اديلسون زاي للبحوث الطبية مؤسسة (لJSB).
Materials
| Name | Company | Catalog Number | Comments |
| الكاشف | شركة | فهرس العدد | تعليقات |
| OVCA433 خلايا سرطان المبيض | هدية من الدكتور دنيس سلامون | ||
| ZT الخلايا الظهارية | هدية من الدكتور تان اينس | ||
| متوسط 199 | Gibco | 19950 | |
| MCDB105 | خلية تطبيقات شركة | 117-500 | |
| FBS حرارة المعطل | Gibco | 10082 | |
| القلم بكتيريا | Gibco | 15070 | |
| 96 لوحات جيدة | كورنينج Costar | 3799 | |
| هيدروكسي إيثيل ميثاكريليت (بولي HEMA) | سيجما ألدريتش | 192066-25G | لبولي HEMA حل حل 6mg بولي HEMA مسحوق في 1ml من EtOH 95٪ |
| EtOH | Pharmco-aaper | 111ACS200 | تمييع إلى 95٪ في DH 2 0 |
| خلية ثقافة غطاء محرك السيارة | Nuaire | NU-425-300 | |
| نسيج الثقافة الحاضنة | الحرارية العلمية | 3110 | |
| حاضنة للبولي HEMA لوحات | آلات Labline | الامبراطورية الثالث 305 | |
| منضدية الطرد المركزي | هيراوس | 75003429/01 | |
| 6 كذلك الزجاج قاع طبق | ماتيك كورب. | P06G-1.5-20-F | |
| فبرونيكتين | سيغما | F1141-1MG | |
| برنامج تلفزيوني | Cellgro | 21-040-CV | |
| Timelapse المجهر: | |||
| مجهر | نيكون | TI-E بمحركات الإسفار معكوس الوقت الفاصل بين مجهر المتكاملة مع نظام التركيز مثالي | |
| عدسة | نيكون | 20X-0.75 apeture العددية | |
| الهالوجين transilluminator | نيكون | 0.52 NA مسافة العمل الطويلة مكثف | |
| الإثارة وانبعاث مرشحات | صفاء مرشحات مرور واحد في السكن نيكون | GFP تحويلة 480/40، إم 525/50 RFP-mCherry تحويلة 575/50 إم 640/50 | |
| أحال وEpifluoresce مسار الضوء | سوتر | ذكي مصاريع | |
| خطي ترميز مرحلة بمحركات | نيكون | ||
| كاميرا جهاز تبريد مشحونة، بالإضافة | هاماماتسو | ORCA-AG | |
| مجهر غرفة حضانة مع تحكم في درجة الحرارة وثاني أكسيد الكربون 2 | مبنية خصيصا | ||
| اهتزاز العزلة طاولة | TMC | ||
| شيكل، عناصر البرنامج | نيكون | الإصدار 3 |
References
- Jemal, A. . CA Cancer J. Clin. 59, 225-249 (2009).
- Ries, L. G., Melbert, D., Krapcho, M., Stinchcomb, D. G., Howlader, N., Horner, M. J., Mariotto, A., Miller, B. A. . SEER Cancer Statistics Review, 1975-2005. , (2007).
- Burleson, K. M. Ovarian carcinoma ascites spheroids adhere to extracellular matrix components and mesothelial cell monolayers. Gynecol. Oncol. 93, 170-181 (2004).
- Birbeck, M. S., Wheatley, D. N. An Electron Microscopic Study of the Invasion of Ascites Tumor Cells into the Abdominal Wall. Cancer Res. 25, 490-497 (1965).
- Witz, C. A., Monotoya-Rodriguez, I. A., Schenken, R. S. Whole explants of peritoneum and endometrium: a novel model of the early endometriosis lesion. Fertil. Steril. 71, 56-60 (1999).
- Zhang, X. Y. Characteristics and growth patterns of human peritoneal mesothelial cells: comparison between advanced epithelial ovarian cancer and non-ovarian cancer sources. J. Soc. Gynecol. Investig. 6, 333-340 (1999).
- Kenny, H. A., Nieman, K. M., Mitra, A. K., Lengyel, E. The First Line of Intra-abdominal Metastatic Attack: Breaching the Mesothelial Cell Layer. Cancer Discovery. 1, 100-102 (2011).
- Niedbala, M. J., Crickard, K., Bernacki, R. J. Interactions of human ovarian tumor cells with human mesothelial cells grown on extracellular matrix. An in vitro model system for studying tumor cell adhesion and invasion. Exp. Cell. Res. 160, 499-513 (1985).
- Kenny, H. A., Krausz, T., Yamada, S. D., Lengyel, E. Use of a novel 3D culture model to elucidate the role of mesothelial cells, fibroblasts and extra-cellular matrices on adhesion and invasion of ovarian cancer cells to the omentum. Int. J. Cancer. 121, 1463-1472 (2007).
- Ksiazek, K. Senescent peritoneal mesothelial cells promote ovarian cancer cell adhesion: the role of oxidative stress-induced fibronectin. Am. J. Pathol. 174, 1230-1240 (2009).
- Burleson, K. M., Boente, M. P., Pambuccian, S. E., Skubitz, A. P. Disaggregation and invasion of ovarian carcinoma ascites spheroids. J. Transl. Med. 4, 6-6 (2006).
- Heyman, L. Vitronectin and its receptors partly mediate adhesion of ovarian cancer cells to peritoneal mesothelium in vitro. Tumour. Biol. 29, 231-244 (2008).
- Heyman, L. Mesothelial vitronectin stimulates migration of ovarian cancer cells. Cell. Biol. Int. 34, 493-502 .
- Lessan, K., Aguiar, D. J., Oegema, T., Siebenson, L., Skubitz, A. P. CD44 and beta1 integrin mediate ovarian carcinoma cell adhesion to peritoneal mesothelial cells. Am. J. Pathol. 154, 1525-1537 (1999).
- Leroy-Dudal, J., Heyman, L., Gauduchon, P., Carreiras, F. Adhesion of human ovarian adenocarcinoma IGROV1 cells to endothelial cells is partly mediated by the alphav integrins-vitronectin adhesive system and induces an alteration of endothelial integrity. Cell. Biol. Int. 29, 482-488 (2005).
- Leroy-Dudal, J. Transmigration of human ovarian adenocarcinoma cells through endothelial extracellular matrix involves alphav integrins and the participation of MMP2. Int. J. Cancer. 114, 531-543 (2005).
- Iwanicki, M. Ovarian cancer spheroids use myosin-generated force to clear the mesothelium. Cancer Discovery. 1, 144-157 (2011).
- Folkman, J., Moscona, A. Role of cell shape in growth control. Nature. 273, 345-349 (1978).
- Gregoire, L., Munkarah, A., Rabah, R., Morris, R. T., Lancaster, W. D. Organotypic culture of human ovarian surface epithelial cells: a potential model for ovarian carcinogenesis. In Vitro Cell Dev. Biol. Anim. 34, 636-639 (1998).
- Roberts, P. C. Sequential molecular and cellular events during neoplastic progression: a mouse syngeneic ovarian cancer model. Neoplasia. 7, 944-956 (2005).
- Okada, T., Okuno, H., Mitsui, Y. A novel in vitro assay system for transendothelial tumor cell invasion: significance of E-selectin and alpha 3 integrin in the transendothelial invasion by HT1080 fibrosarcoma cells. Clin. Exp. Metastasis. 12, 305-314 (1994).
- Zervantonakis, I. K., Kothapalli, C. R., Chung, S., Sudo, R., Kamm, R. D. Microfluidic devices for studying heterotypic cell-cell interactions and tissue specimen cultures under controlled microenvironments. Biomicrofluidics. 5, 13406-1310 (2011).
- Brandt, B. 3D-extravasation model -- selection of highly motile and metastatic cancer cells. Semin. Cancer Biol. 15, 387-395 (2005).
- Condeelis, J., Segall, J. E. Intravital imaging of cell movement in tumours. Nat. Rev. Cancer. 3, 921-930 (2003).
- Dai, J., Ting-Beall, H. P., Hochmuth, R. M., Sheetz, M. P., Titus, M. A. Myosin I contributes to the generation of resting cortical tension. Biophys. J. 77, 1168-1176 (1999).
- Laferriere, J., Houle, F., Taher, M. M., Valerie, K., Huot, J. Transendothelial migration of colon carcinoma cells requires expression of E-selectin by endothelial cells and activation of stress-activated protein kinase-2 (SAPK2/p38) in the tumor cells. J. Biol. Chem. 276, 33762-33772 (2001).
- Dong, C., Slattery, M. J., Rank, B. M., You, J. In vitro characterization and micromechanics of tumor cell chemotactic protrusion, locomotion, and extravasation. Ann. Biomed. Eng. 30, 344-355 (2002).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved