A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
العزلة والثقافة من خلايا الفئران العصبية الجنينية: بروتوكول سريعة
In This Article
Summary
وصفنا منهجية السريع لعزل والثقافة الخلايا العصبية قرن آمون والقشرة من أجنة القوارض. هذا البروتوكول يسمح لنا لإجراء تجارب التي يلزم فيها الثقافات العصبية نقي تقريبا.
Abstract
نحن تصف طريقة سريعة لفصل الخلايا العصبية قرن آمون والثقافة أو من أجنة الفئران القشرية E15-17. ويمكن تطبيق هذا الإجراء بنجاح إلى العزلة من الفأر والخلايا العصبية الأولية الإنسان والأسلاف العصبية. تتم المحافظة على الخلايا العصبية في فصل المصل خالية المتوسطة تصل إلى عدة أسابيع. ويمكن استخدام هذه الثقافات لnucleofection، كيمياء سيتولوجية مناعية، الأحماض النووية الإعداد، وكذلك الكهربية. ويمكن أيضا أن أقدم الثقافات العصبية يمكن transfected مع معدل كفاءة جيدة من خلال تنبيغ lentiviral، وأقل كفاءة، مع فوسفات الكالسيوم أو للدهون، على أساس أساليب مثل lipofectamine.
Protocol
1. بولي-D-ليسين (PDL): إعداد
- أضف 5 مل من عقيم O 2 DDH إلى 5 ملغ من PDL للحصول على حل الأوراق المالية من 1 ملغ / مل.
- خلط الأوراق المالية عن طريق حل pipetting عدة مرات.
- استخدامها على الفور أو تخزين بولي-D-يسين الحل في 2-8 درجة مئوية.
2. بولي-D-ليسين (PDL): صحون بلاستيك طلاء الثقافة الخلية
- تمييع الحل الأوراق المالية PDL مع عقيم O 2 DDH إلى تركيز النهائي من 10 ميكروغرام / مل.
- ماصة حل كاف في طبق 60 مم لتغطية ثقافة مساحة (3 مل لطبق مم 60).
- صخرة بلطف لضمان طلاء حتى من سطح الثقافة.
- احتضان لوحات مغلفة في درجة حرارة الغرفة (RT) بين عشية وضحاها.
- في اليوم التالي، وعادة في اليوم من تشريح، وإزالة الحل بولي-D-يسين بواسطة طموح وتغسل لفترة وجيزة مع 3 مل من معقم O. 2 DDH كرر هذه الخطوة. بعد غسل الثاني، إزالة المياه تماما من الطموح.
- ويمكن تخزين لوحات في 4 درجة مئوية لمدة تصل إلى ثلاثة أسابيع.
3. بولي-D-ليسين (PDL) وLaminin: إعداد وطلاء الزجاج من مجلسين الشرائح
- حلول المخزون مزيج PDL (1 ملغ / مل) وlaminin (1 ملغ / مل) في عقيم O 2 DDH إلى تركيز النهائي من 10 و 5 ميكروغرام / لتر، على التوالي.
- ماصة حل كاف في آبار من كوب من مجلسين الشرائح لتغطية مساحة ثقافة (1 مل لكل بئر من 2 كوب جيد من مجلسين الشرائح).
- صخرة بلطف لضمان طلاء حتى من سطح الثقافة.
- احتضان لوحات مغلفة في RT بين عشية وضحاها.
- في اليوم التالي، وإزالة حل طلاء بولي-D-ليسين، Laminin عبر طموح وتغسل مرتين لفترة وجيزة مع 1 مل من معقم O. 2 DDH بعد غسل الثاني، إزالة المياه تماما من الطموح.
- ويمكن تخزين الشرائح في غرفة درجة مئوية (4) لتصل إلى ثلاثة أسابيع.
ملاحظة: يمكن أن تطلى أي انزلاق حجرة زجاجية يلي: ·ز هذا البروتوكول. نحن غالبا ما تستخدم الشرائح من مجلسين لأن كل شريحة يوفر الإعداد ضبط اختبار تجريبي (غير المعالجة على سبيل المثال مقابل معاملة، مقابل untransfected transfected).
4. تشريح العصبية والثقافة
- تدفئة الكواشف التالية في 37 درجة حمام ماء C:
- TrypLE Express على الأصلي زجاجة 100 مل.
- Neurobasal/B27 المتوسطة كاملة (انظر الجدول الأول). حجم تحسنت يعتمد على عدد من الأطباق لتكون مطلية (على سبيل المثال 30 مل لمدة عشرة أطباق مطلي 60 مم).
- أضف 3 مل من البرد حل E السبات إلى أربعة أطباق ثقافة 60 ملم و 13 مل إلى 15 مل BD الصقر عالية الوضوح أنبوب البولي بروبلين مخروطي.
- إضافة 25-30 مل من المتوسط تشريح الباردة (انظر الجدول الثاني، والدكتور اوليمبيا ميوتشي، والاتصالات الشخصية) إلى كل من ثلاثة أطباق ثقافة 100 ملم. وسيتم استخدام هذه اللوحات، التي تحتوي على كمية كبيرة من المتوسط، لغسل الأجنة على الفور بعد هذهإزالة من الحويصلات الذي يحيط بالجنين (خطوات 4.7 و 4.8).
- الموت ببطء 1 جرذ توقيت E17 حامل بواسطة CO 2 وفقا للسياسة العامة للخدمات الصحية في الرعاية الإنسانية واستخدام الحيوانات المختبرية وتحت رعاية الحيوان وافق مؤسسيا واستخدام بروتوكول.
- رش أسفل البطن مع EtOH 70٪ وخفض بشكل إعلامي عن طريق الجلد والعضلات مع زوج من مقص تعريض الرحم والأجنة.
- إزالة جميع الأجنة ووضعها في صحن 100 ملم تحتوي على معقم وجود فائض من متوسط تشريح الباردة (25-30 مل، انظر الخطوة 4.3).
- قطع أجنة باستخدام زوج من مقص صغير من الكيس الأمنيوسي ووضعها في صحن 100 مم ثانية تحتوي على البارد المتوسط تشريح.
- غسل الأجنة في درجة حرارة الغرفة عن طريق إمالة بلطف طبق 100 ملم للحصول على 5-10 ثواني. ثم، ونقل الأجنة المشطوفة إلى طبق 3 100 ملم تحتوي على تشريح المتوسطة. اثنان يغسل في المتوسط فائض وعادة ما تكون كافية لإزالة كل آثار دماء. ومع ذلك، إذا NECايساري، ويغسل مرة أخرى باستخدام الطازجة 100 ملم تحتوي على صحن 25-30 مل من المتوسط تشريح الباردة.
- باستخدام ملقط stereomicroscope والمنحنية، واستخراج كل دماغ الجنين الفئران من خلال الانسحاب من الجلد والجمجمة. وضع دماغ كامل في واحد من أطباق من عيار 60 ملم (عادة، مع عدم وجود ما يزيد على 5 في أدمغة طبق) مع هاء السبات الباردة حافظ على هذه اللوحات على الجليد.
- تأخذ طبق واحد في وقت واحد، وتحت مجهر تشريح، تفصل بين نصفي الكرة الأرضية وعزل القشور الدماغي إزالة المخ الأوسط والسحايا.
- اختياري: أدمغة قطع على طول خط الوسط، واستخراج الحصين، واتبع الإجراء أدناه لعزل الخلايا العصبية قرن آمون.
- جمع كل القشور تشريح في أنبوب 15 مل مخروطي الشكل واضحة تحتوي على 13 مل من البرد السبات E. اترك القشور الدماغي على الجليد حتى يتم الانتهاء من جميع التشريح. نظرا لصغر حجمها، ويمكن جمعها الحصين تشريح في أنبوب إيبندورف 1.5 مل بدلا من أنبوب 15 مل. إذا رغبت، في هذه الخطوة أو القشوريمكن وضعها الحصين في قارورة تحتوي على cryotube 1 مل من حالة السبات E + 2٪ B27 + جنتاميسين (50 ميكروغرام / مل) + Fungizone (250 نانوغرام / مل) في نسبة 2-4 القشور أو 2-4 الحصين لكل قنينة. ويمكن تخزين أنسجة المخ في 4 درجات مئوية في الظلام لمدة تصل إلى أسبوع واحد (في وقت لاحق مرات لم يتم اختباره بعد). عند الحاجة، واستخدام الملقط غرامة لنقل أنسجة المخ إلى أنبوب 15 مل تحتوي على إسبات E ثم اتبع بروتوكول أدناه لعزل الخلايا العصبية.
- نقل أنبوب إلى نسيج ثقافة غطاء محرك السيارة. السماح للالقشور لتستقر في قاع الأنبوب ثم إزالة بعناية وطاف.
- إضافة 13 مل من E إسبات جديدة للأنبوب 15 مل مخروطي الشكل، والسماح القشور تسوية في الجزء السفلي من الأنبوب وإزالة بعناية وطاف. كرر هذه الخطوة 2 أكثر من مرة، وبعد غسل الماضي، وإزالة بعناية جميع وسائل الإعلام.
- هضم إنزيمي القشور الدماغي وذلك بإضافة 1-2 مل (اعتمادا على عدد من القشور، واستخدام أقل لعزل الحصين) من آر دافئypLE اكسبرس. ختم غطاء للأنبوب مع Parafilm وتطفو الأنبوب في حمام الماء ° 37 مئوية لمدة 10 دقائق.
- رش أنبوب مع الايثانول 70٪ قبل فتح الغطاء وإضافة 10 مل من E. إسبات السماح للالقشور ليستقر على مستوى الجزء السفلي من أنبوب وإزالة طاف. كرر هذه الخطوة ثلاث مرات لغسل TrypLE اكسبرس. في الخطوة الأخيرة، وإزالة بعناية جميع وسائل الإعلام.
- يسحن بلطف (4-5 مرات) على القشور في 2 مل من Neurobasal/B27 المتوسطة كاملة باستخدام النار زجاج المصقول باستور (حوالي 1 ملم في القطر). نتوخى الحذر لتجنب الفقاعات.
- أكرر مرة أخرى 4-5 مع ماصة باستير زجاج أصغر العقيمة في القطر (أي ماصة حول 1/2-3/4 مم في القطر). لا تستخدم ماصة باستير أصغر من هذا أو أنه سيتم تدمير الخلايا.
- السماح للقطع ما تبقى من نسيج (عموما قليلة جدا، إن وجدت) لتسوية.
- نقل العلوي وحيدة الخلية تعليق على أنبوب 15 مل من جديد، تاركا وراءه قطعة من النسيج تسويتها. فروذر تمييع تعليق خلية ما يصل إلى 10-12 مل مع Neurobasal/B27 المتوسطة كاملة.
- تخلط جيدا وتخفف من الخلايا لحساب من قبل واضاف ان 10 ميكرولتر من تعليق خلية إلى 490 ميكروليتر من محلول العد 50X (انظر الجدول الثالث) في أنبوب 1،5 مل إيبندورف.
- لوحة الخلايا في PDL المغلفة لوحات في كثافة من 5.0 X 10 4 / سم 2. إذا nucleofection التي يتعين القيام بها، ونحن نوصي تصفيح الخلايا في أعلى تركيز (8-10 × 10 4 / سم 2).
- عادة، نحن تشريح 9-10 الأجنة في التجربة، كما وتستمد ما يقرب من 13 × 10 6 الخلايا العصبية من كل جنين E17. إذا هناك حاجة لمزيد من الأجنة، تأكد من أن الإجراء بأكمله لا تستمر أكثر من ساعتين.
- إذا رغبت، بعد 24 ساعة من العزلة، يمكن إضافة 10 ميكرون من السيتوزين-β-D-arabinofuranoside (أراك) إلى كل طبق، وذلك لمنع انتشار الأسلحة النووية الغروية. ومع ذلك، لا يلزم هذه الخطوة منذ Neurobasal/B27 المتوسطة يمنع انتشار الدبقية، وفقا لتوصيات الشركة الصانعة (إينفيتروجن / Gibco).
- ويمكن استخدام الخلايا العصبية في التجارب بعد 4-5 أيام في المختبر، على الرغم من أن الوقت المحدد يتوقف على مرحلة التمايز المطلوب. لدينا مثقف الخلايا العصبية لمدة تصل إلى 4 أسابيع من دون حدوث انخفاض كبير في البقاء على قيد الحياة (الشكل 1).
- لاستزراع الموسع، استبدال زراعة المتوسط كل أسبوع مع متوسط Neurobasal/B27 الطازجة كاملة.
5. ممثل النتائج
يمكن أن تتعرض الخلايا العصبية مثقف على الشرائح غرفة زجاجية لكيمياء سيتولوجية مناعية. ويظهر الشكل 1 صورة نموذجية من إحدى الخلايا العصبية القشرية يحدد بعد خمسة أيام في الثقافة وimmunolabeled مع المضادة للMAP-2 الأجسام المضادة لاظهار العمليات العصبية.
ويبين الشكل 2 صورة ممثل العصبون 1 قرن آمون الفئران بعد 3 أسابيع في الثقافة. وسلط الضوء على مورفولوجيا الخلايا العصبية من خلية متمايزة تماما بالخريطة-2 أناmmunolabeling (MAP-2 علامة العصبية، استنساخ فأر ريتوكسيماب AP-20، جين تكس، ارفين، كاليفورنيا)، وبعد إجراء موحدا كما هو موضح سابقا 1. وكانت الصور التي تصور مع المجهر الكسوف نيكون E400 مضان تستقيم مجهزة EXI أكوا الكاميرا (Qimaging)، المزودة بمحركات Z المحور، واكتساب SlideBook5 / deconvolution البرمجيات (ذكي التصوير الابتكارات، وشركة، ودنفر، أول أكسيد الكربون). وdeconvoluted سلسلة من التقاط صور ثلاثية الأبعاد من كل صورة فردية لصورة ثنائية الأبعاد واحدة وحلها عن طريق ضبط قطع إشارة إلى كثافة القصوى القريب لزيادة القرار.
ويبين الشكل 3 نقاء الثقافات العصبية. وقد تم الحصول على البروتين من ثقافات lysates الفئران DIV7 العصبية (CTX) ومن حالة من ورم أرومي دبقي الإنسان (GBM). كما هو متوقع، المحللة العصبية هو إيجابي بقوة للبروتين الخلايا العصبية MAP-2 و سلبية على GFAP علامة نجمي، في حين أن البروتين المحللة الخليج للحاسبات الآلية و هو سلبيأو MAP-2 وايجابية GFAP.
على الرغم من أن في بروتوكول لدينا ونحن قد تستخدم اسبت E لعدة سنوات كما تشريح والشطف المتوسط، مؤخرا يتعين علينا استكشاف الاستخدام إضافية وعملية للغاية من ذلك للحفاظ على أنسجة المخ لاستخدامها مرة أخرى. ويوضح الشكل 4 أيام في المختبر 5 (DIV5) ثقافة من الخلايا العصبية الفئران القشرية معزولة عن القشور الاحتفاظ بها في درجة مئوية (4) لمدة أسبوع واحد في حالة السبات E + B27 بعد تشريح الأصلية من الأجنة. ومطلي الخلايا العصبية على الزجاج من مجلسين الشرائح المغلفة مع PDL وlaminin كما هو موضح سابقا. وكان deconvoluted صورة المكتسبة باستخدام SlideBook5 اقتناء البرمجيات / deconvolution على النحو المبين أعلاه (الشكل 2).

الشكل 1. صورة الممثل من إحدى الخلايا العصبية القشرية nucleofected مع pmaxGFP (Amaxa، Lonza، Walkersville، دكتوراه في الطب)، وimmunolabeled مع خطة عمل البحر المتوسط-2 الأجسام المضادة، في الحمراء. التكبير 100X الأصلي.
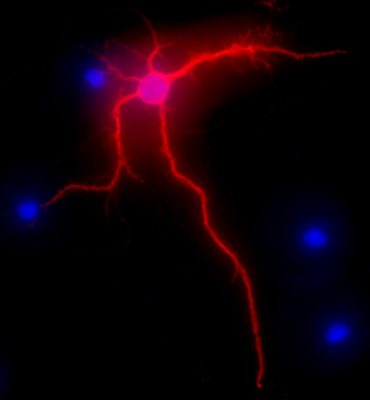
الشكل 2. صورة الممثل تظهر خارطة-2 الوسم المناعي، في الحمراء، من الخلايا العصبية قرن آمون بعد 3 أسابيع في الثقافة. تلوين دابي، في الزرقاء، ويظهر النوى الخلوية. الأصلي تكبير 40X.

لطخة غربية الرقم 3. يظهر نقاء من مزارع الخلايا العصبية. تم فصل 30 ميكروغرام من الخلايا العصبية والبشرية الفئران lysates بروتين الخليج للحاسبات الآلية من قبل الكهربائي وتخضع للتحليل لطخة غربية فقا للإجراءات العادية 1. كان معاديا للGFAP الضد المضادة للخارطة-2 كان الأرنب بولكلونل من الخلايا مما يشير الى (دانفرز، MA)، ماوس وحيدة النسيلة من Chemicon (ميليبور، فالجهاز يبث اشعة تماثل، MA)، والفأر وحيدة النسيلة المضادة للأجسام المضادة GRB2 كان من مختبرات تنبيغ دينار بحريني ( الشرر، MD). وقد استخدم GRB2 كعنصر تحكم التحميل.

صور الممثل الشكل 4. أيام في المختبر 5 (DIV5) العصبونات القشرية الفئران التي تم الحصول عليها من القشور ترك في حالة السبات E + B27 عند 4 درجة مئوية لمدة اسبوع بعد تشريح لها. أ) المرحلة النقيض من الخلايا العصبية مثقف على كوب من مجلسين الشريحة. الأصلي تكبير 20X. B) المناعي يظهر التعبير عن خارطة-2 في العمليات العصبية، في الخضراء، وثقافة وسلبية على GFAP علامة نجمي. تلوين دابي، في الزرقاء، يشير إلى النواة الخلوية. الأصلي تكبير 40X.
Discussion
ووصف طريقة تشريح وثقافة من الخلايا العصبية الفئران قرن آمون والقشرة هنا يتيح إجراء التجارب باستخدام الخلايا العصبية الثقافات نقي تقريبا نمت في المتوسط محددة الصفات كيميائيا (الشكل 3). وعلى الرغم من بروتوكولات لزراعة الخلايا العصبية في مصل الدم النقي تقر...
Disclosures
الإعلان عن أي تضارب في المصالح.
Acknowledgements
نشكر يونا اليس للحصول على مساعدة التحرير. وأيد المشروع التي وصفها عدد جائزة R01MH079751 (PI: F. بيروتزي) من المعهد الوطني للصحة العقلية. المحتوى هو فقط من مسؤولية الكتاب ولا تمثل بالضرورة وجهة النظر الرسمية للمعهد الوطني للصحة العقلية أو المعاهد الوطنية للصحة.
Materials
| Name | Company | Catalog Number | Comments |
| الكاشف | تركيز | ||
| Neurobasal | 98٪ | ||
| B27 | 2٪ | ||
| Glutamax | 0.5 ملم |
الجدول أولا Neurobasal/B27 المتوسطة كاملة.
| الكاشف | تركيز |
| جلوكوز | 16 ملم |
| سكر القصب | 22 ملم |
| HEPES | 10 ملي |
| كلوريد الصوديوم | 160 مم |
| بوكل | 5 ملم |
| نا 2 هبو 4 | 1 مم |
| KH 2 PO 2 | 0.22 ملي |
| جنتاميسين | 50 ميكروغرام / مل |
| Fungizone | 250 نانوغرام / مل |
| درجة الحموضة | 7.4 |
| الأسمولية | 320-330 mOsm |
الجدول الثاني. تشريح المتوسط.
| الكاشف | حجم (ميكرولتر) |
| Neurobasal/B27 المتوسطة كاملة | 240 |
| التريبان البقع الزرقاء بنسبة 0.4٪ | 250 |
| مجموع | 490 |
الجدول الثالث. 50X عد حل.
الجدول الرابع. الكواشف محددة.
| الكاشف | شركة | القط. عدد |
| السبات E | Brainbits | 767171 |
| Neurobasal | Gibco، إينفيتروجن | 21103-049 |
| B27 | Gibco، إينفيتروجن | 17504-044 |
| Fungizone | Gibco، إينفيتروجن | 15290-018 |
| جنتاميسين سلفات | سيجما ألدريتش | G1264 |
| Glutamax 200 ملي مول | Gibco، إينفيتروجن | 35050 |
| TrypLE اكسبريس ث / س أحمر الفينول | Gibco، إينفيتروجن | 12604 |
| السيتوزين-β-D-arabinofuranoside هيدروكلوريد | سيجما ألدريتش | C6645 |
| بولي-D-ليسين | سيجما ألدريتش | P6407 |
| Laminin 1 ملغ / مل | ميليبور | CC095 |
| HEPES | سيجما ألدريتش | H3375 |
| التريبان البقع الزرقاء بنسبة 0.4٪ | Gibco، إينفيتروجن | 15250 |
| معدات | شركة | القط. عدد |
| ستيريو المجهر | أوليمبوس | SZ61 |
| كبير الملقط | FST | 11022-14 |
| غرامة ذات الرؤوس ملقط | موريا | MC40B |
| الدقيقة غرامة ذات الرؤوس ملقط | موريا | MC31 |
| أسلاك شائكة حادة مقص | Roboz | RS-6820 |
| الدقيقة مقص تشريح | FST | 91460-11 |
| الجزئي تشريح مقص منحني | FST | 14067-11 |
| زجاج 2 غرفة الشرائح | مختبر تيك | 154461 |
| 60 أطباق مم | دينار بحريني الصقر | 353002 |
| 100 ملم الأطباق | كورنينج | 430167 |
| 15 مل من أنابيب | دينار بحريني الصقر | 352099 |
| 1.5 مل البرد أنبوب قارورة | نونك | 375353 |
الجدول خامسا معدات محددة.
References
- Aprea, S. Tubulin-mediated binding of human immunodeficiency virus-1 Tat to the cytoskeleton causes proteasomal-dependent degradation of microtubule-associated protein 2 and neuronal damage. J. Neurosci. 26, 4054-4062 (2006).
- Kivell, B. M., McDonald, F. J., Miller, J. H. Serum-free culture of rat post-natal and fetal brainstem neurons. Brain Res. Dev. Brain Res. 120, 199-210 (2000).
- Kivell, B. M., McDonald, F. J., Miller, J. H. Method for serum-free culture of late fetal and early postnatal rat brainstem neurons. Brain Res. Brain Res. Protoc. 6, 91-99 (2001).
- Brewer, G. J. Serum-free B27/neurobasal medium supports differentiated growth of neurons from the striatum, substantia nigra, septum, cerebral cortex, cerebellum, and dentate gyrus. J. Neurosci. Res. 42, 674-683 (1995).
- Banker, G., Goslin, K. . Culturing nerve cells. , (1998).
- Eletto, D. Inhibition of SNAP25 expression by HIV-1 Tat involves the activity of mir-128a. J. Cell Physiol. 216, 764-770 (2008).
- Gualco, E. IGF-IR-dependent expression of Survivin is required for T-antigen-mediated protection from apoptosis and proliferation of neural progenitors. Cell Death Differ. 17, 439-451 (2010).
- Gage, F. H. Survival and differentiation of adult neuronal progenitor cells transplanted to the adult brain. Proc. Natl. Acad. Sci. U.S.A. 92, 11879-11883 (1995).
- Keyser, D. O., Pellmar, T. C. Synaptic transmission in the hippocampus: critical role for glial cells. Glia. 10, 237-243 (1994).
- Pfrieger, F. W., Barres, B. A. Synaptic efficacy enhanced by glial cells in vitro. Science. 277, 1684-1687 (1997).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved