A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
انتاج ناقلات Lentiviral للخلايا Transducing من الجهاز العصبي المركزي
In This Article
Summary
في هذا البروتوكول وصفنا الإنتاج، وتنقية ومعايرة ناقلات lentiviral. ونحن نقدم مثالا على lentiviral إيصال الجينات ناقلات بوساطة في الخلايا العصبية مثقف الابتدائي والنجمية. وقد طرقنا تنطبق أيضا على أنواع الخلايا الأخرى في المختبر و في الجسم الحي.
Abstract
Efficient gene delivery in the central nervous system (CNS) is important in studying gene functions, modeling neurological diseases and developing therapeutic approaches. Lentiviral vectors are attractive tools in transduction of neurons and other cell types in CNS as they transduce both dividing and non-dividing cells, support sustained expression of transgenes, and have relatively large packaging capacity and low toxicity 1-3. Lentiviral vectors have been successfully used in transducing many neural cell types in vitro 4-6 and in animals 7-10.
Great efforts have been made to develop lentiviral vectors with improved biosafety and efficiency for gene delivery. The current third generation replication-defective and self-inactivating (SIN) lentiviral vectors are depicted in Figure 1. The required elements for vector packaging are split into four plasmids. In the lentiviral transfer plasmid, the U3 region in the 5' long terminal repeat (LTR) is replaced with a strong promoter from another virus. This modification allows the transcription of the vector sequence independent of HIV-1 Tat protein that is normally required for HIV gene expression 11. The packaging signal (Ψ) is essential for encapsidation and the Rev-responsive element (RRE) is required for producing high titer vectors. The central polypurine tract (cPPT) is important for nuclear import of the vector DNA, a feature required for transducing non-dividing cells 12. In the 3' LTR, the cis-regulatory sequences are completely removed from the U3 region. This deletion is copied to 5' LTR after reverse transcription, resulting in transcriptional inactivation of both LTRs. Plasmid pMDLg/pRRE contains HIV-1 gag/pol genes, which provide structural proteins and reverse transcriptase. pRSV-Rev encodes Rev which binds to the RRE for efficient RNA export from the nucleus. pCMV-G encodes the vesicular stomatitis virus glycoprotein (VSV-G) that replaces HIV-1 Env. VSV-G expands the tropism of the vectors and allows concentration via ultracentrifugation 13. All the genes encoding the accessory proteins, including Vif, Vpr, Vpu, and Nef are excluded in the packaging system. The production and manipulation of lentiviral vectors should be carried out according to NIH guidelines for research involving recombinant DNA (http://oba.od.nih.gov/oba/rac/Guidelines/NIH_Guidelines.pdf). An approval from individual Institutional Biological and Chemical Safety Committee may be required before using lentiviral vectors. Lentiviral vectors are commonly produced by cotransfection of 293T cells with lentiviral transfer plasmid and the helper plasmids encoding the proteins required for vector packaging. Many lentiviral transfer plasmids and helper plasmids can be obtained from Addgene, a non-profit plasmid repository (http://www.addgene.org/). Some stable packaging cell lines have been developed, but these systems provide less flexibility and their packaging efficiency generally declines over time 14, 15. Commercially available transfection kits may support high efficiency of transfection 16, but they can be very expensive for large scale vector preparations. Calcium phosphate precipitation methods provide highly efficient transfection of 293T cells and thus provide a reliable and cost effective approach for lentiviral vector production.
In this protocol, we produce lentiviral vectors by cotransfection of 293T cells with four plasmids based on the calcium phosphate precipitation principle, followed by purification and concentration with ultracentrifugation through a 20% sucrose cushion. The vector titers are determined by fluorescence- activated cell sorting (FACS) analysis or by real time qPCR. The production and titration of lentiviral vectors in this protocol can be finished with 9 days. We provide an example of transducing these vectors into murine neocortical cultures containing both neurons and astrocytes. We demonstrate that lentiviral vectors support high efficiency of transduction and cell type-specific gene expression in primary cultured cells from CNS.
Protocol
1. التعبئة والتغليف من ناقلات Lentiviral
ويتم إنتاج النواقل Lentiviral بواسطة cotransfection من ناقلات نقل lentiviral والبلازميدات الأخرى اللازمة للتغليف في الخلايا 293T بواسطة فوسفات الكالسيوم طريقة ترنسفكأيشن. نحن نستخدم 10 زراعة الأنسجة 100 ملم أطباق في هذا البروتوكول. يمكن زيادتها إلى أعلى أو إلى أسفل اعتمادا على التطبيقات. يتم الحفاظ على خط خلية 293T في النسور Dulbecco والمتوسطة معدلة (DMEM) مع ارتفاع نسبة الجلوكوز (4500 ملغم / لتر)، على أن تستكمل مع المصل 10٪ بقري جنيني (FBS)، والوحدات 100 / البنسلين مل، 100 ميكروغرام / مل الستربتوميسين في 37 درجة مئوية حاضنة مع 5٪ CO 2.
- البذور 293T الخلايا في التقاء 30-40٪ إلى 10 100 ملم أطباق زراعة الأنسجة (3 × 10 6 خلية / طبق) في ثقافة المتوسط. عودة إلى الخلايا الحاضنة.
- بعد ثقافة ح 20-24، والتحقق من كثافة الخلية. وينبغي أن الخلايا تكون حوالي 80٪ التقاء في وقت ترنسفكأيشن.
- يعد أنبوب 50 مل. إضافة 4.4 مل TE79/10 (1 ملم TrisHCl، 0.1 مليEDTA، ودرجة الحموضة 7.9) ناقص مجموع حجم الحمض النووي للبلازميد التالية. إضافة 100 ميكروغرام نقل lentiviral البلازميد (الشكل 1)، و 58 ميكروغرام pMDLg / pRRE، 31 ميكروغرام pCMV-G، 25 ميكروغرام pRSV، القس، 600 ميكروليتر 2M CaCl 2. اخلطي برفق.
- إعداد أنبوب آخر 50 مل. إضافة 5 مل 2X HBS (0.05 HEPES متر، 0.28 متر كلوريد الصوديوم، 1.5 مم نا 2 هبو 4، ودرجة الحموضة 7.12).
- أخذ الحمض النووي CaCl 2 خليط بنسبة 10 مل ماصة وإضافة إلى أنبوب يحتوي على 2 × HBS، قطرة قطرة بينما vortexing الأنبوب.
- الحفاظ على رد فعل هطول الأمطار في درجة حرارة الغرفة (RT) لمدة 30 دقيقة.
- إزالة أطباق ثقافة من الحاضنة. خلط رد فعل هطول الأمطار بشكل جيد من قبل vortexing. إضافة 1 مل من التعليق على كل الخلايا طبق 100 ملم تحتوي على. ويجب ان يضاف تعليق ببطء، في حين يحوم نقطه نقطه بلطف المتوسطة في طبق. عودة هذه الأطباق إلى الحاضنة وتترك لمدة 5 ساعات.
- إزالة المتوسطة من الثقافة. إضافة 6 مل المتوسطة ثقافة جديدة تحتوي على 6 ملم بو الصوديومtyrate إلى كل طبق. عودة إلى حاضنة للثقافات. بعد ثقافة بين عشية وضحاها، اذا كان هناك مراسل فلوري في التصور، والتحقق من مراسل التعبير الجيني تحت المجهر الفلورسنت. عادة، أكثر من 80٪ من الخلايا التعبير عن الجين المراسل إذا كان مدفوعا من قبل أحد المروجين في كل مكان (مثل CMV المروج).
- يومين (40-44 ساعة) بعد ترنسفكأيشن، جمع طاف في الفترة من 10 إلى أطباق أنابيب 50 مل 2 (حوالي 30 مل كل أنبوب). تجميد طاف في -80 درجة مئوية الثلاجة أو انتقل إلى الخطوة التالية.
2. تركيز وتنقية المتجهات
- أجهزة الطرد المركزي والتي تم جمعها طازجة أو إذابة طاف ب 900 غرام (حوالي 2000 دورة في الدقيقة) لمدة 10 دقيقة لإزالة أي حطام خلية في طاف.
- تعلق حقنة 60 مل إلى 0.2 ميكرون فلتر حقنة SFCA. نقل طاف من 50 مل أنبوب إلى الحقنة. تصفية طاف في polyallomer أنبوب الطرد المركزي.
- تأخذ 5 مل السكروز 20٪ (على استعداد في برنامج تلفزيوني) حتى في ماصة 5 مل. أدخلماصة إلى الجزء السفلي من أنبوب الطرد المركزي التي تحتوي على طاف. إضافة ببطء في حل السكروز تحت طاف ناقلات. كرر هذه الخطوات لطاف من أنبوب آخر.
- منبذة طاف في 11000 دورة في الدقيقة و 4 درجات مئوية لمدة 4 ساعات مع الدوار بيكمان سوينغ SW28.
- إزالة طاف. إضافة 150 ميكروليتر اللاكتوز 4٪ (على استعداد في PBS) إلى كل أنبوب للطرد المركزي. Resuspend الكريات.
- نقل الناقل مركزة من جميع أنابيب الطرد المركزي لأنبوب 1.5 مل. ترك الأنبوب على الجليد لمدة 15 دقيقة.
- خلط تعليق بواسطة ناقلات pipetting. تدور مع microcentrifuge بأقصى سرعة (حوالي 16000 ز) لمدة 1 دقيقة.
- طاف نقل إلى أنبوب 1.5 مل جديد. تقسيم العينة النهائية في 20 aliquots ميكرولتر وخزنها في الثلاجة -80 درجة مئوية.
3. معايرة ناقلات
- البذور 5 × 10/4 أيضا من HT1080 الخلايا في 12 لوحة جيدا في 1 حبة متوسطة الحجم DMEM مل تستكمل مع FBS 10٪.
- بعد overnigحزب التحرير والثقافة، وتعول الخلايا من بئر واحدة ويسجل عدد الخلايا.
- جعل 5 أضعاف تخفيف مسلسل (1:5، 1: 25؛ 1:125، و 1:625) من ناقلات المركزة مع الثقافة المتوسطة. إضافة أنا ميكرولتر من كل ناقلات المخفف إلى آبار منفصلة. ويمكن تكرار هذه العينات لزيادة دقة.
- إضافة 1 ميكروليتر 4 ملغ / مل Polybrene (Hexadimethrine الميثيل) في كل متجه تحتوي بشكل جيد وفي بئر بدون ناقلات. مزيج من قبل يهز بلطف لوحة. العودة إلى الحاضنة لمدة 48 ساعة.
- إزالة المتوسطة من الآبار ثقافة الخلية. يغسل جيدا مع كل برنامج تلفزيوني. إضافة 250 ميكروليتر 1X trypsine-EDTA حل لهذه الخلايا. عندما يتم فصل الخلايا (3-5 دقيقة)، إضافة 1 مل الثقافة المتوسطة. Resuspend الخلايا بواسطة pipetting. نقل تعليق خلية إلى 1.5 مل أنابيب الطرد المركزي.
- الطرد المركزي في 900 غ لمدة 6 دقائق. لنواقل مع جين مراسل فلوري (على سبيل المثال GFP)، انتقل إلى الخطوة 3.7 لتحليل نظام مراقبة الأصول الميدانية. لنواقل بدون مراسل، انتقل إلى الخطوة 3.8 لqPCR الوقت الحقيقي.
- لنواقل تحتوي على fluorescent الجين المراسل، وإزالة طاف وresuspend وبيليه مع 300 ميكرولتر من الفورمالدهايد 3.7٪ في برنامج تلفزيوني. تحديد نسبة الخلايا مراسل إيجابي عن طريق تحليل نظام مراقبة الأصول الميدانية. وسيتم تمثيل وحدات عيار تنبيغ في المليلتر المركزة ناقلات (TU / مل).
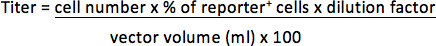
على سبيل المثال، إذا كان transduced 1 × 10 5 الخلايا مع ميكروليتر 1/25 (0.04 ميكرولتر) النواقل والخلايا 30٪ من مراسل إيجابي، سوف يكون من عيار:
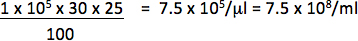
فقط استخدام التخفيفات تقع في وجود علاقة خطية بين النسبة المئوية للخلايا إيجابية وكمية ناقلات وأضاف لحساب عيار. يجب أن يكون عيار النهائي في المتوسط من التتر تم الحصول عليها من transductions من لا يقل عن 2 كميات مختلفة من الناقل.
- لنواقل دونفلوري مراسل الجينات، واستخراج الحمض النووي الجيني من HT1080 الخلايا باستخدام الحمض النووي QIAamp البسيطة كيت (QIAGEN) وفقا لبروتوكول الشركة المصنعة. تضخيم تسلسل ناقلات في الحمض النووي الجيني باستخدام ABI بريزم الكشف عن تسلسل 7000 نظام (النظم البيولوجية التطبيقية) مع الاشعال (HIV-1 في منطقة PBS / PSI 17) 5'-CCGTTGTCAGGCAACGTG-3 "و 5'-3-AGCTGACAGGTGGTGGCAAT '، ومسبار TaqMan 5 '-FAM-AGCTCTCTCGACGCAGGACTCGGC-طمرة-3 ". وقد تضخمت أيضا الجين الزلال الذي هو نسخة واحدة الجينات في الجينوم (2 نسخة / خلية) مع 5'-TGAAACATACGTTCCCAAAGAGTTT-3 الاشعال "و5'-3-CTCTCCTTCTCAGAAAGTGTGCATAT '، وتحقيق 5'-FAM-TGCTGAAACATTCACCTTCCATGCAGA-3-طمرة 'باعتبارها الرقابة الداخلية. تحديد أعداد نسخة من النواقل والزلال بواسطة PCR في لوحة 96-جيدا وفقا لتعليمات تصنيع مع البرنامج التالي: 50 درجة مئوية لمدة 2 دقيقة و 95 درجة مئوية لمدة 10 دقيقة، و 35 دورات من 95 درجة مئوية لمدة 15 ثانية و 60 درجة مئوية لمدة 2 دقيقة. عشرة أضعاف التخفيفات المسلسل من البلازميدات من تركيز معروف (ممثلة نسخةعدد) التي تحتوي على وينبغي أيضا تسلسل قالب يتم تضخيمها لخلق منحنى القياسية لتقدير حجم العينات غير معروف. وسيتم تمثيل عيار وحدات التكامل في المليلتر المركزة ناقلات (وحدة دولية / مل).
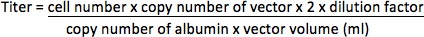
4. تنبيغ من الثقافات القشرة المخية الحديثة
وتعد الثقافات القشرة المخية الحديثة تحتوي على كل من الخلايا العصبية والدبقية من القشور فأر باستخدام إجراء الطلاء على مرحلتين كما هو موضح سابقا 18. ومطلي Neocortices تم الحصول عليها من الأجنة في الفئران الحمل أيام 14-16 على أحادي الطبقة 1 الدبقية المحددة سابقا في الفنزويلية استكمال FBS 10٪، 20 ملم والجلوكوز الجلوتامين 2 ملم في 24-جيدا نسيج لوحة الثقافة.
- بعد 5 أيام في المختبر، إضافة 10 ميكرومتر السيتوزين الأرابينوزيد (آرا-C) في neocثقافة ortical لمنع عدم انقسام الخلايا العصبية. تواصل ثقافة الخلايا لمدة 2 ايام.
- دافئ الثقافة المتوسطة في 37 درجة مئوية ماء الحمام ل5-10 دقيقة. استبدال آرا-C تحتوي على المتوسط مع الثقافة المتوسطة الطازجة (500 ميكروليتر / جيد).
- إضافة ناقلات مع وزارة الداخلية المطلوب (تعدد عدوى، ونسبة من عدد الجسيمات الموجه إلى عدد الخلايا المستهدفة) للثقافة. تواصل الثقافة لمدة 24 ساعة. نحن نستخدم وزارة الداخلية من 1-10 (5 عادة) في الثقافات القشرية الأولية.
- استبدال الثقافة المتوسطة مع المتوسطة الطازجة. تواصل ثقافة. إذا كان هناك جينات مراسل في التركيبة ناقلات، والتحقق من الخلايا تحت المجهر الفلورسنت 2 بعد أيام تنبيغ. وسوف مراسل التعبير الجيني في الخلايا العصبية تكون مرئية 2-7 بعد تنبيغ، اعتمادا على تصميم ناقلات والجرعة المستخدمة.
5. ممثل النتائج
والتتر من ناقلات lentiviral المنتجة مع هذا النطاق بروتوكول 10 8 -10 10 وحدة دولية / مل، whicح هي مناسبة لتنبيغ من مجموعة متنوعة من أنواع الخلايا من الجهاز العصبي المركزي على حد سواء في التجارب المختبرية والحية. الجدول رقم 1 ورقم 2 وتظهر نتيجة لممثل باستخدام ناقلات التي ينتجها هذا البروتوكول. نحن transduced الثقافات القشرة المخية الحديثة الفئران مع ناقلات lentiviral التعبير عن بروتين فلوري الخضراء (GFP) التي تسيطر عليها المروج (SYN) synapsin أو الغروية بروتين حمضي لييفي المروج (GFAP). سبعة أيام بعد تنبيغ، أجرينا المناعية إلى الخلايا العصبية والخلايا النجمية التسمية مع أضداد NeuN ومكافحة GFAP، على التوالي. كما هو مبين في الجدول 1 والشكل. 2A، بعد تنبيغ مع ناقلات تحمل المروج synapsin، أكثر من 90٪ من الخلايا العصبية (NeuN + الخلايا) صريحة GFP والنجمية رقم (GFAP + الخلايا) التعبير عن هذا الجين المراسل. عندما يتم استخدام المروج GFAP في التركيبة ناقلات (الشكل 2B)، حوالي 80٪ من الخلايا النجمية (GFAP + الخلايا) EXPRESق GFP؛ جميع + الخلايا النجمية هي GFP كما أكده colocalization مع GFAP وغياب التعبير GFP في الخلايا NeuN المسمى. هذه النتائج تثبت أن ناقلات lentiviral هي فعالة جدا لتوصيل الجينات المحورة إلى خلايا من الجهاز العصبي المركزي وخلية محددة التعبير الجيني يمكن أن يتحقق عندما يتم استخدام المروجين المناسبة.
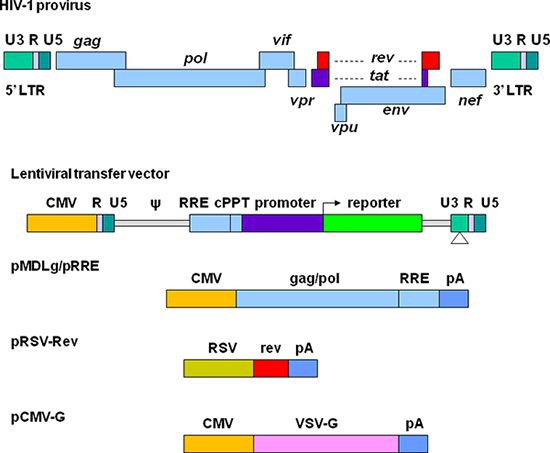
الشكل 1. التمثيل التخطيطي من فيروس نقص المناعة البشرية القائمة على المتجهات lentiviral والبلازميدات التعبئة والتغليف. ويرد-1 فيروس نقص المناعة البشرية طليعة الفيروس في الأعلى. يتم فصل العناصر لإنتاج متجه إلى أربع البلازميدات المختلفة. نقل lentiviral البلازميد يحتوي على هجين 5 'LTR التي يتم استبدال منطقة U3 مع المضخم للخلايا (CMV) مروج، إشارة التعبئة والتغليف (ψ)، وتسلسل RRE، المسالك polypurine المركزية (cPPT)، الجين من الفائدة (على سبيل المثال مراسل فلوري) جنبا إلى جنب مع أحد المروجين من خيار، وLTR 3 'فيهتتم إزالة تماما متواليات التنظيمية لرابطة الدول المستقلة من منطقة U3. pMDLg / pRRE يحتوي على هفوة والجينات بول وتسلسل RRE من HIV-1 تحت سيطرة المروج CMV. pRSV-القس يحتوي على تسلسل ترميز القس مدفوعا المروج RSV. pCMV-G تحتوي على جينات بروتين VSV الجميع تحت سيطرة المروج CMV. السلطة الفلسطينية يشير إلى إشارة تذييل بعديد الأدينيلات من الجينات β-غلوبين الإنسان.
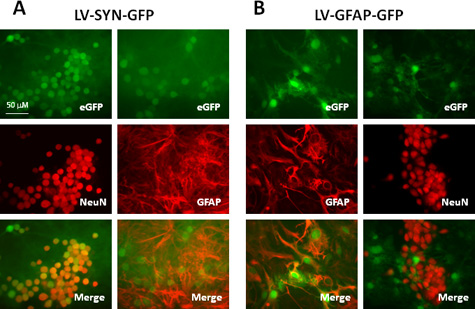
الشكل 2. transduced التعبير عن الجينات صحافي في ثقافة مختلطة الماوس القشرة المخية الحديثة مع ناقلات lentiviral تحمل خلية نوع محدد المروجين. وtransduced والثقافات مع LV-SYN-GFP (A) أو LV-GFAP-GFP ناقلات (B) في وزارة الداخلية من 5. سبعة أيام بعد تنبيغ، وimmunostained الخلايا مع الجسم المضاد المضادة للNeuN أو المضادة GFAP. لوحات تظهر العلوي GFP مضان، لوحات تظهر وسط المناعية ويتم دمج أدنى لوحات الصور (GFP: الأخضر؛ NeuN أو GFAP: أحمر).
| ناقلات | GFP + الخلايا في الخلايا العصبية | GFP + في الخلايا النجمية |
| LV-SYN-GFP | 92.2 ± 7.3 | 0 |
| LV-GFAP-GFP | 0 | 78،3 ± 11،5 |
الجدول رقم 1. transduced مقارنة التعبير GFP في الثقافات القشرة المخية الحديثة الفئران مع ناقلات تحمل lentiviral المروجين مختلف 1.
وtransduced 1 الثقافات الفئران القشرة المخية الحديثة (5 × 10 5 / جيد في 24 لوحة جيد) مع LV-SYN-GFP أو LV-GFAP GFP-1 في وزارة الداخلية من 5. سبعة أيام بعد تنبيغ، وثبتت الثقافات وimmunostained لNeuN أو GFAP. احصي عدد الخلايا GFP وNeuN / GFAP التعبير في الصور من 10 حقول في حالة تجريبية. القيم تمثل نسبة مئوية من الخلايا العصبية (NeuN + الخلايا) أوالنجمية (GFAP + الخلايا) الذي أعرب أيضا عن الجينات مراسل GFP. قيم أظهرت وسائل ± SD من ثلاث تجارب مستقلة.
Discussion
في هذا البروتوكول، لقد أظهرنا إنتاج النواقل lentiviral وتطبيق هذه النواقل في الثقافات القشرة المخية الحديثة. أثبتنا كفاءة وخلية نوع محدد تنبيغ مع الناقلة التي تنتجها هذه الأساليب. عندما يتم استخدام المروج synapsin، GFP التعبير بدقة الخلايا العصبية المحددة. عندما يتم استخدام ?...
Disclosures
الإعلان عن أي تضارب في المصالح.
Acknowledgements
وأيد هذا العمل من قبل المعاهد الوطنية للصحة منح العلوم العصبية الأساسية مخطط (P30 NS057105، المدارس الأردنية البريطانية) لجامعة واشنطن، برنامج مشروع المنح NS032636 (المدارس الأردنية البريطانية)، ومركز الأمل للاضطرابات العصبية.
Materials
| Name | Company | Catalog Number | Comments |
| اسم كاشف | شركة | فهرس العدد | |
| DMEM | سيغما الدريخ | D5796 | |
| MEM | إينفيتروجن | 11090-081 | |
| مصل بقري جنيني | Hyclone | SV3001403 | |
| برنامج تلفزيوني | Mediatech | 21-040-CM | |
| التربسين-EDTA | سيغما الدريخ | T3924 | |
| الصوديوم الزبدات | سيغما الدريخ | B5887 | |
| Hexadimethrine بروميد (Polybrene) | سيغما الدريخ | H9268 | |
| 293T الخلايا | ATCC | CRL-11268 | |
| HT1080 الخلايا | ATCC | CCL-121 | |
| فالكون 100 × 20 ملم أنسجة الثقافةه طبق | العلوم البيولوجية دينار بحريني | 353003 | |
| 1 × 3 ½ في أنبوب الطرد المركزي polyallomoer | بيكمان كولتر، | 326823 | |
| 0.2 ميكرون حقنة فلتر | كورنينج | 431219 | |
| QIAamp DNA البسيطة كيت | QIAGEN | 51304 |
References
- Naldini, L. In vivo gene delivery and stable transduction of nondividing cells by a lentiviral vector. Science. 272, 263-267 (1996).
- Zufferey, R. Self-inactivating lentivirus vector for safe and efficient in vivo gene delivery. J. Virol. 72, 9873-9880 (1998).
- Davidson, B. L., Breakefield, X. O. Viral vectors for gene delivery to the nervous system. Nat. Rev. Neurosci. 4, 353-364 (2003).
- Gascon, S., Paez-Gomez, J. A., Diaz-Guerra, M., Scheiffele, P., Scholl, F. G. Dual-promoter lentiviral vectors for constitutive and regulated gene expression in neurons. J. Neurosci. Methods. 168, 104-1012 (2008).
- Hioki, H. Efficient gene transduction of neurons by lentivirus with enhanced neuron-specific promoters. Gene Ther. 14, 872-882 (2007).
- Li, M. Optimal promoter usage for lentiviral vector-mediated transduction of cultured central nervous system cells. J. Neurosci. Methods. 189, 56-64 (2010).
- Naldini, L., Blomer, U., Gage, F. H., Trono, D., Verma, I. M. Efficient transfer, integration, and sustained long-term expression of the transgene in adult rat brains injected with a lentiviral vector. Proc. Natl. Acad. Sci. U.S.A. 93, 11382-11388 (1996).
- Blomer, U. Highly efficient and sustained gene transfer in adult neurons with a lentivirus vector. J. Virol. 71, 6641-6649 (1997).
- Consiglio, A. Robust in vivo gene transfer into adult mammalian neural stem cells by lentiviral vectors. Proc. Natl. Acad. Sci. U.S.A. 101, 14835-14840 (2004).
- Jakobsson, J., Ericson, C., Jansson, M., Bjork, E., Lundberg, C. Targeted transgene expression in rat brain using lentiviral vectors. J. Neurosci. Res. 73, 876-885 (2003).
- Arya, S. K., Guo, C., Josephs, S. F., Wong-Staal, F. Trans-activator gene of human T-lymphotropic virus type III (HTLV-III). Science. 229, 69-73 (1985).
- Sirven, A. The human immunodeficiency virus type-1 central DNA flap is a crucial determinant for lentiviral vector nuclear import and gene transduction of human hematopoietic stem cells. Blood. 96, 4103-4110 (2000).
- Burns, J. C., Friedmann, T., Driever, W., Burrascano, M., Yee, J. K. Vesicular stomatitis virus G glycoprotein pseudotyped retroviral vectors: concentration to very high titer and efficient gene transfer into mammalian and nonmammalian cells. Proc. Natl. Acad. Sci. U.S.A. 90, 8033-8037 (1993).
- Farson, D. A new-generation stable inducible packaging cell line for lentiviral vectors. Hum. Gene Ther. 12, 981-997 (2001).
- Broussau, S. Inducible packaging cells for large-scale production of lentiviral vectors in serum-free suspension culture. Mol. Ther. 16, 500-507 (2008).
- Wang, X., McManus, M. Lentivirus production. J. Vis. Exp. (32), e1499 (2009).
- Sastry, L., Johnson, T., Hobson, M. J., Smucker, B., Cornetta, K. Titering lentiviral vectors: comparison of DNA, RNA and marker expression methods. Gene Ther. 9, 1155-1162 (2002).
- Snider, B. J., Lobner, D., Yamada, K. A., Choi, D. W. Conditioning heat stress reduces excitotoxic and apoptotic components of oxygen-glucose deprivation-induced neuronal death in vitro. J. Neurochem. 70, 120-129 (1998).
- Mazarakis, N. D. Rabies virus glycoprotein pseudotyping of lentiviral vectors enables retrograde axonal transport and access to the nervous system after peripheral delivery. Hum. Mol. Genet. 10, 2109-2121 (2001).
- Kato, S. Neuron-specific gene transfer through retrograde transport of lentiviral vector pseudotyped with a novel type of fusion envelope glycoprotein. Hum. Gene Ther. 22, 1511-1523 (2011).
- Segura, M. M., Garnier, A., Durocher, Y., Ansorge, S., Kamen, A. New protocol for lentiviral vector mass production. Methods Mol. Biol. 614, 39-52 (2010).
- Kutner, R. H., Puthli, S., Marino, M. P., Reiser, J. Simplified production and concentration of HIV-1-based lentiviral vectors using HYPERFlask vessels and anion exchange membrane chromatography. BMC Biotechnol. 9, 10 (2009).
- Laughlin, M. A., Chang, G. Y., Oakes, J. W., Gonzalez-Scarano, F., Pomerantz, R. J. Sodium butyrate stimulation of HIV-1 gene expression: a novel mechanism of induction independent of NF-kappa B. J Acquir Immune Defic Syndr Hum Retrovirol. 9, 332-339 (1995).
- Gasmi, M. Requirements for efficient production and transduction of human immunodeficiency virus type 1-based vectors. J. Virol. 73, 1828-1834 (1999).
- Palsson, B., Andreadis, S. The physico-chemical factors that govern retrovirus-mediated gene transfer. Exp. Hematol. 25, 94-102 (1997).
- Lizee, G. Real-time quantitative reverse transcriptase-polymerase chain reaction as a method for determining lentiviral vector titers and measuring transgene expression. Hum. Gene Ther. 14, 497-507 (2003).
- Lee, J. K., Chung, J., McAlpine, F. E., Tansey, M. G. Regulator of G-Protein Signaling-10 Negatively Regulates NF-{kappa}B in Microglia and Neuroprotects Dopaminergic Neurons in Hemiparkinsonian Rats. J. Neurosci. 31, 11879-11888 (2011).
- Shevtsova, Z., Malik, J. M., Michel, U., Bahr, M., Kugler, S. Promoters and serotypes: targeting of adeno-associated virus vectors for gene transfer in the rat central nervous system in vitro and in vivo. Exp. Physiol. 90, 53-59 (2005).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved