A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
غير الغازية التصوير من المبيضات المنتشر في يرقات اسماك الزرد
In This Article
Summary
والتطوير السريع، وصغر حجمها والشفافية من الزرد هي مزايا هائلة لدراسة سيطرة المناعة الفطرية للعدوى 1-4. هنا علينا أن نبرهن تقنيات لاصابة يرقات اسماك الزرد باستخدام العوامل المسببة للأمراض الفطرية المبيضات البيض من جانب microinjection، المنهجية المتبعة في الآونة الأخيرة لتوريط بلعمية النشاط أوكسيديز NADPH في السيطرة على إزدواج الشكل الفطرية 5.
Abstract
المبيضات نشر الناجمة عن المبيضات البيض الممرض هي مشكلة هامة سريريا في المستشفى الأفراد ويترافق مع معدل وفيات 1 تعزى 30 إلى 40٪ 6. ويتم التحكم عادة المبيضات الأجهزة عن طريق المناعة الفطرية، والأفراد ذوي العيوب الوراثية في الخلايا المناعية الفطرية مكونات مثل NADPH أوكسيديز بلعمية هم اكثر عرضة لالمبيضات 7-9. ولا يعرف سوى القليل جدا عن القوى المحركة للC. وقد أنشأت المبيضة البيضاء التفاعل مع الخلايا المناعية الفطرية في الجسم الحي. واسعة في الدراسات المختبرية التي من خارج جيم المضيفة المبيضة البيضاء تنبت داخل الضامة، ويتم تدمير بسرعة من قبل العدلات 10-14. الدراسات في المختبر، على الرغم من المفيد، لا يمكن أن ألخص المجمع في بيئة الجسم الحي، والذي يتضمن الساعة التي تعتمد على ديناميات مستويات خلوى، التجهيزات المصفوفة خارج الخلية، والاتصالات بين الخلايا 10، 15-18 اليرقة الزرد توفر مجموعة الفقاريات وتنوعا فريدا لدراسة العدوى. عن ال 30 يوما الأولى من يرقات اسماك الزرد تنمية لديها دفاعات المناعة الفطرية فقط 2، 19-21، وتبسيط دراسة الأمراض مثل داء المبيضات نشر التي تعتمد اعتمادا كبيرا على الحصانة الفطرية. حجم صغير والشفافية من يرقات اسماك الزرد تمكين التصوير ديناميات العدوى على المستوى الخلوي لكل من المضيف والممرض. ويمكن استخدام اليرقات المعدلة وراثيا مع الاستشعاع خلايا المناعة الفطرية للتعرف على أنواع معينة الخلايا المشاركة في عدوى 22-24. ويمكن استخدام تعديل المضادة للإحساس [أليغنوكليوتيد] (Morpholinos) لاسقاط المكونات المناعية المختلفة مثل NADPH أوكسيديز بلعمية ودراسة التغيرات في الاستجابة لfungaل إصابة 5. بالإضافة إلى المزايا الأخلاقية والعملية لاستخدام أقل الفقاريات الصغيرة، ويرقات اسماك الزرد توفر إمكانية فريدة من نوعها لصورة معركة ضارية بين الممرض والمضيف على حد سواء وintravitally في اللون.
وقد استخدم الزرد إلى عدوى نموذج لعدد من البكتيريا المسببة للأمراض البشرية، وقامت بدور فعال في تقدم كبير في فهمنا للعدوى المتفطرات 3 و 25. ومع ذلك، إلا في الآونة الأخيرة أن العوامل الممرضة أكبر من ذلك بكثير مثل الفطريات قد استخدمت لنقل العدوى يرقة 5، 23، 26، وحتى الآن لم يكن هناك وصفا تفصيليا للمنهجية البصرية عدوى. هنا نقدم تقنيات لدينا microinjection بطين الدماغ المؤخر من الزرد 25 متزمت، بما في ذلك التعديلات التي نبذلها لالبروتوكولات السابقة. النتائج التي توصلنا إليها باستخدام نموذج الزرد اليرقات للعدوى فطرية تختلف من الدراسات في المختبر، وتعزيز الحاجة لدراسة intera المضيف الممرضction في البيئة المعقدة للمضيف بدلا من نظام مبسط للطبق بيتري 5.
Protocol
تم تنفيذ جميع البروتوكولات رعاية الزرد والتجارب تحت رعاية الحيوان المؤسسية واللجنة الاستخدام (IACUC) بروتوكول A2009-11-01.
1. Morpholino وصحون حقن اليرقات
تجريبية مدتها: * (10-15 دقيقة)
درجة الصعوبة: *
- لحقن البيض، ويعد حل الاغاروز 2٪ في ماء معقم والميكروويف. عندما يبرد المحلول صب بعض من ذلك في طبق بيتري عميق إضافية (فيشر العلمية) حتى يصبح كامل ونصف. بارد على الجليد، وتأكد من لوحة غير مستوى.
- مرة واحدة في صحن قد بردت، صب طبقة 15 مليلتر أعلى الاغاروز 2٪. رش حقنة بيضة مخدد قالب من البلاستيك (التكيفية أدوات العلوم) مع الماء المعقم من زجاجة رذاذ. بعناية وضع الجانب الأخدود العفن الى اسفل الاغاروز الساخنة. عندما الاغاروز قد بردت، واستخدام ملعقة معدنية مسطحة (VWR العلمية) لفصل القالب من الآغاوارتفع. إزالة ببطء الشبكة من الاغاروز. أطباق التفاف حقن الجنين في Parafilm (VWR العلمية)، ومخزن مقلوب في 4 درجة مئوية.
- لحقن يرقات الأسماك، ويعد حل الاغاروز 2٪ كما هو موضح. صب الحل في طبق بيتري حجم قياسي (VWR العلمية) وتوضع جانبا حتى يتصلب. أطباق التفاف حقن اليرقات في Parafilm وتخزين معكوسة في 4 درجة مئوية.
2. الفطرية الثقافة التحضير
تجريبية المدة: ** (30 دقيقة)
درجة الصعوبة: **
- إعداد خلاصة الخميرة، ببتون، سكر العنب (YPD) لوحات أجار: 10 جم / لتر خلاصة الخميرة، و 20 غرام / لتر ببتون، 20 الدكستروز جم / لتر، و 20 غرام / لتر في أجار والتعقيم. لتحضير السائل YPD 10 جم / لتر خلاصة الخميرة، و 20 البيبتون غ / ليتر، 20 الدكستروز جم / لتر ودقيقة الأوتوكلاف 20-30 في 121 درجة مئوية.
- قبل يومين من التهابات الأسماك إعداد لوحة من خط المجمدةأسهم الثقافات المبيضات البيض على أجار YPD للحصول على المستعمرات واحد.
- احتضان عند 37 درجة مئوية خلال الليل.
- وضع 5 مل مرق YPD إلى 16 × 150 ملم أنابيب ثقافة (VWR العلمي).
- قبل يوم من العدوى الأسماك اختيار 1 مستعمرة صغيرة على أجار YPD مع وتد خشبي (VWR العلمي). وضع العصا في أنبوب ثقافة وعباب في جميع أنحاء لاعادة تعليق مستعمرة في السائل YPD.
- تنمو بين عشية وضحاها في 37 درجة مئوية على طبل الثقافة أسطوانة TC-7 النسيج مجهز عجلة أنبوب اختبار قياس 14 بوصة (نيو برونزويك العلمي).
- في اليوم التالي، وتدور باستمرار 1 مل من ثقافة في ز 14000x لمدة 1 دقيقة في أنبوب مل 1.7 (Axygen). إزالة طاف وresuspend لبيليه في السائل المتبقي من vortexing (VWR العلمي).
- إضافة 1 مل 1X الفوسفات مخزنة المالحة (VWR العلمية) والدوران كما هو موضح سابقا.
- تكرار غسل PBS 3 مرات.
- تمييع 1:100 التخفيف في برنامج تلفزيوني 1X (10 ميكرولتر من المبيضة البيضاء جيم المغسول إلى 990 ف 1X ميكرولترBS).
- الاعتماد على عدادة الكريات (VWR العلمي).
- تمييع إلى 10 7 خلية / مل.
3. الزرد العدوى
تجريبية المدة: **** (1-3 ساعات)
درجة الصعوبة: ****
- جمع الأجنة وفقا للمادة (5) ومخزن في الماء البيض، و 60 ملغم / لتر أملاح المحيط الفورية (فيشر العلمية) في ماء منزوع الأيونات العقيمة.
- باستخدام مجهر تشريح مثل SZ61 أوليمبوس (أوليمبوس)، الأجنة dechorionate يوم عدوى. استخدم دومون Dumoxel ملاقط (VWR العلمي) لسحب المشيماء 27 بصرف النظر مثل فتح كيس من رقائق، أو كزة برفق ملاقط مغلقة في الموقف في المشيماء ثم فتح ببطء لهم. وينبغي للأسماك البوب الحق في الخروج من المشيماء.
- دوامة اضافية طبق بيتري عميق مع غطاء للتحرك على السمك في وسط الطبق. نقل الأسماك إلى غطاء الطبق. إزالة البيض والمياهاستبدال مع وسائل الاعلام الجديدة. إضافة إلى الأسماك وسائل الاعلام.
- دافئ أطباق حقن اليرقات في حاضنة عند 28 درجة مئوية. إعداد tricaine سلفونات الميثان (غرب الكيميائية شركة) في التخفيف 200 ميكروغرام / مل لالتخدير الأسماك.
- عد الى العدد المرغوب فيه من اليرقات للعدوى (20-50 الأسماك). وضع الأسماك في الميثان tricaine حل سلفونات وانتظر دقيقة 1-2 حتى يتوقف عن الحركة.
- تشغيل وحدة MPPI-3 حقن (الآلات العلمية التطبيقية). تأكد من أن مفتاح ضغط على "نبض" و "مدة النبضة" تم تعيين إلى 9 مع 3 PSI لوحدة احداهما. فتح صمام في خزان النتروجين حتى الضغط على وحدة حقن يقرأ 30 PSI.
- تحميل micropipette سحبت 28 مع 5 ميكرولتر من المبيضات البيض vortexed بتركيز 1x10 7 خلية / مل. وضع micropipette في حامل micropipette (الآلات العلمية التطبيقية). ملء فارغة إضافية طبق بيتري العميق مع المياه. نقل micropipette حتى غيض أناق في الرأي مجرد لمس سطح المياه عبر مجهر تشريح واستخدام دومون Dumoxel ملاقط (VWR العلمية) على قصاصة الإبرة نحو 3mm من غيض من ماصة وانسحبت.
- اضغط على مفتاح القدم (الآلات العلمية التطبيقية) للتحقق من تم قص إبرة. يجب أن تشاهد سائل تفريق إذا كانت ناجحة. وينبغي أن القطر من بلعة السائل يكون هناك اكبر من القطر من تلميذ من يرقة متزمت الزرد 25 (0.21 ملم، مما أسفر عن نطاق 4.9 NL في الحجم). ضبط الضغط وفقا لذلك إذا وبلعة السائل كبيرة جدا أو صغيرة جدا.
- تخدير السمك في سلفونات الميثان tricaine (200 ميكروغرام / مل). مرة واحدة قد توقفت السمكة تتحرك، ودوامة الطبق مع غطاء على وحتى الأسماك في المركز. جمع 50 الأسماك باستخدام ماصة نقل (فيشر العلمية). اضغط على جانب من ماصة لتسوية الأسماك نحو الحافة. ماصة بلطف السمك على طبق الاغاروز اليرقات باستخدام وسائل أقل قدر ممكن.
- خط السمك مع قضيب زجاج أملس (الحرص على عدم سحق منهم!). كما نضح السوائل قدر ممكن من خارج الصحن. استخدام KimWipe إلى ذبالة بعيدا أي رطوبة.
- وضع طبق السمك مع الاغاروز اليرقات تحت المجهر حتى تحصل على عرض جيد من السمك وإبرة لفي نفس الوقت. تحريك الإبرة زجاج نحو السمك. التكبير في الأسماك على حد سواء وإبرة كما قمت بوضع إبرة نحو السمك. تحرك بعناية الإبرة الزجاج في الحويصلة الأذنية 27، 29 (الأذن) من السمك أولا. عليك أن تعرف ذات مرة كنت قد انتقلت الإبرة في الأسماك لأنه عندما دفع التبديل القدم (الأدوات العلمية التطبيقية)، والبطين الدماغ المؤخر سوف ترفع قليلا.
- اضغط على مفتاح القدم (الآلات العلمية التطبيقية) ومشاهدة السائل داخل الدماغ المؤخر تفريق السمك بطين 27. سحب الإبرة من السمك والانتقال إلى الأسماك القادمة. كرر الإجراء حتى يكون لديك حقن كل من الاسماك على لوحة. إزالة أي دالأسماك EAD وحقن بدائل للحفاظ على العدد الصحيح (50 الأسماك). لكل مجموعة من 50 سمكة حقن يجب أن يكون مستعدا إبرة microinjection جديد، أو جيم لل المبيضة البيضاء يستقر في الجزء السفلي من إبرة ويسد عليه، أو رميات من تركيز حقن.
- يغسل السمك الخروج من طبق من الصيد في صحن والرش البيض الماء على الأسماك في بيئة نظيفة من خارج صحن بيتري العميقة التي تحتوي على 60 مل البيض في المياه. من المهم عدم ترك الأسماك على الاغاروز لمدة أطول من 15-20 دقيقة أو أنها سوف تجف وتموت.
- كرر كامل عملية الحقن حتى الانتهاء. ولا ننسى برنامج تلفزيوني وغير ممرضة تحقن الضوابط.
- عند الانتهاء، والحفاظ على الأسماك عند 28 درجة مئوية.
- إغلاق صمام خزان النيتروجين. نقل التبديل وحدة حقن من "نبض" و "مستمرة" لتخفيف الضغط في خط دبابة، يجب أن الضغط ينخفض إلى الصفر عند هذه النقطة. تبديل وحدة حقن مرة أخرى إلى "نبض". إيقاف تشغيل وحدة حقن وتنظيف منطقة العمل.
4. اعداد السمك للتصوير
تجريبية المدة: ** (30 دقيقة)
درجة الصعوبة: **
- إعداد tricaine حل سلفونات الميثان كما كان من قبل (200 ميكروغرام / مل). الخروج من الأسماك المصابة، وتحويلها إلى tricaine.
- إعداد 47.9 مل 0.4٪ منخفضة ذوبان الاغاروز (VWR العلمي) في مياه البيض. تسخين حل بواسطة الميكروويف. بارد إلى 37 درجة مئوية وإضافة سلفونات الميثان tricaine (200 ميكروغرام / مل) إلى خليط
- مرة واحدة يجمد السمك في سلفونات الميثان tricaine، ماصة الأسماك الفردية في طبق بيتري (VWR العلمية) التي تحتوي على 0.4٪ انخفاض ذوبان الاغاروز (VWR العلمي).
- المقبل، نقل الأسماك من الاغاروز ذوبان منخفضة في الآبار الفردية للزجاج صحن القاع (ماتيك شركة) للتصوير. كما استخدم القليل الاغاروز ذوبان أدنى مستوى ممكن وبالتالي فإن الأسماك شقة تقع في الجزء السفلي من صحن. فقط استخدام ما يكفي من tricaine-الاغاروز لملء فيالدوائر المجموع من الزجاج طبق أسفل.
5. التعديلات ذات الصلة إلى [جوف] بروتوكولات
بال micropipettes لMicroinjection
تجريبية مدتها: * (10-15 دقيقة)
درجة الصعوبة: *
- سحب قضبان الزجاج المجوف BF120-69-10 (آلات سوتر) باستخدام المشتعلة براون Micropipette بولير نموذج P-97 (سوتر الصكوك) وفقا ليوان وآخرون. 30. اختيار برنامج رقم 7 مع الحرارة الشروط التالية = 470، السرعة = 120، الوقت = 200. الإبرة الناتج هو 8 ملم من شطبة إلى طرف، ويثقب مرة في 3 مم فوق طرف لديه يبلغ قطرها حوالي 10 ميكرومتر.
- تحميل micropipette الزجاج في أقواس. حدد "سحب". فإن خيوط التدفئة تسخين الإبر وفقا لمعايير البرنامج وقضيب الزجاج سيفصل في اثنين بال micropipettes انسحبت. بال micropipettes مخزن في صندوق تخزين ماصة (Suttالصكوك إيه).
مجموعة جنين، حقن Morpholino والصيانة
مدة تجريبية: *** (1-2 ساعات)
درجة الصعوبة: ***
- جمع الأجنة وفقا لأساليب روزن وآخرون. 31. استخدام منخل البلاستيك (التركيبات من Knutsford) لجمع بيض التفريخ من الدبابة (الموائل المائية). عقد غربال رأسا على عقب على طبق بيتري عميق اضافية وشطف بالماء خزان لجمع البيض.
- لإعداد morpholino، إضافة الماء المعقم ميكرولتر 300 إلى 300 من nanomoles morpholino (GeneTools، ذ م م). هذا يعطي الأوراق المالية العاملة من 1.0 ملم.
- التحقق من تركيز morpholino باستخدام Nanodrop (الحرارية العلمية). حدد "الحمض النووي وتغيير نوع العينة إلى" الآخر الطول الموجي و "إلى 265. أدخل مستمر عن طريق ضرب الوزن الجزيئي للmorpholino بحلول عام 1000 مقسوما على absorptivitذ معامل المدرجة في الممتلكات morpholino ورقة بنسبة ضئيلة.
- فارغة في nanodrop مع 2 ميكرولتر حمض الهيدروكلوريك N 0.1. تمييع 5 ميكرولتر من الحل morpholino إلى 95 ميكرولتر من حمض الهيدروكلوريك N 0.1 (20x والتخفيف). ضع 2 ميكروليتر من التخفيف على قاعدة التمثال nanodrop والتدبير فوق. مضاعفة تركيز من قبل عامل تخفيف (20). هذا يعطي تركيز عمل morpholino. لحساب تركيز millimolar تقسيم تركيز حصل عليها الوزن الجزيئي للmorpholino.
- تعد الأوراق المالية العاملة في morpholino العازلة Danieau (58 مم كلوريد الصوديوم، 0.7 مم بوكل، 0.4 ملم MgSO 4، 0.6 ملم الكالسيوم (لا 3) 2، HEPES ملي 5.0، 7.6 درجة الحموضة) والفينول الحمراء 0.01٪ (VWR العلمي).
- للعمل حقن morpholino اتباع بروتوكول وفقا لروزن وآخرون (31). ويوان وآخرون. 30. شطف الأطباق حقن morpholino مع الماء الدافئ والبيض في 28 درجة مئوية لمدة 15 دقيقة. إزالة المياه من أطباق الحقن والتشكيلة 1-Cأجنة مرحلة ELL في أخاديد الطبق حقن (أعدت من القسم 1) مع ماصة نقل. وسوف تعقد كل لوحة ما يقرب من 250 بيضة. حقن 1-2 أجنة مرحلة الخلية مع morpholino. وسوف البيض تبقى في مرحلة واحدة خلية لمدة 15 27 دقيقة.
- شطف البيض مع حقن المياه عند الانتهاء من البيض (منزوع الأيونات الماء المعقم مع 60 ملغم / لتر أملاح المحيط فورية)، وتجري في 60 مل ماء البيض في أطباق بتري خارج عميق. يمكن إعادة استخدامها أطباق حقن Morpholino. التشطيف مع الماء البيض عند الانتهاء وتخزين معكوسة في 4 درجة مئوية.
- لتخزين الأجنة إضافة 60 مل البيض المياه إلى الطبق. عد الى 110 الأجنة مع ماصة نقل إلى فصل إضافي أطباق بتري عميق مع 60 مل من البيض في المياه. إضافة الميثيلين الأزرق 0.00003٪ لمنع نمو الجراثيم واحتضان الأجنة عند 28 درجة مئوية.
- لتسريع تنمية أجنة من الحفاظ على أطباق الجنين في 33 درجة مئوية لمدة 24 ساعة وفقا للمرحلة وآخرون كيميل (27).، مما يسمح للأجنة لتطوير لرئيسزاوية الجذع من 75 درجة (زم 25 مرحلة 27).
- للعمل عدوى اليرقات إبقاء الأجنة في 28 درجة مئوية بعد عن طريق الحقن مع جيم المبيضة البيضاء.
- كل يوم استبدال أطباق جنين مع 60 مل من المياه العذبة البيض.
التصوير
تجريبية مدتها: ***** (1-5 ساعات)
درجة الصعوبة: ***
- اعداد الاسماك في الاغاروز ذوبان منخفضة (وفقا للمادة 4.2) مع tricaine في أطباق زجاجية التصوير أسفل (ماتيك شركة) كما هو موضح سابقا. وضع طبق على تاسعا-81 أوليمبوس (أوليمبوس) مرحلة مجهر مقلوب. جلب الأسماك إلى التركيز تحت التكبير 4X تحت المقابل تدخل الفرق (DIC) ضوء. يمكن التقاط الصور في 20X، 4X، وتكبير 40X في مدينة دبي للإنترنت، TRITC (ميثيل ثيوسيانات رودامين)، وFITC (فلوريسئين الفصيلة) إعدادات التصفية
- استخدام التاسع-81 أوليمبوس المجهر المقلوب مع FV-1000 ليزر متحد البؤر المسح الضوئي وفقا للنظام وآخرون Ariga 32. إجراء دورات في وقت تكبير 40X من خلال وضع Z-مداخن مع شرائح ميكرومتر 1-1،5 في كل ساعة من الإصابة.
- لفترة طويلة وقت التصوير بالطبع من 2 ساعة أو أكثر، ووضع طبقة من الاغاروز ذوبان منخفض فوق السمك في طبق التصوير كل 2-3 ساعات. هذا يمنع الاغاروز من الجفاف وسحق الأسماك بينما يتم تصوير ذلك. لدورات وقت طويل مع عدد قليل من الأسماك، واستخدم في مرحلة ساخنة (Bioptechs شركة) للحفاظ على 28 درجة مئوية خلال العدوى.
6. ممثل النتائج
مثال على جيم الدماغ المؤخر البطين ناجح ويرد عدوى المبيضة البيضاء في يرقة الزرد في 5 ساعات ما بعد العدوى (HPI) و HPI 24 في (الشكل 1). بلعم تشبه الخلايا مع جيم اجتاحت وينظر الى المبيضة البيضاء في الدماغ المؤخر البطين في 5 HPI. بنسبة 24 HPI، C. المبيضة البيضاء داخل البلاعم، مثل خليةق في الأنسجة ذيل ظهري يدل على المبيضات نشرها. هذه نتيجة عدوى تعتمد بشكل كبير على حقنة دقيقة من خميرة جيم على شكل 10-15 المبيضة البيضاء إلى البطين الدماغ المؤخر. ويمكن فحص الأسماك المصابة فورا بعد الحقن ضمان ذلك.
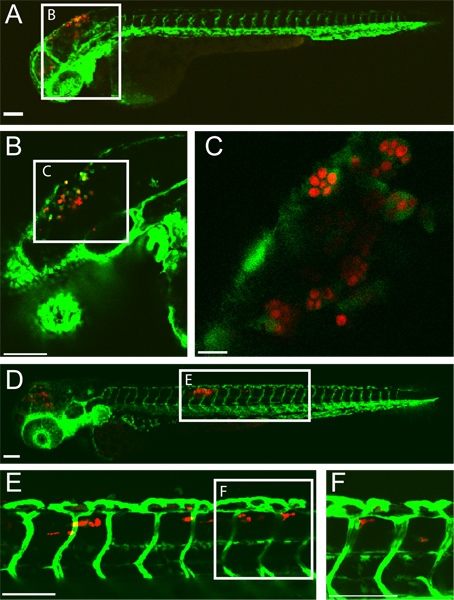
الشكل 1 المعدلة وراثيا fli1: EGFP 22 و 33 يرقة المصابين المبيضات البيض CAF2-yCherry والتقط intravitally بواسطة الفحص المجهري متحد البؤر. (ميلان) 5 ساعات ما بعد الإصابة (A) يرقة المصابة مع EGFP في التعبير عن مثل خلايا البلاعم في موقع الإصابة (الدماغ المؤخر البطين) شريط مقياس = 100 ميكرون. (B و C) وصور تضخم أعلى من السمك ذاته، والتي تبين C. المبيضة البيضاء داخل البالعات. مقياس شريط = 100 ميكرون للباء وجيم عن 10 ميكرومتر (مدافع) 24 ساعة بعد الإصابة (D) يرقة المصابة مع المبيضات نشرها مع CAF2-yCherry C. المبيضة البيضاء داخل لجنة الهدنة العسكرية EGFProphage تشبه الخلايا في الأنسجة الذيل ظهري. شريط مقياس = 100 ميكرون. (E و F) وصور تضخم أعلى من السمك ذاته، والتي تبين C. المبيضة البيضاء في ذيل الأنسجة. شريط مقياس = 100 ميكرون.
Discussion
طريقة microinjection الزرد المقدمة هنا يختلف عن Gutzman وآخرون (34). في ذلك هنا علينا أن نبرهن عن طريق حقن الحويصلة الأذنية إلى البطين الدماغ المؤخر من اليرقات HPF 36-48. الأسلوب وصفنا يسمح للحقن متسق من 10-15 الخميرة إلى البطين الدماغ المؤخر مع انخفاض تلف الأنسجة. هذا البروت...
Disclosures
الإعلان عن أي تضارب في المصالح.
Acknowledgements
فإن الكتاب أود أن أشكر مختبر الدكتور كارول كيم للتدريب microinjection، كلاريسا هنري لتقديم المشورة بشأن تسريع تطور الجنين واستخدام المعدات، وناثان لوسون للمساهمة fli1: EGFP الأسماك. ونحن نشكر أعضاء المختبر ويلر والحوائط شون لقراءة نقدية للمخطوطة. ونود أيضا أن نشكر مارك Nilan للرعاية الأسماك والمشورة، وريان Phennicie وجابور كريستين لتقديم المشورة الفنية في هذا المشروع. وقد تم تمويل هذا العمل من خلال مساعدة مالية البحوث MAFES إلى الإخوة ك، وهي هاتش MAFES منحة E08913-08، وجائزة NCRR المعاهد الوطنية للصحة P20RR016463 إلى يلر ر.
Materials
| Name | Company | Catalog Number | Comments |
| اسم كاشف | شركة | فهرس العدد | تعليق (اختياري) |
| التفريخ الدبابات | الموائل المائية | 2L | |
| 1.7 مل من أنابيب | Axygen | MCT-175-C | |
| لحظة المحيط | فيشر العلمية | S17957C | |
| إضافي عميق أطباق بتري | فيشر العلمية | 08-757-11Z | |
| معيار أطباق بتري | VWR العلمية | 25384-302 | |
| نقل ماصات | فيشر العلمية | 13-711-7M | |
| خلاصة الخميرة | VWR ScientiFIC | 90000-726 | |
| الببتون مادة تنشأ عن البروتينات | VWR العلمية | 90000-264 | |
| سكر العنب | فيشر العلمية | D16-1 | |
| أجار | VWR العلمية | 90000-760 | |
| يمكن التخلص منها عدادة الكريات | VWR العلمية | 82030-468 | |
| التخزين المؤقت فوسفات المالحة | VWR العلمية | 12001-986 | |
| دومون Dumoxel الملقط | VWR العلمية | 100501-806 | |
| خشبية المسامير | VWR العلمية | 10805-018 | |
| KimWipes | VWR العلمية | 300053-964 | |
| انخفاض تذوبالاغاروز | VWR العلمية | 12001-722 | |
| الاغاروز للأطباق حقن | VWR العلمية | 12002-102 | |
| المشتعلة براون Micropipette بولير | سوتر الآلات | P-97 | |
| قضبان الزجاج المجوف | سوتر الآلات | BF120-69-10 | لقضبان زجاج أملس عن طريق التسخين فوق الموقد بنسن |
| ماصة صندوق التخزين | سوتر الآلات | BX10 | |
| MPPI-3 نظام حقن | الأجهزة العلمية التطبيقية | MPPI-3 | |
| عودة وحدة الضغط | الأجهزة العلمية التطبيقية | حدة حراسة الحدود | |
| Micropipette حامل عدة | تطبيق صحيفةإد الأجهزة العلمية | MPIP | |
| قدم تبديل | الأجهزة العلمية التطبيقية | FSW | |
| Micromanipulator | الأجهزة العلمية التطبيقية | MM33 | |
| المغناطيسي قاعدة | الأجهزة العلمية التطبيقية | المغناطيسي قاعدة | |
| Tricaine الميثان سلفونات | الغربي الكيميائية المؤتمر الوطني العراقي. | MS-222 | |
| تشريح نطاق | أوليمبوس | SZ61 أعلى SZX-ILLB2-100 قاعدة | |
| متحد البؤر المجهر | أوليمبوس | تاسعا-81-1000 FV مع نظام المسح الضوئي ليزر متحد البؤر | |
| TC-7 أسطوانة الثقافة طبلة نسيج مع 14 بوصة عجلة أنبوب اختبار | نيو برونزويك العلمي | TC-7 | |
| التصوير صحون | شركة ماتيك | P24G-1.0-10-F | |
| نصائح ماصة للتحميل الإبر | إيبندورف | 930001007 | |
| شبكات لوحة سكب | التكيف أدوات العلم | TU-1 | |
| المرحلة الساخنة | Bioptechs المؤتمر الوطني العراقي. | دلتا T-5 | |
| شقة أداة البسط | VWR العلمية | 82027-486 | |
| البلاستيك المناخل | الأواني أون لاين Knutsford | 12 سم | |
| Parafilm | VWR العلمية | 52858-000 | |
| دوامة جيني | VWR العلمية | 14216-184 | |
| 16 × 150 مم الثقافة أنابيب | VWR العلمية | 60825-435 | |
| Nanodrop | الحرارية العلمية | ND 2000 | |
| الفينول الأحمر | VWR العلمية | 97062-478 | |
| حمض الهيدروكلوريك | VWR العلمية | 87003-216 | |
| كلوريد الصوديوم | VWR العلمية | BDH4534-500GP | |
| بوكل | VWR العلمية | BDH4532-500GP | |
| MgSO 4 | VWR العلمية | BDH0246-500GP | |
| كاليفورنيا (NO 3) 2 | VWR العلمية | BDH0226-500GP | |
| HEPES | VWR العلمية | BDH4520-500GP | |
| Morpholinos | GeneTools، ذ م م |
References
- Trede, N. S., Langenau, D. M., Traver, D., Look, A. T., Zon, L. I. The use of zebrafish to understand immunity. Immunity. 20, 367-379 (2004).
- Kanther, M., Rawls, J. F. Host-microbe interactions in the developing zebrafish. Curr. Opin. Immunol. 22, 10-19 (2010).
- Meeker, N. D., Trede, N. S. Immunology and zebrafish: spawning new models of human disease. Dev Comp Immunol. 32, 745-757 (2008).
- Tobin, D., May, R. C., Wheeler, R. T. Zebrafish: a see-through host and fluorescent toolbox to probe host-pathogen interaction. PLoS Pathog. , (2011).
- Brothers, K. M., Newman, Z. R., Wheeler, R. T. Live imaging of disseminated candidiasis in zebrafish reveals role of phagocyte oxidase in limiting filamentous growth. Eukaryot. Cell. 10, 932-944 (2011).
- Pfaller, M. A., Diekema, D. J. Epidemiology of invasive candidiasis: a persistent public health problem. Clin. Microbiol. Rev. 20, 133-163 (2007).
- Ashman, R. B. Innate versus adaptive immunity in Candida albicans infection. Immunol. Cell Biol. 82, 196-204 (2004).
- de Repentigny, L. Animal models in the analysis of Candida host-pathogen interactions. Curr. Opin. Microbiol. 7, 324-329 (2004).
- Rogers, T. J., Balish, E. Immunity to Candida albicans. Microbiol. Rev. 44, 660-682 (1980).
- Calderone, R., Sturtevant, J. Macrophage interactions with Candida. Immunol. Ser. 60, 505-515 (1994).
- Frohner, I. E., Bourgeois, C., Yatsyk, K., Majer, O., Kuchler, K. Candida albicans cell surface superoxide dismutases degrade host-derived reactive oxygen species to escape innate immune surveillance. Mol. Microbiol. 71, 240-252 (2009).
- Kumamoto, C. A., Vinces, M. D. Contributions of hyphae and hypha-co-regulated genes to Candida albicans virulence. Cell Microbiol. 7, 1546-1554 (2005).
- Lorenz, M. C., Bender, J. A., Fink, G. R. Transcriptional response of Candida albicans upon internalization by macrophages. Eukaryot. Cell. 3, 1076-1087 (2004).
- Rubin-Bejerano, I., Fraser, I., Grisafi, P., Fink, G. R. Phagocytosis by neutrophils induces an amino acid deprivation response in Saccharomyces cerevisiae and Candida albicans. Proc. Natl. Acad. Sci. U. S. A. 100, 11007-11012 (2003).
- Behnsen, J. Environmental dimensionality controls the interaction of phagocytes with the pathogenic fungi Aspergillus fumigatus and Candida albicans. PLoS Pathog. 3, e13 (2007).
- Lavigne, L. M. Integrin engagement mediates the human polymorphonuclear leukocyte response to a fungal pathogen-associated molecular pattern. J. Immunol. 178, 7276-7282 (2007).
- Newman, S. L., Bhugra, B., Holly, A., Morris, R. E. Enhanced killing of Candida albicans by human macrophages adherent to type 1 collagen matrices via induction of phagolysosomal fusion. Infect. Immun. 73, 770-777 (2005).
- Netea, M. G., Brown, G. D., Kullberg, B. J., Gow, N. A. An integrated model of the recognition of Candida albicans by the innate immune system. Nat. Rev. Microbiol. 6, 67-78 (2008).
- Lam, S. H., Chua, H. L., Gong, Z., Lam, T. J., Sin, Y. M. Development and maturation of the immune system in zebrafish, Danio rerio: a gene expression profiling, in situ hybridization and immunological study. Dev. Comp. Immunol. 28, 9-28 (2004).
- Magnadottir, B. Innate immunity of fish (overview). Fish Shellfish Immunol. 20, 137-151 (2006).
- Sullivan, C., Kim, C. H. Zebrafish as a model for infectious disease and immune function. Fish Shellfish Immunol. 25, 341-350 (2008).
- Lawson, N. D., Weinstein, B. M. In vivo imaging of embryonic vascular development using transgenic zebrafish. Dev. Biol. 248, 307-318 (2002).
- Ellett, F., Pase, L., Hayman, J. W., Andrianopoulos, A., Lieschke, G. J. mpeg1 promoter transgenes direct macrophage-lineage expression in zebrafish. Blood. 117, e49-e56 (2011).
- Renshaw, S. A. A transgenic zebrafish model of neutrophilic inflammation. Blood. 108, 3976-3978 (2006).
- Lesley, R., Ramakrishnan, L. Insights into early mycobacterial pathogenesis from the zebrafish. Curr Opin. Microbiol. 11, 277-283 (2008).
- Chao, C. C. Zebrafish as a model host for Candida albicans infection. Infect. Immun. 78, 2512-2521 (2010).
- Kimmel, C. B., Ballard, W. W., Kimmel, S. R., Ullmann, B., Schilling, T. F. Stages of embryonic development of the zebrafish. Dev Dyn. , 203-253 (1995).
- Cianciolo Cosentino, C., Roman, B. L., Drummond, I. A., Hukriede, N. A. Intravenous Microinjections of Zebrafish Larvae to Study Acute Kidney Injury. J. Vis. Exp. (42), e2079 (2010).
- Haddon, C., Lewis, J. Early ear development in the embryo of the zebrafish, Danio rerio. J. Comp. Neurol. 365, 113-128 (1996).
- Yuan, S., Sun, Z. Microinjection of mRNA and Morpholino Antisense Oligonucleotides in Zebrafish Embryos. J. Vis. Exp. (27), e1113 (2009).
- Rosen, J. N., Sweeney, M. F., Mably, J. D. Microinjection of Zebrafish Embryos to Analyze Gene Function. J. Vis. Exp. (25), e1115 (2009).
- Ariga, J., Walker, S. L., Mumm, J. S. Multicolor Time-lapse Imaging of Transgenic Zebrafish: Visualizing Retinal Stem Cells Activated by Targeted Neuronal Cell Ablation. J. Vis. Exp. (43), e2093 (2010).
- Redd, M. J., Kelly, G., Dunn, G., Way, M., Martin, P. Imaging macrophage chemotaxis in vivo: studies of microtubule function in zebrafish wound inflammation. Cell Motil. Cytoskeleton. 63, 415-422 (2006).
- Gutzman, J. H., Sive, H. Zebrafish Brain Ventricle Injection. J. Vis. Exp. (26), e1218 (2009).
- Davis, J. M. Real-time visualization of mycobacterium-macrophage interactions leading to initiation of granuloma formation in zebrafish embryos. Immunity. 17, 693-702 (2002).
- Meijer, A. H. Identification and real-time imaging of a myc-expressing neutrophil population involved in inflammation and mycobacterial granuloma formation in zebrafish. Dev. Comp. Immunol. 32, 36-49 (2008).
- Mathias, J. R. Live imaging of chronic inflammation caused by mutation of zebrafish Hai1. J. Cell Sci. 120, 3372-3383 (2007).
- Hall, C., Flores, M. V., Storm, T., Crosier, K., Crosier, P. The zebrafish lysozyme C promoter drives myeloid-specific expression in transgenic fish. BMC Dev. Biol. 7, 42 (2007).
- Vergunst, A. C., Meijer, A. H., Renshaw, S. A., O'Callaghan, D. Burkholderia cenocepacia creates an intramacrophage replication niche in zebrafish embryos, followed by bacterial dissemination and establishment of systemic infection. Infect Immun. 78, 1495-1508 (2010).
- Le Guyader, D. Origins and unconventional behavior of neutrophils in developing zebrafish. Blood. 111, 132-141 (2008).
- Clatworthy, A. E. Pseudomonas aeruginosa infection of zebrafish involves both host and pathogen determinants. Infect. Immun. 77, 1293-1303 (2009).
- Brannon, M. K. Pseudomonas aeruginosa Type III secretion system interacts with phagocytes to modulate systemic infection of zebrafish embryos. Cell Microbiol. 11, 755-768 (2009).
- Levraud, J. P. Real-time observation of listeria monocytogenes-phagocyte interactions in living zebrafish larvae. Infect. Immun. 77, 3651-3660 (2009).
- van der Sar, A. M. Zebrafish embryos as a model host for the real time analysis of Salmonella typhimurium infections. Cell Microbiol. 5, 601-611 (2003).
- Phennicie, R. T., Sullivan, M. J., Singer, J. T., Yoder, J. A., Kim, C. H. Specific resistance to Pseudomonas aeruginosa infection in zebrafish is mediated by the cystic fibrosis transmembrane conductance regulator. Infect Immun. 78, 4542-4550 (2010).
- Prajsnar, T. K., Cunliffe, V. T., Foster, S. J., Renshaw, S. A. A novel vertebrate model of Staphylococcus aureus infection reveals phagocyte-dependent resistance of zebrafish to non-host specialized pathogens. Cell Microbiol. 10, 2312-2325 (2008).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved