A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
وظيفية تقييم الحركة المعوية والتهاب الأمعاء الجدار في القوارض: التحليلات في نموذج موحد من التلاعب المعوية
In This Article
Summary
علوص ما بعد الجراحة (POI) هي مضاعفات عملية جراحية في البطن مما يؤدي إلى زيادة معدلات الاعتلال والبقاء في المستشفى لفترات طويلة. لأن استراتيجيات وقائية أو علاجية تعاني من نقص البحوث المكثفة ضرورية. أنشئت لذلك لدينا نموذج الفأر موحدة وقابلة للتحقيق في الفيزيولوجيا المرضية لPOI ودراسة الخيارات العلاجية المحتملة.
Abstract
التهاب القناة الهضمية هو السبب الشائع لمجموعة متنوعة من الأمراض التي تصيب الإنسان. نماذج البحوث الحيوانية حاسمة في التحقيق في مجمع الخلوية والجزيئية علم الأمراض المعوية. على الرغم من أن الغشاء المخاطي الغلالة وغالبا ما يكون الجهاز من الاهتمام في العديد من الأمراض الالتهابية، والأعمال الأخيرة أثبتت أن الظاهرة العضلية (ME) هو أيضا جهازا مناعيا للغاية التي تؤوي شبكة كثيفة من immunocytes المقيمين. 1،2 أجريت هذه الأعمال ضمن موحدة نموذج للتلاعب المعوية (IM) الذي يؤدي إلى التهاب في جدار الأمعاء، وتقتصر أساسا إلى ME. سريريا هذا الالتهاب يؤدي إلى الأمعاء لفترة طويلة dysmotility، والمعروفة باسم علوص ما بعد الجراحة (POI) والذي هو اختلاط متكررة والتي لا يمكن تجنبها بعد عملية جراحية في البطن. 3 ويتميز التهاب تحرير سطاء proinflammatory مثل IL-6 4 أو الناقلات العصبية IL-1β أو المثبطة مثل nitriج أكسيد (NO) .. 5 وفي وقت لاحق، وأرقام هائلة من immunocytes يتسرب إلى ME، التي يسيطر عليها العدلات النوى (السوداء) وحيدات والحفاظ أخيرا POI .. 2 دائم لعدة أيام، وهذا يؤدي إلى شلل الأمعاء زيادة خطر الطموح، إزفاء البكتيرية والمضاعفات المعدية حتى تعفن الدم والفشل العضوي المتعدد ويسبب عبئا عالية الاقتصادية .. 6
في هذا المخطوط أن نبرهن على نموذج موحد للتقييم في IM والجسم الحي العبور المعوي (GIT) والعبور القولون. وعلاوة على ذلك نحن يبرهن على وجود طريقة لفصل لي من الغشاء المخاطي تليها الغلالة تحليل المناعية، وهو أمر حاسم للتمييز بين الاستجابات الالتهابية في كل من هذه المقصورات immunoactive غاية جدار الامعاء. جميع التحليلات بسهولة نقلها إلى أي نماذج بحثية أخرى، مما يؤثر على وظيفة الجهاز الهضمي.
Protocol
1. الحيوانات
تم الحصول على الذكور C57Bl6 / J الفئران مع متوسط وزن 25 غ من فينكلمان من هارلان (Borchen، ألمانيا). أجريت جميع التجارب وفقا للقانون الاتحادي بشأن حماية الحيوانات. وتلت مبادئ الرعاية الحيوانية المعملية. واستمرت الحيوانات على ضوء 12-HR / دورة الظلام، وقدمت مع تشاو القوارض المتاحة تجاريا والحنفية المياه libitum الإعلانية. وينبغي أن يضم الحيوانات لا تقل عن 7 أيام بعد وصوله إلى مرفق حيوانك قبل التجارب لاحظ أن جميع التجارب يمكن تكييفها بسهولة للفئران أو الأنواع الأخرى ومع تعديلات طفيفة في نماذج حيوانية كبيرة.
2. المنطوق الداخلي
- هو فعل التخدير والمحافظة عليها مع isoflurane (ابوت، فيسبادن، ألمانيا) في الأكسجين. بعد ظهور الحيوانات في مكان التخدير موقف ضعيف والأطراف بشريط لاصق الإصلاح (Leukosilk، بيرسدورف، هامبورغ، ألمانيا).
- بعد الحلاقة والتعقيم الجراحي للجدار البطن يتم تنفيذ البطن متوسط على طول 2 سم. دخول تجويف البطن عن طريق شق على طول ألبا لينيا. مكان اثنين الكامشات معقمة للحفاظ على البطن المفتوحة. eventerate بعناية الأمعاء الدقيقة إلى اليسار وضعها على شاش القطن مبللة.
- إخلاء كامل محتويات الأمعاء الدقيقة لمعي مع اثنين من تطبيقها القطن رطبة ومعقمة (المشوهين، Neunkirchen، ألمانيا) في وقت واحد من قبل المتداول قضيب من بوابة المعدة إلى الأعور. تنبيه: تجنب نزيف من جدار الامعاء الصغيرة أو آفات الأوعية الأمعاء. وضع الجزء الخلفي الأمعاء إلى الكهف دون التواء البريتوني لمنع نقص التروية أو انسداد الميكانيكية وإغلاق شق البطن باستخدام الطبقة الثانية المستمر 5/0 polyamid غير قابل للامتصاص الغرز (Ethicon، مدينة Norderstedt، ألمانيا).
3. بعد العملية الجراحية العناية
- بعد العملية وضع الحيوان تحت مصباح التدفئة، observiنانوغرام عليه حتى تعافى من التخدير. وضع الماوس مرة أخرى في قفص والسماح بالوصول إلى الماء والغذاء. نظرا لخاصية المواد الأفيونية أن تؤثر التمعج، ونحن أداء تسكين المحيطة بالجراحة مع المسكنات (لmetamizol سبيل المثال) في مياه الشرب.
4. وظيفية الدراسات 24 ساعة بعد IM
- الجهاز الهضمي العابر (GIT)
- تخدير الفئران قليلا مع isoflurane في الموارد البشرية 22،5 الأكسجين بعد IM. hyperextend بعناية رئيس الماوس وسحب اللسان مع ملقط غير حادة. ملء حقنة 1 مل مع لا يقل عن 100 ميكرولتر فلوريسئين التي تحمل علامات ديكستران (FITC-ديكستران، 70،000 ميغاواط، سيغما الدريتش، Taufkirchen، ألمانيا)، توصيله إلى القسطرة الشريانية (Vygon، Ecouen، فرنسا) وإدراج بعناية باعتبارها القسطرة أنبوب المعدة في المعدة.
- حقن لفترة وجيزة 100 ميكرولتر FITC-ديكستران وسحب القسطرة. اسمحوا الحيوان مستيقظا وانتظر 90 دقيقة. وخلال هذا الوقت الفئران في الحصول على غذاء أو ماء.
- إعداد 15 2 مل أنابيب الغزل وتسمية لهم على التوالي.
- الموت ببطء الفئران بعد 90 دقيقة بالتزقيم وإزالة الجهاز الهضمي بأكمله من المعدة إلى المستقيم. وضع وسادة على الأمعاء البوليسترين وتجنب التمدد. CAVE: ومن المهم للغاية إزالة الأمعاء بلطف لتجنب تحول السائل dextrane-FITC في الجزء القريبة. لبداية قد يكون من المفيد استخدام مقاطع في بداية ونهاية كل جزء.
- قياس طول الأمعاء الدقيقة الكاملة لكامل طول والقولون. تقسيم الأمعاء الدقيقة إلى أجزاء متساوية الحجم 10 قبل ان تتهم من أسفل إلى لوحة البوليسترين مع القنيات. تقسيم إلى 3 أجزاء القولون. وقد أعد لك 15 قطاعات (المعدة # 1)، عشرة أجزاء متساوية الحجم الأمعاء الدقيقة (# 2-11)، الأعور (# 12) وثلاثة 3 أجزاء القولون متساوية الحجم (# 13-15).
- القطع الأمعاء في مواقف ملحوظ، والاستيلاء عليها مع ملقط وطردهم مرة واحدة مع جسر الملك حسين مل 1،0 في جسر الملك حسين containi معدة مسبقانانوغرام 2،0 مل أنابيب ودوامة بقوة لمدة 20 ثانية. يتم وضع المعدة والأعور مباشرة وقطع الأنابيب في المعدة. ملء هذه الأنابيب مع 1.0 مل جسر الملك حسين، وبالتالي الشطف آثار محتويات اللمعية من مقص في الأنابيب.
- أجهزة الطرد المركزي لتحقيقات في إطار التعاون الإقليمي 12000 لمدة 5 دقائق في درجة حرارة الغرفة في جدول الطرد المركزي الأعلى. خلال الطرد المركزي إعداد 15 أخرى مرقمة على التوالي أنابيب مل 1.5.
- نقل supernatants واضحة في أنبوب جديد 1.5 مل وتخزينها في الظلام في 4 درجات مئوية حتى التحليل (الخطوة التالية). يمكن تخزين تحقيقات لعدة أيام في 4 درجات مئوية دون خسارة كبيرة في إشارة FITC. التخزين لمدة أطول 0.09٪ صوديوم إضافة-أزيد أو مخزن في <-18 ° C.
- ماصة 100 ميكرولتر من duplets supernatants على طبق 96-جيدا الأسود (غرينر بيو واحد، Frickenhausen، ألمانيا). ماصة اثنين من 100 ميكرولتر من العينات جسر الملك حسين كما فارغة.
- قراءة لوحة في القارئ مضان (سافير، TECAN، CRAILSHEIM، ألمانيا) وتحديد fluorescencه في 494 نانومتر (امتصاص) / 521 نانومتر (الانبعاثات) الطول الموجي. طرح القيم الفارغة من العينات.
- حساب مركز هندسي (GC) من FITC-ديكستران التوزيع، الذي هو في الواقع مركز الثقل لتوزيع علامة، من خلال الصيغة التالية: = Σ GC (الجزء * إشارة٪ من إجمالي الفلورسنت لكل قطعة رقم) / 100
ملاحظة: بضرب النسبة المئوية للمضان من كل قطعة مع عدد فئتها ويتم تقييم والمتوسط الموزون لتوزيع علامة داخل الأمعاء. ويتأثر توزيع هذه النقطة من قبل كل من والمسافة التي تقطعها علامة، ولكن لا تتحمل أية الكامنة توزيع محددة. غالبا ما يقدم 7 وقيمة GC المحسوبة في توليفة مع الرسم البياني مما يدل على توزيع ديكستران FITC خلال القناة الهضمية (الشكل 1A).
- القولون العابر
- يجب أن تكون مخدرة الفئران ضعيفة مع isoflurانو 2٪ في الأوكسجين. تنبيه: تأكد من أن الحيوان سوف مستيقظا خلال 40 ثانية.
- تدرس بعناية سالكية القولون عن طريق إدراج التحقيق ناسور (قضيب معدني، 2 مم) من خلال فتحة الشرج إلى القولون.
- باستخدام مسبار الناسور دفع كوب مم 2 3 سم الكرة في القولون وسحب التحقيق على الفور. ضع الماوس في قفص شفافة والبدء في قياس الوقت بعد أن سحبت لجنة التحقيق ناسور من القولون. إبقاء العين على الماوس وإيقاف الوقت مباشرة بعد الكرة الزجاجية أصبحت تفرز.
5. تحليل العينات النسيجية من ME متفرقة
- يتم قطع شرائح Midjejunal من الأمعاء ومنغمسين في جسر الملك حسين الباردة في طبق Sylgard شغلها.
- ويعلق مساريق إلى الطبق مع 0.2 ملم الإبر الحشرات (أدوات العلوم الجميلة، هايدلبرغ، ألمانيا).
- خفض فتح الجزء على طول حدودها المساريقي وتمتد إلى 120٪ من طوله ~ والعرض. وضع اللمسات الأخيرة على التثبيت مع الحشراتدبابيس على موقع الآخر من مساريق. شطف الطبق مع sylgard بعناية الطازجة الباردة الجليد جسر الملك حسين، وبيغ بالتالي على جميع محتويات اللمعية.
يمكن لي الآن فصل ميكانيكيا من الغشاء المخاطي الغلالة تبدأ من مساريق. أثناء إعداد استبدال المبرد الطازج جسر الملك حسين عدة مرات. - ويمكن فصل الغشاء المخاطي الغلالة صدمة المجمدة في النيتروجين السائل لمزيد من التحليل أو التخلص منها.
- إصلاح معزولة ME جبل كله مع الإيثانول بنسبة 100٪ لمدة 10 دقيقة في درجة حرارة الغرفة.
يغسل كل جبل ثلاث مرات باستخدام جسر الملك حسين مبردة. ملاحظة: يمكن أيضا مثبتات أخرى (أي 4٪ الفورمالديهايد، وحامض الخليك، ماتقصر) يمكن أن تستخدم بعد اختبار التوافق مع تحليل لاحقة. - يتصاعد ME كامل على استعداد للمزيد من تلطيخ النسيجية أو immunhistochemical:
- الكيمياء النسيجية: الميلوبيروكسيداز (MPO) تلطيخ
يمكن فحص PMNs مخترقة من قبل بروتوكول MPO تلطيخ التالية.- حل 10 ملغ Hمرساة ييتس كاشف (Polyscience أوروبا، Eppelheim، ألمانيا) في 10 مليلتر من جسر الملك حسين وإضافة 100 ميكرولتر من 3٪ H 2 O 2. إعداد الحل الطازجة مباشرة قبل استخدام وإعادة استخدام ما لا.
- احتضان يتصاعد كله لمدة 10 دقيقة في درجة حرارة الغرفة.
- شطف العينات على نطاق واسع مع جسر الملك حسين الباردة واحتضان لمدة 10 دقيقة.
- تحميل العينات في تصاعد مائي المتوسطة (Aquatek، ميرك، دارمشتات، ألمانيا) وبعد التجفيف لمدة 2 ساعة في تحليل الشرائح تحت المجهر الخفيفة.
- عد الأرقام من الخلايا في 5 مجالات اختيارها عشوائيا وحساب باسم خلايا إيجابية MPO / مم 2.
- تلوين المناعى:
وفقا لذلك إلى تلطيخ MPO النسيجية، يمكن إجراء stainings المناعى لليتصاعد كله. أساسا، يمكن: هل تم وضع بروتوكولات تلطيخ المناعى من مزارع الخلايا أو الأنسجة شرائح تكييفها بسهولة لتلطيخ جبل بأكمله. ومع ذلك، وتحسين إجراءات محددة لمكافحةالهيئات ونوصي بشدة.- قطع العينات إلى 5 قطع X 5 مم وأداء تلطيخ مل 2،0 في الجولة أنابيب الطرد المركزي في أسفل ميكرولتر 150 ~ - 200 ميكرولتر حل الأجسام المضادة.
- لا يمكن أن يؤديها تثبيت ومنع الإجراء (أي 3٪ BSA في برنامج تلفزيوني لمدة 1 ساعة في درجة حرارة الغرفة) في "طبق sylgard".
- لا يمكن أن يؤديها خطوات الغسيل في برنامج تلفزيوني أو مخازن أخرى في 12-وحات جيدة.
- نقل العينات. بعناية مع ملقط حاد بين أنابيب وألواح تلطيخ الغسيل.
- بعد غسل العينات النهائية جبل الداخلي في مكافحة يتلاشى مع تصاعد المتوسطة تغطية زلات وتحليل مع المجهر الفلورسنت.
6. الثقافة جهاز ME
- ومقطوعة الأمعاء الصغيرة كلها بعد 24 ساعة IM ووضعها في جسر الملك حسين الباردة تحتوي على 200 U / مل البنسلين G و 100 ميكروغرام / مل الستربتوميسين (جسر الملك حسين + P / S).
- قطع الوتر في أطوال سم 3 ويعلقون كل قطعة لتصل إلى Sylgard تحتوي غلاSS الطبق.
- إزالة مساريق مع مقص غرامة، وتنزلق الأمعاء على إبرة الحياكة.
- شق برفق مع ملقط ME حادة وتجريدها الخروج من تحت مخاطية باستخدام قضيب من القطن رطبة. الغلالة المخاطية يبقى على إبرة الحياكة ويمكن أن تكون مفاجئة تجميد لمزيد من التحقيق. ويتم جمع ME في جسر الملك حسين الباردة + P / S.
- قطع شرائح معزولة ME الى قطع صغيرة من 2 - 4 ملم طول واحتضان في الجليد الباردة جسر الملك حسين + P / S لمدة نصف ساعة ويشطف العينة عدة مرات.
- نقل نحو 50-60 ملغ ME (لا يقل عن نصف ME واحد الأمعاء الدقيقة) في لوحة 24-معقمة جيدا تحتوي على 500 ميكرولتر ق Dulbecco تعديل النسر المتوسط (DMEM).
- احتضان عند 37 درجة مئوية و 5٪ CO 2 على مدار 24 ساعة لأخرى.
- تفقد مزارع الخلايا لتلوث جرثومي أو فطري تحت المجهر.
- جمع طاف، وتدور باستمرار لمدة 5 دقائق في إطار التعاون الإقليمي وتجميد 1000 المفاجئة في النيتروجين السائل. وفي الوقت نفسه صمة عار تجفيف MUSCجنيه الأنسجة على منديل نظيف لمدة 30 ثانية والوزن.
- ويمكن استخدام التحليل اللاحق لSupernatants من السيتوكينات صدر (IL-6) من ELISA او نواتج أخرى (أي النتريت) في طاف من خلال اتباع تعليمات بتصنيع.
- تطبيع التركيزات المقاسة في وزن ME الأنسجة.
7. ممثل النتائج
- وظيفية الدراسات
المعلمة الأكثر أهمية لتقييم شدة POI هو فحص GIT في الجسم الحي. الشكل 1A يوضح توزيع نموذجية من ديكستران FITC على طول الجهاز الهضمي في الضوابط غير المعالجة والتلاعب intestinally الفئران 24 ساعة بعد الجراحة. "تعمل الشام" الحيوانات أظهرت GIT طبيعية مع مركز هندسي محسوب (GC) في حين الأعور IM أدى إلى تأخير كبير في GIT من الصائم الداني (1B الشكل)
وتركز بشكل منفصل من قبل الحركة القولون على قياس الوقت الكرة يا إفرازاتحاد كرة القدم الزجاج الكرة مم 2. تعمل الشام الفئران تظهر وقت إفراز 48 حتي 200 ثانية بينما IM أدى إلى إفراز الوقت المطول بين 470 حتي 775 ثانية (الشكل 1C). - المورفولوجية الدراسات
ويمكن تحليل لوصف الظواهر التهابات تمديد داخل العديدة ME من الكريات البيض باستخدام الكيمياء النسيجية المناعية أو. في الشكل 2A + B وجود انخفاض في PMNs "الشام تعمل" لوحظ الحيوانات (39 ± 7 خلية / ملم 2). أدى IM من الأمعاء الدقيقة إلى تسلل PMN قوية (660 ± 86 خلية / ملم 2) مقارنة مع الفئران تعمل الشام - ME الجهاز الثقافة
العديد من الوسطاء التهابات يتحرر من الخلايا التي يصعب كشفها في الأنسجة لست]. كشف الجهاز الثقافات تسمح للوساطة المحررة في طاف الثقافة. وسيط ممثل في POI هو NO، وهو ناقل عصبي مثبط الرئيسية كما في القناة الهضمية .. 5
لا يمكن أن يتم الكشف عن NO في طريق مسدود الجهاز MEsupernatants تلح من الحيوانات تحكم unoperated (5 ± 6 ميكرومتر / 24 الأنسجة / موارد بشرية ملغ). في الفئران الشام (البطن) تعمل القاعدية لم يلاحظ أي مستويات من 53 ميكرومتر ± 36/24 ساعة الأنسجة / ملغ. ME الثقافات من الفئران التلاعب intestinally (حصاد 24 ساعة بعد الجراحة) تنتج أكثر بكثير NO (2254 ± 853 ميكرومتر / 24 الأنسجة / موارد بشرية ملغ) خلال 24 ساعة الثقافة الجهاز ME (الشكل 3).

الشكل 1. تأثير على GIT IM (A + B) والعبور القولون (C) وقد تم قياس GIT كما في المئة من ديكستران فلوريسئين التي تحمل علامات غير قابل للامتصاص الجهاز الهضمي في 15 قطاعات المعدة (ستو) والأمعاء الدقيقة (SI 1-9 )، الأعور (CEC)، وسرطان القولون (CO) -90 دقيقة بعد الابتلاع عن طريق الفم. وقد تم قياس العبور القولون حيث أن الوقت من الانسحاب التحقيق الناسور حتى إفراز حبة الزجاج مم 2. (A) توزيع الجهاز الهضمي من DEX-ثيوسيانات فلوريسئينتران بعد عملية صورية أو IM. في الحيوانات الشام تعمل يقع معظم علامة في الأعور أو القولون القريبة بالمقارنة مع موقع صائمية القريبة في الحيوانات التلاعب بها. الخطوط المنقطة تشير إلى حساب GC. (B) أظهرت حساب من GC لفترة طويلة وقت العبور المعوي بعد IM. (C) أظهرت القولون عبور وقت تأخير كبير في الفئران مقارنة مع الحيوانات IM الشام تعمل. يتم عرض GC للقطاعات الأمعاء كما يعني 15 (ن = 5). تم عرض الوقت المستغرق من القولون يعني مع جميع القيم الفردية (ن = 6). = *** P <0.001، وطالب اختبار t.
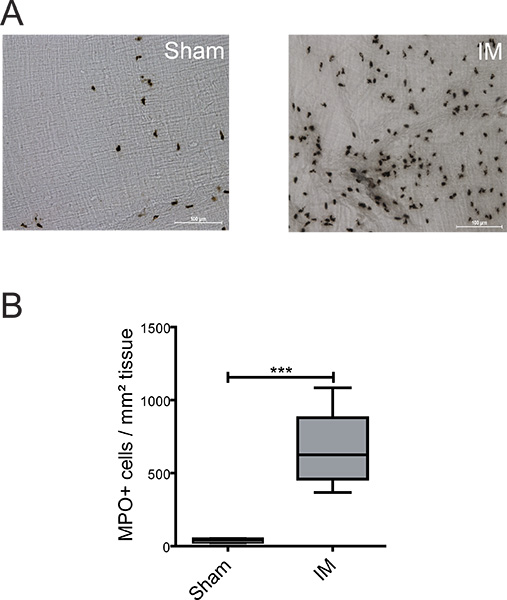
الشكل 2. الكشف عن الخلايا إيجابية MPO داخل الأمعاء الدقيقة ME. (A) كانت ملطخة ME يتصاعد كله مع كاشف ييتس إشتق للكشف عن MPO إيجابية على مدار 24 ساعة PMN بعد فتح البطن (الشام) أو إجراء IM. (ب) تحديد كميات من الخلايا إيجابية MPO في غضون 5 اختيارها عشوائيا في الحقول الماوس. ن = 6 أnimals لكل مجموعة. = *** P <0.001، وطالب اختبار t.
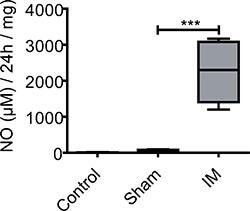
الشكل 3. NO الإنتاج في supernatants ثقافة ME. عينات من العضلات الضوابط unoperated، تعمل الشام، وأخذت الفئران IM 24 ساعة بعد العمل الجراحي ومثقف لمدة 24 ساعة. وأظهرت الفئران غير المعالجة فقط لإنتاج منخفضة جدا القاعدية من NO. بعد فتح البطن وزيادة NO التحرير دون قياس فروق ذات دلالة إحصائية بين المجموعة الضابطة والفئران تعمل الشام. وزادت بشكل كبير بعد 24 ساعة إنتاج NO IM مقارنة مع الفئران غير المعالجة أو تعمل الشام. ن = 5 لكل مجموعة الحيوانات. = *** P <0.001، 1 ANOVA الطريقة.
Discussion
كشفت دراسة مقارنة وتحليل مستويات مختلفة من IM (صغير اندحاق الامعاء لمدة 10 دقيقة مقابل بلطف التفتيش في الأمعاء الدقيقة باستخدام القطن تطبيقها مقابل اثنين IM مع إخلاء محتوى الأمعاء الدقيقة في الأعور) وجود علاقة بين مدى التلاعب الجراحية وPOI. مقارنة مع المجموعات الأخرى IM أ...
Disclosures
الإعلان عن أي تضارب في المصالح.
Acknowledgements
وأيد هذا العمل من المنح المقدمة من جمعية الألمانية للبحوث (KA1270/3-1/2) وBONFOR (O-112.0040).
Materials
| Name | Company | Catalog Number | Comments |
| اسم كاشف / معدات | شركة | كتالوج رقم | |
| Ethilon 5/0 | Ethicon | 1666H | |
| القطن تطبيقها | شوهوا | 71010 | |
| قسطرة الشرايين | Vygon | 115-798 | |
| 96 لوحة جيدا (أسود) | غرينر بيو واحد | 655096 | |
| الزجاج الكرة (2 مم) | Worf | متوفرة عند الطلب | |
| دبابيس الحشرات | أدوات العلوم الجميلة | 26000-25 | |
| تاق ييتس الكاشف | Polyscience | 560694 | |
| Aquatek | ميرك | HC109850 | |
| DMEM | Lonza | BE12 F-604 | |
| FITC-ديكستران (MW 70000) | سيغما الدريتش | 46945-500MG-F |
References
- Wehner, S., Behrendt, F. F., Lyutenski, B. N., Lysson, M., Bauer, A. J., Hirner, A., Kalff, J. C. Inhibition of macrophage function prevents intestinal inflammation and postoperative ileus in rodents. Gut. 56, 176-185 (2007).
- Kalff, J. C., Schwarz, N. T., Walgenbach, K. J., Schraut, W. H., Bauer, A. J. Leukocytes of the intestinal muscularis: their phenotype and isolation. J. Leukoc. Biol. 63, 683-691 (1998).
- Kehlet, H. Postoperative ileus. Gut. 47, iv85-iv86 (2000).
- Wehner, S., Schwarz, N. T., Hundsdoerfer, R., Hierholzer, C., Tweardy, D. J., Billiar, T. R., Bauer, A. J., Kalff, J. C. Induction of IL-6 within the rodent intestinal muscularis after intestinal surgical stress. Surgery. 137, 436-446 (2005).
- Kalff, J. C., Schraut, W. H., Billiar, T. R., Simmons, R. L., Bauer, A. J. Role of inducible nitric oxide synthase in postoperative intestinal smooth muscle dysfunction in rodents. Gastroenterology. 118, 316-327 (2000).
- Iyer, S., Saunders, W. B., Stemkowski, S. Economic burden of postoperative ileus associated with colectomy in the United States. J. Manag. Care Pharm. 15, 485-494 (2009).
- Miller, M. S., Galligan, J. J., Burks, T. F. Accurate measurement of intestinal transit in the rat. J. Pharmacol. Methods. 6, 211-217 (1981).
- Kalff, J. C., Schraut, W. H., Simmons, R. L., Bauer, A. J. Surgical manipulation of the gut elicits an intestinal muscularis inflammatory response resulting in postsurgical ileus. Ann. Surg. 228, 652-663 (1998).
- Wehner, S., Straesser, S., Vilz, T. O., Pantelis, D., Sielecki, T., de lC, V., Hirner, A., Kalff, J. C. Inhibition of p38 mitogen-activated protein kinase pathway as prophylaxis of postoperative ileus in mice. Gastroenterology. 136, 619-629 (2009).
- Konigsrainer, I., Turck, M. H., Eisner, F., Meile, T., Hoffmann, J., Kuper, M., Zieker, D., Glatzle, J. The Gut is not only the Target but a Source of Inflammatory Mediators Inhibiting Gastrointestinal Motility During Sepsis. Cell Physiol. Biochem. 28, 753-760 (2011).
- Schwarz, N. T., Kalff, J. C., Turler, A., Speidel, N., Grandis, J. R., Billiar, T. R., Bauer, A. J. Selective jejunal manipulation causes postoperative pan-enteric inflammation and dysmotility. Gastroenterology. 26, 159-169 (2004).
- Engel, D. R., Koscielny, A., Wehner, S., Maurer, J., Schiwon, M., Franken, L., Schumak, B., Limmer, A., Sparwasser, T., Hirner, A. T helper type 1 memory cells disseminate postoperative ileus over the entire intestinal tract. Nat. Med. , (2010).
- Stoffels, B., Schmidt, J., Nakao, A., Nazir, A., Chanthaphavong, R. S., Bauer, A. J. Role of interleukin 10 in murine postoperative ileus. Gut. 58, 648-660 (2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved