A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
عرضية الترشيح الفائق التدفق: A "الخضراء" طريقة لاختيار الحجم وتركيز الجسيمات النانوية الفضة الغروية
In This Article
Summary
الترشيح الفائق تدفق عرضية (TFU) هو أسلوب يستخدم لإعادة تدوير فصل الوزن القائم العينات البيولوجية. وقد تم تكييف TFU لتحديد الحجم (1-20 نانومتر قطر) والتركيز بشدة كمية كبيرة من الفضة النانوية polydisperse (4 L من مل ميكروغرام 15،2 -1 أسفل إلى 4 مل من مل ميكروغرام 8،539.9 -1) مع الحد الأدنى من التجميع.
Abstract
في أيامنا هذه، وتستخدم على نطاق واسع AgNPs في تصنيع المنتجات الاستهلاكية والمطهرات المياه 1 و 2 التداوي، 1 و 3 و 4 الأجهزة الطبية الحيوية نظرا لخصائصها المضادة للميكروبات قوية. تتأثر بشدة هذه التطبيقات 3-6 جسيمات متناهية الصغر بحجم AgNP والدولة التجميع . وجود العديد من التحديات في تصنيع تسيطر 7 و حجم القائمة على العزل من 4،8 AgNPs، unfunctionalized متجانسة بحيث تكون خالية من العدوانية كيميائيا متوجا / استقرار وكلاء أو المذيبات العضوية. 7-13 القيود الخروج من سمية المواد الكاشفة، أو تخفيض التكاليف المرتفعة كفاءة أساليب التوليف أو العزلة AgNP (على سبيل المثال، الطرد المركزي، التي تعتمد على حجم ذوبان، الحجم الاستبعاد اللوني، وما إلى ذلك). 10،14-18 وللتغلب على هذه، ونحن أظهرت مؤخرا أن TFU يسمح سيطرة أكبر على التركيز، وحجم حالة التجميع AgNPs كريتون (300مل مل قدرها 15.3 ميكروغرام -1 أسقل إلى 10 مل مل من 198.7 ميكروغرام -1) من الطرق التقليدية من العزلة مثل تنبيذ فائق 19
TFU هي طريقة إعادة تدوير تستخدم عادة لعزل الوزن القائم من الفيروسات والبروتينات والخلايا. 20،21 لفترة وجيزة، يتم تمرير عينة السائل من خلال سلسلة من الأغشية الألياف المجوفة مع حجم المسام تتراوح من 1،000 دينار إلى 10 دينار. وعلقت أصغر مكونات أو مذابة في العينة تمر عبر حاجز مسامي مع المذيب (الراشح)، في حين يتم الاحتفاظ أكبر مكونات (retentate). ويمكن اعتبار TFU "خضراء" طريقة لأنه لا أضرار ولا يتطلب عينة إضافية للقضاء على المذيبات السامة الزائدة الكواشف ومنتجاته. وعلاوة على ذلك، يمكن تطبيق TFU لمجموعة كبيرة ومتنوعة من الجسيمات النانوية على حد سواء مرشحات مسعور وماء متوفرة.
وكانت الهدفين الرئيسيين لهذه الدراسة: 1) لتوضيحالجوانب التجريبية للنهج TFU من خلال تجربة الفيديو المدعوين و2) لإثبات جدوى الأسلوب TFU للحصول على أكبر كميات من الجسيمات النانوية الغروية وأصغر حجم retentate. تم تصنيعه لأول مرة، AgNPs unfuctionalized (4 L، 15.2 ميكروغرام مل -1) باستخدام طريقة كريتون راسخة 22،23 من الحد من AGNO 3 مع NABH 4. ثم تم تصغير AgNP التشتت المتعدد عبر TFU 3-الخطوة باستخدام فلتر 50-نانومتر (460 سم 2) لإزالة الركام وAgNPs AgNP-أكبر من 50 نانومتر، تليها اثنين KD-100 (200 سم 2 و 20 سم 2) مرشحات لتركيز AgNPs. وتميزت باستخدام عينات ممثلة انتقال المجهر الإلكتروني، القياس الطيفي للأشعة فوق البنفسجية فيس الاستيعاب، ورامان الطيفي، وإضافة بالحث البلازما مطياف الانبعاث الضوئي. تألف retentate النهائية لعالية التركيز (4 مل، مل 8،539.9 ميكروغرام -1) بعد المتواضع المجمعة ومتجانسةAgNPs من 1-20 نانومتر في القطر. هذا يتوافق مع الفضة العائد تركيز حوالي 62٪.
Protocol
1. توليف AgNPs الغروية
يتم وصف آلية رد فعل للأسلوب كريتون (معدلة بشكل طفيف وغير مكلفة) 22 بقدر كبير من التفصيل في المعلومات دعم المرجعية بافل et.al مع التحلل غير مرغوب فيها جنبا إلى رد فعل NABH 4 في درجة حرارة الغرفة أو أعلى 23
- تنظيف الأواني الزجاجية لمدة 12-24 جميع الموارد البشرية في حمام 10٪ 3 HNO، ثم ل4-12 ساعة في هيدروكسيد الصوديوم M 1.25 في حمام الايثانول 40٪، وأخيرا الأوتوكلاف. وينبغي أن تشطف جيدا الأواني الزجاجية لا تقل عن خمس مرات مع الماء عالى النقاء (17 MΩ أو أعلى) بعد حمض وقاعدة حمام الخطوات.
- إعداد 300 مل من محلول 2 4 ملم وNABH 100 مل من حل ملي 1 3 AGNO باستخدام المياه المبردة في تعقيمها 10 ° C. فإن درجات الحرارة المنخفضة منع جنبا إلى رد فعل NABH 4.
- إضافة 300 مل من 2 مم إلى الحل 4 NABH بقيمة 500 مل قارورة مخروطي تابع رد فعلaining بار ضجة والتفاف القارورة مع رقائق الألومنيوم لمنع أكسدة الفضة. ضع قارورة في حمام جليدي على طبق من ضجة وإثارة في 325 دورة في الدقيقة حل لمدة 10 دقيقة.
- رئيس السحاحة 25 مل من الشطف مع عمود كامل من الماء عالى النقاء. بعد فتيلة، وملء السحاحة مع الحل 3 AGNO والتفاف مع رقائق الألومنيوم.
- في غرفة مظلمة، إضافة 50 مل من 1 مم 3 AGNO حل بمعدل 1 قطرة ثانية -1 إلى الحل 4 NABH مع التقليب المستمر (الشكل 1A). تغطية الجزء الأوسط من الجهاز مع "خيمة احباط" لتقليل التعرض للضوء أثناء بالإضافة AGNO 3. وبالإضافة إلى ذلك AGNO ال 3 دقيقة تتطلب 30-40. تجديد حمام جليدي بشكل دوري.
- بعد ال 3 AGNO بالإضافة اكتمال تجديد حمام الثلج ويستمر التحريك الحل الغروية ل45-50 دقيقة إضافية. وأشار تشكيل AgNPs الغروية عن تغيير في لون من عديم اللونإلى الأصفر الذهبي، والذي هو سمة من سطح صدى مأكل الحد الأقصى من AgNPs (1B الشكل).
- بمجرد الانتهاء من رد الفعل، بردت الغروانية. ويمكن الجمع بين دفعات AgNP الغروية بعد أسبوع واحد إذا كان الغروانية ظلت متسقة، أي حل الغروية لم تجميعها وتميزت الدفعة باستخدام القياس الطيفي للأشعة فوق البنفسجية فيس الاستيعاب والتحليل الطيفي لتحديد رامان التجميع ممكن أو الملوثات.
2. توصيف AgNPs الغروية
واستخدمت كاري A 50 UV-VIS-NIR الطيف (فاريان شركة) ونظام LabRamHR رامان 800 (HORIBA Jobin ايفون، وشركة) مجهزة لBX41 أوليمبوس المجهر متحد البؤر رامان، لتوصيف AgNP. كانوا يعملون في WinUV كاري البرمجيات، LabSpec V.5 والمنشأ 8،0 البرمجيات لجمع البيانات وتحليلها.
ملاحظة: سوف المعلمات اقتناء يجب أن يكون الأمثل للنماذج R الأجهزة الأخرى.
تحديد مأكل سطح صدى AgNPs الغروية عن طريق الأشعة فوق البنفسجية فيس المطياف
- ملء 1 سم 3 كوفيت القابل للتصرف مع الغروانية كريتون والماء عالى النقاء في نسبة حجم 1:10. ملء آخر 1 سم 3 كوفيت مع الماء عالى النقاء لتصحيح خط الأساس فارغة. مسح خارج كل cuvettes مع Kimwipe.
- تعيين الطيف الامتصاصية إلى وضع حد أدنى من القيمة -0.5 Y إلى حد أقصى من Y 1.0. تعيين النافذة X المسح الضوئي ل200-800 نانومتر وتحديد معدل المسح السريع للدقيقة نانومتر 4800 -1 مع تصحيح خط الأساس.
- إدراج كوفيت مملوءة بالماء في الصك وتشغيل تفحص خط الأساس. كرر إذا لزم الأمر حتى يتحقق عنصر تحكم خط الأساس غير صفرية.
- استبدال كوفيت فارغة مع كوفيت عينة المسح والبدء في الامتصاصية لجمع امتصاص الطيف للأشعة فوق البنفسجية فيس الغروية من العينة (الشكل 1C).
اختبار نقاء AgNPs الغروية عن طريق التحليل الطيفي رامان
نظرا لضيق الوقت المتاح للمظاهرة الفيديو (10-15 دقيقة الفيديو) والحد من مساحة النص بروتوكول (الحد الأقصى 3 صفحات)، لن يكون هذا القسم التجريبية مسجلة على شريط فيديو.
- تعيين إعدادات المعلمة الصك على النحو التالي: مصدر الإثارة (632.8 نانومتر و-ني)، والتصفية (أي التصفية، قوة الليزر في العينة ~ 17 ميغاواط)، فتحة مبائر (300 ميكرون)، مطياف (730 سم -1)، مقضب الثلاثية الأبعاد (600 بساتين / مم)، الهدف عدسة (50X طويلة المسافة الجوية العاملة الهدف)، زمن التعرض (30 ق)، ودورات تراكم (5).
- استخدام ماصة نظيفة لملء كوفيت الكوارتز 2 مل مع المادة الغروية، وإدراج المكونات بلطف. استخدام Kimwipe لتنظيف قبالة بصمات الأصابع، أو اللطخات الغروانية من سطح كوفيت. انخفاض كبير في المرحلة المجهر. تحديد الهدف 50X عدسة ووضع كوفيت على خشبة المسرح.
- تركز جامعة الدول العربية إيه شعاع على الغروانية AgNP مباشرة تحت الجدار الداخلي للكوفيت باستخدام وضع الفيديو من الصك والكاميرا أوليمبوس. إطفاء الأنوار الغرفة والحصول على طيف رامان (1D الشكل).
3. اختيار الحجم وتركيز AgNPs الغروية عن طريق الترشيح الفائق تدفق تماسي (TFU)
واستخدم II KrosFlo بحوث تصفية نظام (الطيف المختبرات، رانشو دومينغيز، CA) للحد من التشتت المتعدد AgNP والتركيز عليها (الشكل 2). وكانت الخطوات الثلاث لعملية TFU: (1) مقاس اختيار AgNPs وAgNP-المجاميع من نانومتر في القطر-50 وأكبر باستخدام 50-نانومتر MidiKros polysulfone وحدة (460 سم 2)، 2) اختيار حجم وتركيز AgNPs من 1-20 نانومتر في القطر باستخدام 100-MidiKros دينار تصفية (200 سم 2)، و (3) الحد من حجم علاوة على ذلك باستخدام MicroKros 100-polysulfone دينار تصفية (20 سم 2) (الشكل 3).
ق = "jove_step"> الخطوة 1
- ربط حجم التغذية MasterFlex 17 أنابيب إلى مضخة تمعجية حسب الشكل 2A. ستكون هناك حاجة إلى Y-مفرق تقاطع أنابيب وللمجموعة يصل. نعلق أنابيب إلى وحدة MidiKros 50-نانومتر. تأكد من تأمين أنابيب لتصفية باستخدام العلاقات البريدي. حدد 17 حجم أنابيب باستخدام زر SIZE.
- حدد عكس اتجاه مضخة باستخدام زر DIR. تأكد من زر MODE على INT.
- خفض سعر مضخة لأقل من 300 مل -1 دقيقة قبل البدء المضخة. ينبغي تعديل معدل مضخة وفقا لحجم أنابيب المستخدمة. يجب أن يكون الإعداد صغيرة للسماح للمشغل مع الاستجابة السريعة لتسرب محتمل ولكن كبيرة بما يكفي للا يزال لها تأثير النظام فتيلة. من أجل خلق الفراغ اللازمة لرسم الغروانية من الخزان إلى الأنبوب والتصفية، وقطع الأنبوب الذي يؤدي من القسم السفلي للمرشح إلى الجزء العلوي من تقاطع-Y في وسط الأنبوب.
- ضع جزء من الأنابيب التي تؤدي من تصفية في زجاجة وخزان المشبك قبالة الجزء السفلي من الأنابيب بالقرب من تقاطع-Y مع المشبك أو باليد. تشغيل المضخة. يجب أن الفراغ الناجم عن بدء شفط الغروانية.
- مرة واحدة في السائل يتدفق بحرية من خلال أنبوب، إيقاف المضخة، والانضمام إلى القسم المكسور من أنابيب مع تقاطع أنابيب وتأمين العلاقات مع البريدي. تشغيل المضخة مرة أخرى ومواصلة الترشيح.
- تحقق دائرة أنابيب للكشف عن التسربات. إذا تم العثور على تسرب، تسرب إصلاح عن طريق ضبط تركيب أو إعادة تأمين-بالتعادل البريدي. مرة واحدة هو نظام أنابيب تسرب الحرة، ويمكن زيادة معدل تدفق المضخة إلى ما لا يزيد عن 700 مل -1 دقيقة. وينبغي أن يكون الأمثل معدل ضخ هذه القيمة وفقا لحجم أنابيب أنابيب لتجنب الفشل. مواصلة الترشيح حتى يتم استنزاف السائل في الخزان الزجاجة إلى أي شيء تقريبا.
- مرة واحدة في الترشيح اكتمال جمع الراشح الذي يحتوي AgNPs 50 نانومتر وقطرها األصغرلير. يمكن حفظ retentate لمزيد من التحليل وفقا لتطبيق AgNP محددة.
الخطوة 2
- شطف الأنابيب مع 2٪ HNO 3 والمياه فائقة النقاء قبل تثبيت MidiKros 100-دينار تصفية باستخدام نفس الإعداد للوحدة 50-نانومتر.
- كرر الخطوة 3.3 باستخدام وحدة MidiKros 100-دينار كويتي.
- مرة واحدة في الترشيح اكتمال جمع محتويات الأنابيب وتصفية (100 دينار كويتي retentate). يجب أن يكون حجم ما يقرب من 50 مل.
الخطوة 3
- توصيل أنابيب حجم MasterFlex (14) وMicroKros 100-FILTER دينار للمضخة تحوي حسب الشكل 2B. تأمين جميع التقاطعات مع العلاقات البريدي. حدد حجم أنابيب 14 على مضخة باستخدام زر SIZE وانخفاض معدل ضخ إلى 30 دقيقة -1 مل.
- بدء عملية الترشيح. تحقق دائرة أنابيب للكشف عن التسربات. إذا تم العثور على تسرب، تسرب إصلاح عن طريق ضبط صالحتينغ أو إعادة تأمين. بالتعادل البريدي
- مرة واحدة هو نظام أنابيب تسرب مجانا، يمكن زيادة معدل تدفق المضخة إلى ما لا يزيد عن 90 دقيقة -1 مل. مواصلة الترشيح حتى السائل المتبقي في الزجاجة خزان يحتوي على كمية ضئيلة من التركيز.
- ويمكن جمع محتويات المتبقية من الأنابيب وفلتر في زجاجة الخزان عن طريق إزالة أنبوب التغذية من الزجاجة في حين أن مضخة لا يزال قيد التشغيل. مرة واحدة محتويات أنابيب وفلتر في خزان الزجاجة، قد يتم تشغيل المضخة قبالة.
4. الكمي المبلغ الفضة الغروية في AgNPs بواسطة البلازما بالحث طيف الانبعاث الضوئي (ICP-OES)
تم هضمها كيميائيا كل عينة الغروية وكان كميا كمية من الفضة من قبل ICP-OES باستخدام مطياف A 710E (فاريان شركة). تم انشاء وحدة المعايرة منحنى الانحدار الخطي للفضة (الشكل 4) باستخدام المعايير الفضة ثمانية (0، 3، 7، 10، 15، 25، 50، 100 ميكروغرام وL -1)، والتي أعدت من على 10،000 القياسية مل ميكروغرام الفضة -1 لتحليل المعادن النزرة (الترا العلمية).
- هضم كيميائيا باستخدام عينات HNO 3. عينات ممثلة هي الغروانية الأصلي (الخطوة 1)، 50 نانومتر الترشيح (الخطوة 1)، 100-retentate دينار كويتي (الخطوة 2)، والأخيرة 100-retentate دينار كويتي (الخطوة 3) (الشكل 3).
- يجب تخفيفه العينات مع 2٪ HNO 3 باستخدام نسب حجم التالية: 1:1000 لالغروانية الأصلي، 1:1000 للرشاحة 50-نانومتر، 1:25،000 لretentate 100-دينار كويتي الأولى، و1:250،000 لل المباراة النهائية 100-retentate دينار كويتي. لمنع الرشح الفضة، ينبغي تخزينها في حاويات جميع العينات البولي بروبلين منخفض الكثافة.
- تعيين المعلمات أداة ICP-OES على النحو التالي: الطول الموجي للAG (328.068 نانومتر)، والسلطة (1.20 كيلوواط)، والبلازما تدفق (15.0 L دقيقة -1)، تدفق المساعدة (1.50 L دقيقة -1)، وضغط البخاخات (200 كيلو باسكال ).
- كل ساوينبغي قياس mple في ثلاث نسخ مع الوقت من تكرار 10 ثانية. وينبغي أن تستخدم لقياس الوقت بين استقرار 15 ثانية وثانية 30 عينة تأخير امتصاص. وينبغي الأخذ A فارغة بين كل عينة طريقة للحد من احتمال انتقال التلوث.
5. توزيع حجم AgNPs الغروية عن طريق المجهر الإلكتروني بالإرسال (TEM)
تم استخدام EM فيليبس 208S TEM لتصور AgNPs الغروية. تم القبض على micrographs الإلكترون باستخدام كاميرا ذات دقة عالية Bioscan غاتان وتحليلها في برامج يماغيج 24
- تمييع العينة 100-retentate دينار كويتي مع الماء عالى النقاء (1:100 نسبة حجم). إيداع 20 ميكرولتر من الغروانية الأصلي والمخفف 100-retentate دينار كويتي (الخطوة 3) على 300-شبكة الشبكات الذهب formvar المغلفة (علوم المجهر الإلكتروني). السماح للشبكات لتجف في المجفف. عرض خلال يوم واحد.
- تعيين تسريع المحتملة للصك في 70 كيلو فولت TEM لتصور AgNPs. Capture micrographs الإلكترون (الشكل 5) باستخدام كاميرا عالية الدقة، وباستثناء ما شكل ملفات الصور المعلمة (TIFF).
6. ممثل النتائج
توليف وتوصيف AgNPs الغروية
فقد تم تصنيع بنجاح أربعة لترات من AgNPs كريتون الغروية باستخدام الإعداد المعروضة في الشكل 1A. كان الغروانية النهائي صفة اللون الأصفر الذهبي (1B الشكل). 22 و 23 وطيف الامتصاص للأشعة فوق البنفسجية فيس هذا الغروانية كان نموذجي، متناظرة حادة سطح مأكل الذروة (SPR) على 394 نانومتر (الشكل 1C). قدم رامان طيف من الغروانية كريتون الأصلي والنهائي retentate 100-دينار كويتي فقط ثلاثة أنماط الذبذبات، وهي منحنية (1640 سم -1) والمتماثلة وغير المتماثلة وسائط تمتد من H 2 O (3245 سم -1 و 3390 سم -1 ، على التوالي) (1D الشكل).
TFU من AgNPs الغروية
وصفت الإعداد TFU والتخطيطي لعملية TFU 3-خطوة في أرقام 2 و 3، على التوالي. في الخطوة 1، واستخدم عامل تصفية 50-نانومتر (460 سم 2) لتحديد الحجم وإزالة الركام وAgNPs AgNP-50-نانومتر من قطر وأكبر من الغروانية الأصلي (حوالي 100 مل من 50 نانومتر retentate). ورافق هذه الخطوة أيضا من انخفاض حجم صغير من 4 L من الغروانية الأصلي أسفل إلى 3.9 L 50 نانومتر الترشيح. تم استخدام أية خطوة أو تعطيل تدفق الغسيل العكسي. تم الحصول على تخفيض حجم أكبر (أي إزالة الماء) في الخطوة 2، عندما تم تشغيل في وقت لاحق الراشح 50-نانومتر من خلال مرشح 100-دينار كويتي (200 سم 2). كان الناتج 100-retentate دينار وبلغ حجم التداول الإجمالي لل50 مل. تم القضاء على معظم مشتقات التوليف والكواشف الزائدة في هذه الخطوة من خلال المذيب الماء (3،850 مل من 100 KD-الراشح). علاوة على ذلك، تم تحقيق AgNP تركيز من قبل additخفضت ايون من خطوة الترشيح الثالث إلى إجراء عنها سابقا. (19) وفي هذه الخطوة 3، مرشح 100-دينار كويتي من مساحتها أقل (20 سم 2) حجم 100-retentate دينار إلى 4.0 مل. فإن القياسات تبين أن هذا TEM النهائي 100-دينار كويتي retentate تتألف في معظمها من AgNPs المجمعة المتواضع من 1-20 نانومتر في القطر.
ICP-OES وTEM من AgNPs الغروية
تم انشاء وحدة المعايرة منحنى الانحدار الخطي (الشكل 4) للفضة من ثمانية معايير (0، 3، 7، 10، 15، 25، 50، و 100 ميكروغرام L -1). ثم تم تحديد مبلغ من الفضة في كل من الممثل أربعة عينات من الغروية منحنى المعايرة ICP-OES من خلال استقراء: الغروانية الأصلي (15.2 جزء في المليون، الشكل 3A)، و 50 نانومتر الترشيح (14.1 جزء في المليون، الشكل 3B)، أول 100 - retentate دينار كويتي (683.1 جزء في المليون، الشكل 3C) والأخيرة 100-retentate دينار كويتي (8،538.9 جزء في المليون، الشكل 3D).العائد الفعلي للجزء في المليون 15،2 قريبة جدا من العائد النظرية التقليدية بنسبة 15.4 جزء في المليون للتفاعل كريتون. وقد انعكس التركيز الشديد من AgNPs (4 مل من 8،538.9 جزء في المليون) من تغيير جذري في لون أصفر ذهبي من لالغروانية الأصلي إلى البني الداكن للretentate 100-دينار كويتي النهائي (الشكل 3، تدرجا من الصور قارورة). تم العثور على نوعية المرشحات لتكون حاسمة بالنسبة لعملية TFU، ولا سيما إلى الخطوة 1. تراوحت تركيزات النهائي retentate من 3،390.1 9،333.3 جزء في المليون جزء في المليون إلى اعتمادا على حالة من المرشحات (المستخدمة بكثرة مقابل العلامة التجارية الجديدة). إذا كان غشاء تصبح المسام للخطر، سيتم أيضا AgNPs التي لديها أقل من أقطار-50 نانومتر ويتم الاحتفاظ سينخفض في وقت لاحق من المبلغ الإجمالي AgNPs التي يتم جمعها في الترشيح. يمكن تعظيم الاستفادة من عملية الترشيح لتشمل مراقبة ضغط التنظيف السليم وزيادة العمر الافتراضي للمرشحات.
micrographs ممثل TEM وتظهر الأصلي كريتون الغروانية والنهائي 100-retentate دينار كويتي (الخطوة 3) في الشكل 5A و5C، على التوالي. في حالتها unaggregated، AgNPs تظهر المناطق جولة سوداء على خلفية رمادية أخف. وقد تم تحديد حوالي 800 AgNPs في micrographs TEM كل من العينتين وحللت باستخدام برنامج J الصورة. تم تعريف واحد من الجسيمات محيط كاملة والمغلقة. تم تعيين قيمة العتبة المنطقة بسرعة 1.0 نانومتر 2 وفقا لهذا القرار من micrographs TEM. ثم تم تصدير التهم AgNP والبيانات إلى Microsoft Excel المنطقة وتم استقراء بأقطار AgNP. تم تحديد قطر AgNP المتوسط في الغروانية الأصلي والنهائي retentate 100-دينار كويتي لتكون 9،3 نانومتر نانومتر و11.1، على التوالي. ثم تم تصدير القياسات قطر AgNPs إلى 8،0 البرمجيات المنشأ وشيد رسم بياني حجم TEM لكل عينة (الشكل 5B 5D و).
1 "SRC =" / files/ftp_upload/4167/4167fig1.jpg "/>
الشكل 1. A التجميعي) الإعداد، B) لون مميز، C) UV-فيس طيف الامتصاص، وD) الطيف رامان من AgNPs كريتون الغروية.

الشكل 2 TFU الإعداد تجريبي لخطوات) 1 و 2: I) التي تحتوي على خزان AgNPs كريتون الغروية. II) خزان لجمع الرشاحة. III) Y-تقاطع في الأنابيب. IV) تحوي رئيس المضخة. . V) إما 50-100-نانومتر أو ميدي دينار تصفية Kros B) الخطوة 3: I) التي تحتوي على خزان AgNPs كريتون الغروية. II) خزان لجمع الرشاحة. III) 100 دينار كويتي مايكرو Kros التصفية.
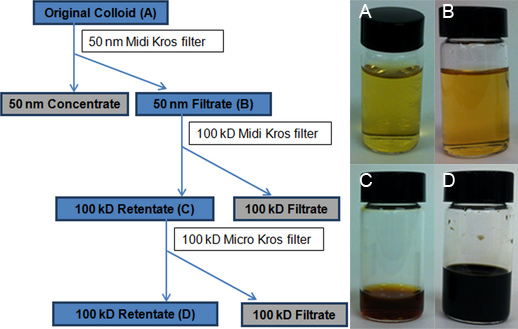
الشكل 3. مخطط انسيابي يصور عملية TFU. المربعات الزرقاء المظللة بمناسبة المعلقات الغروية من AgNPs جمعها لمزيد من التحليل. قارورة عhotographs تظهر A) الأصل الغروانية دفعة، B) 50 نانومتر الترشيح التي تم جمعها بعد معالجة الغروانية الأصلي من خلال تصفية 50-نانومتر (460 سم 2)، C) أولا retentate 100-دينار كويتي تم الحصول عليها بعد تخفيض حجم باستخدام دينار كويتي 100-ميدي Kros تصفية (200 سم 2)، وD) النهائي retentate 100-دينار الناتجة عن تخفيض حجم باستخدام دينار كويتي 100-مايكرو Kros تصفية (20 سم 2). و100-دينار كويتي الترشيح يشبه الماء.
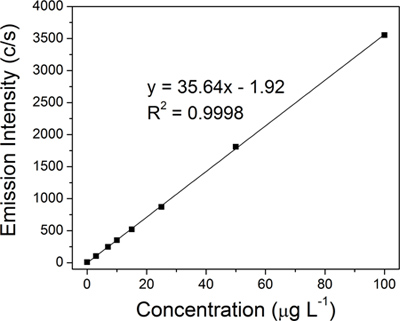
الشكل 4 ICP-OES المعايرة الخطية التي شيدت باستخدام معايير الفضة الثامن: 0، 3، 7، 10، 15، 25، 50، و 100 ميكروغرام L -1.
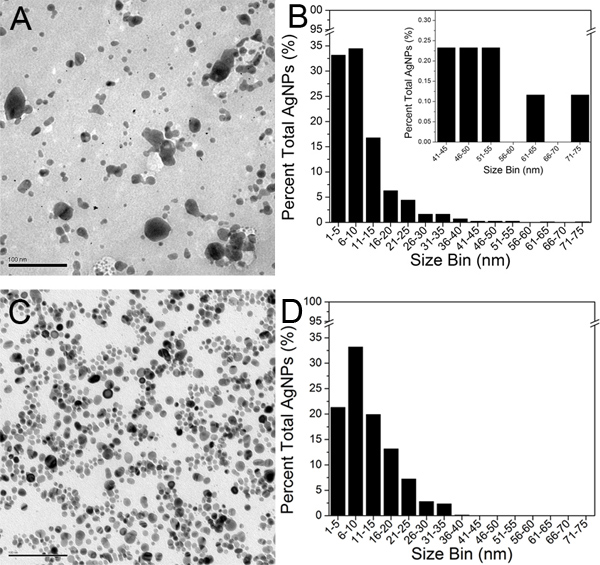
micrographs TEM الشكل 5. من A AgNPs) كريتون الأصلي وC) 100-النهائي دينار retentate (شريط المقياس100 نانومتر). المدرج الاحصائي حجم TEM شيدت من خلال تحليل حوالي 800 AgNPs لB) الأصلي AgNPs كريتون، وD) النهائي retentate 100-دينار كويتي. وأقحم في 5B يوضح الشكل الموسع حجم 41-75 نانومتر النطاق لأغراض المقارنة. اضغط هنا لمشاهدتها بشكل اكبر شخصية .
Discussion
UV-فيس المطياف الاستيعاب والتحليل الطيفي رامان من AgNPs الغروية
ومن المعروف جيدا أن عددا من القمم سطح صدى مأكل في طيف الامتصاص يقلل من الغروانية والتماثل للزيادات AgNPs. بالإضافة إلى ذلك، AgNP التجميع يؤدي إلى ظهور قمم أوسع أو أحمر تحول.
Disclosures
الإعلان عن أي تضارب في المصالح.
Acknowledgements
ومن المسلم به بامتنان بتمويل من مؤسسة العلوم الوطنية من خلال NUE في الهندسة وبرامج اتحاد LEADER.
Materials
| نترات الفضة (AGNO 3) | أكروس العضوية شركة | CAS: 7761-88-8 | |
| بوروهيدريد الصوديوم (NABH 4) | أكروس العضوية شركة | CAS: 16940-66-2 | |
| حمض النيتريك (HNO 3، أوبتيما) | شركة فيشر العلمية | A467-1 | تتبع الصف معدنية للتحليل ICP |
| 10000 ميكروغرام مل -1 الفضة القياسية، EnviroConcentrate | فائقة العلمي | US-IAA-047 | |
| KrosFlo بحوث II ط تماسي نظام الترشيح تدفق | مختبرات شركة الطيف | SYR2-01N-U20 | |
| 0،05 ميكرون PS (0.5 مم) 460 سم 2 | مختبرات شركة الطيف | X30S-900-02N | |
| ميدي 100 دينار PS 200 سم 2 | مختبرات شركة الطيف | X3-100S-02N-901 | |
| Micro100 دينار PS 20 سم 2 | مختبرات شركة الطيف | X1AB-300-10N | |
| MasterFlex C-L أنابيب فليكس / S الحجم 17 | كول بالمر شركة الصك | 06424-17 | |
| MasterFlex C-L أنابيب فليكس / S حجم 14 | كول بالمر شركة الصك | 06424-14 | |
| كاري الطيف UV-VIS-NIR 50 | فاريان شركة | ||
| LabRam HR 800 نظام | HORIBA Jobin ايفون شركة | ||
| فاريان ICP-710ES OES | فاريان شركة |
الجدول 1. الكواشف محددة والمعدات.
References
- Savage, N., Diallo, M. S. Nanomaterials and Water Purification: Opportunities and Challenges. Journal of Nanoparticle Research. 7, 331-342 (2005).
- Jain, J. Silver Nanoparticles in Therapeutics: Development of an Antimicrobial Gel Formulation for Topical Use. Mol. Pharmaceutics. 6, 1388-1401 (2009).
- Dal Lago, V., Franca, d. O., de, A. G., Kobarg, J., Borba Cardoso, M. Size-selective silver nanoparticles: future of biomedical devices with enhanced bactericidal properties. J. Mater. Chem. 21, 12267-12273 (2011).
- Panacek, A. Silver Colloid Nanoparticles: Synthesis, Characterization, and Their Antibacterial Activity. J. Phys. Chem. B. 110, 16248-16253 (2006).
- Elechiguerra, J. Interaction of silver nanoparticles with HIV-1. Journal of Nanobiotechnology. 3, 6 (2005).
- Jana, N. R., Sau, T. K., Pal, T. Growing Small Silver Particle as Redox Catalyst. J. Phys. Chem. B. 103, 115-121 (1999).
- Tolaymat, T. M. An evidence-based environmental perspective of manufactured silver nanoparticle in syntheses and applications: A systematic review and critical appraisal of peer-reviewed scientific papers. Sci. Total Environ. 408, 999-1006 (2010).
- Willets, K. Surface-enhanced Raman scattering (SERS) for probing internal cellular structure and dynamics. Analytical and Bioanalytical Chemistry. 394, 85-94 (2009).
- Novak, J. P., Nickerson, C., Franzen, S., Feldheim, D. L. Purification of Molecularly Bridged Metal Nanoparticle Arrays by Centrifugation and Size Exclusion Chromatography. Anal. Chem. 73, 5758-5761 (2001).
- Hossain, M. K., Kitahama, Y., Huang, G. G., Han, X., Ozaki, Y. Surface-enhanced Raman scattering: realization of localized surface plasmon resonance using unique substrates and methods. Analytical and Bioanalytical Chemistry. 394, 1747-1760 (2009).
- Henglein, A., Giersig, M. Formation of Colloidal Silver Nanoparticles: Capping Action of Citrate. J. Phys. Chem. B. 103, 9533-9539 (1999).
- Sapsford, K. E., Tyner, K. M., Dair, B. J., Deschamps, J. R., Medintz, I. L. Analyzing Nanomaterial Bioconjugates: A Review of Current and Emerging Purification and Characterization Techniques. Anal. Chem. 83, 4453-4488 (2011).
- Al-Somali, A., Krueger, K. M., Falkner, J. C., Colvin, V. L. Recycling Size Exclusion Chromatography for the Analysis and Separation of Nanocrystalline Gold. Anal. Chem. 76, 5903-5910 (2004).
- Hanauer, M., Pierrat, S., Zins, I., Lotz, A., Sonnichsen, C. Separation of Nanoparticles by Gel Electrophoresis According to Size and Shape. Nano Lett. 7, 2881-2885 (2007).
- Sweeney, S. F., Woehrle, G. H., Hutchison, J. E. Rapid Purification and Size Separation of Gold Nanoparticles via Diafiltration. J. Am. Chem. Soc. 128, 3190-3197 (2006).
- Clarke, N. Z., Waters, C., Johnson, K. A., Satherley, J., Schiffrin, D. J. Size-Dependent Solubility of Thiol-Derivatized Gold Nanoparticles in Supercritical Ethane. Langmuir. 17, 6048-6050 (2001).
- Schaaff, T. G. Isolation of Smaller Nanocrystal Au Molecules: Robust Quantum Effects in Optical Spectra. J Phys Chem B. 101, 7885-7891 (1997).
- Trefry, J. C. Size Selection and Concentration of Silver Nanoparticles by Tangential Flow Ultrafiltration for SERS-Based Biosensors. J. Am. Chem. Soc. 132, 10970-10972 (2010).
- Bhattacharjee, S., Bhattacharjee, C., Datta, S. Studies on the fractionation of & beta-lactoglobulin from casein whey using ultrafiltration and ion-exchange membrane chromatography. J. Membr. Sci. 275, 141-150 (2006).
- Eppler, A., Weigandt, M., Schulze, S., Hanefeld, A., Bunjes, H. Comparison of different protein concentration techniques within preformulation development. Int. J. Pharm. 421, 120-129 (2011).
- Creighton, J. A., Blatchford, C. G., Albrecht, M. G. Plasma resonance enhancement of Raman scattering by pyridine adsorbed on silver or gold sol particles of size comparable to the excitation wavelength. J. Chem. Soc. Faraday Trans. 2, 790-798 (1979).
- Pavel, I. E. Estimating the Analytical and Surface Enhancement Factors in Surface-Enhanced Raman Scattering (SERS): A Novel Physical Chemistry and Nanotechnology Laboratory Experiment. J. Chem. Educ. , (2011).
- Rasband, W. S. . ImageJ. , (1997).
- Kelly, K. L., Coronado, E., Zhao, L. L., Schatz, G. C. The Optical Properties of Metal Nanoparticles: The Influence of Size, Shape, and Dielectric Environment. J. Phys. Chem. B. 107, 668-677 (2003).
- Śileikaitċ, A., Prosyčevas, I., Puišo, J., Juraitis, A., Guobienċ, A. Analysis of Silver Nanoparticles Produced by Chemical Reduction of Silver Salt Solution. Mater. Sci. (Medziagotyra). 12, 287-291 (2006).
- Lewis, L. N. Chemical catalysis by colloids and clusters. Chem. Rev. 93, 2693-2730 (1993).
- Li, Y., Wu, Y., Ong, B. S. Facile Synthesis of Silver Nanoparticles Useful for Fabrication of High-Conductivity Elements for Printed Electronics. J. Am. Chem. Soc. 127, 3266-3267 (2005).
- Sun, Y., Xia, Y. Shape-Controlled Synthesis of Gold and Silver Nanoparticles. Science. 298, 2176-2179 (2002).
- Han, X., Zhao, B., Ozaki, Y. Surface-enhanced Raman scattering for protein detection. Analytical and Bioanalytical Chemistry. 394, 1719-1727 (2009).
- Pavel, I. Label-Free SERS Detection of Small Proteins Modified to Act as Bifunctional Linkers. J. Phys. Chem. C. 112, 4880-4883 (2008).
- Ladner, D. A., Steele, M., Weir, A., Hristovski, K., Westerhoff, P. Functionalized nanoparticle interactions with polymeric membranes. J. Hazard. Mater. , (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved