A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
اختبار قابلية المضادات الحيوية الناجم عن الإجهاد على رقاقة
In This Article
Summary
لقد طورنا منصة microfluidic لاختبار قابلية المضادات الحيوية السريعة. يتم تمرير السوائل بسرعات عالية على البكتيريا التي شلت حركتها في الجزء السفلي من قناة microfluidic. في وجود الإجهاد والمضادات الحيوية ، تموت سلالات البكتيريا المعرضة بسرعة. ومع ذلك، يمكن للبكتيريا المقاومة البقاء على قيد الحياة هذه الظروف العصيبة.
Abstract
لقد طورنا طريقة ميكروفلويديك سريعة لاختبار قابلية المضادات الحيوية في بيئة قائمة على الإجهاد. يتم تمرير السوائل بسرعات عالية على البكتيريا التي شلت حركتها في الجزء السفلي من قناة microfluidic. في وجود الإجهاد والمضادات الحيوية ، تموت سلالات البكتيريا المعرضة بسرعة. ومع ذلك، البكتيريا المقاومة البقاء على قيد الحياة هذه الظروف العصيبة. الفرضية وراء هذه الطريقة جديدة: تنشيط الإجهاد للمسارات الكيميائية الحيوية، والتي هي أهداف للمضادات الحيوية، يمكن تسريع اختبار قابلية المضادات الحيوية. بالمقارنة مع طرق اختبار قابلية المضادات الحيوية القياسية ، يتم حذف الخطوة المقيدة للمعدل - النمو البكتيري - أثناء تطبيق المضادات الحيوية. ويندمج التنفيذ التقني للطريقة في مزيج من التقنيات المعيارية والنهج المبتكرة. وتشمل الأجزاء القياسية من هذه الطريقة بروتوكولات الثقافة البكتيرية، وتحديد قنوات microfluidic في البوليديميثيلسيلوكسيان (PDMS)، ورصد صلاحية الخلية مع الفلورسينس، ومعالجة الصور دفعة لعد البكتيريا. أجزاء مبتكرة من هذه الطريقة هي في استخدام تدفق وسائل الإعلام الثقافة لتطبيق الإجهاد الميكانيكية، واستخدام الإنزيمات لتلف ولكن ليس قتل البكتيريا، واستخدام الركائز microarray للتعلق البكتيري. يمكن استخدام المنصة المطورة في تطوير واختبار الأدوية ذات الصلة بالمضادات الحيوية وغير الحيوية. بالمقارنة مع تجارب التعليق البكتيري القياسية ، يمكن تشغيل تأثير الدواء وإيقافه مرارا وتكرارا خلال فترات زمنية خاضعة للرقابة. الملاحظة المتكررة لنفس السكان البكتيرية ممكنة على مدار التجربة نفسها.
Introduction
يؤدي ظهور المقاومة البكتيرية إلى تكثيف الحاجة إلى اختبارات سريعة للحساسية للمضادات الحيوية القائمة على النمط الظاهري من أجل حماية أدويتنا الملاذ الأخير. وتستند اختبارات قابلية القياسية على تثبيط النمو البكتيري في وجود المضادات الحيوية التي تستغرق عدة (8-24) ساعات لإكمال. لقد طورنا اختبار قابلية جديدة للمضادات الحيوية على منصة microfluidic التي تعتمد على تنشيط الإجهاد من المسارات التركيب الحيوي لتسريع عمل المضادات الحيوية.
تحمل اختبارات قابلية المضادات الحيوية على مقياس microfluidic ميزة الاستخدام الفعال للعينة ، لأنها تتطلب أعدادا صغيرة من البكتيريا. بالإضافة إلى ذلك، يمكن أن تكون أجهزة microfluidic متعددة من أجل اختبار عينات متعددة في ظل ظروف متعددة1،2. في الآونة الأخيرة ، تم الإبلاغ عن عدد من الطرق الدقيقة لاختبار قابلية المضادات الحيوية3-9. في هذه الطرق، تزرع البكتيريا داخل نانو وقطرات بيكوليتر3،7،في الحجم الكامل للقناة microfluidic4-6،8،أو كبكتيريا واحدة مترجمة كهربائيا إلى السطح السفلي للقناة9. على الرغم من أن هذه الاختبارات تتم في قنوات microfluidic ، إلا أنها تراقب جميعا النمو الميكروبي في وجود وعدم وجود مضادات حيوية مماثلة للطرق التقليدية. يتم أخذ قياسات النمو عن طريق الكثافة البصرية، والأصباغ الحساسة لhh، أو تباين المجال / المرحلة الساطعة أو صور الفلورسينس. على الرغم من أن بعض هذه الاختبارات أسرع من الطرق التقليدية، إلا أن كل منها يكتشف مقاومة المضادات الحيوية بشكل سلبي. وبعبارة أخرى، لا تزال هذه الأساليب تتطلب من المستخدم الانتظار للنمو البكتيري كمقروءة نهائية.
في المقابل، قمنا بتطوير طريقة تستخدم مزيجا من القص والإجهاد الأنزيمي لتنشيط المسارات الكيميائية الحيوية الحساسة للمضادات الحيوية10. تحدي البكتيريا وشدد مع تلك المضادات الحيوية يخلق اختبار قابلية أكثر سرعة. البكتيريا المقاومة للمضادات الحيوية قادرة على تحمل الظروف العصيبة. البكتيريا المعرضة، من ناحية أخرى، تقتل بسرعة من الضغوط مجتمعة. تحدد النسبة المئوية لوفيات الخلايا بعد ساعة واحدة، التي تقاس بالمنظار الدقيق باستخدام بقعة الخلايا الميتة الفلورية، النمط الظاهري للبكتيريا (المقاومة مقابل المعرضة).
من أجل التنفيذ الناجح لطريقتنا ، يجب شل حركة البكتيريا على السطح السفلي للقناة الدقيقة. وبهذه الطريقة، يمكن أن تتعرض البكتيريا لضغوط مختلفة وصورت في وقت واحد تحت المجهر في طائرة واحدة. يتم استخدام شريحة زجاجية مجهرية مغلفة لشل حركة البكتيريا. الشريحة هو precoated من قبل الشركة المصنعة مع مجموعات epoxide لربط البروتين غير محددة. الربط غير المحدد لهذه البيروكسيدات إلى البروتينات السطحية البكتيرية يعلق بشكل مشترك البكتيريا على سطح الشريحة.
يتم اختبار السلالات في ظل ظروف مماثلة (القص + الإجهاد الأنزيمي) في غياب (التحكم) ووجود (تجربة) المضادات الحيوية. يتم التقاط صور الطور والمجهر الفلوري لكل قناة تلقائيا كل دقيقتين لمدة ساعة واحدة. ثم يتم إجراء تسميات المقاومة من خلال مقارنة نسبة البكتيريا الميتة في القناة التجريبية بتلك الموجودة في قناة التحكم. بعد ساعة واحدة، تعتبر عينة مع نسبة وفيات الخلايا أكبر من 1٪ عرضة، في حين أن أقل من 0.5٪ وفاة يدل على المقاومة. وتعتبر النسب المئوية التي تقع بين هذين الانقطاعين غير محددة ويجب اختبار العينة مرة أخرى.
يتم تعريف القنوات الدقيقة في PDMS ، وهي مادة مفضلة للأجهزة الدقيقة11. وتكتسي نسبة PDMS شفافية بصرية في مجموعة واسعة من الأطوال الموجية، وهي متوافقة بيولوجيا، وغير خاملة، ووافرة بالنسبة للغازات، ولها نفاذية منخفضة للسوائل؛ لذلك هو مناسبة جيدا ل هذا تجارب.
يتم إنشاء الإجهاد الميكانيكية / القص من خلال تدفق وسائل الإعلام درجة حرارة الغرفة على البكتيريا المشلومة. (ملاحظة: ارتفاع درجة حرارة الوسائط إلى 37 درجة مئوية ليس له تأثير كبير على نتيجة الفحص.) مضخات حقنة الآلي قوة وسائل الإعلام (التي تحتوي على بقعة الخلية الميتة +/- المضادات الحيوية، فضلا عن الضغوطات الأنزيمية الاختيارية) من خلال قنوات microfluidic (200 ميكرومتر × 400 ميكرومتر) بمعدل تدفق 1 مل / دقيقة لإعطاء 6.25 كيلو باسكال من قوة القص أو معدل القص من 6000ثانية -1. هذا المعدل يساوي أو يتجاوز ضغوط القص التي تمت دراستها مسبقا على المكورات العنقودية.
تم اختيار الإنزيم ، ليسوستوفين ، للتجارب الأولية لأنه يسبب ضررا مباشرا لجدار خلية المكورات العنقودية. كان تركيز الليسوستافين (0.7 نانوغرام /مل) كافيا للتسبب في تلف جدار الخلية البكتيرية ، ولكنه لم يكن كافيا للتسبب في موت الخلايا البكتيرية دون مضاد حيوي في الإطار الزمني للتجربة. ليس مطلوبا ليسوستافين للتسمية الصحيحة للحساسية البكتيرية لكنه لا يزيد من النتيجة، مما يؤدي إلى زيادة موت الخلايا في سلالات عرضة. في المقابل، إجهاد القص أمر بالغ الأهمية لوظيفة المقايسة. عندما يتم التعامل مع سلالات المكورات العنقودية المراسية الحساسة للميثيسيلين مع الليسوستوفين والأوكسيسيلين في غياب التدفق ، لا يتم تسجيل أي موت خلية على مدار التجربة.
يتم رصد صلاحية الخلية مع بقعة خلية ميتة الفلورسنت12. واستند اختيار الصبغة على قدرتها على وصم الخلايا التالفة فقط بشكل انتقائي، وعدم سمية للخلايا الحية، وفلورسينس خلفيتها المنخفضة، مما سمح بإضافتها المباشرة إلى وسائط الخلية دون خطوات إضافية. وكان اختيار تركيز صبغة فلورية من 0.25 ميكرومتر لتحقيق مستويات إشارة مقبولة خلال 1.6 ثانية التعرض للضوء الإثارة الفلورية.
بيتا لاكتام، أوكساسيلين، استخدمت في دراساتنا الأولية. مقاومة للميثيسيلين S. أوريوس (MRSA) الأنواع مقاومة لأوكسيسيلين ولن تظهر أي موت خلية ملحوظ في الإطار الزمني للتجربة. تم تحديد تركيز 50 ميكروغرام /مل في الدراسات الأولية. أعطى انخفاض تركيزات المضادات الحيوية فصلا أقل بين السلالات المقاومة والمعرضة للإصابة ، في حين أن التركيزات الأعلى لم تسبب فرقا ملموسا في النتائج التجريبية.
وقد سبق لنا أن أبلغنا عن نجاح تطوير الاختبار الذي يجمع بين الضغوط الميكانيكية والانزيمية التي تؤثر بشكل مباشر على جدار الخلية البكتيرية13 مع مضاد حيوي يمنع التركيب الحيوي لجدار الخلية14,15. وقد أجريت هذه التجارب إثبات المبدأ على لوحة من MRSA وحساسة للميثيسيلين S. أوريوس (MSSA). ومع ذلك ، مع اختيار المعلمات التجريبية المناسبة ، يجب أن تكون طريقتنا قابلة للتطبيق على أنواع متعددة من البكتيريا وفئات متعددة من المضادات الحيوية.
Protocol
1. جعل طبقة PDMS (الشكل 1)
- مزيج PDMS بقوة وعامل علاج في نسبة 10:1. لإزالة الفقاعات، ديغا الخليط اللزج في غرفة فراغ لمدة 1 ساعة في درجة حرارة الغرفة.
- على مقياس، صب PDMS ببطء على قالب الألومنيوم. صب من المركز والحفاظ على القالب تسويتها. تأكد من ترك دبابيس كشف. توقف عن صب مرة واحدة يتم تحقيق الوزن المستهدف.
يتطلب العفن لدينا 4 غرام من PDMS و 0.4 غرام من كاشف المعالجة. - مستوى القالب داخل الفرن، وعلاج في 37 درجة مئوية بين عشية وضحاها.
أوقات المعالجة البديلة هي ساعتين عند 60 درجة مئوية أو ساعة واحدة عند 90 درجة مئوية. - تشريح طبقة PDMS الشفاء على طول حافة القالب وتقشير بعناية الخروج من سطح العفن مع زوج من ملقط. تنظيف سطح العفن مع الإيثانول 70٪ وQ-تلميح.
2. تجميع خلية التدفق وفقا لل الشكل 2
يتم التجميع القياسي ل PDMS مع الشرائح الزجاجية من خلال معالجة بلازما الأكسجين لكلا السطحين ، مما يضمن الترابط الخالي من التسرب بين PDMS والانزلاق الزجاجي المجهر. في البروتوكول المقدم ، فإن علاج البلازما يدمر الطلاء الكيميائي على الشريحة الزجاجية. ولذلك فإن الشريحة هي ضغط مختومة بدلا من البلازما المعالجة.
- ضع النافذة الزجاجية في جيب الخلية التدفق.
- وضع شريحة زجاجية مغلفة على النافذة الزجاجية داخل جيب الخلية تدفق مع الجانب النشط حتى، ووضع طبقة PDMS مع قنوات تواجه أسفل على أعلى من ذلك. ضع الشريحة PDMS بطريقة تتماشى بها مدخلات القناة مع الفتحات في اللوحة المعدنية. ادفع الهواء برفق من بين الطبقات.
- قم بقلب تجميع الشرائح PDMS/glass بحيث يواجه PDMS النافذة الزجاجية. تداخل مدخلات قناة PDMS مع الثقوب في لوحة معدنية.
- ضع لوحة الضغط على القمة وشد البراغي.
- ضع خلية التدفق المجمعة تحت المجهر. تعيين التكبير المجهر إلى 60X وprealign مواقف القناة.
3. إعداد البكتيريا مرحلة السجل
- قبل يوم من التجربة: تلقيح 50 مل من مرق مولر هينتون الذي يحتوي على 2٪ NaCl (MH2) مع مستعمرة بكتيرية. هزة في 250 دورة في الدقيقة بين عشية وضحاها في 37 °C.
يمكن دراسة سلالة بكتيرية واحدة أو اثنتين في تجربة واحدة للترسين الموصوف. - قبل التجربة: اخلط 50 ميكرولتر من زراعة البكتيريا بين عشية وضحاها في 50 مل من وسائط MH2. هز في 250 دورة في الدقيقة لمدة 3 ساعات في 37 درجة مئوية لضمان البكتيريا في مرحلة السجل.
4. دافئ مكونات الحل التجريبي على الأقل 10 دقائق قبل أن تكون هناك حاجة إليها
- إذابة الصبغة الفلورية (5 mM الأسهم) والليسوستافين (10 ميكروغرام / مل الأسهم) في درجة حرارة الغرفة.
- قم بتدفئة مسحوق الأوكسيسيلين إلى درجة حرارة الغرفة.
5. إعداد وتحميل تعليق البكتيرية
- بعد نهاية 3 ساعة من الزراعة الفرعية: تناول 10 مل من زراعة البكتيريا والطرد المركزي بمعدل 1650 × غرام لمدة دقيقتين.
- إزالة البكتيريا العملاقة وإعادة الإنفاق في 1 مل من وسائل الإعلام MH2 الطازجة.
- إرفاق طول قصير من الأنابيب إلى 1 مل لوير قفل حقنة. مسح أنابيب حقنة مع 1 مل من وسائل الإعلام. ترك قليلا من وسائل الإعلام في الأنابيب لتجنب فقاعات الهواء عند الرسم في تعليق البكتيرية.
- تحميل 0.7 مل من البكتيريا نوع 1 في الحقنة. ملء قناتين من الخلية تدفق مع نوع البكتيريا 1. مشاهدة السائل لتظهر على الجانب الآخر من القناة بعد كاليفورنيا. 150 ميكرولتر.
تتغير شفافية القناة لأنها مليئة بالبكتيريا. - إذا جربت أنواع بكتيريا متعددة، كرر إجراء التحميل للبكتيريا من النوع 2 في القناتين المتبقيتين من خلية التدفق.
- ضع خلية التدفق داخل الحاضنة عند 37 درجة مئوية لمدة 45 دقيقة للسماح بالتسوية البكتيرية والتعلق بسطح الشريحة.
6. إعداد وتحميل الحلول التجريبية
- إعداد 140 ميكرولتر من محلول صبغة فلورية 0.5 mM عن طريق خلط 14 ميكرولتر من مخزون الصبغة الفلورية (5 mM) و 126 ميكرولتر من وسائط MH2.
- تمييع 10 ملغ من أوكساسيلين في 40 مل من وسائل الإعلام MH2 للحصول على تركيز نهائي من 250 ميكروغرام / مل أوكساسيلين.
- إعداد 130 مل من حل التحكم مع تركيزات النهائي من 0.25 ميكرومتر صبغة الفلورسنت و 0.7 نانوغرام / مل من اليسوستافين. للقيام بذلك، اخلط 65 ميكرولتر من الصبغة الفلورية (0.5 مللي متر)، و9.12 ميكرولتر من مخزون الليسوستافين (10 ميكروغرام/مل) و130 مل من وسائط MH2.
- إعداد 130 مل من محلول المضادات الحيوية مع تركيزات النهائي من 0.25 ميكرومتر صبغة الفلورسنت, 0.7 نانوغرام / مل من الليسوستافين, و 50 ميكروغرام / مل oxacillin. للقيام بذلك، قم بخلط 65 ميكرولتر من الصبغة الفلورية (0.5 مللي متر)، و9.12 ميكرولتر من مخزون الليسوستفين (10 ميكروغرام/مل)، و26 مل من الأوكسيلين (250 ميكروغرام/مل) و104 مل من وسائط MH2.
- ملء اثنين من المحاقن 60 مل مع حل السيطرة واثنين من المحاقن 60 مل مع محلول المضادات الحيوية. الحفاظ على حلول ملفوفة في رقائق الألومنيوم لتجنب التدهور الناجم عن الضوء من الكواشف.
ملء المحاقن لحساب الخسارة بسبب التنظيف من الأنابيب. - إزالة فقاعات الهواء من المحاقن عن طريق الخفقان. إرفاق وملء أنابيب الإدخال إلى طرف مع الحل التجريبي.
- تركيب المحاقن على المضخة. ضع الحقنة بأصغر حجم أولا، ثم قم بقفل موضع المكبس. تناسب بقية المحاقن على المضخة، والضغط على المكبس حسب الضرورة.
- تعيين سرعة المضخة إلى 1 مل / دقيقة وحجم المضخة إلى 60 مل. القيام تدفق مع المضخة حتى يتم رؤية تيار ثابت من السائل من جميع المحاقن.
7. إعداد خلية التدفق تحت المجهر
- إزالة خلية التدفق من الطرد المركزي وتركيبها على مرحلة المجهر(الشكل 3).
- توصيل أنابيب الإدخال/الإخراج بكل قناة من قنوات خلية التدفق (مخرج واحد لكل قناة).
جمع الإخراج في أربع حاويات مختلفة يسمح لقياس أحجام إخراج القناة الفردية.
8. تشغيل تجربة 60 دقيقة
- تحقق من المواضع المنحازة مسبقا من الخطوة 2.5. إذا لم يتم توسيط حقل الرؤية المجهر على القناة و/أو خارج التركيز، قم بضبط الإعدادات وحفظ المواقف الجديدة.
قد لا يكون التركيز الدقيق ممكنا قبل بدء التدفق بسبب الكثافة العالية للبكتيريا المحملة. - تعيين وقت اكتساب التباين المرحلة إلى 10 msec ووقت اكتساب مضان إلى 1600 msec.
- احصل على تباين المرحلة وصور الفلورسينس لكل موضع قبل بدء التدفق.
وهذا يعطي تقديرا نوعيا للكثافة البكتيرية المحملة. - بدء تدفق السائل والتحقق فورا من أن المجهر يركز على الجزء السفلي من القنوات.
- خذ تباين المرحلة وصور الفلورسينس للمناطق المستهدفة في الدقيقة الأولى من التدفق.
- الحصول على الصور كل 2 دقيقة بعد أول مجموعة من الصور حتى 60 دقيقة من التدفق قد حدث. إعادة التركيز حسب الضرورة.
9. تطهير خلية التدفق
- جعل محلول التبييض 10٪ في كوب (100 مل). ملء 4 × 20 مل المحاقن مع 10 مل من الخليط. قم بتكبيل المحاقن وربطها بخلية التدفق.
وسوف يستغرق ~ 1-2 دقيقة للقنوات لتكون واضحة من البكتيريا. - تعيين سرعة المضخة إلى 1 مل / دقيقة وحجم المضخة إلى 3 مل. تشغيل لمدة 3 دقائق.
- ملء 4 × 60 مل المحاقن مع 60 مل من المياه DI. قم بتكبيل المحاقن وربطها بخلية التدفق.
- تعيين سرعة المضخة إلى 1 مل / دقيقة وحجم المضخة إلى 30 مل. تشغيل لمدة 30 دقيقة.
- مراقبة تنظيف القناة تحت المجهر.
- تفكيك خلية التدفق. تجاهل الشريحة الايبوكسي المستخدمة. نقع مكونات خلية التدفق في المياه DI لمدة 20 دقيقة.
10. تحليل الصور وتوليد البيانات
- عد عدد البكتيريا في كل صورة.
برنامج الوصول المفتوح، CellProfiler يستخدم لتنفيذ معالجة صورة الدفعة16. يتم تلخيص مخطط تفصيلي رفيع المستوى روتين CellProfiler في الجدول 1. عدد البكتيريا الموجودة في صورة التباين المرحلة (نع)يعطي العدد البكتيري الكلي. عدد البكتيريا المرئية في صورة مضان (Nو)يعطي عدد البكتيريا الميتة. - حساب نسبة موت الخلية البكتيرية العادية كدالة للوقت.
- استيراد Nf و Np للصور الفردية في برنامج تحليل البيانات.
- حساب جزء من البكتيريا الميتة في كل قناة في نقطة زمنية محددة التي قدمها الكسر (Nو / نع)في ر = T.
- طرح جزء من البكتيريا الميتة الموجودة في بداية التجربة (ر = 1 دقيقة) لكل من السيطرة والقنوات التجريبية.
- طرح جزء من البكتيريا الميتة الموجودة في قناة التحكم من ذلك الموجود في القناة التجريبية في كل نقطة زمنية مع المعادلة التالية:
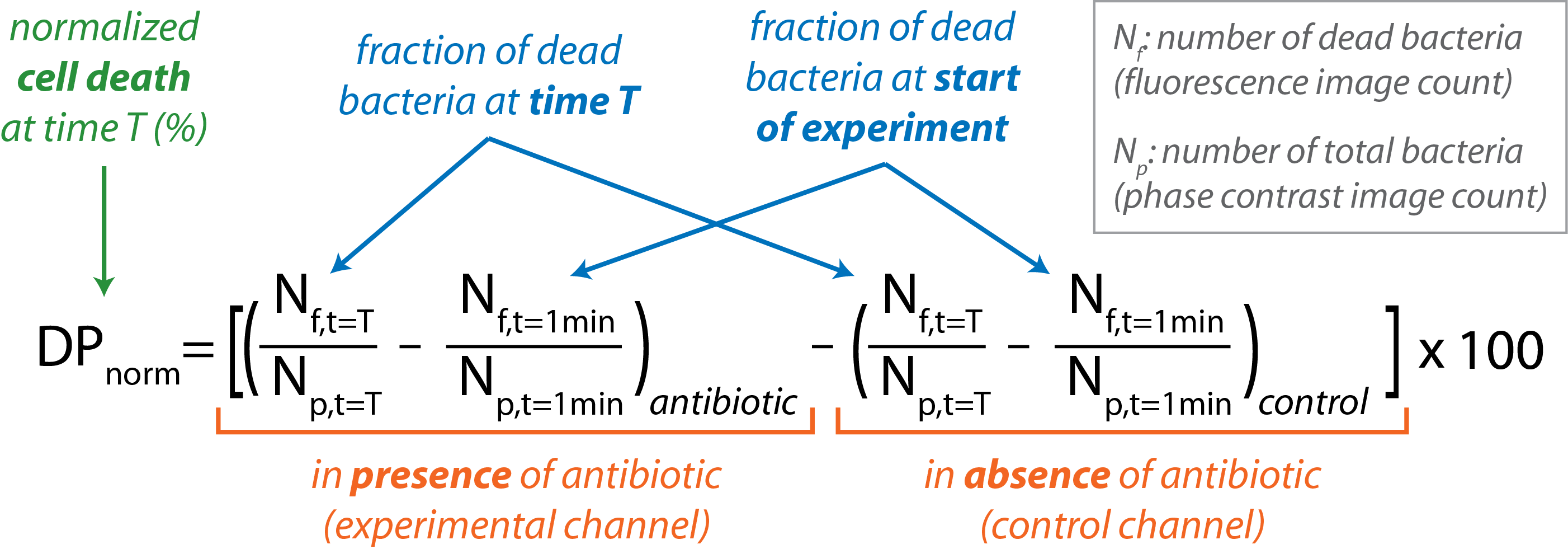
- الرسم البياني DPالقاعدة مقابل ر لمسار التجربة.
لاحظ أن عينة مع خلية نسبة وفاة أكبر من 1٪ تعتبر عرضة، في حين أن أقل من 0.5٪ وفاة يدل على المقاومة. وتعتبر النسب المئوية التي تقع بين هذين الانقطاعين غير محددة ويجب اختبار العينة مرة أخرى. - استخدم جدول بيانات لتلخيص وتحليل النتائج من تجارب مختلفة.
النتائج
تظهر البيانات المعروضة في الشكل 4 استجابة سلالة المكورات العنقودية المردية المعرضة للخطر بمرور الوقت في قناة ميكروفلويديك تحتوي على المضادات الحيوية. تظهر صور تباين المرحلة المكتسبة في دقيقة واحدة وفي نهاية تجربة الساعة 1 في الشكلين 4A و B. تظهر بيانا?...
Discussion
تم التحقق من صحة البروتوكول المقدم وتحسينه في مجموعة من التجارب مع سلالات المكورات العنقودية المقاومة للميثيسيلين والميثيسيلين10. لذلك ، يجب أن ينطبق هذا البروتوكول دون تعديل بشكل مباشر على سلالات أخرى من S. aureus والمضادات الحيوية الأخرى مع آليات العمل التي تؤثر على التمثيل...
Disclosures
الأسلوب microfluidic هو براءة اختراع معلقة: ساور بودج A, شارون A, كلاشنيكوف M, فيرز H, المخترعين; طريقة وجهاز للكشف السريع عن مقاومة المضادات الحيوية البكتيرية / براءة اختراع القابلية PCT/US10/33523.
Acknowledgements
نشكر المهندسين والطلاب في مركز فراونهوفر للابتكار الصناعي. للمساعدة في تصميم، والآلات، والتشغيل الآلي للنظام التجريبي، ونحن نشكر أندرياس برينزن، هولغر فيرز، دوغ فوس، ديفيد شارجين، والدكتور سودونغ شو. نشكر جوليا كوكارتز وميلاني زيمرمان ونيكو كريتزمار وتيم غومبل وجوش فيلانويفا ومونوري شيميزو وكاتارزينا كوليغا للمساعدة في اختبار البروتوكولات التجريبية وجمع البيانات. نعترف بالدكتورتين آن كاربنتر ومارك أنتوني براي من منصة التصوير في المعهد العريض بجامعة هارفارد ومعهد ماساتشوستس للتكنولوجيا للمساعدة في تطوير روتين تحليل الصور في CellProfiler. تم دعم المشروع الموصوف جزئيا من خلال جوائز R21AI079474 و 1R01AI101446 من المعهد الوطني للحساسية والأمراض المعدية. المحتوى هو مسؤولية المؤلفين فقط ولا يمثل بالضرورة الآراء الرسمية للمعهد الوطني للحساسية والأمراض المعدية أو المعاهد الوطنية للصحة. كما تم دعم المشروع من قبل فراونهوفر الولايات المتحدة الأمريكية.
Materials
| Name | Company | Catalog Number | Comments |
| SYTOX Green | Invitrogen Corporation | S7020 | Dead cell fluorescence stain |
| Bovine Serum Albumin (BSA) | Sigma Aldrich, Inc | A9418-5G | Used for lysostaphin storage |
| Sodium Acetate | Sigma Aldrich, Inc | S8750-500G | Used for lysostaphin storage |
| Lysostaphin | Cell Sciences | CRL309A | Arrives as 1 mg solid. For storage: Dissolve in 20 mM sodium acetate. Mix with BSA solution to final concentration of 1% BSA and 100 µg/ml lysostaphin for storage |
| Oxacillin salt | Sigma Aldrich, Inc | 28221-1G | Antibiotic |
| Mueller Hinton Broth | Fisher Scientific | DF0757-17-6 | |
| Sodium chloride | Sigma Aldrixh | S3014-500G | 2% added to Mueller-Hilton broth prior to autoclaving |
| 1 ml, Luer-lock syringe | BD (Beckton, Dickinson and Comp.) | 14-823-2F | |
| 2 oz, Luer-lock syringe | BD (Beckton, Dickinson and Comp.) | 309653 - 60 mL | Overfill to ~65 ml |
| Microscope | |||
| Inverted Fluoresccence Microscope Olympus IX-70 | Cambridge Scientific | 9349 | |
| 60X, Fluorescence/Phase contrast objective | Olympus Corp. | LCPlan F1 60x/0.70 Ph2 | |
| Retiga 12-bit monochrome CCD camera | QImaging | RET-4000R-F-M-12-C | |
| Microscope automation | |||
| Shutters phase contrast/fluorescence | PRIOR Scientific | H204/H202 | |
| X/Y Stage | PRIOR Scientific | H107AENN | |
| Focus motor | PRIOR Scientific | H122 | |
| Joystick for XYZ control | PRIOR Scientific | CS152EF | |
| Proscan Controller | PRIOR Scientific | H3-XY2 | |
| Image Acquisition Software | Fraunhofer CMI | ||
| Flow Cell Assembly and PDMS | |||
| Flow Cell | BU Scientific Instruments Facility/Fraunhofer CMI | 3333-1044 | Engineering drawings were produced by Fraunhofer CMI |
| Glass window | Fraunhofer CMI | 3333-1054 | Glass window was cut to the proper size at Fraunhofer CMI |
| BOROFLOAT Window 50 mm x 50 mm | Edmund Optics Inc. | NT48-543 | |
| Sealing plate | BU Scientific Instruments Facility | 3333-1045 | |
| Epoxide glass slide | Arrayit Corporation | SuperEpoxy 2 | |
| PDMS master | Fraunhofer CMI | 3333-1053 | Master machined in aluminum or brass with UPM-0005 (ultrapresicion fly-cutting machine) |
| PDMS slide design | Fraunhofer CMI | 3333-1053 | |
| Tubing | |||
| Nut, Super flangeless Tinytight, headless, 1/16 in, PEEK, green | IDEX Health Science | M-644-03 | Flow cell inputs/outputs are tapped for this ferrule |
| Ferrule, Tinytight, 1/16 in, 6-40, .030 in TH, PEEK w/ SS lock ring, black | IDEX Health Science | M-657 | |
| Nut, Super flangeless Tinytight, headless, 1/16-1/32 in, 1/4-28, PEEK, natural | IDEX Health Science | P-255 | |
| Ferrule, Super Falngeless, 1/16 in, Tefzel (ETFE), yellow | IDEX Health Science | P-259 | Fits Luer-lock adapter |
| Tubing, Teflon FEP, .030 in x 1/16 in x 20 ft, green | IDEX Health Science | 1520G | |
| Adapter, quick connect female Luer to female 1/4-28, PEEK, red | IDEX Health Science | P-658 |
References
- Mairhofer, J., Roppert, K., Ertl, P. Microfluidic systems for pathogen sensing: a review. Sensors. 9, 4804-4823 (2009).
- Yager, P., et al. Microfluidic diagnostic technologies for global public health. Nature. 442, 412-418 (2006).
- Boedicker, J. Q., Li, L., Kline, T. R., Ismagilov, R. F. Detecting bacteria and determining their susceptibility to antibiotics by stochastic confinement in nanoliter droplets using plug-based microfluidics. Lab Chip. 8, 1265-1272 (2008).
- Cao, J., et al. Uncovering toxicological complexity by multi-dimensional screenings in microsegmented flow: modulation of antibiotic interference by nanoparticles. Lab Chip. 12, 474-484 (2012).
- Chen, C. H., et al. Antimicrobial susceptibility testing using high surface-to-volume ratio microchannels. Anal. Chem. 82, 1012-1019 (2010).
- Churski, K., et al. Rapid screening of antibiotic toxicity in an automated microdroplet system. Lab Chip. 12, 1629-1637 (2012).
- Eun, Y. J., Utada, A. S., Copeland, M. F., Takeuchi, S., Weibel, D. B. Encapsulating bacteria in agarose microparticles using microfluidics for high-throughput cell analysis and isolation. ACS Chem. Biol. 6, 260-266 (2011).
- Kim, K. P., et al. In situ monitoring of antibiotic susceptibility of bacterial biofilms in a microfluidic device. Lab Chip. 10, 3296-3299 (2010).
- Peitz, I., van Leeuwen, R. Single-cell bacteria growth monitoring by automated DEP-facilitated image analysis. Lab Chip. 10, 2944-2951 (2010).
- Kalashnikov, M., Lee, J. C., Campbell, J., Sharon, A., Sauer-Budge, A. F. A microfluidic platform for rapid, stress-induced antibiotic susceptibility testing of Staphylococcus aureus. Lab Chip. 12, 4523-4532 (2012).
- McDonald, J. C., Whitesides, G. M. Poly(dimethylsiloxane) as a material for fabricating microfluidic devices. Acc. Chem. Res. 35, 491-499 (2002).
- Roth, B. L., Poot, M., Yue, S. T., Millard, P. J. Bacterial viability and antibiotic susceptibility testing with SYTOX green nucleic acid stain. Appl. Environ. Microbiol. 63, 2421-2431 (1997).
- Francius, G., Domenech, O., Mingeot-Leclercq, M. P., Dufrene, Y. F. Direct observation of Staphylococcus aureus cell wall digestion by lysostaphin. J. Bacteriol. 190, 7904-7909 (2008).
- Jordan, S., Hutchings, M. I., Mascher, T. Cell envelope stress response in Gram-positive bacteria. FEMS Microbiol. Rev. 32, 107-146 (2008).
- Koch, A. L. Bacterial wall as target for attack: past, present, and future research. Clin. Microbiol. Rev. 16, 673-687 (2003).
- Carpenter, A. E., et al. CellProfiler: image analysis software for identifying and quantifying cell phenotypes. Genome Biol. 7, R100 (2006).
- Kohanski, M. A., Dwyer, D. J., Collins, J. J. How antibiotics kill bacteria: from targets to networks. Nat. Rev. Microbiol. 8, 423-435 (2010).
- Kohanski, M. A., Dwyer, D. J., Hayete, B., Lawrence, C. A., Collins, J. J. A common mechanism of cellular death induced by bactericidal antibiotics. Cell. 130, 797-810 (2007).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved