Method Article
حقن العقدة داخل الليمفاوية من جزيئات البوليمر القابلة للتحلل الحيوي
In This Article
Summary
الغدد الليمفاوية هي الأنسجة المناعية التي تنسق الاستجابة المناعية وهي هدف حاسم لللقاحات. وقد استخدمت المواد الحيوية لاستهداف الغدد الليمفاوية بشكل أفضل والتحكم في تسليم المستضدات أو المساعدين. تصف هذه الورقة تقنية تجمع بين هذه الأفكار لحقن جزيئات البوليمر المتوافقة بيولوجيا في الغدد الليمفاوية.
Abstract
يعتمد توليد الاستجابة المناعية التكيفية على الصرف الفعال أو الاتجار بالمضاد إلى الغدد الليمفاوية لمعالجة وعرض هذه الجزيئات الغريبة على الخلايا الليمفاوية T و B. وهكذا أصبحت الغدد الليمفاوية أهدافا حاسمة لللقاحات الجديدة و العلاجات المناعية. وتتمثل إحدى الاستراتيجيات الحديثة لاستهداف هذه الأنسجة في حقن العقدة الليمفاوية مباشرة بمكونات اللقاح القابل للذوبان، وكانت التجارب السريرية التي تنطوي على هذه التقنية واعدة. كما تم بحث العديد من استراتيجيات المواد الحيوية لتحسين استهداف العقد الليمفاوية، على سبيل المثال، ضبط حجم الجسيمات للصرف الأمثل لجسيمات لقاح المواد الحيوية. في هذه الورقة نقدم طريقة جديدة تجمع بين حقن العقدة الليمفاوية المباشرة مع جزيئات البوليمر القابلة للتحلل الحيوي التي يمكن أن تكون محملة بمضاد أو المساعد أو مكونات اللقاح الأخرى. في هذه الطريقة يتم تصنيع الجسيمات الدقيقة البوليمرية أو الجسيمات النانوية من خلال بروتوكول مستحلب مزدوج معدل يتضمن مثبتات الدهون. يتم تأكيد خصائص الجسيمات(مثل الحجم وتحميل البضائع) عن طريق الحيود بالليزر والمجهر الفلوري على التوالي. ثم يتم تحديد الغدد الليمفاوية الماوس عن طريق الحقن الطرفي للصبغة التتبع غير السامة التي تسمح التصور من موقع الحقن الهدف وترسب لاحقة من جزيئات البوليمر في الغدد الليمفاوية. وتسمح هذه التقنية بالتحكم المباشر في جرعات وتركيبات المواد الحيوية ومكونات اللقاح التي يتم توصيلها إلى الغدد الليمفاوية ويمكن تسخيرها في تطوير لقاحات جديدة قائمة على المواد الحيوية.
Introduction
الغدد الليمفاوية (LNs) هي مراكز القيادة في الجهاز المناعي. في هذا الموقع المناعي، مستضد تقديم الخلايا رئيس الخلايا الليمفاوية السذاجة ضد مستضدات أجنبية محددة لتنشيط الاستجابات المناعية الخلوية والفكاهية. وهكذا أصبحت ال LNs هدفا جذابا لإيصال اللقاحات و العلاجات المناعية. لسوء الحظ ، فإن معظم استراتيجيات اللقاح تؤدي إلى تسليم مستضد ومطهرات غير فعالة وعابرة إلى الأنسجة اللمفاوية1. ولذلك يمكن أن يكون للنهج التي تحسن استهداف مكونات اللقاحات والاحتفاظ بها في اللقاحات المضادة للنواة تأثير كبير على فعالية وكفاءة اللقاحات الجديدة.
استراتيجية واحدة للتحايل على التحدي المتمثل في استهداف LN التي أظهرت اهتماما كبيرا في التجارب السريرية الجديدة مباشرة، داخل LN(i.LN.) حقن2-4. استخدمت هذه التجارب إرشادات بالموجات فوق الصوتية لتوصيل اللقاحات إلى LNs كإجراء بسيط للمرضى الخارجيين. بالمقارنة مع طرق الحقن الطرفية التقليدية، أدى هذا النهج إلى تجنيب جرعة كبيرة وتحسين فعالية في السياقات العلاجية بما في ذلك الحساسية والسرطان2-4. استخدمت هذه الدراسات حقن I.LN. من اللقاحات القابلة للذوبان(أي خالية من المواد الحيوية) التي تم تطهيرها بسرعة عن طريق التصريف اللمفاوي. لذلك، حقن متعددة- أو دورات من حقن متعددة- تدار لتحقيق هذه الآثار العلاجية المثيرة للإعجاب. تحسين الاحتفاظ في LN يمكن أن تعزز التفاعل بين مستضد و / أو الخلايا المساعد والمناعية، وزيادة تحسين فعالية فتيلة الخلايا المناعية. ويدعم هذه الإمكانات من الدراسات الحديثة التي تظهر الحركية من مستضد والتسليم المساعد تلعب دورا حاسما في تحديد الاستجابة المناعية المحددة ولدت5-7. وعلاوة على ذلك، فإن توطين الجرعات الدوائية وجرعات اللقاح وتقليلها إلى أدنى حد يمكن أن يقلل أو يزيل الآثار الجهازية، مثل الالتهاب المزمن.
وقد درست المواد الحيوية على نطاق واسع لتعزيز فعالية وكفاءة اللقاحات1،8،9. ويمكن للتغليف أو الامتزاز على ناقلات المواد الحيوية أن يحمي البضائع ماديا من التدهور وأن يتغلب على قيود الذوبان. ومن السمات البارزة الأخرى لحاملات المواد الحيوية، مثل الجسيمات الدقيقة أو النانوية البوليمرية، القدرة على تحميل عدة فئات من البضائع، ثم إطلاق هذه الشحنات على فترات خاضعة للرقابة. ومع ذلك، فإن أحد القيود الكبيرة التي لا تزال تعوق لقاحات المواد الحيوية والمواد المناعية في الجسم الحي هو الاستهداف غير الفعال للخلايا المناعية والاتجار المحدود بالغدد الليمفاوية. على سبيل المثال، الحقن المحيطي للقاحات المواد الحيوية من خلال الطرق التقليدية(مثل داخل الجلد، العضلي) عادة ما تظهر استهداف LN الفقراء، مع ما يصل إلى 99٪ من المواد المحقونة المتبقية في موقع الحقن4،10. وفي الآونة الأخيرة، تم ضبط حجم حاملات اللقاحات ذات المواد الحيوية لتحسين الاتجار التفضيلي بهذه اللقاحات أو تصريفها إلى ال LNs من خلال التدفق الخلالي8,10. وقد أدت هذه التطورات إلى تعزيز الاستجابات المناعية الخلوية والفكاهية، مما يؤكد على أهمية استهداف وهندسة بيئة ال LN للقاحات الجديدة.
تقدم هذه الورقة بروتوكول التطعيم الذي يجمع بين جزيئات البوليمر المثبتة بالدهون وتسليم I.LN. لتوليد مستودعات لقاح الإطلاق الخاضعة للرقابة5,11. بناء على الدراسات الحديثة التي تستخدم التقنيات الجراحية ل I.LN. في الفئران6,7,12,13, وضعنا استراتيجية سريعة وغير جراحية لحقن لقاحات المواد الحيوية فيالحيواناتالصغيرة 5 . الجمع بين تسليم i.LN. مع ناقلات لقاح المواد الحيوية عززت بقوة CD8 استجابة الخلايا التائية في غضون 7 أيام بعد حقنة واحدة من مستودعات لقاح الإطلاق الخاضعة للرقابة5. كما تم توليد استجابة فكاهة قوية(أي تيترز الأجسام المضادة) ؛ وارتبطت كلا التعزيزتين بزيادة الاحتفاظ بمكونات اللقاح في العقد اللمفاوية التي تم التوسط فيها عن طريق الإطلاق المراقب من ناقلات المواد الحيوية. ومن المثير للاهتمام أن حجم جزيئات اللقاح غير مصير هذه المواد مرة واحدة في LNs: أظهرت الجسيمات النانوية امتصاصا مباشرا متزايدا من قبل الخلايا ، في حين بقيت الجسيمات الدقيقة الأكبر في بيئة LN خارج الخلية وأطلقوا الشحنات(على سبيل المثال المساعد) التي تناولها مستضد مقيم في LN يقدم الخلايا5. وتشير هذه البيانات إلى مسارين يمكن استغلالهما للحصول على لقاحات جديدة عن طريق التحكم في حجم المواد الحيوية التي يتم حقنها بال i.LN.
في هذه المقالة يتم تصنيع جزيئات البوليمر القابلة للتحلل الحيوي المستقرة بالدهون (الصغرى والنوانوية) باستخدام استراتيجية مستحلب مزدوجمعدلة 5،11. خصائص الجسيمات تتميز الحيود الليزر والمجهر. ثم يتم حقن هذه الجسيمات مباشرة في LNs الإربية التي تم تحديدها غير جراحيا باستخدام صبغة التتبع الشائعة غير التكسينية14. يمكن استخدام تحليل ما بعد الحقن للشبكات غير الرقمية حسب الأنسجة أو قياس التدفق الخلوي للتحقق من توزيع الجسيمات داخل بيئة LN ، وكذلك لمراقبة امتصاص الخلايا والاحتفاظ بالجسيمات بمرور الوقت. للبروتوكولات التي تفصل المعالجة النسيجية وقياس التدفق الخلوي ، تتم إحالة القراء إلى مقالات JoVE الأخيرة وتقارير المجلات15-22. وتبين النتائج النموذجية استهداف ال LN المحلي لهذه المستودعات التي يمكن استغلالها لتحقيق استجابات مناعية فعالة وفعالة أو لتكييف المناعة لمسببات الأمراض المستهدفة.
Protocol
تم الانتهاء من جميع الدراسات الحيوانية في هذا البروتوكول وفقا للمبادئ التوجيهية الاتحادية، والدولة، والمحلية، وذلك باستخدام بروتوكولات استعرضتها ووافقت عليها لجنة الرعاية والاستخدام المؤسسية للحيوانات في جامعة ميريلاند (IACUC).
1. تركيب الجسيمات الدقيقة والنانوية المثبتة بالدهون
- في قارورة زجاجية 7 مل (ق)، والجمع بين DOPC، DSPE-PEG، والدهون DOTAP في نسبة الضرس 60:20:20 لإعداد مزيج الدهون الرئيسية.
- لتجميع عينة واحدة: نقل 242.9 ميكرولتر، 287.4 ميكرولتر، و 71.9 ميكرولتر، من DOPC، DSPE-PEG، وDOTAP على التوالي، في القارورة باستخدام 2 مل من الماصة المصلية الزجاجية.
- لتجميع عينات متعددة: مضاعفة كل حجم الدهون أعلاه من قبل عدد من العينات والجمع في قارورة واحدة، ثم نقل aliquots متساوية من هذا الخليط الدهون في قوارير المقابلة لكل عينة ليتم إعدادها.
- الدهون الجافة تحت تيار لطيف من غاز النيتروجين لمدة 10 دقائق، أو وضعها في فرن فراغ بين عشية وضحاها.
- في قارورة زجاجية واحدة فارغة سعة 20 مل، قم بإذابة 80 ملغ من PLGA في 5 مل من ثنائي كل كلوروميثان لكل عينة جسيم لتوليد محلول مخزون بوليمر 16 ملغ/مل.
- أضف 5 مل من محلول البوليمر إلى القارورة (القارورات) التي تحتوي على الدهون المجففة والغطاء والدوامات لمدة 30 ثانية.
- لتجميع الجسيمات الدقيقة:
- ابدأ في سونيكينج المرحلة العضوية التي تحتوي على البوليمر والدهون وغيرها من البضائع غير القابلة للذوبان في الماء على الجليد في 12 W باستخدام sonicator.
- إنشاء مستحلب الماء في النفط (ث / س) باستخدام ماصة لإضافة 500 ميكروغرام من المقطر H2O، أو H2O تحتوي على 1 ملغ من الببتيد والبروتين، أو غيرها من البضائع القابلة للذوبان في الماء.
- مواصلة سونيكاتينج لمدة 30 ثانية في 12 W على الجليد، هزاز بلطف القارورة صعودا وهبوطا وجانب إلى جنب حول طرف سونيكاتور لضمان استحلاب كامل.
- إنشاء مستحلب الماء في النفط في الماء (ث / س / ث) عن طريق صب مستحلب ث / س في 40 مل من H2O في كوب 150 مل.
- تجانس لمدة 3 دقائق في 16،000 دورة في الدقيقة باستخدام المتجانس الرقمي.
- إضافة شريط اثارة المغناطيسي، ونقل الكأس إلى لوحة اثارة، والسماح للمستحلب ث / س / ث لتحريك بين عشية وضحاها لإزالة المذيبات الزائدة.
- لتجميع الجسيمات النانوية:
- بدء sonicating المرحلة العضوية التي تحتوي على البوليمر والدهون، وغيرها من البضائع غير القابلة للذوبان في الماء على الجليد في 14 W.
- إنشاء مستحلب ث / س باستخدام ماصة لإضافة 500 ميكروغرام من المقطر H2O، أو H2O تحتوي على 1 ملغ من الببتيد والبروتين، أو غيرها من البضائع القابلة للذوبان في الماء.
- مواصلة سونيكاتيينج لمدة 30 ثانية في 14 واط على الجليد.
- إنشاء مستحلب ث / س / ث عن طريق صب مستحلب ث / س إلى 40 مل من H2O في كوب 150 مل و sonicating لمدة 5 دقائق في 16 واط على الجليد. صخرة بلطف القارورة صعودا وهبوطا وجانبا إلى جنب حول طرف sonicator لضمان استحلاب كامل.
- إضافة شريط اثارة المغناطيسي، ونقل القارورة إلى لوحة اثارة والسماح للمستحلب ث / س / ث لتحريك بين عشية وضحاها لإزالة المذيبات الزائدة.
- في صباح اليوم التالي، غسل وجمع الجسيمات:
- صب مستحلب من خلال 40 ميكرومتر نايلون شبكة مصفاة الخلية في أنبوب مخروطي 50 مل.
- جزيئات الطرد المركزي لمدة 5 دقائق في 5000 × ز للجسيمات الدقيقة أو 5 دقائق في 24000 × غرام للجسيمات النانوية.
- decant الجسيمات العملاقة وغسل عن طريق إعادة تعليق في 1 مل من H2O.
- نقل الجسيمات المعلقة إلى أنبوب 1.5 مل من أجهزة الطرد المركزي الدقيق.
- جهاز طرد مركزي لمدة 5 دقائق عند 5000 × غرام للجسيمات الدقيقة أو 5 دقائق عند 24500 × غرام للجسيمات النانوية.
- غسل الجسيمات مرتين أكثر عن طريق إزالة supernatant، وإعادة تعليق في 1 مل H2O، والطرد المركزي كما هو الحال في الخطوة 1.6.5. بعد الغسيل، تعليق الجسيمات في 1 مل H2O للاستخدام الفوري، أو lyophilize للتخزين الموسع.
2. قياس العائد التوليفي
- Preweigh فارغة 20 مل قارورة زجاجية. إضافة 100 ميكرولتر من تعليق الجسيمات إلى القارورة preweighed بعد pipetting صعودا وهبوطا مع micropipette لخلط.
- Lyophilize الجسيمات أو الجافة تحت تيار لطيف من النيتروجين.
- وزن القارورة التي تحتوي على البوليمر المجفف. تحديد إنتاجية الجسيمات في القارورة عن طريق طرح الوزن الأصلي للقارورة من كتلة القارورة التي تحتوي على الجسيمات المجففة.
- تحديد العائد الكلي للجسيمات عن طريق ضرب كتلة الجسيمات في القارورة بعامل التخفيف. لتحديد نسبة العائد، قم بتقسيم كتلة الجسيمات على الحد الأقصى لكتلة الإدخال النظري واضرب بنسبة 100٪.
3. تحديد حجم الجسيمات
- تنظيف خلية كسر الزجاج على غرار cuvette الموردة عن طريق ملء مع الماء deionized ومسح مع مسحة القطن يميل. نقل 10 مل من المقطر H2O إلى الخلية فصيل تنظيفها، إضافة المغناطيسية الصغيرة اثارة شريط، وتحميل الخلية كسر في جبل الخلية من محلل حجم الجسيمات.
- ضبط سرعة التحريك المغناطيسي في محلل الجسيمات لتحقيق خلط كامل في خلية الكسر وإغلاق باب المقصورة.
- محاذاة الليزر إلى خلية الكسر باستخدام واجهة برنامج الصك.
- استخدم واجهة برنامج الأداة لتسجيل قراءة خط الأساس مع الخلية الكسرية التي تحتوي على H2O المقطر فقط.
- ماصة تعليق الجسيمات الأصلي صعودا وهبوطا مع micropipette لخلط.
- ماصة 10 ميكرولتر من تعليق الجسيمات (عادة ما يقرب من 0.5 ملغ) في خلية الكسر. تأكد من أن حجم عينة الجسيمات المضافة إلى الخلية كافية لتوليد قوة الإشارة في النطاق المناسب كما هو مبين في واجهة برنامج الجهاز. تعتمد الكتلة الفعلية للجسيمات المطلوبة على نسبة العائد والخصائص البصرية لعينة الجسيمات.
- أغلق باب حجرة محلل حجم الجسيمات وقاس حجم الجسيمات باستخدام مؤشر انكساري قدره 1.60 ل PLGA.
- استخدام واجهة البرنامج لحساب قطر الجسيمات باستخدام أساس عدد.
4. تصور الجسيمات
- تعليق الجسيمات ماصة صعودا وهبوطا مع micropipette لخلط. تخفيف تعليق الجسيمات إلى 1 ملغ / مل في الماء deionized.
- إعداد شريحة المجهر بإضافة 3 ميكرولتر من تعليق الجسيمات المخففة وتركيب غطاء بزاوية 45 درجة لتجنب تكوين الفقاعة. ضع الشريحة على مرحلة المجهر والصورة باستخدام مجموعات التصفية المناسبة لكل شحنة فلورية.
5. إعداد الفئران ل I.LN. حقن
- إعداد محلول صبغ التتبع:
- إعداد محلول 0.1٪ (ث / v) من صبغة التتبع عن طريق حل 10 ملغ من مسحوق الصبغة مع 10 مل من H2O المقطر.
- تعقيم محلول الصبغة في قارورة زجاجية باستخدام فلتر حقنة 0.2 ميكرومتر.
- قبل يوم واحد من الحقن، تخدير الماوس باستخدام isoflurane وفقا لبروتوكول IACUC الحيوانية المعتمدة. لتقييم عمق التخدير، قم بإجراء اختبار انعكاس قرصة إصبع القدم ومراقبة معدل التنفس لضمان معدل تنفس يبلغ حوالي 100-140 نفسا في الدقيقة.
- حلق الشعر في قاعدة الذيل و hindquarter باستخدام المقصات في حين يتم تخدير الماوس. إزالة الشعر من الجانب البطني للحيوان وجانبيا حولها إلى الجانب الظهري فقط فوق مفصل الساق الخلفية (الورك).
- حقن صبغة التتبع.
- لكل حقنة صبغة، استخدم ميكروبايت لنقل 10 ميكرولتر من محلول الصبغة إلى أنبوب طرد دقيق، وتوبيخ كامل 10 ميكرولتر إلى إبرة 31G متصلة بحقنة 1 مل.
- حقن 10 ميكرولتر من محلول صبغ تحت الجلد على كل جانب من قاعدة الذيل حيث قص الشعر، وإعادة تحميل بين الحقن.
- إزالة الشعر المتبقي عن طريق تطبيق كريم مزيل الشعر خفيفة عن طريق مسحات القطن. تأكد من تغطية المنطقة بين الفخذ الخلفي والبطن.
- السماح كريم إزالة الشعر لاحتضان على الجلد لمدة 3 دقائق. بعد الحضانة، يد قفاز مبللة مع H2O الدافئ وفرك بلطف كريم إزالة الشعر في الجلد.
- إزالة كريم مزيل الشعر على الفور عن طريق التبول يد قفاز مع H2O الدافئة وفرك قاعدة الذيل و hindquarter. كرر حتى تتم إزالة إزالة الشعر الزائد، مع التأكد من الحفاظ على اليد الرطب لتجنب تهيج.
- إزالة إزالة الشعر المتبقية من الماوس عن طريق التبول قطعة قماش ناعمة أو منشفة ورقية مع H2O الدافئة وفي حركة واحدة، ومسح الجزء السفلي من الماوس. تجنب حركة فرك لمنع الكشط أو تلف الجلد إلى الماوس.
- السماح الماوس لاسترداد تحت مصباح الحرارة والعودة إلى عقد.
6. I.LN. حقن الجسيمات
- في اليوم التالي، تخدير الماوس باستخدام isoflurane وفقا لبروتوكول IACUC الحيوانية المعتمدة.
- فحص الماوس للتأكد من تصريف صبغة التتبع في كل عقدة الليمفاوية الأربية. يجب أن تكون العقدة الليمفاوية مرئية ك بقعة مظلمة بالقرب من الفخذ الخلفي والبطن.
- إعداد محلول حقن الجسيمات:
- إعادة ضغط الجسيمات في المقطر H2O في تركيز الحقن المطلوب. لكل حقنة، استخدم ميكروبايت لنقل 10 ميكرولتر من محلول الجسيمات إلى أنبوب طرد دقيق.
- يستنشق كامل 10 ميكرولتر في إبرة الأنسولين 31G تعلق على حقنة 1 مل.
- حقن جرعة الجسيمات:
- بعد تصور LN، تشديد الجلد حول LN باستخدام الإبهام والسبابة، والإصبع الأوسط لسحب السخرية الجلد والسماح لوضع تسيطر عليها من حجم الحقن.
- اقترب من LN مع الإبرة بزاوية 90 درجة إلى الجلد واختراق الجلد عبر LN المصبوغ إلى عمق 1 مم.
- قم بحقن وحدة التخزين بالكامل ببطء. أثناء الحقن، لاحظ حجم LN من خلال الجلد لتأكيد الحقن عن طريق توسيع LN مرئية.
- السماح للفأر بالاسترداد تحت مصباح حراري والعودة إلى عقد أو إجراء اختبارات إضافية.
لتقنيات التحليل ذات الصلة(مثل علم الأنسجة، قياس التدفق الخلوي) انظر JoVE المقالات 265، 1743، و 3054 والبروتوكولات الحالية في علم المناعة،الفصلين 5 و 2115-22.
النتائج
يمكن تقسيم النتائج المتوقعة للبروتوكولات المعروضة في هذه المخطوطة إلى ثلاث فئات: تخليق الجسيمات، وإعداد الحيوانات، وحقن الجسيمات.
يصور الشكل 1 تركيب وتوصيف جزيئات البوليمر القابلة للتحلل الحيوي، المثبتة بالدهون الأمفيتامينية. نتائج مستحلب / المذيبات بروتوكول تخليق التبخر (الشكل 1A) يمكن تقييمها نوعيا عن طريق الفحص البصري للمحلبات النهائية المتولدة. يجب أن تكون دفعات الجسيمات مستحلبات متجانسة ومستقرة ذات مظهر معتم. وتشمل المضاعفات المستحلبات التي كريم أو flocculate، وغالبا ما يرجع ذلك إلى التخزين غير السليم للمثبتات الدهون. لتجنب عدم الاستقرار هذا، يجب تخزين الدهون عند -80 درجة مئوية في حالة جفاف أو في قارورة مغلقة مطهرة بالنيتروجين. يمكن إجراء تقييم كمي لتركيب الجسيمات باستخدام حيود الليزر أو تشتت الضوء الديناميكي لتحليل توزيع الحجم(الشكل 1B). وتشمل النتائج المتوقعة أحجام الجسيمات أحادية الوسائط الموزعة بإحكام، مما يشير إلى وجود مجموعة موحدة من الجسيمات. تولد معلمات التجميع الموصوفة في هذه المخطوطة متوسط توزيعات متوسطة تركزت على حوالي 100 نانومتر أو 3 ميكرومتر للجسيمات النانوية والجسيمات الدقيقة على التوالي. ويمكن تحقيق مزيد من التقييم النوعي لتركيب الجسيمات من خلال تعديل البروتوكول المذكور أعلاه ليشمل فئات متعددة من البضائع الفلورية. في الشكل 1C، صور المجهر من الجسيمات الدقيقة محملة الببتيد الفلوري (FITC ، الأخضر) ، وصبغة ليبوفيليك (دي دي ، الأحمر) ، وصورة تراكب (الأصفر) تأكيد خلق جزيئات ضمن نطاق الحجم المطلوب وتغليف الببتيد داخل حجم الجسيمات.
يلخص الفريقان الأولان من الشكل 2 النتائج المتوقعة لإعداد الحيوانات لاستراتيجية حقن I.LN. الموصوفة في هذه الورقة. تتضمن المنهجية وضع علامات على LNs الإربية عن طريق الحقن المحيطي لمتتبع غير السموم لتحديد موقع حقن الجسيمات اللاحقة I.LN. (الشكل 2A)5. كما لوحظ، فإن تصريف صبغة التتبع بعد الحقن تحت الجلد في قاعدة الذيل سيمكن من تصور LNs الإربية(الشكل 2B)5. يمكن أن يشكل تناول الكريمات مزيلة الشعر المعتمدة مخاطر على الفئران. وهكذا، ينبغي الحرص على إزالة بدقة جميع كريم تطبيقها، مع إيلاء اهتمام خاص إلى الكفوف، والجانب البطني من الفئران. يجب إزالة مزيل الشعر باستخدام قطعة قماش مبللة أو ناعمة أو منشفة ورقية مبللة في حركة واحدة ناعمة. تجنب فرك لإزالة كريم، لأن هذا يمكن أن يؤدي إلى سحجات على الجلد المكشوفة من الفئران.
يمكن تقييم تأكيد التسليم المحلي إلى LN الأربي من خلال الملاحظة أو علم الأنسجة. يمكن مراقبة حجم LN بصريا أثناء الحقن كمؤشر على الحقن الناجح. وتشمل النتائج المتوقعة التوزيع الفعال للشحنات في جميع أنحاء هيكل ال LN، دون تسرب كبير إلى الأنسجة أو الخلايا المجاورة. علاوة على ذلك ، كما السائل المحقون يزيح / يخفف التتبع في LN ، يجب أن يصبح تركيز الصبغة / التلوين أقل كثافة بعد الحقن. يجب أن تكشف مراقبة الأنسجة عن LN سليم ، ولكن موسع بسبب حقن السوائل. وتشمل التحديات المحتملة حقن بسرعة كبيرة جدا أو فقدان LN، وكلاهما يمكن أن يسبب elution من حجم في الأنسجة تحت الجلد المحيطة بها. ويمكن تأكيد هذه النتائج غير المرغوب فيها عن طريق التشريح أو الأنسجة، حيث سيتم ملاحظة تعليق الجسيمات ينتشر إلى الخلايا والأنسجة البعيدة عن العقد المستهدفة للحقن. وعلى النقيض من ذلك، ستكون النتيجة المتوقعة هي تحديد LN أربي موسع بسبب احتواء الجسيمات داخل بنية LN. المعالجة النسيجية لل LNs المقتطعة يمكن أن تؤكد بشكل قاطع تسليم البضائع إلى الأنسجة اللمفاوية ، كما هو موضح في الشكلين 2C و 2D. لاحظ أن الجسيمات في الشكل 2 تتضمن شحنة فلورية للسماح بتصور الشحن أثناء الحقن ، وكذلك أثناء المعالجة النسيجية والمجهر الفلوري.
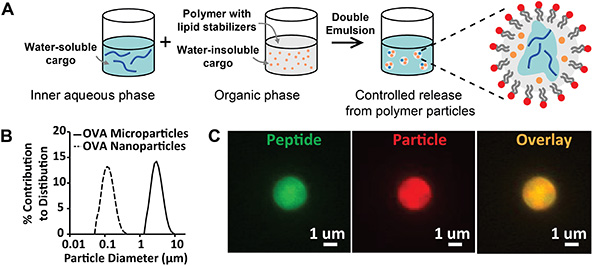
الشكل 1 - الأرقام 1- الأرقام 1 توليف وتوصيف الجسيمات المثبتة الدهون. أ)مخطط تخطيطي يصف تركيب الجسيمات المثبتة بالدهون التي أعدها مستحلب / تبخر المذيبات. ب)توزيعات الحجم من الجسيمات الدقيقة (خط صلب، قطر = 2.8 ميكرومتر) والجسيمات النانوية (خط متقطع، قطر = 113 نانومتر). ج)صور المجهر الفلورية من الجسيمات المحملة الببتيد المسمى الفلورسنت وصبغة الجسيمات الفلورية. التسميات: الببتيد (الأخضر) والجسيمات (الأحمر). انقر هنا لعرض صورة أكبر.

الشكل 2 - الأرقام 2- الأرقام التي تم i.LN. حقن وتوزيع الجسيمات القابلة للتحلل الحيوي داخل LN. أ)منهجية لحقن i.LN. ب)تصور LNs في الماوس من خلال الجلد (الصورة العليا) وبعد necropsy (الصورة السفلى)5. ج)تلطيخ النسيجية من LN تأكيد ترسب وتوزيع الجسيمات الدقيقة البوليمر المسمى الفلورسنت (الجسيمات، الأخضر؛ تي الخلايا، الأحمر؛ الخلايا البائية، الزرقاء). د)الجسيمات النانوية ذات العلامات الفلورية (50 نانومتر، الصورة اليسرى) والجسيمات الدقيقة (6 ميكرومتر، الصورة اليمنى) في LNs 24 ساعة بعد الحقن. انقر هنا لعرض صورة أكبر.
Discussion
وتسمح التقنية الموصوفة في هذا البروتوكول بتوصيل اللقاحات الخاضعة للرقابة إلى ال LNs وخلايا تقديم المستضد المقيم في LN. ويمكن توطين الشحنات المغلفة بالمواد الحيوية داخل ال LN، مما يتيح التلاعب بجرعات نوع أو أكثر من البضائع التي يتم تسليمها إلى البيئة الدقيقة ل LN. وقد ثبت أن التعريب والإطلاق المراقب من جزيئات البوليمر يولد استجابة مناعية خلوية وروح الدعابة قوية بجرعات أقل بكثير من النهج التقليدية. علاوة على ذلك ، من خلال التلاعب بحجم حامل المواد الحيوية ، يمكن تعديل الوضع الأساسي للمعالجة الخلوية بين الإقبال المباشر على الجسيمات النانوية أو إطلاق الشحن خارج الخلية من الجسيمات الدقيقة الأكبر5. وتحدد هذه النتائج جدوى إيصال المواد الحيوية من ال I.LN. كمنصة لإيصال اللقاحات العلاجية.
وقد تم تركيب جزيئات PLGA مستحلب / تبخر المذيبات تستخدم على نطاق واسع في تطبيقات تسليم المخدرات23،24. وبالتالي فإن التحديات المحتملة المرتبطة بهذه التقنية تتعلق في معظمها بنجاح تحديد اللقاحات وترسبها في الموقع المستهدف للN. على الرغم من أن استخدام صبغة التتبع يسهل تصور ال LNs الأربية المستهدفة ، فإن الحجم والعمق المستهدفين تحت الجلد صغيران. وهكذا ، يوصي المؤلفون بتخصيص الوقت والفئران لممارسة إعداد وحقن الفئران. أثناء إعداد الحيوان(أي الحلاقة وتطبيق إزالة الشعر) ، يجب الحرص على عدم قطع الفئران على الجانب البطني للحيوان حيث تجعل زاوية الساق مع البطن الجلد أكثر عرضة للإصابة من المقصات. بالإضافة إلى ذلك، يجب إزالة جميع مزيل الشعر بالماء الدافئ لمنع الحيوانات من تناول الكريم أثناء سلوك الاستمالة العادي. لممارسة حقن LN، يمكن إعطاء تركيز صبغة تتبع أعلى وممارسة الحيوانات يمكن القتل الرحيم، ومن ثم حقنها عدة مرات. يمكن أن تكون نخر الفئران حقن التالية ويمكن مقارنة حجم LNs من الحيوانات المحقونة مع LN السيطرة غير مصححة. أحد قيود هذه التقنية هو الحد المادي لحجم الحقن التي يمكن تحميلها في بنية LN. يقترح بروتوكولنا حجم حقن قدره 10 ميكرولتر في الفئران ، على الرغم من أن دراسات أخرى أبلغت عن أحجام حقن أكبر على الأقل يصل إلى 20 ميكرولتر.13 ومع ذلك ، فإن التسليم المباشر لللقاحات عن طريق حقن I.LN. يسمح بتجنيب الجرعة بشكل كبير لذلك لا ينبغي أن تكون وظيفة هذه اللقاحات محدودة بشكل عام بقيود الحجم.
وكما لوحظ، فإن تغيير الخاصية المادية للجسيمات(أي الحجم) هو آلية فعالة لتغيير المسار أو النتائج الناجمة عن المواد الحيوية والشحنات المغلفة في أنسجة LN. يمكن بسهولة تعديل بروتوكول التبخر المستحلب / المذيبات لتغيير الخصائص الفيزيائية أو الكيميائية مثل الشحنة السطحية أو الوظيفة ، ومعدل التحلل الحيوي / إطلاقالشحنة 23،24. على سبيل المثال، يمكن ضبطها الحركية الإفراج من خلال التراكيب البوليمر البديلة، ويمكن تغيير وظيفة السطح باستخدام التراكيب الدهنية المعدلة أو بولي (الفينيل الكحول). ويمكن بسهولة التلاعب بالشحنة المحملة في جزيئات لاحتواء مستضدات أو مواد مضادة مختلفة لمسببات الأمراض المستهدفة. وتتحقق ميزة هذا النهج من خلال الجمع بين تسليم i.LN. وإطلاق البضائع المحلية الخاضعة للرقابة من المواد الحيوية. هذا التآزر يؤسس منصة التي يمكن استغلالها لتوليد بكفاءة الاستجابات المناعية التكيفية باستخدام جرعات دقيقة ومع انخفاض الآثار الجانبية غير محددة / الجهازية.
Disclosures
وقد رعت شركة HORIBA المحدودة جزئيا تكاليف الإنتاج ورسوم الوصول لهذه المقالات.
Acknowledgements
تم تمويل هذا العمل جزئيا من قبل مؤسسة PhRMA وجائزة البحث والباحث من جامعة ماريلاند ، كوليدج بارك. نشكر البروفيسور داريل إيرفين على دعم العمل الأولي الذي تم إجراؤه في الانتهاء من "الهندسةالموقعية للجسم المجهري للعقدة الليمفاوية عن طريق الحقن داخل الأنف لجسيمات البوليمر المساعد". 5
Materials
| Name | Company | Catalog Number | Comments |
| 1,2-dioleoyl-sn-glycero-3-phosphocholine1,2-dioleoyl-sn-glycero-3-phosphocholine (DOPC) | Avanti Polar Lipids | 850375 | 10 mg/ml stock in chloroform |
| 1,2-distearoyl-sn-glycero-3-phosphoethanolamine-N-[amino(polyethylene glycol)-2000] ammonium salt (DSPE-PEG) | Avanti Polar Lipids | 880128 | 10 mg/ml stock in chloroform |
| 1,2-Dioleoyl-3-trimethylammonium-propane chloride salt (DOTAP) | Avanti Polar Lipids | 890890 | 10 mg/ml stock in chloroform |
| Polylactic-co-glycolic acid (PLGA) | Sigma-Aldrich | P2191 | Lactide:Glycolide (50:50). MW 30,000-60,000 |
| Dichloromethane (DCM) | VWR | BDH1113 | |
| Isoflurane | Vetone | 502017 | |
| Nair | Nair | ||
| Evans blue tracer dye | VWR | AAA16774-09 | |
| U-100 BD Ultra-Fine Short Insulin Syringes, 31 G 5/16 in needle | VWR | BD328418 | |
| Single-Use Needles, BD Medical, 21 G, 1.5 in needle | VWR | BD305167 | |
| Syringes with BD Luer-Lok Tip, BD Medical, 1 ml | VWR | BD309628 | |
| Falcon Cell Strainers, Sterile, Corning, 40 µm | VWR | 21008-949 | |
| Vybrant DiD Cell-Labeling Solution | Invitrogen | V-22887 | |
| Fluoresbrite YG Microspheres 6.00 µm | Polysciences | 17149 | |
| Fluoresbrite YG Microspheres 0.05 µm | Polysciences | 17156 | |
| Ovalbumin, Purified | Worthington Biochemical | LS003056 | |
| Qsonica Sonicator Ultrasonic Processor Q125 | Qsonica | Q125 | 1/8 in diameter microtip probe |
| Ultra-Turrax T 25 digital homogenizer | IKA | YO-04739-22 | 10 G dispersing element |
| Fluorescent Microscope | Olympus | IX-83 | |
| Laser Diffraction Particle Size Distribution Analyzer | Horiba | LA-950 | Including provided cuvette-style glass fraction cell |
| Professional 8685 Peanut Classic Clippers | Wahl |
References
- Swartz, M. A., Hirosue, S., Hubbell, J. A. Engineering Approaches to Immunotherapy. Sci. Transl. Med. 4, (2012).
- Adamina, M., et al. Intranodal immunization with a vaccinia virus encoding multiple antigenic epitopes and costimulatory molecules in metastatic melanoma. Mol. Ther. 18, 651-659 (2010).
- Ribas, A., et al. Intra-Lymph Node Prime-Boost Vaccination against Melan A and Tyrosinase for the Treatment of Metastatic Melanoma: Results of a Phase 1. Clinical Trial. Clin. Cancer Res. 17, 2987-2996 (2011).
- Senti, G., et al. Intralymphatic allergen administration renders specific immunotherapy faster and safer: a randomized controlled trial. Proc. Natl. Acad. Sci. U.S.A. 105, 17908-17912 (2008).
- Jewell, C. M., Lopez, S. C. B., Irvine, D. J. In situ engineering of the lymph node microenvironment via intranodal injection of adjuvant-releasing polymer particles. Proc. Natl. Acad. Sci. U.S.A. 108, 15745-15750 (2011).
- Johansen, P., et al. Antigen kinetics determines immune reactivity. Proc. Natl. Acad. Sci. U.S.A. 105, 5189-5194 (2008).
- Randolph, G. J., Angeli, V., Swartz, M. A. Dendritic-cell trafficking to lymph nodes through lymphatic vessels. Nat. Rev. Immunol. 5, 617-628 (2005).
- Irvine, D. J., Jewell, C. M. Ch. 132. Comprehensive Biomaterials. Ducheyne, P., et al. , (2011).
- Moon, J. J., Huang, B., Irvine, D. J. Engineering Nano- and Microparticles to Tune Immunity. Adv. Mater. 24, 3724-3746 (2012).
- Reddy, S. T., et al. Exploiting lymphatic transport and complement activation in nanoparticle vaccines. Tissue Eng. Part A. 14, 734-735 (2008).
- Bershteyn, A., et al. Polymer-supported lipid shells, onions, and flowers. Soft Matter. 4, 1787-1791 (2008).
- Johansen, P., et al. Direct intralymphatic injection of peptide vaccines enhances immunogenicity. Eur. J. Immunol. 35, 568-574 (2005).
- Mohanan, D., et al. Administration routes affect the quality of immune responses: A cross-sectional evaluation of particulate antigen-delivery systems. J. Controlled Release. 147, 342-349 (2010).
- Harrell, M. I., Iritani, B. M., Ruddell, A. Lymph node mapping in the mouse. J. Immunol. Methods. 332, 170-174 (2008).
- He, H., Courtney, A. N., Wieder, E., Sastry, K. J. Multicolor Flow Cytometry Analyses of Cellular Immune Response in Rhesus Macaques. J. Vis. Exp. , 1743(2010).
- Matheu, M. P., Parker, I., Cahalan, M. D. Dissection and 2-Photon Imaging of Peripheral Lymph Nodes in Mice. J. Vis. Exp. e265. , 265(2007).
- Salmon, H., et al. Ex vivo Imaging of T Cells in Murine Lymph Node Slices with Widefield and Confocal Microscopes. J. Vis. Exp. , 3054(2011).
- Donaldson, J. G. in Current Protocols in Immunology: Immunofluorescence Staining. , John Wiley & Sons, Inc. (2001).
- Hofman, F. in Current Protocols in Immunology: Immunohistochemistry. , John Wiley & Sons, Inc. (2001).
- Holmes, K., Lantz, L. M., Fowlkes, B. J., Schmid, I., Giorgi, J. V. in Current Protocols in Immunology: Preparation of Cells and Reagents for Flow Cytometry. , John Wiley & Sons, Inc. (2001).
- Sharrow, S. O. in Current Protocols in Immunology: Overview of Flow Cytometry. , John Wiley & Sons, Inc. (2001).
- Sharrow, S. O. in Current Protocols in Immunology: Analysis of Flow Cytometry Data. , John Wiley & Sons, Inc. (2001).
- Anderson, J. M., Shive, M. S. Biodegradation and biocompatibility of PLA and PLGA microspheres. Adv. Drug Deliv. Rev. 28, 5-24 (1997).
- Danhier, F., et al. PLGA-based nanoparticles: an overview of biomedical applications. J. Controlled Release. 161, 505-522 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved