A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
ال
In This Article
Summary
يتم استخدام نهج الفجوة الفازلين قطع مفتوحة للحصول على تسجيلات انخفاض مستوى الضجيج من التيارات الأيونية والمعزولة من القنوات الأيونية التي تعتمد على الجهد أعرب في البويضات القيطم مع ارتفاع القرار من حركية القناة بسرعة. مع تعديلات طفيفة، ويمكن أن يقترن الجهد المشبك قياس التألق لبروتوكول البويضة قطع مفتوحة.
Abstract
الفجوة البويضة الفازلين قطع مفتوحة (COVG) تقنية المشبك الجهد يسمح لتحليل الخصائص الكهربية والحركية من القنوات الأيونية مغاير في البويضات. تسجيلات من الإعداد قطع مفتوحة مفيدة بشكل خاص لتسوية منخفضة التيارات حجم النابضة، وتفعيل سريع الحالية الأيونية، والتعطيل. وتشمل الفوائد الرئيسية على مدى يومين الجهد الكهربائي المشبك (TEVC) تقنية زيادة سرعة المشبك، ونسبة تحسن الإشارة إلى الضوضاء، والقدرة على تعدل بين الخلايا والوسط خارج الخلية.
هنا، ونحن توظيف قناة الصوديوم القلب البشري (HNA V 1.5)، وأعرب في البويضات القيطم، للتدليل على الإعداد قطع مفتوحة والبروتوكول وكذلك التعديلات المطلوبة لإضافة قدرات التألق المشبك الجهد.
خصائص سريع القنوات الأيونية تفعيل، مثل HNA V 1.5، لا يمكن حلها بالكامل بالقرب من درجة حرارة الغرفة باستخدام TEVC، في whicوفرضت ح مجمل غشاء البويضة، مما يجعل من الصعب السيطرة على الجهد. ومع ذلك، في تقنية قطع مفتوحة، عزل سوى جزء صغير من غشاء الخلية يسمح للقط السريع المطلوبة لتسجيل بدقة حركية سريعة في حين منع قناة متهدم المرتبطة تقنيات المشبك التصحيح.
بالتزامن مع تقنية COVG، حركية القناة الايونية والخصائص الكهربية يمكن أن يعاير مزيد باستخدام الجهد المشبك قياس التألق، حيث يتم تعقب البروتين الحركة عبر السيستين اقتران fluorophores تطبيقها خارج الخلية، إدخال البروتينات الفلورية المرمزة وراثيا، أو إدماج من الأحماض الأمينية غير طبيعي في المنطقة من اهتمام 1. تعطي هذه البيانات معلومات إضافية حول الحركية التي تعتمد على إعادة ترتيب الجهد بتكوين جزئي من البروتين عن طريق تغييرات في المكروية المحيطة جزيء نيون.
Introduction
تسمح التقنيات الجهد لقط المتخصصة في تسجيل التيارات الأيونية في إمكانات غشاء رقابة. تستخدم على نطاق واسع يومين الجهد الكهربائي المشبك (TEVC) وتوفير تقنيات المعلومات المشبك التصحيح الكهربية يمكن الاعتماد عليها على خصائص العديد من القنوات الأيونية. ومع ذلك، كل من هذه الأساليب لديهم عيوب التي تحول دون الحصول على البيانات الموثوقة لقنوات الصوديوم الجهد بوابات قنوات سريعة وتفعيل سريع أخرى في الأغشية مثل تلك البويضات القيطم. مختبرات Bezanilla وستيفاني بالتالي تطوير تقنية الفجوة الفازلين الجهد المشبك قطع مفتوحة (COVG) لالبويضات 2. وقد تم تطبيق هذه التقنية على نطاق واسع لتسجيل، نا +، K +، والكالسيوم 2 + قنوات 3-8.
أثناء تسجيل COVG، انقسمت مغاير، معربا عن البروتين غشاء البويضة إلى ثلاث مناطق. يتم تسجيل البيانات الحالية الأيونية من منطقة رأس البويضة كماوفرضت حمام المحيطة بالمنطقة أعلى إلى إمكانية الأوامر، التي يمكن تغييرها بسهولة وبسرعة. حراس المنطقة الوسطى ضد التيارات التسرب من يجري فرضت لنفس المحتملة على المنطقة الأعلى 9. منطقة القاع حيث فتح البويضة (قطع مفتوحة) يحدث من خلال استخدام حل سابونين أو قنية. يسمح الكيميائية أو فتح دليل الغشاء في منطقة أسفل السيطرة على إمكانات الداخلية، التي فرضت على الأرض، ويجعل الخلايا متجاورة الداخلية مع الحل النواب. نضح من الحلول في مجلس النواب يمكن ضبط خصائص البيئة الداخلية، في حين حل الصرف في غرفة أعلى يغير محيطه الخارجي. 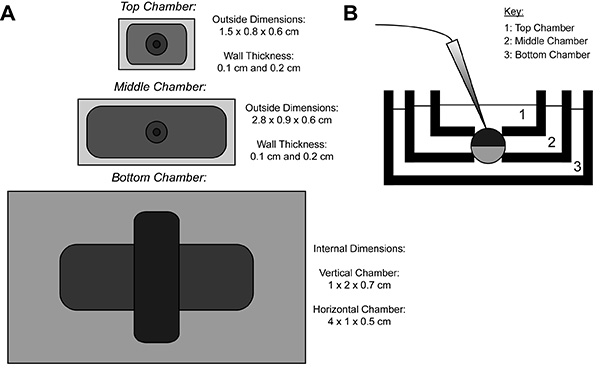
الشكل 1. بويضة قص المفتوحة الجهد المشبك الحمام إعداد مخطط (أ) الأعلىأسفل نظرا للحمامات ثلاثة فصلها عن بعضها البعض. يتم عرض أبعاد غرف لCOVG على هذا الرقم. (ب) عرض جانب من الإعداد الحمامات في موقف الاختبار. اضغط هنا لمشاهدة صورة بشكل اكبر .
وتشمل مزايا تقنية COVG انخفاض مستوى الضجيج الحالي (1 غ في 3 كيلو هرتز)، والسيطرة على تكوين الأيونية وسائل الإعلام الخارجية، والقدرة على تعديل وسائل الإعلام الداخلية، القرار وقت سريع (20-100 μsec الوقت المستمر للتسوس ل قدرة عابرة)، والتسجيلات مستقرة لعدة ساعات 9. مساوئ هي أنه يتطلب معدات متخصصة وأكثر صعوبة لتنفيذ مقارنة مع اثنين لقط الجهد الكهربائي (TEVC) 10.
في حين ان النهج COVG يتطلب معدات متخصصة للغاية والعناصر الإجرائية المعقدة، يمكن أن تسمح لاقتناء VALUالبيانات الكهربية قادرة. هذه البيانات، مثل النابضة التيارات مع حركية سريعة والتيارات الذيل 4، يمكن تسجيل دون بعض القضايا المرتبطة مع غيرها من البروتوكولات الجهد لقط بما في ذلك قناة متهدم. تعديلات طفيفة على الإعداد COVG يمكن أن تسمح لاستخدام وحدات تحكم في درجة الحرارة وقياس التألق المشبك الجهد (VCF). إدراج عناصر الجهد المشبك قياس التألق داخل التجمع COVG يمكن زيادة إخراج البيانات من خلال إضفاء القدرة على رصد التغيرات متعلق بتكوين البروتين في وقت واحد في حين تم تسجيل الحالي 11-13.
Protocol
1. الإعداد الأولي معدات
- ضع المرحلة ومناور مسرى مكروي على نظام الاهتزاز والعزل (مثل جدول الهواء) مع قفص فاراداي المحيطة لمنع الضوضاء الكهربائية والميكانيكية.
- جندى ستة الكريات حج / أجكل إلى ستة بوصة أطوال الأسلاك 24 AWG. واحدة من هذه الأطوال (أن تكون متصلا P1)، لصق في سلك الثاني لتشكيل "Y". على طرفي كل سلك لحام الذهب BNC دبوس، الذي تم تضمينه مع مكبر للصوت.
- ربط خمسة الكريات حج / أجكل ملحوم إلى 24 AWG الأسلاك إلى headstage الحمام / الحرس (P1، P2، CC، GS1، GS2 و). ربط "أنا" حج / أجكل بيليه إلى "أنا" headstage والسلك الثاني نزوله من P1 إلى headstage V2.
- توصيل مكبر للصوت للوحدة الحصول على البيانات وفقا لتوجيهات في كتيبات المعدات.
- وضع والايبوكسي والثرمستورات تحكم في درجة الحرارة. الخيط الثرمستور كتلة من خلال ثقب في scaffol المعادند مباشرة فوق مركز للعنصر التدفئة / التبريد. وضع والايبوكسي الثرمستور حمام في حفرة حفرها في الجسم من أسفل إلى غرفة إجراء درجة حرارة قريبة جدا ولكن لا الاتصال الحل.
2. البويضة وإعداد أولية
- لتسجيل قناة وأعرب heterologously مثل HNA V 1.5، توليف مرنا (المستمدة من hSCN5a) وحقنه في البويضة القيطم قبل حوالي 4-5 أيام أداء بروتوكول 4. لhSCN5a، يتم الحصول التعبير الذروة بعد احتضان لمدة 4-5 أيام في 19 درجة مئوية. الرجوع إلى ريتشاردز وDempski 14 و 15 كوهين وآخرون للحصول على إرشادات مفصلة حول البويضة، وإعداد مرنا، وحقن البويضة.
- كلوريد السلك أجكل والكريات أجكل قبل البدء بروتوكول 4. للقيام بذلك، ضع واحدة من نهاية السلك والكريات في التبييض لمدة 20 دقيقة على الأقل، وطالما O / N. مرة واحدة تم كلوريد الكرياتالطبعه، يضعوا لهم مشعب باستخدام لاصق.
ملاحظة: القيادة الحالية من خلال الأسلاك يمكن أن تستخدم أيضا لكلوريد السلك والكريات. هذه التقنية سوف تزيد من سرعة chloridation ولكن أيضا تتطلب المزيد من المعدات. نرى تقنيات Chloriding أسلاك الفضة لمزيد من التعليمات 16.
3. أجار جسر إعداد
- جعل لا يقل عن ستة جسور أجار بواسطة تسخين واحدة من نهاية الأنابيب الشعرية البورسليكات في لهب المتوسط. تأكد من أن نهاية الأنابيب الشعرية هو في الجزء العلوي من اللهب الأزرق. جعل جسور إضافية في حالة وقوع ضرر للأصول.
- بمجرد تسخين أنبوب شعري حتى، استخدم ملقط لجعل زاوية 90 درجة الانحناء في الأنبوب. تهدف لثني مع انحناء سلس بدلا من الزاوية المفاجئ أو أنها قد تقلل بشكل كبير من القطر الداخلي من الزجاج، مما يجعل ملء أكثر صعوبة ويزيد من المقاومة من الجسر.
- جعل الثاني 90 ° منحنىفي نفس الاتجاه 25 مم أسفل أنبوب شعري من أول منعطف باستخدام نفس الخطوات.
ملاحظة: طول الدقيق للجسر لا يهم طالما أن حجم الجسر هو ثابت، ولكن في النهاية يجب أن تكون أطوال مناسبة للتلاعب سيتم استخدامها على. نضع في اعتبارنا أن المقاومة جسر يتناسب مع طوله، وينبغي أن يكون الحد الأدنى. - بمجرد أن يبرد الأنابيب الشعرية، واستخدام الزجاج القاطع ذات الرؤوس الماس لتقليم "أرجل" من الجسر إلى ما يقرب من 5 ملم.
- إدراج أطوال الأسلاك البلاتين في الأنابيب الشعرية من الجسور الثلاثة "الحالية توريد" لتحسين الأداء من خلال تقليل المقاومة في آغار 17. قطع أي سلك البلاتين الزائدة حتى لا يكون هناك أي أسلاك مكشوفة خارج الأنبوب.
ملاحظة: نظرا لارتفاع تكلفة البلاتين واسترداد وإعادة استخدام أي سلك من الجسور المحطمة. - دفع سلك البلاتين الى مزيد من الأنابيب الشعرية مع غرامة ذات الرؤوس تنفيذ مثل ر micropipetteالملكية الفكرية بحيث السلك هو 1 مم أقصر من الزجاج على طرفي الأنبوب الشعري.
- جعل 100 مل من 1 M NMDG مخزنة مع 1.2 غرام من HEPES. استخدام متر الرقم الهيدروجيني وإضافة MES مسحوق هيدرات حتى يتم التوصل إلى درجة الحموضة من 7.4 (~ 10 ز). مرة واحدة وقد تم التوصل إلى الرقم الهيدروجيني من 7.4، وإزالة القطب درجة الحموضة. تخصيص 40 مل من الحل للحفاظ كحل التخزين.
- إضافة أجار المحبب لإنتاج 2-3٪ خليط أجار. يذوب ضجة والحرارة حتى حل أجار واضحة. لا افراط أو تغلي الحل لأنها سوف تصبح لزجة بشكل مفرط وملء سوف يكون من الصعب الجسور.
- نقل الحل أجار إلى دورق جديدة وإضافة شريط ضجة صغيرة. يستمر التسخين والتحريك بسرعة معتدلة.
- إضافة الجسور الشعرية في وقت واحد مع الساقين مواجهة. مع مرور الوقت سوف تملأ الجسور مع أجار. بدلا من ذلك، وملء الجسور عن طريق دفع أجار حل من خلال حقنة تعلق على طرف ماصة صغيرة.
- مرة واحدة عدم وجود فقاعات في بريdges، استرداد الجسور من الحل أجار ووضع الجسور على منشفة ورقية لتجف. أي الجسور مع فقاعات المتبقية يمكن تحريكها مع ملقط لتسهيل خروج فقاعة.
ملاحظة: أجار استقر مع فقاعات يمكن إزالتها تماما بغمر الجسور في الماء المغلي. مرة واحدة تتم إزالة آغار، واستخدام خط فراغ لإزالة المياه المتبقية. ويمكن بعد ذلك الجسور يمكن إعادة استخدامها للعلاج أجار. - إزالة أجار الزائدة من الجسور عندما تجف. إضافة 60 مل من الماء إلى حل الاحتياطي 40 مل ووضع الجسور في حلول التخزين.
4. قطع مفتوحة إعداد تزوير
- بدوره على مصدر المياه للتحكم في درجة الحرارة ومن ثم التحول إلى قوة للتحكم في درجة الحرارة. الانتظار حتى تصل درجة حرارة حمام درجة حرارة معينة (19 درجة مئوية).
- سحب microelectrodes من البورسليكات الأنابيب الشعرية مع مجتذب مسرى مكروي إلى المقاومة من 0.2-0.5 MΩ.
ملاحظة: خفض نقطةالمقاومة ETTE يحسن سرعة لقط. ومع ذلك، هم أكثر عرضة للتلف البويضة أقل ماصات المقاومة. مطلوب التجريب لتحديد أفضل قيمة المقاومة ماصة لكل تطبيق. - إعداد الحل سابونين عن طريق خلط 0.125 غرام من سابونين الجافة مع 50 مل من محلول الداخلية. وهذا يؤدي إلى حل 0.25٪. عكس برفق لمزج.
- تحت المجهر تشريح تطبيق كمية صغيرة من الفازلين حول حافة الحفرة على الجانب العلوي من غرفة الوسط والجانب السفلي من الغرفة العلوية مع كائن جدا يميل غرامة.
ملاحظة: إن "دونات" من الفازلين تساعد على الحفاظ على البويضة في مكان أكثر من الحفرة وسوف تساعد في تشكيل الختم. ومع ذلك، الكثير من الفازلين سوف فخ الفقاعات ومنع من الوصول إلى حلول سطح البويضة. - إضافة 3 M بوكل حل في فتحات متعددة عقد الكريات حج / أجكل حتى لا يكون هناك أي تجاوز من فتحات ولكن الكريات وينتهي الجسر الساق هي كوفالأحمر. تنظيف قطرات بوكل اضافية لمنع الاتصالات غير المرغوب فيها بين فتحات الكهربائية.
- إضافة الحل الخارجي إلى الدنيا والمتوسطة غرف الحمام.
- وضع الجسور أجار في فتحات في أجكل بيليه متعددة بحيث ساق واحدة في الجسر هو في كل فتحة. في وقت لاحق سوف يتم وضع الساق الأخرى من الجسور في غرف منها (P1، P2، أعلى CC؛ GS1، GS2 المتوسطة (حارس)، وأنا القاع). تأكد من أن الجسور سلك البلاتين هي في GS2، P2، وأنا فتحات.
يتم غسلها ضمان الجسور مع الماء المقطر وجافة تماما قبل إدخالها في حمام الغرفة: ملاحظة. - تشغيل نظام الحصول على البيانات وجهاز الكمبيوتر. بدء تسجيل البرمجيات.
5. قطع مفتوحة الداخلي
- تثبيت الجزء العلوي والمتوسطة غرف البويضة دون بويضة. حرك الغرفة أعلى من الوسط بحيث الفتحات الموجودة في المجلسين لا تتداخل. ملء جميع الغرف مع حل الخارجية ووضع كل الأقطاب في غرف كل منها.
ملاحظة: لا تضغط على غرفة أعلى على طول الطريق عند تثبيت الدوائر. تأكد لا تزال هناك فجوة صغيرة جدا بين الغرفتين. الترتيب خارج المركز يزيد من مقاومة نظام غرفة لمحاكاة أفضل وجود الخلية. هذه العملية، تسمى "موازنة الجسور"، يعوض عن إمكانيات تعويض ما قد ينشأ من التجانس بين الجسور أجار.- إيقاف الأوامر الخارجية وكلا المشابك. تحقق القراءة الحالية على مكبر للصوت. ضبط مع مفك البراغي الصغيرة ف تعويض على ظهر الحمام / رئيس الحرس المرحلة الحالية إلى الصفر.
- التبديل تبديل حمام / الحرس على مكبر للصوت إلى نشطة وضبط GS تعويض للحصول صفر الحالي.
- تكرار بين "نشطة" و "السلبي" حتى كلاهما معقول قريبة إلى الصفر (<100 غ).
- إزالة الغرفة العلوية ونقل بويضة في غرفة حمام المتوسطة باستخدام مضخة ماصة. تأكد من أن oocyيتم وضع الشركة المصرية للاتصالات خلال ثقب في وسط الحمام.
ملاحظة: عند إعداد بويضة لVCF، ضع الخلية المسمى في غرفة مع القطب الحيواني (الجانب المظلم) متجهة لأعلى. لا يهم التوجه الخلايا إذا لم يتم تنفيذ VCF. - إزالة حل الخارجية الزائدة من أسفل حمام باستخدام الشافطة لإنشاء ختم بين البويضة وسطح الحمام.
- وضع غرفة حمام على أعلى البويضة بحيث يتم توسيط ثقب في الغرفة على رأس البويضة. باستخدام الإبهام والإصبع الوسطى، وتطبيق ببطء الضغط لأسفل على الغرفة حتى يتم الضغط عليه بإحكام ضد البويضة وذلك لفضح سوى جزء صغير من الغشاء إلى الحمام العلوي من خلال ثقب.
ملاحظة: إن البويضة قد انتفاخ تحت ضغط من الغرفة العليا. لا تنطبق القوة المفرطة لغرفة أعلى، وهذا سوف يسبب البويضة إلى تمزق. ملاقط نصائح وضعها على زوايا قطري للغرفة أعلى يمكن استخدامه كبديل للأصابع لتطبيق ورقةذ ضغط هبوطي. - إضافة الحل الخارجي إلى الحمامات أعلى وأسفل حتى أنها تكاد تكون كاملة.
- وضع الساقين خالية من الجسور أجار في حل الخارجية لكل حمام كما رأينا في الشكل 2 (جسر التنسيب). تأكد من أن كل جسر يستريح في موقعه الصحيح حمام. (I سد في الحمام السفلي، GS1 وGS2 الجسور في الحمام المتوسطة، وP1، P2، والجسور CC في حمام العليا). التبديل تبديل حمام / الحرس على مكبر للصوت إلى نشطة.
ملاحظة: تأكد من عدم وجود اتصالات 3 M بوكل بين الجسور وآبارهم، وغرف التسجيل. وعلاوة على ذلك، وجعل هي الطراز الجسور على يقين من ذلك أنهم المثارة أعلاه الحلول غرفة تسجيل.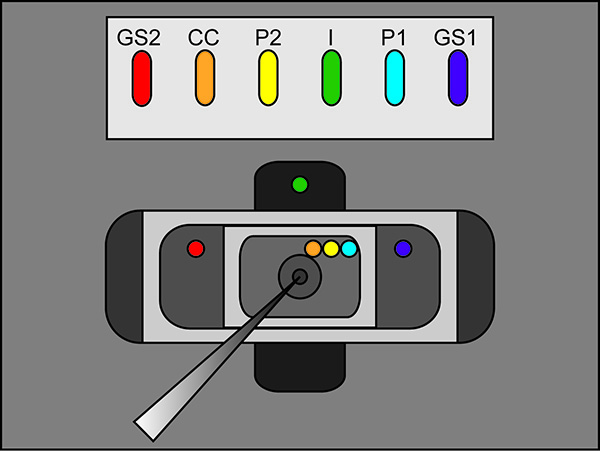
الشكل 2. مواقع أجار جسر إعداد مخطط الموقع. تنسيب نهايات خالية من الجسور أجارفي مختلف الحمامات. اضغط هنا لمشاهدة صورة بشكل اكبر . - بدء بروتوكول الاختبار في برنامج تسجيل. إذا تبين نبض النزوح العمودي للقسم الأفقي بين قمم اثنين على تطبيق 100 بالسيارات نبض أكبر من 100 غ (الموافق 0.3 MΩ مع حمام / حارس في السلبي) ثم زيادة ضيق من غطاء الحمام. انظر الشكل 3 للحصول على مثال لاختبار النبض المثالي.
ملاحظة: بروتوكول اختبار تنبعث نبضة الجهد لمعرفة ما إذا كان غطاء حمام ضيق بما فيه الكفاية ولقد تم تجميع كل المكونات بشكل صحيح. بدلا من ذلك، يمكن استخدام اختبار وظيفة من مكبر للصوت.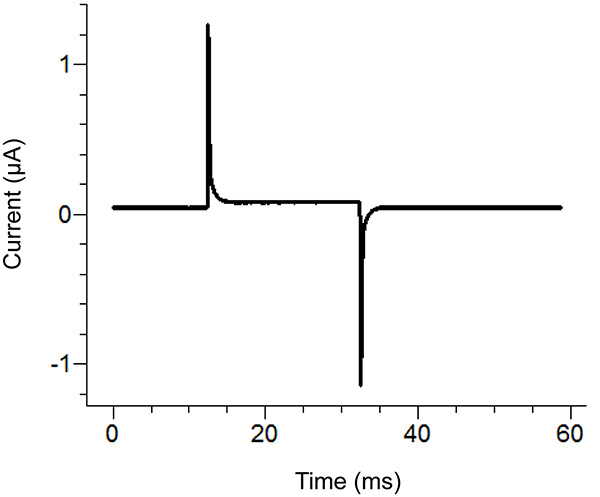
الرقم 3. مثالية نبض اختبار البرمجيات من التسجيل. نبض الاختباريجب أن يتشابه نبض أعلاه تبعا للبروتوكول التطبيقية. التيار عقد (المركز الأساسي) وينبغي أن تكون قريبة من الصفر. اضغط هنا لمشاهدة صورة بشكل اكبر . - إزالة الحل الخارجي في الحمام السفلي واستبدالها مع حل سابونين. كن حذرا لتجنب خلق فقاعات أثناء إضافة سابونين. لضمان أقصى قدر من استبدال، وتطبيق الشفط على الطرف الآخر من الحمام السفلي بينما تضيف الحل.
- بعد تمت إضافة الحل سابونين، ومراقبة الاختبار نبض التكرار. إذا كانت ذروة بروتوكول الاختبار يقلل أو يختفي ثم وهذا هو علامة على ان هناك فقاعة تقع تحت البويضة. في هذه الحالة، إزالة الحل سابونين ثم يحل محله.
ملاحظة: Permeabilization هو عادة كاملة في غضون 30 ثانية بمحلول سابونين الطازجة. قد يكون حلول صعوبة في الوصول الخلية إذا كانت هناك فقاعات المحاصرينأو إذا كان لا يزال طبقة الجريبي على بويضة سيئة هضمها. تم permeabilized البويضة (فتح) عند المنحدر من ارتفاع الجهد النقصان (زيادة في وقت ثابت من تسوس).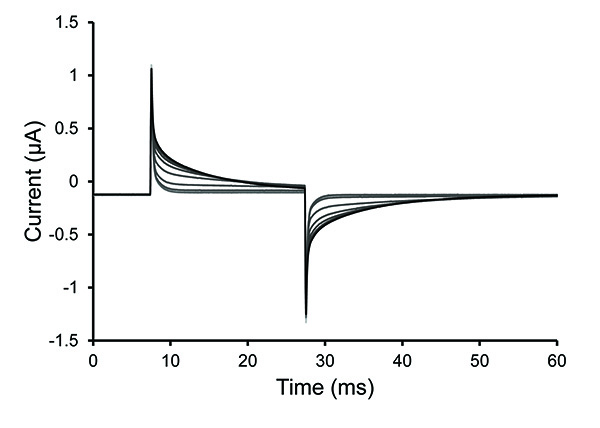
الشكل 4. اختبار نبض يتتبع خلال سيت Permeabilization. آثار مختارة من بروتوكول نبض الاختبار بعد أن قدم حلا سابونين 0.25٪ الى غرفة البويضة القاع. زيادة ثابت وقت تسوس ينظر في آثار يوضح بزيادة قدرها البويضة permeabilization. اضغط هنا لمشاهدة صورة بشكل اكبر . - بمجرد permeabilized الخلية، وإزالة الحل سابونين وملء حوض الاستحمام مع الحل الداخلي. وقف بروتوكول الاختبار.
ملاحظة: على الرغم من سابونين يسمح بالوصول إلىالداخلية للخلية التي كتبها permeabilizing الغشاء، موازنة لتركيزات أيون بين انخفاض حمام وسيتوبلازم البويضة عن طريق الانتشار هو عملية بطيئة جدا. قد تتطلب هذه العملية عشرات من الدقائق تبعا للظروف (الشكل 5). - تحقق من وجود أي مستويات عالية من الحل في الحمامات وتبلور بوكل بين آبار مشعب وهذه يمكن أن تسبب دوائر قصيرة وسلوك خاطئ.
- استخدام حقنة لحقن تعديل 3 M بوكل إلى مسرى مكروي. نفض الغبار مسرى مكروي عدة مرات مع إصبع واحد في حين تستعد مع الأصابع الأخرى.
ملاحظة: هذه الخطوة مطلوبة لإزالة أي فقاعات الهواء المحبوس داخل مسرى مكروي. - جبل القطب بوكل شغل على الذراع مياداة مجهرية عن طريق إدراج خيوط الأسلاك في نهاية مسرى مكروي مفتوحة. دفع نهاية مسرى مكروي في حامل خيوط والتأكد من القطب ليست فضفاضة. تشديد قفل كهربائي.
ملاحظة: ماكه من أن الأسلاك لديه حتى أجكل طلاء لالقطب لتعمل بشكل طبيعي. - تأرجح الذراع في الموقف على حمامات بويضة وتشديد المشابك لمنع المزيد من حركة الذراع.
- باستخدام المقابض مناور، والمشي القطب أسفل إلى الحمام. تأكد من أن أي اختبار النبض يتم تطبيقها والتي لم يتم تنشيط ميزة اختبار الغشاء عند هذه النقطة.
ملاحظة: قبل أن يتم إدخال طرف القطب في السائل، V1-V2 على المشبك الجهد سوف تقرأ الجهد الايجابي. مرة واحدة يتم إدخال طرف القطب في السائل، ينبغي للمتر الجهد على المشبك الجهد تغيير إلى قيمة قريبة من الصفر. للحصول على تسجيلات VCF، يحتاج القطب الاقتراب من الخلية في زاوية الضحلة إلى حد ما يترك مجالا للموضوعية. التخوزق الخلية مع القطب خارج المركز، وأقرب إلى حافة التصحيح غشاء معزولة أيضا يساعد على تجنب اصطدام الهدف مع القطب. - وقف المشي القطب أسفل. تعيين القطب تعويضالمحتملة إلى الصفر عن طريق الضغط على زر V1 ومن ثم تقليل الجهد V1 إلى الصفر عن طريق ضبط V1 الإزاحة. بالإضافة إلى ذلك، تؤدي نفس التكيف لV2. إمكانات الفرق V1-V2 يجب قراءة 000 بالسيارات.
- التبديل إلى V1 وتحويل Z-الاختبار على قياس مقاومة القطب. ستسقط تدريجيا قيمة ونهج المقاومة الفعلية. تهدف لقيمة المقاومة من 0.2-0.5 MΩ.
- مواصلة المشي القطب أسفل نحو التصحيح المرئي من بويضة في الحمام العلوي. مرة واحدة في مسرى مكروي قريب جدا من البويضة، ومشاهدة القراءة V1-V2 لمعرفة متى يدخل القطب البويضة؛ سوف V1-V2 الجهد يصبح سلبيا عندما يدخل مسرى مكروي الخلية.
ملاحظة: القيمة المعروضة في هذه المرحلة هو احتمال غشاء الخلية، وسوف تتأثر قنوات أعرب والحلول المستخدمة. سوف إدراج مسرى مكروي بعيدا جدا تلف غشاء الخلية. - فتح بروتوكول جمع البيانات فيتسجيل البرمجيات.
- الوجه على التبديل المشبك على المشبك الجهد وضبط القدرة على مطابقة الأوامر (على سبيل المثال -100 بالسيارات) عن طريق ضبط مقبض تقع على "أنا" headstage.
- الوجه على السعة والتعويض المقاومة التبديل.
- الوجه "اختبار" تشغيل في "أوامر" منطقة المشبك الجهد. استخدام الذبذبات لتصور إشارة. ضبط المقابض التعويض سم في قطاع تكييف إشارة للحد من العابرين بالسعة على الذبذبات. لا الإفراط في تعويض القمم إلى النقطة التي تحدث قمم عكس إضافية أو قمم تبدأ في وضع انحناء السيني، الذي يمكن أن يعرض القطع الأثرية في التسجيل.
- مرة واحدة تم تخفيض السعة يدويا إلى مستوى مرض، إيقاف التبديل الاختبار.
- بدء تسجيل البيانات في بروتوكول برنامج تسجيل.
6. تنظيف
- عندما يكون التسجيلات النحلن الانتهاء، إيقاف جميع مفاتيح مختلفة على المشبك الجهد بما في ذلك المشبك وحمام / مفاتيح الحراسة.
- استخدام ملقط لإزالة الجسور أجار من مختلف الحمامات.
- إزالة الحمام العلوي ونضح كل الحلول والبويضة من جميع الحمامات.
- استخدام زجاجة من الماء منزوع الأيونات لشطف جميع الحمامات ثم نضح الحمامات مع فراغ. كرر هذه الخطوة 3-5X.
- مسح تبلور بوكل قبالة الجسور ووضع الجسور في حلول التخزين. الجسور يمكن إعادة استخدامها لعدة أسابيع طالما يتم تخزينها بشكل صحيح.
- نضح الحل بوكل من الآبار متعددة وشطف متعددة مع الماء منزوع الأيونات عدة مرات.
- إيقاف جميع المعدات المختلفة بما في ذلك التحكم في درجة الحرارة وتسجيل البرمجيات.
7. إضافة الجهد المشبك قياس التألق
- اتبع الخطوات في القسم من 1 إلى 6 في البروتوكول إن الرب المنشورة سابقا 16 Examining ديناميكية بتكوين جزئي للبروتينات الغشاء في الموقع مع الموقع الموجه وصفها الإسفار: اضغط هنا لعرض الصفحة.
- تنفيذ الخطوات الموجودة في القسم 4 من خلال 5.22 من بروتوكول COVG المذكورة آنفا باستخدام مجهر VCF الغروب في التركيز 4X.
ملاحظة: التسجيلات VCF تتطلب أكبر غرف حمام البويضة مما هو مطلوب في القياسات COVG. (تقع أبعاد غرف VCF مخصص في قائمة المواد.) يجب أن تكون هذه الغرفة VCF قادرة على استيعاب أكبر في وقت واحد عدسة الهدف، مسرى مكروي، والجسور أجار. بالإضافة إلى ذلك، فإن القطب الحيواني (الجانب المظلم من البويضة) يحتاج إلى أن تواجه التصاعدي في غرفة خلفية منخفضة للتسجيلات VCF. - جعل الجزء العلوي من بويضة في التركيز باستخدام الهدف 40X الغمر بالمياه.
ملاحظة: التبديل من 4X إلى الهدف 40X يتطلب جنرال الكتريك محددةometry لخفض مفتوحة مكونات وعناية فائقة حتى لا تصل إلى القطب، والجسور، أو الغرف عندما خفض الهدف 40X. وعلاوة على ذلك، ونظرا لزيادة حجم الحرس في الأعلى، وضمان عدم توصيل هذا الحجم حمام من الحرس العلوي مع الحرس المتوسطة عند تعيين الهدف 40X في المكان. - التركيز على حلقة حول محيط سطح البويضة المكشوفة، بحيث أعلى جدا من البويضة هو أعلى قليلا من الطائرة من التركيز.
ملاحظة: التعديل في الطائرة س ص قد تكون ضرورية بحيث يتم تعبئة مجال الرؤية في الغالب مع الغشاء وليس غرفة. ويتم إنجاز الترجمة XY بسهولة عن طريق وضع المجهر على مرحلة الترجمة. - تحريك المكعب مرشح في مسار بصري وتبديل مسار الضوء من العدسة إلى الكاشف (الصمام الثنائي).
- بدوره على مصدر الضوء VCF.
- إطفاء الأنوار العلوية، وعلى ضوء الألياف إضاءة، وغيرها من مصادر الضوء.
ملاحظة: من الناحية المثالية، VCFيجب أن يتم تنفيذ التسجيلات في غرفة مظلمة تماما. - تشغيل بروتوكول مضان في برنامج تسجيل.
النتائج
الشكل 4 يعرض يتم تطبيق التغيير في نفاذية البويضة كحل سابونين إلى القسم السفلي من بويضة. الشكل 5 يوضح سعر الصرف حل داخل الخلايا عن طريق الانتشار التالية permeabilization سابونين. ويلزم 20-40 دقيقة من أجل التوصل إلى حالة مستقرة، 2،18.
Discussion
البويضة الفازلين الفجوة الجهد تقنية المشبك قطع مفتوحة يسمح لتسوية سريعة للبيانات، وانخفاض مستوى الضجيج، وزيادة السيطرة على الحل الداخلي وتكوين الحل الخارجي، والتسجيلات مستقرة عبر بروتوكولات طويلة نسبيا 19. هذه المزايا تعيين هذه التقنية وبصرف النظر عن مستوى ا...
Disclosures
والكتاب ليس لديهم ما يكشف.
Acknowledgements
جميع أعضاء جامعة واشنطن في سانت لويس مختبر الهندسة القلب الجزيئي. A بوروز مرحبا بكم جائزة شهادة الصندوق في واجهة العلمية - 1010299 (لشبيبة).
Materials
| Name | Company | Catalog Number | Comments |
| External Solution | Brand | Catalog Number | [Final], weight, or volume |
| N-methyl-D-glucamine (NMDG) | Sigma-Aldrich | M2004 | 25mM |
| MES Sodium Salt | Sigma-Aldrich | M5057 | 90mM |
| HEPES | Research Products International | H75030 | 20mM |
| Calcium hydroxide | Sigma-Aldrich | 239232 | 2mM |
| MES Hydrate | Sigma-Aldrich | M8250 | variable (pH to 7.4) |
| Internal Solution | |||
| N-methyl-D-glucamine (NMDG) | Sigma-Aldrich | M2004 | 105mM |
| MES Sodium Salt | Sigma-Aldrich | M5057 | 10mM |
| HEPES | Research Products International | H75030 | 20mM |
| Ethylene glycol-bis(2-aminoethylether)-N,N,N',N'-tetraacetic acid (EGTA) | Sigma-Aldrich | E4378 | 2mM |
| MES Hydrate | Sigma-Aldrich | M8250 | variable (pH to 7.4) |
| Depolarizing Solution | |||
| KCl | Sigma-Aldrich | 221473 | 110mM |
| Magnesium chloride | Sigma-Aldrich | M8266 | 1.5mM |
| Calcium Chloride | Caisson | C021 | 0.8mM |
| HEPES | Research Products International | H75030 | 10mM |
| Pipet Solution | |||
| KCl | Sigma-Aldrich | 221473 | 3M |
| Saponin Solution | |||
| Saponin | Sigma-Aldrich | 47036 | 0.125g |
| Internal Solution | See above | 50mL | |
| Agar Bridge Solution | |||
| N-methyl-D-glucamine (NMDG) | Sigma-Aldrich | M2004 | 100ml of 1M |
| HEPES | Research Products International | H75030 | 1.2g |
| MES Hydrate | Sigma-Aldrich | M8250 | variable (pH to 7.4) |
| Granulated Agar | Research Products International | A20250 | 3% |
| NMDG Storage Solution | |||
| NMDG, HEPES, MES Hydrate solution | see above | 40ml | |
| Water | 60ml | ||
| Name of Material/ Equipment | Company | Catalog Number | Comments/Description |
| High Performance Oocyte Clamp | Dagan | CA-1B | |
| Data Acquisition System | Axon CNS | Digidata 1440A | |
| Oscilloscope | Tektronix | TDS 210 | |
| Rack Power Filter | APC | G5 | |
| Heating/Cooling Bath Temperature Controller | Dagan | HCC-100A | |
| PC | Dell | Optiplex 990 | |
| pCLAMP 10.3 Voltage Clamp Software | Molecular Devices, LLC | pCLAMP10.3 | |
| TMC Vibration Control TableTop Platform | TMC | 64 SERIES | |
| TMC Vibration Control Air Table | TMC | 20 Series | |
| V1/I Electrode Data Collector | Dagan | part of CA-1B | |
| MX10L Micromanipulator | Siskiyou | MX10L | |
| Bath/Guard (I/V) Headstage (with appropriate connectors) | Dagan | part of CA-1B | |
| Microscope | Omano | OM2300S-JW11 | |
| Temperature Control Bath | Custom or Dagan | Custom or HE-204C | Custom chamber made from materials from Cool Polymers (D-series). Dagan also provides a prefeabricated stage (HE-204C). |
| Custom AgCl Pellet Container | Custom | Custom | Custom machined |
| Ag/AgCl electrode, pellet, 2.0 mm | Warner | E-206 | |
| External Oocyte Bath | Custom or Dagan | Custom or CC-1-T-LB | Custom machined or purchased from Dagan |
| Internal Oocyte Bath | Custom or Dagan | Custom or CC-TG-ND | Custom machined or purchased from Dagan |
| Capillaries for Agar Bridges and Pulled Electrodes | Warner | G150T-4 | |
| Rotatable Mounts for the Microscope, Micromanipulator, and Bath | Siskiyou | SD-1280P | |
| Fiber-Lite | Dolan-Jenner | LMI-600 | |
| Regular Bleach | Clorox | 470174-764 | |
| Xenopus laevis Oocytes | Nasco | LM535M (sexually mature females) | |
| 90 Na+ External Solution | See Solutions sheet | ||
| 10 Na+ Internal Solution | See Solutions sheet | ||
| 3 M KCL | See Solutions sheet | ||
| Saponin | Sigma-Aldrich | 47036 | |
| NMDG Storage Solution | See Solutions sheet | ||
| 5mL transfer pipets | SciMart | GS-52 | |
| Modified KCl electrode injector | BD | 309659 | Plastic syringe tip melted to allow for injection of solution into electrodes. Alternatively, a Microfil by WPI can be purchased. |
| Microvaccum | Custom | Custom | |
| Forceps | VWR | 63040-458 | |
| Oocyte Handling Tools (Pipette Pump) | VWR | 53502-222 | |
| Deionized Water Squirt Bottle | VWR | 16649-911 | |
| Vaseline Petroleum Jelly | Fisher Scientific | 19-086-291 | |
| Additional Materials Required for VCF Recordings: | |||
| VCF Microscope | Nikon | Eclipse FN1 | |
| Nikon CFI APO 40XW NIR Objective | Nikon | N40X-NIR | |
| X-Y Translator System for Fixed-Stage Upright Microscopes | Sutter Instruments | MT500-586 | |
| External VCF Oocyte Bath | Custom | Custom machined. The chamber dimensions are 2.7 x 1.9 x 0.4 cm. | |
| Internal VCF Oocyte Bath | Custom | Custom machined. The chamber dimensions are 1.6 x 1.6 x 0.4 cm. | |
| Modified Temperature Control Bath | Custom | Custom chamber made from materials from Cool Polymers (D-series). The chamber dimensions of the modified temperature controller bath are 2.7 x 1.9 x 0.3 cm for the horizontal chamber, and 1 x 2.5 x 0.5 cm for the vertical chamber. |
References
- Kalstrup, T., Blunck, R. Dynamics of internal pore opening in KV channels probed by a fluorescent unnatural amino acid. Proc. Natl. Acad. Sci. U.S.A. 110, 8272-8277 (2013).
- Stefani, E., Bezanilla, F. Cut-open oocyte voltage-clamp technique. Methods Enzymol. 293, 300-318 (1998).
- Muroi, Y., Chanda, B. Local anesthetics disrupt energetic coupling between the voltage-sensing segments of a sodium channel. J. Gen. Physiol. 133, 1-15 (2009).
- Stefani, E., Toro, L., Perozo, E., Bezanilla, F. Gating of Shaker K+ channels: I. Ionic and gating currents. Biophys. J. 66, 996-1010 (1994).
- Wang, S., Liu, S., Morales, M. J., Strauss, H. C., Rasmusson, R. L. A quantitative analysis of the activation and inactivation kinetics of HERG expressed in Xenopus oocytes. J. Physiolt. 502 (Pt 1), 45-60 (1997).
- Neely, A., Garcia-Olivares, J., Voswinkel, S., Horstkott, H., Hidalgo, P. Folding of active calcium channel beta(1b) -subunit by size-exclusion chromatography and its role on channel function. J. Biol. Chem. 279, 21689-21694 (2004).
- Silva, J. R., Goldstein, S. A. Voltage-sensor movements describe slow inactivation of voltage-gated sodium channels I: wild-type skeletal muscle. Na(V)1.4. J. Gen. Physiol. 141, 309-321 (2013).
- Silva, J. R., Goldstein, S. A. Voltage-sensor movements describe slow inactivation of voltage-gated sodium channels II: a periodic paralysis mutation in Na(V)1.4 (L689I). J. Gen. Physiol. 141, 323-334 (2013).
- Taglialatela, M., Toro, L., Stefani, E. Novel voltage clamp to record small, fast currents from ion channels expressed in Xenopus oocytes. Biophys. J. 61, 78-82 (1992).
- Clare, J. J., Trezise, D. J. . Expression and analysis of recombinant ion channels : from structural studies to pharmacological screening. , (2006).
- Cha, A., Zerangue, N., Kavanaugh, M., Bezanilla, F., Susan, G. A. . Methods in enzymology. 296, 566-578 (1998).
- Lakowicz, J. R. . Principles of fluorescence spectroscopy. 3rd edn. , (2006).
- Cha, A., Bezanilla, F. Characterizing voltage-dependent conformational changes in the Shaker K+ channel with fluorescence. Neuron. 19, 1127-1140 (1997).
- Richards, R., Dempski, R. E. Examining the conformational dynamics of membrane proteins in situ with site-directed fluorescence labeling. J. Vis. Exp. , (2011).
- Cohen, S., Au, S., Pante, N. Microinjection of Xenopus laevis oocytes. J. Vis. Exp. , (2009).
- Raynauld, J. P., Laviolette, J. R. The silver-silver chloride electrode: a possible generator of offset voltages and currents. J. Neurosci. Methods. 19, 249-255 (1987).
- Gagnon, D. G., Bissonnette, P., Lapointe, J. Y. Identification of a disulfide bridge linking the fourth and the seventh extracellular loops of the Na+/glucose cotransporter. J. Gen. Physiol. 127, 145-158 (2006).
- Pantazis, A., Olcese, R., Roberts, G. . Cut-Open Oocyte Voltage-Clamp Technique. In: Roberts G. (Ed.) Encyclopedia of Biophysics: SpringerReference. , (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved