Method Article
تصور التفاعلات الحمض النووي البروتين في الخلايا البكتيرية عن طريق لايف Photoactivated تتبع جزيء واحدة
In This Article
Summary
Photoactivated المجهر التعريب (النخيل) جنبا إلى جنب مع تتبع جزيء واحد يسمح الملاحظة المباشرة والكمي للتفاعلات الحمض النووي البروتين في الخلايا القولونية الحية.
Abstract
تفاعلات الحمض النووي البروتين هي في قلب العديد من العمليات الخلوية الأساسية. على سبيل المثال، تخضع تكرار الحمض النووي، والنسخ، والإصلاح، وتنظيم كروموسوم من البروتينات الحمض النووي ملزم بأن تعترف هياكل الحمض النووي محددة أو تسلسل. ساعدت في المختبر تجارب لتوليد نماذج مفصلة عن وظيفة العديد من أنواع البروتينات الحمض النووي ملزم، ولكن ، والآليات الدقيقة لهذه العمليات وتنظيمها في بيئة معقدة من الخلايا الحية تظل أقل بكثير من المفهوم. قدمنا مؤخرا طريقة لقياس أنشطة إصلاح الحمض النووي في الخلايا القولونية الحية باستخدام Photoactivated توطين مجهرية (النخيل) جنبا إلى جنب مع تتبع جزيء واحد. ويحدد لنا النهج العام الأحداث الحمض النووي ملزم الفردية عن طريق التغيير في التنقل من بروتين واحد على ارتباط مع الصبغي. جزء من جزيئات منضم يوفر مقياس كمي المباشر للفعل البروتينivity وفرة من ركائز أو مواقع الربط على مستوى خلية واحدة. هنا، نحن تصف مفهوم الأسلوب وإظهار إعداد العينات، والحصول على البيانات، وإجراءات تحليل البيانات.
Introduction
يصف هذا البروتوكول في القياس المباشر للتفاعلات الحمض النووي البروتين في الخلايا الحية القولونية. تقنية تستخدم التغيير في معامل الانتشار من بروتين واحد fluorescently المسمى لأنه يربط كروموسوم (الشكل 1). للتدليل على أسلوب ونحن نستخدم الحمض النووي بوليميريز الأول (Pol1)، وهو بروتين الحمض النووي ملزم تنميط الذي يملأ الفجوات في النسخ المتماثل الحمض النووي حبلا متخلفة ومسارات إصلاح الختان 1.
ظهور فائقة الدقة مضان المجهري تمكن التصور من الهياكل الجزيئية في الخلايا مع قرار نانومتر. Photoactivated توطين مجهرية (النخيل) توظف البروتينات الفلورية التي يمكن تفعيلها من حالة الظلام الأولية إلى حالة الفلورسنت (الشكل 2). فقط يتم تنشيط مجموعة فرعية من جميع الجزيئات المسمى في أي وقت لتحديد مواقفهم بطريقة متسلسلة، بصرف النظر عن ركان مجموع تركيز الجزيئات المسمى في العينة 2. الدقة في الترجمة جزيء يعتمد بشكل رئيسي على حجم الفلورسنت وظيفة نقطة انتشار (قوات الأمن الفلسطينية)، وعدد من الفوتونات التي تم جمعها، وإشارة الخلفية 3. تركز العديد من التطبيقات لهذه الطريقة على تحسين التصور من الهياكل الخلوية. إدراك أن النخيل يمكن دمجها مع واحدة جزيء تتبع 4 فتحت آفاقا جديدة لمتابعة مباشرة لحركة الأرقام التعسفي من البروتينات وصفت في الخلايا الحية. زيادة الحساسية والقرار الزماني من المجاهر مضان الآن تسمح تتبع واحد نشرها البروتينات الفلورية في السيتوبلازم البكتيري 5.
هنا، ونحن توظيف PAmCherry، وهو بروتين فلوري هندسيا الذي يحول بشكل لا رجعة فيه من حالة nonfluorescent الأولية إلى حالة الفلورية على التشعيع مع 405 نانومتر ضوء 6. يمكن fluorophores PAmCherry تفعيلها تكون الصورةد بواسطة الإثارة في 561 نانومتر، وتعقب لعدة إطارات حتى photobleaching من. علينا أن نظهر قدرة طريقة لتحديد الأحداث الحمض النووي ملزم عابرة للبروتينات واحدة باستخدام مزيج من Pol1 وPAmCherry. علاج الخلايا مع methanesulfonate الميثيل (MMS) يسبب الضرر DNA مثيلة التي تحولت إلى ركائز الحمض النووي شق من الانزيمات إصلاح قاعدة الختان. يظهر لدينا وسيلة واضحة ملزمة للجزيئات Pol1 واحد ردا على الضرر MMS 7.
Protocol
1. الثقافة الخلية
استخدام أنابيب ثقافة عقيمة ونصائح ماصة. وE. سلالة القولونية AB1157 بولا-PAmCherry يحمل PAmCherry الانصهار-C محطة من Pol1. تم إدراج الانصهار في الموقع الكروموسومات الأم عن طريق استبدال الجين من النوع البري باستخدام امدا الأحمر إعادة التركيب كما هو موضح في داتسينكو وآخرون. وأكد 8 وظائف من البروتين الانصهار كما تقرره معدلات النمو الخلوي وحساسية على الحمض النووي الإضرار كيل الميثيل methanesulfonate (MMS). مزيد من المعلومات حول بناء سلالة خلية يمكن العثور عليها في أبهوف وآخرون. 7، داتسينكو وآخرون. 8، و رييس-اموث وآخرون. تزرع 9 الثقافات الخلية في M9 الحد الأدنى من المتوسط للحد من تألق ذاتي وتجنب جزيئات أساسية عن شريحة المجهر. بدلا من ذلك، وسيلة تحديدا الغنية بالمغذيات ويمكن استخدام 10.
- سلسلة انتصارات E. كولاي سلالة AB1157 بولا-PAmCherry من الأسهم المجمدة الجلسرين على مرق لوريا (LB) لوحة الاغاروز مع المضادات الحيوية الانتقائية (هنا، 25 ميكروغرام / مل الكاناميسين)، واحتضان عند 37 درجة مئوية خلال الليل.
- تطعيم ثقافة 5 مل من LB مستعمرة وحيدة الخلية وينمو بمعدل 37 درجة مئوية اهتزاز في 220 دورة في الدقيقة لمدة 3 ساعة.
- تمييع الثقافة 1:10،000 في 5 مل الحد الأدنى من المتوسط (M9 المتوسطة، والأحماض الأمينية MEM + البرولين والفيتامينات MEM، 0.2٪ الجلسرين)، واحتضان عند 37 درجة مئوية اهتزاز في 220 دورة في الدقيقة ليلة وضحاها.
- في صباح اليوم التالي، وقياس الكثافة الضوئية (OD) باستخدام مقياس الطيف الضوئي وتمييع الثقافة في 5 مل الحد الأدنى من المتوسط الطازجة لOD 0.025. تنمو لمدة 2 ساعة على 37 درجة مئوية اهتزاز في 220 دورة في الدقيقة إلى أوائل المرحلة الأسي (OD 0.1).
- التركيز 1 مل من الخلايا في أنبوب microcentrifuge 1.5 مل بواسطة الطرد المركزي في 2300 x ج لمدة 5 دقائق. إزالة طاف و resuspend بيليه خلية في 20 ميكرولتر المتوسطة المتبقية ودوامة.
2. المجهر الشريحة Preparatأيون
- إعداد 1.5٪ انخفاض في مضان الحل الاغاروز في DH 2 O. استخدام الميكروويف لإذابة الاغاروز حتى الحل واضح. مزيج 500 ميكرولتر من الحل الاغاروز ذاب مع 500 ميكرولتر من 2X الحد الأدنى من المتوسط من قبل pipetting بلطف صعودا وهبوطا عدة مرات.
- نشر الحل الاغاروز بالتساوي على مركز ساترة المجهر (لا سمك 1.5). هذا الذي ينبغي القيام به بسرعة قبل يبرد الاغاروز، وتجنب الفقاعات.
- تتسطح لوحة مع ساترة الثاني (لا يوجد سمك 1.5). لإزالة جزيئات الفلورسنت الخلفية، تم coverslips أحرق سابقا في فرن على 500 درجة مئوية لمدة 1 ساعة. ويمكن تخزين coverslips أحرق لعدة أسابيع في درجة حرارة الغرفة مغطاة في رقائق الألومنيوم.
- للتجارب الحمض النووي من التلف، وإعداد وسادة تحتوي على 100 ملي الاغاروز MMS. اتبع الإجراء في الخطوات 2،1-2،3، ولكن إضافة 8.3 ميكرولتر MMS إلى 500 ميكرولتر من M9 المتوسطة قبل الاختلاط مع 500 ميكرولتر من 1.5٪ الاغاروز ذاب، لتركيز النهائي من 100 ملي MMS. (Caution! MMS سامة والتشوهات الخلقية ويجب التعامل معها قفازات وقناع، نظارات واقية، ومعطف المختبر).
- إزالة الشريحة الأعلى من لوحة وإضافة 1 ميكرولتر من تعليق خلية مركزة على لوحة. لشل حركة الخلايا من خلال تغطية لوحة مع ساترة غير المستخدمة حرق (لا سمك 1.5، مطابقة للمواصفات الهدف المجهر) وعن طريق الضغط بلطف شديد على الشريحة. وينبغي تصوير الخلايا خلال 45 دقيقة من الشلل قبل أن يجف وحة agarose. لمنع جفاف خلال التجارب أطول، ومنصات الاغاروز يمكن أن تكون مختومة باستخدام حشوات السيليكون.
- للتجارب الحمض النووي الضرر، واحتضان خلايا يجمد على لوحة تحتوي على 100 ملي الاغاروز MMS لمدة 20 دقيقة في وعاء مرطب في درجة حرارة الغرفة قبل التصوير.
3. إعداد المجهر الحصول على البيانات
يعتمد النخيل على كشف وتوطين دقيقة من البروتينات الفلورية واحد. حساسية والمواءمة الأمثل للالمجهر هو أمر حاسم لجودة البيانات. المجاهر مضان واحدة جزيء عادة توظف التأمل إجمالي الداخلية (TIR) إضاءة لتعزيز نسبة الإشارة إلى الضوضاء التي كتبها fluorophores فقط مثيرة داخل قسم رقيقة فوق سطح ساترة. هنا، والتصوير داخل E. يتطلب القولونية عالية الإضاءة يميل 11، وهو ما يمكن تحقيقه على المجهر TIRF من خلال خفض طفيف في زاوية ضوء الإثارة. يتطلب التصوير PAmCherry مزيد من 405 نانومتر ليزر تنشيط ضوئي و561 نانومتر الإثارة الليزر. يتم تسجيل الانبعاثات مضان على الإلكترون ضرب اتفاقية مكافحة التصحر (EMCCD) الكاميرا في التكبير مما أدى إلى طول بكسل 114.5 نانومتر / بكسل. لأفضل دقة الترجمة، وينبغي أن حجم بكسل تتطابق تقريبا عرض الانحراف المعياري من قوات الأمن الفلسطينية لضمان أخذ العينات كافية دون نشر إشارة على عدد كبير جدا من بكسل. الشكل 3 يبين التخطيطي من الحد الأدنى من الإعداد النخيل. فيلم 1يعطي انطباعا عملية بناء المجهر مفصل، انظر أبهوف وآخرون 7 للحصول على وصف مفصل للأداة.
- أداء محاذاة المجهر الروتينية. قياس نانومتر 405 و 561 نانومتر ليزر شدة موجة مستمرة أمام الهدف. ضبط كثافة 561 نانومتر إلى 3.5 ميغاواط (~ 400 واط / سم 2) و 405 نانومتر إلى 10 كثافة μW (~ 1 واط / سم 2). استخدام محايدة الكثافة عجلة تصفية متغير باستمرار أن يسمح التعديل التدريجي من 405 نانومتر كثافة 0-10 μW. إيقاف تشغيل إضاءة ليزر حتى بداية التجربة.
- ضع العينة على مرحلة المجهر وجعل الخلايا في التركيز في وضع المنقولة المجهر الضوئي (الشكل 4A). كسب الكاميرا EMCCD أن يكون مغلقا لمنع تلف الكاميرا عن التعرض المفرط.
- تحديد مجال الرؤية اقتصاص لتقليل حجم البيانات وزيادة كاميرا قراءة العداد السرعة.
- تغطية عينة من الضوء المحيط وSWITالفصل على كسب EMCCD الكاميرا.
- تعيين معدل الإطار إلى 15.26 مللي ثانية / الإطار (بما في ذلك 0.26 ميللي ثانية كاميرا الوقت قراءات). راجع "زمن التعرض والإثارة شدة" في قسم النقاش.
- عرض البيانات كاميرا للتحقق من إشارة خلفية داكنة (الشكل 4B).
- التبديل على الليزر 561 نانومتر والتحقق من إشارة الخلفية الإثارة (الشكل 4C).
- التبديل على الليزر 405 نانومتر لتنشيط ضوئي من البروتينات الانصهار Pol1-PAmCherry وزيادة كثافة حتى تظهر PSFS مضان.
- ضبط زاوية شعاع الإثارة لإلقاء الضوء فقط قسم رقيقة من العينة على مقربة من سطح ساترة.
- تحقيقا لهذه الغاية، وتركز شعاع الليزر في المستوى البؤري الخلفي من 1.4 الهدف 100X NA (الشكل 3). ترجمة عدسة التركيز عمودي على شعاع يتحرك التركيز بعيدا عن مركز الهدف مما تسبب في شعاع للخروج من تحت زاوية الهدف.
- منظمة العفو الدوليةم لتحقيق أقصى قدر من كثافة مضان وتقليل إشارة الخلفية. لاحظ أن النقل البري الدولي الإثارة صارمة هو الأمثل لfluorophores الصورة داخل 100 نيوتن متر من سطح ساترة، ومع ذلك، والتصوير البروتينات الحمض النووي ملزم المرتبطة E. القولونية نوواني يتطلب إضاءة أعمق ما يصل إلى 0.8 ميكرون.
4. الحصول على البيانات
هنا، نحن تصف بروتوكول عام لاقتناء فيلم النخيل. وينطبق الإجراء نفسه لتصوير Pol1-PAmCherry البروتينات الانصهار في التالفة E. القولونية الخلايا وتحت العلاج المستمر الحمض النووي من التلف مع MMS. وتطبيق طريقة لالبروتينات الانصهار من مختلف الوزن الجزيئي أو نسخة رقم لكل خلية تتطلب إعدادات اقتناء مختلفة (انظر القسم مناقشة).
- العثور على حقل جديد للعرض (فوف) من الخلايا في وضع المجهر الضوئي المنقولة وتركيز الصورة. أخذ لقطة كاميرا لتسجيل (4A الشكل) الخطوط العريضة الخلية.
- تغطية عينة من الضوء المحيط والتبديل على كسب EMCCD الكاميرا.
- التبديل على الليزر 561 نانومتر، وتبييض تألق ذاتي الخلوية والمواقع الخلفية على ساترة لبضع ثوان قبل البدء في الحصول على البيانات. لخلايا نمت وتصويرها في M9 المتوسطة وحرق باستخدام coverslips عادة ما يكون هناك خلفية مضان قليلا جدا، ولكن يمكن أن تكون مفيدة لتصوير prebleaching الخلايا في وسط النمو الغنية مثل LB. نلاحظ أن الإضاءة الشديدة سامة بالنسبة للخلايا بحيث prebleaching يجب أن تبقى إلى أدنى حد ممكن.
- بدء اقتناء فيلم النخيل تحت المستمر 561 نانومتر الإثارة في 15.26 مللي ثانية / الإطار.
- التبديل على الليزر 405 نانومتر، وزيادة تدريجية في شدة على مدار الفيلم، تصل إلى 1 واط / سم 2. تجنب ارتفاع 405 نانومتر شدة التي تسبب تألق ذاتي الخلوية. إيلاء الاهتمام لكثافة جزيئات الفلورسنت - من المهم للحفاظ على معدلات منخفضة تفعيل بحيث PSFS بشكل واضحمعزولة في كل إطار (أرقام 4D-F).
- تسجيل 10،000 لقطة / فيلم (اعتمادا على عدد من الجزيئات ليمكن تصوير لكل خلية)؛ فيلم واحد وعادة ما يستغرق 2-3 دقيقة ويتطلب 0.5-1 غيغابايت من مساحة القرص الثابت اعتمادا على حجم من مجال الرؤية.
- كرر الإجراء اقتناء لعدة فوف. لاحظ أن كل فوف لا يمكن تصويرها مرة واحدة لأن fluorophores PAmCherry الحصول photoactivated والمبيضة لا رجعة فيه.
5. تحليل البيانات
إطار تحليل البيانات الآلي وقوية أمر ضروري لأداء وكفاءة الأسلوب. نستخدم برامج مخصصة مكتوب في MATLAB.
- إجراء تحليل التعريب باستخدام خوارزميات الموصوفة في كروكر وآخرون 12، هولدن وآخرون 13، HoldenI وآخرون 14، ويزر وآخرون. يتم تحديد 15 PSFS الأول في الفرقة تمرير صورة تصفيتها باستخدام نواة جاوس مع 7 بكسلق القطر (الشكل 5A). مواقف المرشح تتوافق مع PSFS مع شدة ذروة بكسل أعلاه 4.5 أضعاف الانحراف المعياري للإشارة الخلفية (الشكل 5B). ومحليا ألمع بكسل لكل PSF مرشح بمثابة تخمين الأولية لتركيب وظيفة جاوس بيضاوي الشكل (الشكل 5C). المعلمات تناسب الحرة هي: X-الموقف، ص الموقف، X-العرض، ص العرض، زاوية دوران، والسعة، والخلفية الإزاحة. حسابات قناع التمويه بيضاوي الشكل لجزيء أثناء وقت التعرض، والذي يطمس ويشوه قوات الأمن الفلسطينية.
- رسم الناتجة (س، ص) تعريب من جميع الأطر من الفيلم النخيل على صورة المجهر الضوئي المنقولة من نفس فوف. يجب أن تظهر من تعريب Pol1-PAmCherry ضمن المنطقة الوسطى من E. الخلايا القولونية (الشكل 6A). إذا يبدو أن العديد من تعريب خارج الخلايا، تم تعيين عتبة توطين منخفضة جدا أو العينة الواردة خلفية الجزيئات الفلورسنت.
- لتحليل تتبع الآلي، وتنفيذ MATLAB من الخوارزمية الموضحة في كروكر وآخرون 12 يمكن استخدامها (انظر "التحليل إنتشار" في قسم النقاش). المواقف التي تظهر في لقطة لاحقة ضمن إطار تتبع المعرفة هي متصلة لتشكيل مسار. في حالة أن تعريب متعددة تحدث في نفس الإطار، يتم تعيين المسارات فريد عن طريق التقليل من مجموع أطوال الخطوة. للاطلاع على مناقشة مفصلة للاعتبارات المختلفة عند حساب معاملات نشر من بيانات تتبع واحد الجسيمات، انظر 15 ويزر وآخرون.
- يستخدم خوارزمية معلمة الذاكرة لحساب امض عابرة أو تعريب غاب خلال المسار. هنا، ونحن تعيين المعلمة الذاكرة إلى 1 الإطار، ويمكن أن تستخدم القيم العليا لتتبع fluorophores مع الدول مظلمة طويلة الأمد.
- اختيار نافذة تتبع مناسبة استنادا إلى الخطوات التالية المعايرة. لPol1، ونحن نستخدم 0.57 ميكرون (5 بكسل).
- تشغيل خوارزمية تتبع لمجموعة من المعلمات تتبع النافذة. حساب عدد من المسارات قياس لكل خلية بوصفها وظيفة من تتبع نافذة للتعرف على أصغر ممكن النافذة التي لا تتبع تقسيم المسارات (الشكل 6B).
- رسم الناتجة عن المسارات على الصورة المجهر الضوئي المنقولة من نفس فوف لتصور التوزيع المكاني للحركة جزيء داخل الخلايا. يجب المسارات Pol1 عرض نشر محصورة داخل الخلايا واحد (أرقام 6C-D).
- إذا كان جزء من المسارات ويبدو أن عبور بين خلايا هذا يشير إلى أن جزيئات منفصلة مرتبطة خطأ لأن إطار تتبع اختير كبيرة جدا و / أو كان معدل تنشيط ضوئي عالية جدا (الشكل 6E).
- رسم التوزيع التراكمي للأطوال خطوة بين تعريب التوالي (الشكل 6F). يرتفع منحنى التشبع وبسلاسة للنوافذ تتبع كبيرة بما فيه الكفايةولكن يظهر حافة قطع إذا تم اختيار نافذة صغيرة جدا.
- لتحليل خصائص نشر Pol1، حساب، يعني تشريد التربيعية (MSD) بين تعريب التوالي لكل مسار مع مجموعه من الخطوات N):
MSD = 1 / (N-1) Σ ط = 1 N-1 (خ ط +1 - خ ط) 2 + (ص +1 ط - ط ذ) 2.
وتشمل المسارات فقط مع لا يقل عن 4 خطوات (N ≥ 5 تعريب) للحد من عدم اليقين في القيم الإحصائية MSD. - رسم منحنى القيم MSD على نطاق المرات تأخر عن طريق حساب تشريد أكثر من إطارات متعددة (الشكل 6G). شكل منحنى MSD يمكن أن تساعد على تصنيف الحركة الجزيئية المرصودة (الشكل 6H).
- حساب معامل الانتشار D واضح * لكل مسار من MSD:
= D * MSD / (4 Δt) - الموضع σ 2 / Δt.
ر الثانيإدارة مخاطر المؤسسات يصحح الخطأ توطين المقدرة (هنا، σ = 40 نانومتر الموضع وΔt = 15.26 ميللي ثانية، انظر 15 ويزر وآخرون). - رسم بياني لD * القيم المقاسة من جميع المسارات في (7A الشكل) فوف.
- تحديد جزيئات Pol1 الفردية التي تظهر منضمة إلى كروموسوم على أساس قياس D * قيمة لكل مسار. فصل سكان المربوطة (توزيع حادة تركزت في D * ~ 0 ميكرومتر 2 / ثانية) والجزيئات نشرها بحرية (توسيط توزيع واسعة في D * ~ 0.9 ميكرومتر 2 / ثانية) عن طريق تحديد عتبة D * <0.15 ميكرومتر 2 / ثانية ( الحانات الحمراء في أرقام 7A و 7D).
- تنفيذ التعريب، وتتبع، وتحليل للنشر في الخلايا التالفة Pol1 (أرقام 7A-C) والخلايا تحت العلاج تلف الحمض النووي مع MMS (أرقام 7D-E). جزء من المسارات المربوطة يوفر مقياس كمي المباشر للDNوهناك نشاط إصلاح Pol1 في الجسم الحي.
النتائج
ويتضح مفهوم photoactivated واحدة جزيء تتبع لدراسة التفاعلات الحمض النووي البروتين في الجسم الحي في الشكل 1. تم الكشف عن PAmCherry البروتينات الانصهار في حي E. الخلايا القولونية بطريقة متسلسلة حسب photoactivating الجزيئات واحدة عشوائيا مع 405 نانومتر ضوء على تردد جزيء أقل من واحد لكل خلية في كل مرة. يتم تصوير جزيئات المنشط تحت المستمر 561 نانومتر الإثارة. يمكن تتبع حركة الجزيئية في الخلية من خلال ربط تعريب قريب في سلسلة من الإطارات حتى photobleaching من لا رجعة فيه. لأنه تباطأ انتشار البروتينات الحمض النووي ملزم ملزم على الكروموسوم، ومعامل الانتشار الواضح D * تم الحصول عليها لكل مسار تقارير مباشرة على الفرد التفاعلات الحمض النووي البروتين.
يوضح الشكل 2 تنشيط ضوئي من Pol1-PAmCherry البروتينات الانصهار في حي E. الخلايا القولونية. تأثير كثافة 405 نانومتر سن يمكن أن ينظر إلى كثافة جزيئات الفلورسنت في الشكل 4. لاحظ أنه لا يتم تحديد كثافة فقط من كثافة 405 نانومتر ولكن بالإضافة إلى ذلك من قبل عدد من الجزيئات التي تتوفر لتفعيل؛ يتم استنفاد تجمع من جزيئات المتبقية على مدار فيلم النخيل.
يتم إجراء تحليل التعريب لكل إطار من الفيلم النخيل كما هو موضح في الشكل 5. قمنا بقياس دقة الترجمة باستخدام جزيئات قادرة على الحركة في الخلايا أو الجزيئات ثابتة ملزمة في الخلايا الحية. أعطى إعدادات تملكنا دقة توطين σ الموضع = 40 نانومتر، وذلك بالاتفاق مع التنبؤ النظري 3.
مما أدى إلى تعريب Pol1 تحتل المنطقة الوسطى من الخلية (الشكل 6A)، تلخص على نطاق واسع في التنظيم المكاني للE. القولونية نوواني 7. غالبية Pol1 المسارات في الخلايا التالفة عرض المتنوعةالانصهار كما هو مبين في الشكل 6C. خلية نموذجي يحتوي على عدة مئات من المسارات Pol1 (الشكل 6D)، بما يتفق مع عدد نسخة من حوالي 400 جزيئات في Pol1 E. القولونية الخلية 1 أرقام 6B و 6E-F توفير التوجيه بشأن اختيار مناسبة المعلمة نافذة تتبع - إذا كان إطار تتبع كبير جدا، هم أكثر عرضة لتصبح مرتبطة بشكل خاطئ إلى مسار جزيئات مختلفة، وإذا كان إطار تتبع صغير جدا، والمسارات مع الخطوات تعد وسيتم تقسيم. منحنى MSD لPol1 يرتفع خطيا للمرة تأخر قصيرة والتشبع في بعض الأحيان تأخر وقتا أطول بسبب زنزانة حبس (الشكل 6G). يمكن التعرف على أنواع مختلفة من الحركة الجزيئية عن طريق تحليل MSD. الحركة الموجهة يعطي منحنى مكافئ؛ يتميز الحركة البراونية من خلال خط مستقيم، ومنحنى الانتشار يقتصر تصل إلى الهضبة؛ إزاحة منحنى MSD للجسيمات قادرة على الحركة يمثل لترعدم اليقين ocalization (الشكل 6H). معلومات إضافية عن واحد الجسيمات تتبع واستكشاف الأخطاء وإصلاحها نصائح يمكن العثور عليها في أرنولد وآخرون 16
طبقنا سابقا طريقة لقياس النشاط الحمض النووي إصلاح Pol1 ردا على الخارجية الضرر ألكلة الحمض النووي 7. وD * الرسم البياني للPol1 المسارات في الخلايا التالفة يظهر السكان المهيمن نشرها جزيئات (أرقام 7A-C). جزء صغير من 2.7٪ جزيئات Pol1 المربوطة المرجح تشارك في النسخ المتماثل حبلا المتخلفة وإصلاح الحمض النووي من التلف الذاتية. تحت المستمر الضرر 100 ملي MMS، سكان المسارات مع D * ~ 0 ميكرون الزيادات 2 / ثانية إلى 13.8٪ (الشكل 7D). وتمثل هذه المسارات جزيئات Pol1 الأفراد الذين يؤدون إصلاح الحمض النووي التوليف لملء الفجوات واحد النوكليوتيدات كجزء من مسار إصلاح قاعدة الختان. مواقف المسارات المربوطة تظهر مواقع الفرديةالحمض النووي من التلف ومواقع الإصلاح (الشكل 7E-F).
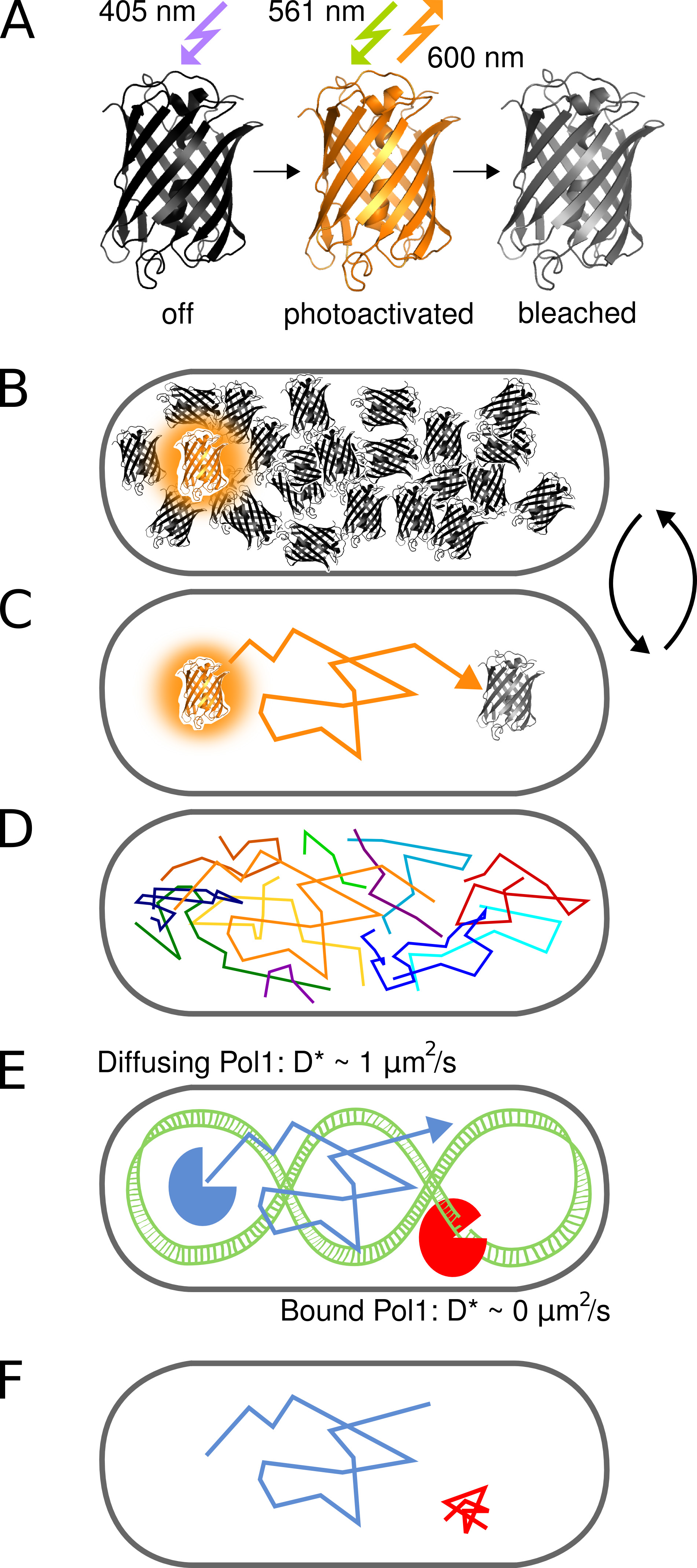
الشكل 1. تمثيل رسومي للأسلوب. (A) والبروتين PAmCherry الفلورسنت يمكن photoactivated من دولة nonfluorescent الأولي عند التعرض للضوء 405 نانومتر. الدولة مشرق هو متحمس في 561 نانومتر، وتنبعث مضان حوالي 600 نانومتر حتى التبييض fluorophore لا رجعة فيه. (ب) التحكم في معدل تنشيط ضوئي يسمح التصوير فقط واحدة عشوائيا تنشيط البروتين PAmCherry الانصهار لكل خلية في أي وقت في حين أن مجموعة كبيرة تعسفا من الجزيئات التي لم يتم تفعيلها أو تم بالفعل ابيض بقايا في حالة الظلام. (C) يتم تحديد الموقف من جزيء نيون من مركز قوات الأمن الفلسطينية المعزولة و TRacked لعدة إطارات حتى photobleaching من. وتسجل (D) المسارات من العديد من الجزيئات بطريقة متسلسلة. (EF) تفاعل بروتين ملزمة الحمض النووي مع تسلسل الهدف الكروموسومات أو هيكل توقف حركة ناشر عشوائي. تتميز جزيئات منضم وغير منضم من قبل معامل الانتشار الواضح D * المستخرجة من المسارات واحد. الكسر الناتج عن الجزيئات المربوطة يعطي مقياس كمي لنشاط بروتين ملزمة الحمض النووي في الجسم الحي. اضغط هنا لمشاهدة صورة أكبر.
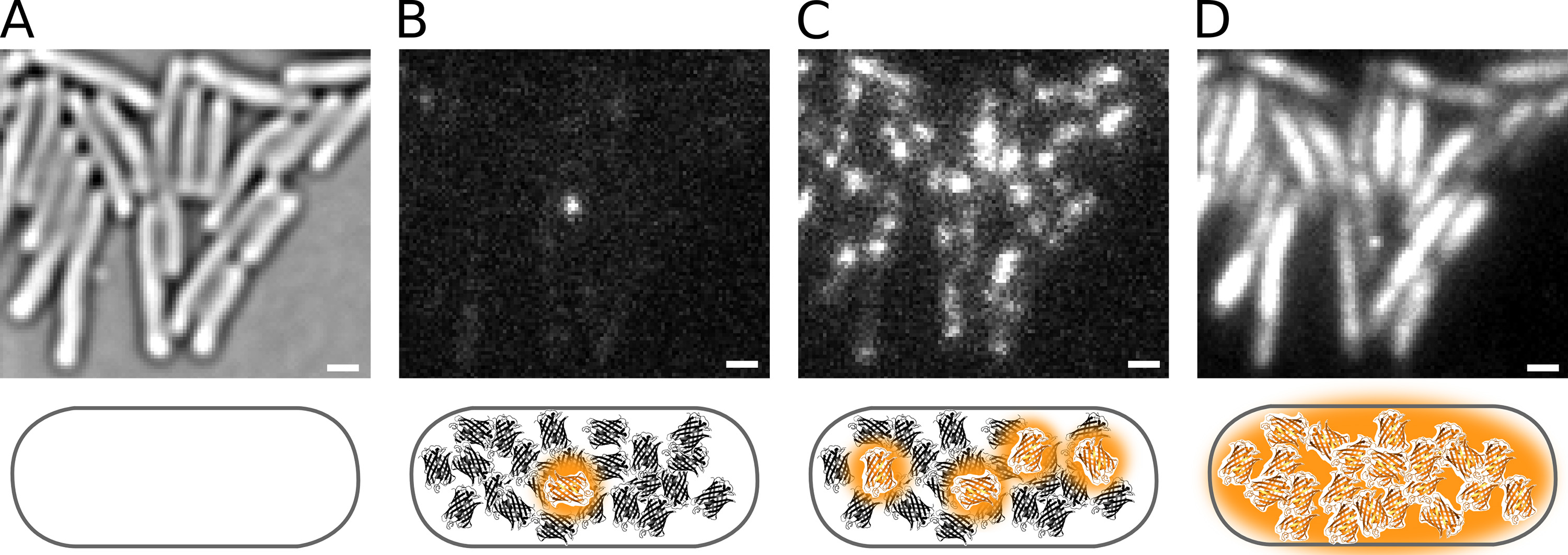
الشكل 2. تنشيط ضوئي من Pol1-PAmCherry في حي E. الخلايا القولونية. أشرطة النطاق: 1 ميكرون. يتم عرض الخطط تحت كل لوحة. ( أ) المنقولة صورة المجهر الضوئي من الخلايا ثبتوا على وسادة الاغاروز. (B) Phototactivating على fluorophore PAmCherry واحد في خلية واحدة. (C) وارتفاع معدل تنشيط ضوئي يزيد من عدد الجزيئات الفلورسنت. (D) PAmCherry المتكاملة مضان من فيلم النخيل. اضغط هنا لمشاهدة صورة أكبر.
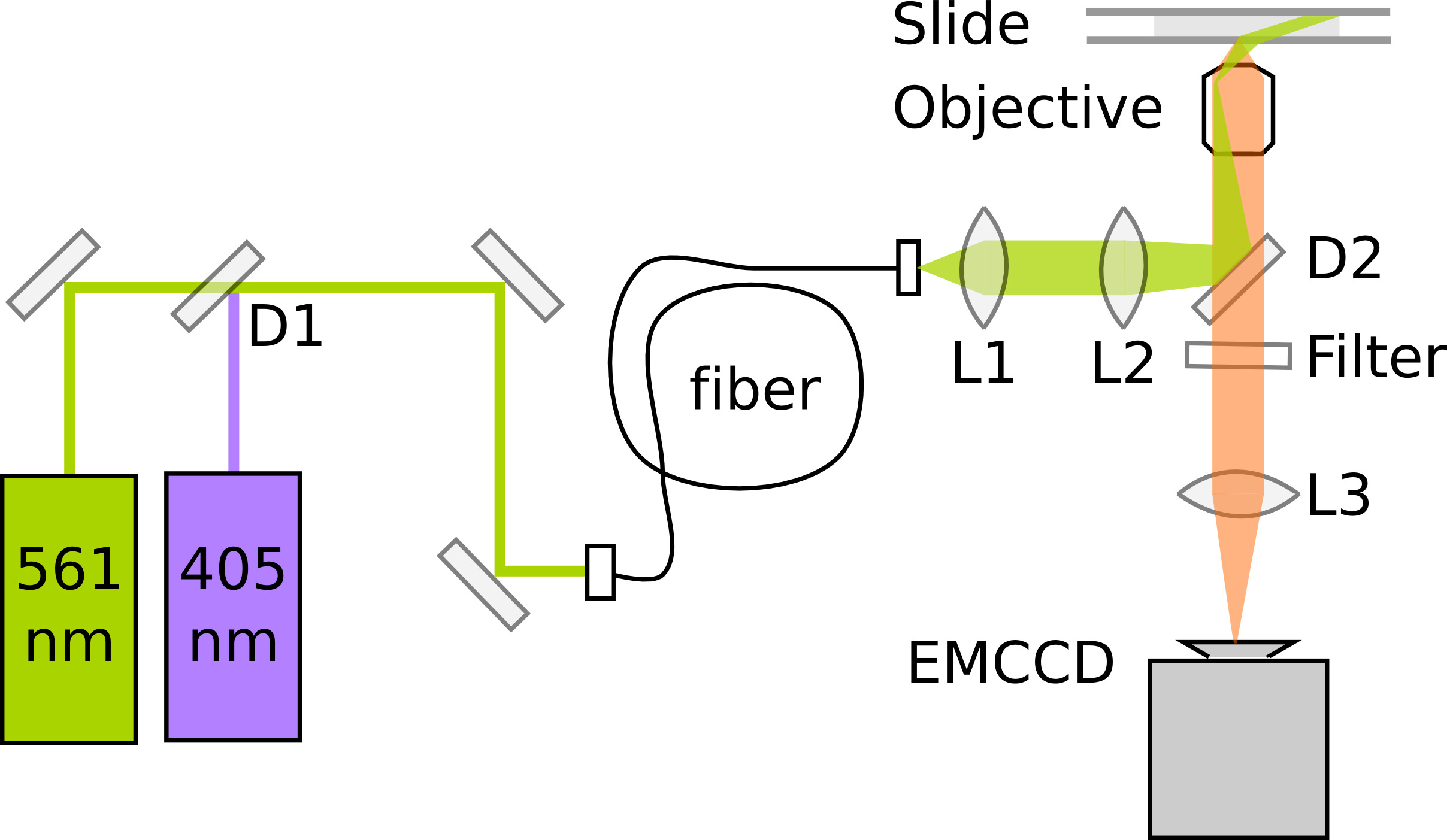
الرقم 3. التخطيطي من الحد الأدنى من الإعداد لPALM photoactivating وPAmCherry التصوير الانصهار البروتينات D1: مرآة مزدوج اللون (على سبيل المثال 550 نانومتر تمريرة طويلة). D2: مرآة مزدوج اللون (على سبيل المثال 570 نانومتر تمريرة طويلة). L1: عدسة الموازاة. L2: عدسة النقل البري الدولي. L3: عدسة أنبوب.1177/51177fig3highres.jpg "الهدف =" _blank "> اضغط هنا لمشاهدة صورة أكبر.

الشكل 4. صور ممثل عن فيلم النخيل مع 15.26 مللي ثانية / الإطار أشرطة النطاق: 1 ميكرون. (A) الصورة المنقولة ضوء الخلايا يجمد على وسادة الاغاروز. (ب) صورة خلفية الظلام يقاس على الكاميرا EMCCD مع الليزر مغلقا. (C) صورة خلفية الإثارة في ظل استمرار الإثارة 561 نانومتر قبل تنشيط ضوئي. (DF) زيادة كثافة 405 نانومتر يؤدي إلى ارتفاع معدلات تنشيط ضوئي من PAmCherry، تصوير تحت المستمر 561 نانومتر الإثارة. وتظهر المناطق محاصر تضخيم أدناه. (D) قليلة 405 نانومتر شدة (<1 μW) نشاطا عدد قليل جدا من جزيئات الفلورسنت في مجال الرؤية. (E) متوسطة 405النتائج كثافة نانومتر (~ 2 μW) تنشيط ضوئي في كثافة PSF جيدة لتوطين وتحليل تتبع. (F) العالي الكثافة 405 نانومتر (~ 10 μW) ينشط أكثر من جزيء نيون في بعض الخلايا، مما يحجب التعريب وتحليل تتبع. اضغط هنا لمشاهدة صورة أكبر.

الرقم 5. التوضيح التحليل التعريب. أشرطة النطاق: 1 ميكرومتر (A) الفرقة تمرير تصفية يزيل الضوضاء بكسل زائفة ويسطح التدرجات كثافة عبر مجال الرؤية. (ب) يتم تحديد PSFS المرشح في الصورة التي تمت تصفيتها استنادا إلى عتبة المعرفة من قبل المستخدم التي يتم اختيارها لتقليل المكتشفة الإيجابية الكاذبة والسلبية الكاذبة. وthreshoدينار يتوافق مع الحد الأدنى للكثافة بكسل مرشح مقسوما على خلفية انحراف معياري (نسبة الإشارة إلى الضوضاء، SNR). (C) ومحليا ألمع بكسل الذي يمر يخدم عتبة كما تخمين توطين الأولية (عبر البرتقال) لصالح جاوس بيضاوي الشكل ثنائي الأبعاد. أشرطة النطاق: 0.5 ميكرون. فائقة الدقة الناتجة التعريب (الصليب الأزرق) يبلغ متوسط دقة σ الموضع = 40 نانومتر. اضغط هنا لمشاهدة صورة أكبر.
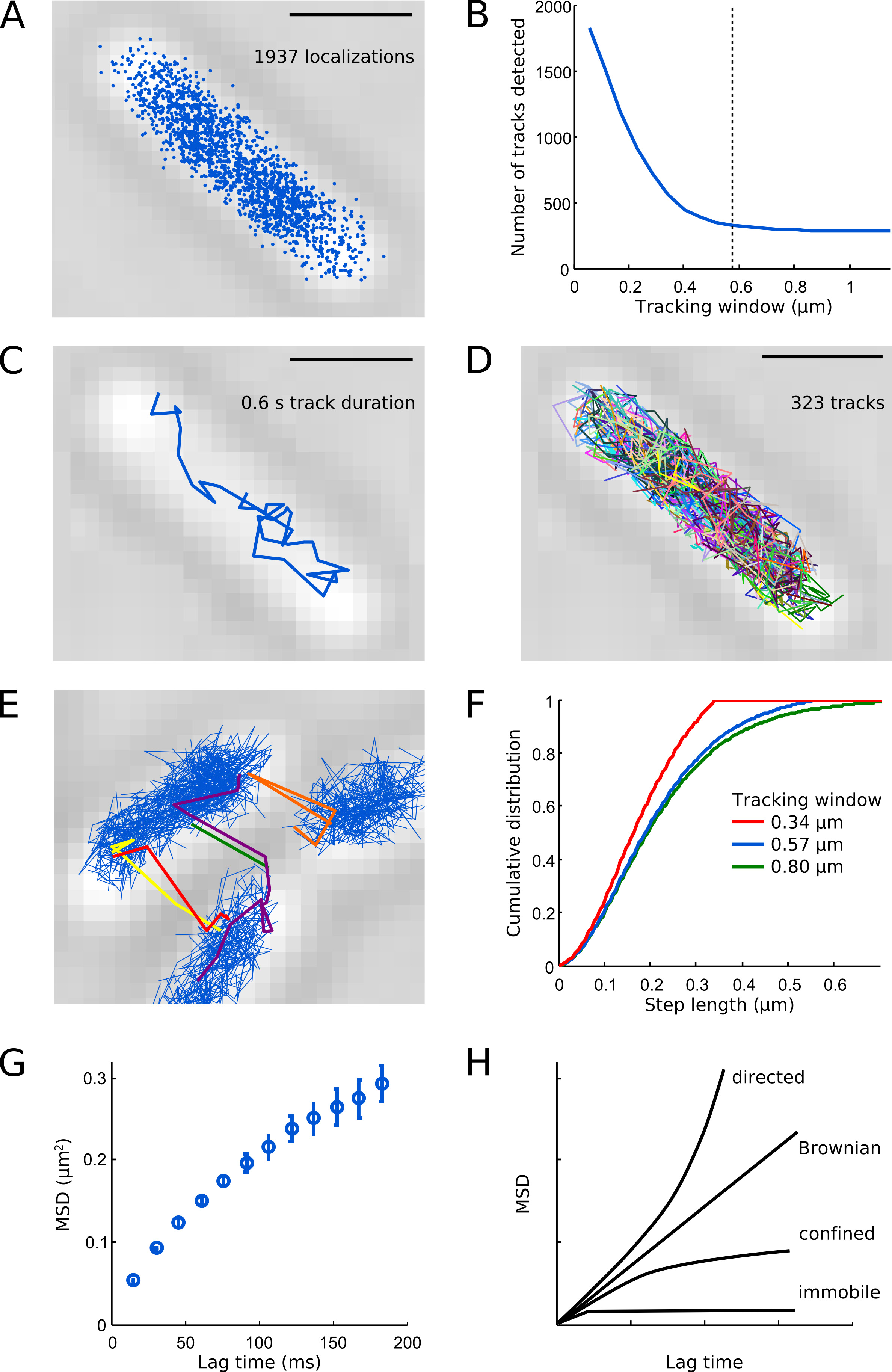
. الرقم 6 توضيحات من التحليل تتبع أشرطة النطاق: 1 ميكرون. (أ) جميع تعريب الكشف من Pol1-PAmCherry في زنزانة سبيل المثال. (ب) عدد من المسارات كشفإد في الخلية سبيل المثال بوصفها وظيفة من النافذة تتبع. نوافذ صغيرة تتبع مسارات تقسيم الجزيء، الأمر الذي يؤدي إلى مصطنعة عدد كبير من المسارات. خط متقطع يدل خيارنا للمعلمة نافذة تتبع (0.57 ميكرون، 5 بكسل) - وهذا يعطي حلا وسطا جيدا بين الكشف عن التوزيع الكامل من الخطوات والحفاظ على مسارات مختلفة من الجزيئات سليمة. (C) المسار مثال واحد جزيء Pol1-PAmCherry. (D) جميع المسارات قياس هو مبين في ألوان عشوائية. (E) التحف تتبع إذا ما تم اختيار إطار تتبع كبيرة جدا (0.8 ميكرومتر هنا، 7 بكسل) أو كثافة PSFS في الإطار مرتفع جدا. (F) توزيعات تراكمية من أطوال خطوة للنوافذ تتبع: 0.34 ميكرومتر (3 بكسل، خط أحمر)، 0.57 ميكرون (5 بكسل، الخط الأزرق)، و 0.80 ميكرون (7 بكسل، الخط الأخضر). لاحظ أن الإطار تتبع 0.34 ميكرون يقطع خطوات أطول من 0.34 ميكرون التي من الواضحباقتطاع التوزيع الكامل من الخطوات. بالكشف عن إطار تتبع 0.57 ميكرون تقريبا نفس التوزيع من الخطوات كما يفعل نافذة تتبع 0.80 ميكرون. منحنى (G) MSD يظهر نشر تقتصر من Pol1. منحنيات (H) تخطيطي للMSD الحركة الموجهة والحركة البراونية، نشر المحصورة، والجزيئات قادرة على الحركة. اضغط هنا لمشاهدة صورة أكبر.
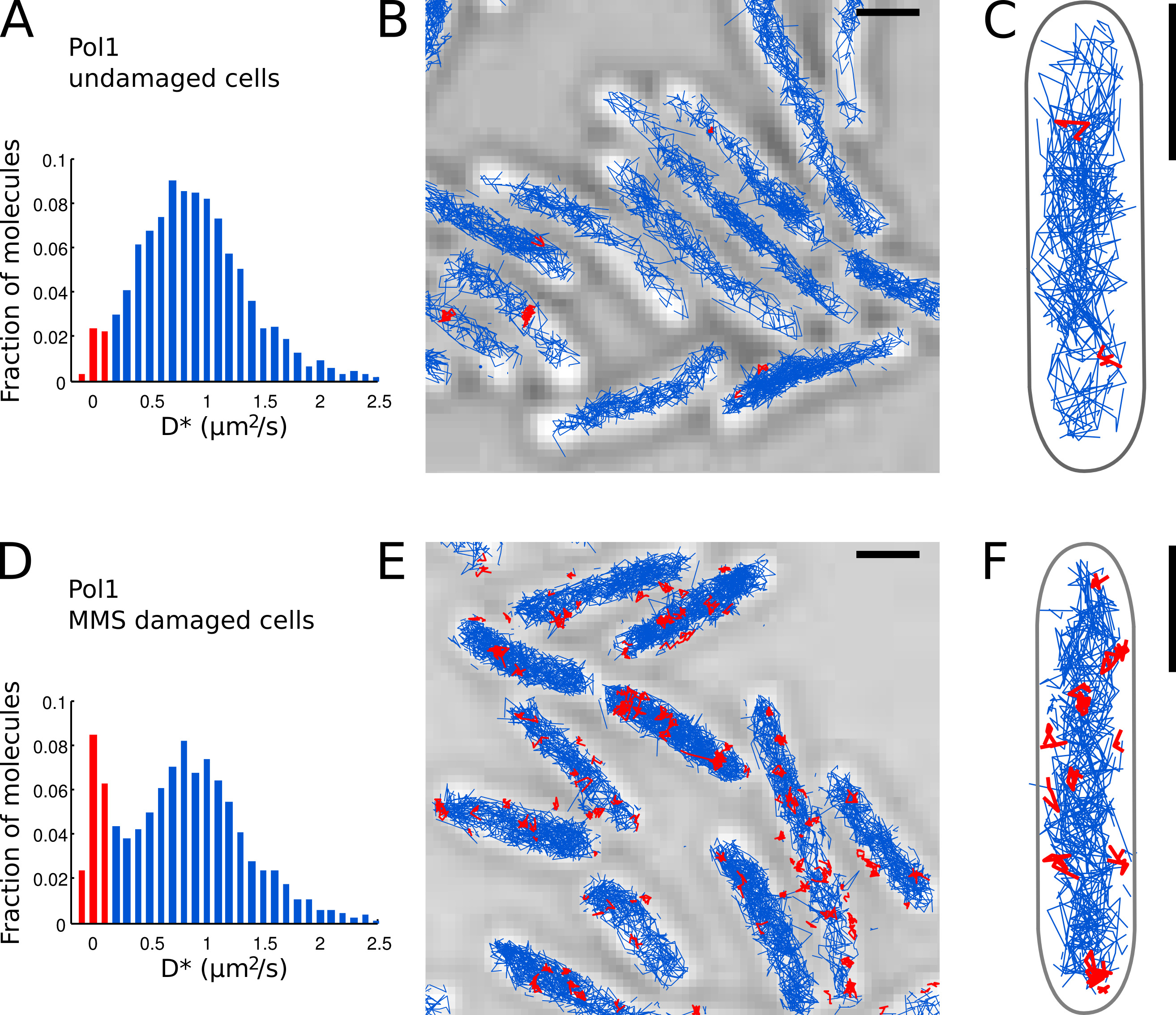
الرقم 7. القياس المباشر للنشاط إصلاح الحمض النووي من Pol1 في حي E. القولونية الخلايا أشرطة النطاق: 1 ميكرون. (A) من الرسم البياني الظاهر معامل الانتشار D * لجميع المسارات من 4 أو أكثر من الخطوات في مجال الرؤية من الخلايا التالفة (N = 4،162 المسارات). سكان الجزيئات المصنفة ب س اوند يتم تمييز باللون الأحمر. وترد (BC) من المسارات Pol1-PAmCherry على صورة المجهر الضوئي المنقولة. يتم عرض المسارات تصنف على أنها ملزمة وفقا لمعامل الانتشار في الحمراء. (D) D * الرسم البياني للقياس المسارات Pol1 في الخلايا ثبتوا على وسادة الاغاروز مع 100 ملي MMS والمحتضنة لمدة 20 دقيقة قبل التصوير (N = 2،128 المسارات). ويرد السكان من جزيئات ملزمة تشارك في إصلاح الحمض النووي في الحمراء. (EF) Pol1-PAmCherry المسارات على الصورة المنقولة المجهر الضوئي تظهر مسارات الأحداث واحدة Pol1 إصلاح الحمض النووي في الحمراء. اضغط هنا لمشاهدة صورة أكبر.

الفيلم 1. بناء الإعداد PALM مفصل.JoVE_Uphoff_Movie1.avi "الهدف =" _blank "> اضغط هنا لمشاهدة الفيديو.
Discussion
نناقش العديد من الاعتبارات الرئيسية لنجاح التجربة.
الاختيار والتعبير عن بروتين فلوري الانصهار: هناك لوحة كبيرة من البروتينات الفلورية photoactivatable وphotoswitchable 17. الخيار محدد يعتمد على خصائص المجهر، وخاصة أجهزة الليزر والفلاتر المتاحة. الجمع بين 405 نانومتر و 561 نانومتر هو المثل الأعلى للالبروتينات الفلورية photoactivatable المشتركة. اخترنا PAmCherry 6 لأنه لم تظهر أي أحادى والتجميع في الخلايا. علاوة على ذلك، لا رجعة فيه تنشيط ضوئي يسمح إحصاء عدد fluorophores تفعيلها لقياس أعداد نسخة البروتين في الخلية. بدلا من التعبير عن البروتين الانصهار من البلازميد، ونحن نفضل الإدراج الكروموسومات من ترميز الجين للبروتين الانصهار في البرية من نوع مكان. وهذا يضمن استبدال كامل للبروتين في المصالح مع الفلورسنت هاءrsion والحفاظ على النوع البري مستوى التعبير.
معدل تنشيط ضوئي: من المهم لضبط معدل تنشيط ضوئي بحيث جزيء في المتوسط أقل من واحد لكل خلية في حالة الفلورسنت في أي إطار من الفيلم. هذا يعتمد على كثافة 405 نانومتر، وغادر عدد من الجزيئات ليتم تفعيلها. بكثافات التصوير منخفضة جدا، ومع ذلك، سيتم تصويرها ليس كل جزيئات قبل نهاية الفيلم أو الأفلام الطويلة جدا لا بد من الحصول عليها. عدد الإطارات المسجلة في الفيلم يعتمد على عدد نسخة من البروتينات الانصهار لكل خلية ومتوسط photobleaching من عمر PAmCherry في ظروف الإثارة المستخدمة. عدد نسخة من Pol1 هو ~ كان 400 الجزيئات / خلية 1 والقيمة المتوسطة للتوزيع الأسي photobleaching من العمر ~ 4 إطارات. عن طريق زيادة كثافة تدريجيا 405 نانومتر، وتوزع بالتساوي على تفعيل الأطر 10،000 من الفيلم. لذلك، كل خلية هو OCCUPالعبوات الناسفة بواسطة جزيئات الفلورسنت لما مجموعه 1،600 ~ الإطارات، وضمان تداخل قليلا من PSFS ومضاعفات تتبع في فيلم من 10،000 الإطارات.
وقت التعرض والإثارة شدة: قبل كل شيء، وأوقات التعرض بحاجة إلى أن تكون قصيرة بما فيه الكفاية لمراقبة PSFS حادة مع الحركة قليلا وضوح. ومع ذلك، ينبغي اختيار معدل الإطار لانتاج الحركة الجزيئية يمكن ملاحظتها بين الإطارات المتعاقبة وراء عدم اليقين التعريب، وإلا تضيع الفوتونات حاسمة من قبل الإفراط المسار. يجب أخذ عينات من حركة الجزيئات غير منضم في فترات زمنية طويلة بما فيه الكفاية لتكون مميزة بوضوح من الحركة واضح من جزيئات ملزمة نظرا لعدم اليقين التعريب. عندما يتم تعيين وقت التعرض، ويجب أن تعدل شدة قوات الأمن الفلسطينية. دقة الترجمة من قوات الأمن الفلسطينية يزيد مع عدد من الفوتونات الكشف خلال مدة إطار. شدة الإثارة أعلى زيادة معدل بو الفوتونر أيضا معدل photobleaching من وإشارة الخلفية. استخدام أقل شدة الإثارة التي تعطي دقة التعريب المطلوب. لPol1-PAmCherry اخترنا 15.26 مللي ثانية / الإطار و 3.5 ميغاواط 561 نانومتر الإثارة (400 واط / سم 2). من المهم لتأكيد بقاء الخلية لظروف التصوير خاصة من خلال رصد نمو الخلايا والتشكل قبل وبعد الحصول على البيانات (انظر معلومات تكميلية في أبهوف وآخرون. 7).
Pol1 يسلك وقت ملزم لل~ 2 ثانية إلى ركيزة الحمض النووي في الجسم الحي شق 7، وبالتالي فإننا نتوقع أن غالبية الجزيئات إما أن يكون في الدولة منضم أو غير منضم لمدة كاملة من مسار. جزيئات ملزمة تظهر متحركة أساسا لمواقع كروموسوم لها معامل الانتشار عدة أوامر من حجم أقل (~ 10 -5 2 ميكرون / ثانية، إلمور وآخرون 18) من Pol1 نشرها في السيتوبلازم (~ 1 ميكرون 2 / ثانية).
تحليل نشر: يتم حساب معامل الانتشار D واضح * من MSD من المسارات الفردية، بمعدل متوسط أعلى من الحد الأدنى من 4 خطوات (5 إطارات) لتقليل الخطأ الإحصائي. نلاحظ أن ~ 75٪ من جزيئات التبييض في غضون اقل من 5 إطارات لظروف التصوير وصفها. هذه المسارات القصيرة لا توفر اليقين إحصائية كافية لتمييز جزيئات منضم وغير منضم. ومع ذلك، فإن الكسور النسبية للجزيئات منضم وغير منضم أن يقدم تقريرا عن نشاط البروتين تكون مستقلة عن عدد من المسارات تحليلها.
ومن المفيد لحساب الخطأ PSF التعريب (σ الموضع) في حساب D * لأن عدم اليقين يضيف خطوة عشوائية واضحة لتوطين كل جزيء 15.
لتحسين تصنيف الجزيئات مقيدة ونشرها، نوصي حساب D * بوتح من التشريد خطوة واحدة وتشريد أكثر من مرة من إطارين. فمن الممكن بعد ذلك إلى تعيين اثنين منفصلة D عتبات *: D * (15 ميللي ثانية) <0.15 ميكرومتر 2 / ثانية وD * (30 ميللي ثانية) <0.075 ميكرون 2 / ثانية.
لاحظ أن D * هو معامل الانتشار الواضح أن يتأثر الحبس خلية من المسارات وعدم وضوح الحركة بسبب نشرها خلال فترة التعرض. لاستخراج دقيق معاملات نشر متحيز، وقد ثبت أنه من المفيد أن نقارن الحركة لاحظ أن البيانات محاكاة بناء على مؤشر ستوكاستيك البراونية نموذج الحركة 5،7. ويمكن أيضا أن تستخدم البيانات محاكاة لاختبار إجراءات تحليل البيانات.
التطبيقات المحتملة لهذه الطريقة: نحن وصف نهج عام لتصور وقياس التفاعلات الحمض النووي البروتين في الجسم الحي بواسطة التغيير في التنقل من البروتين على ملزما للكروموسوم. أنشطة الحمض النووي أوالبروتينات ملزمة الحمض النووي الريبي المشاركة في إصلاح، والنسخ، والنسخ، وصيانة كروموسوم بالتالي يمكن اتباعها في الوقت الحقيقي على مستوى خلية واحدة مع دقة مكانية أقل من الحد الحيود الضوئية. Photoactivated تتبع جزيء واحد يمتد أساليب تتبع التقليدية التي تقتصر على عدد قليل من الجزيئات المسماة لكل خلية. طريقة بديلة الذي يقيس الانتشار الجزيئي في الجسم الحي هو الإسفار الانتعاش بعد photobleaching من (FRAP). في حين FRAP مفيد جدا لقياس خصائص الانتشار العالمي في الخلايا الكبيرة، هي محدودة في قدرتها على حل العديد من الأنواع الجزيئية مع التنقلات المختلفة في بيئة غير متجانسة مكانيا، وخاصة بالنسبة للخلايا البكتيرية الصغيرة.
لقد طبقنا photoactivated واحدة جزيء تتبع لقياس أنشطة الحمض النووي ملزم وتعريب التحت خلوية من مجموعة من البروتينات المختلفة في E. القولونية بما في ذلك Pol1، يغاز DNA والبروتين الجبهة الاسلامية للانقاذ، والحمض النوويالبلمرة الثالث 7، وكذلك الصيانة الهيكلية للبروتينات الكروموسومات MukB، E، F و19. نحن نتوقع ويمكن أيضا طريقة أن تتكيف مع أنواع الخلايا الأخرى.
Disclosures
يعلن الكتاب ليس لديهم مصالح مالية المتنافسة.
Acknowledgements
نحن نعترف جوستين بينكني ويوهانس Hohlbein للمساعدة في بناء المجهر مفصل وشيموس هولدن لتوطين البرمجيات. رودريغو رييس-اموث والشكر لتوفير E. سلالة القولونية. وقد تم تمويل هذا البحث من قبل الأوروبي الإطاري السابع جنة برنامج المنح FP7/2007-2013 HEALTH-F4-2008-201418، UK التكنولوجيا الحيوية والعلوم البيولوجية مجلس البحوث غرانت BB/H01795X/1، ومنحة مجلس البحوث الأوروبي 261227 لANK. وقد تم تمويل DJS بواسطة منحة WT083469 برنامج يلكوم ترست. وأيد SU بواسطة زمالة الدكتوراه ماثووركس.
Materials
| Name | Company | Catalog Number | Comments |
| E. coli strain carrying a chromosomal insertion for a PAmCherry DNA-binding fusion protein | created by Lambda-Red recombination | ||
| MEM amino acids | Invitrogen | 11130-051 | minimal medium supplement |
| MEM vitamins | Invitrogen | 11120-052 | minimal medium supplement |
| Agarose | BioRad | 161-3100 | certified molecular biology grade |
| Microscope coverslips No 1.5 thickness | Menzel | BB024060SC | remove background particles by heating slides in furnace at 500 °C for 1 hr |
| Methyl methanesulfonate (MMS) | Sigma-Aldrich | 129925 | CAUTION: toxic |
| PALM setup | home-built | described in Uphoff et al.7 | |
| MATLAB | MathWorks | for data analysis and visualization | |
| Localization software | custom-written, available online | http://www.physics.ox.ac.uk/Users/kapanidis/Group/Main.Software.html | MATLAB and C++ software package that can be adapted for localization analysis. Cite Holden et al.13 if used in publication. |
| Tracking software | available online | http://physics.georgetown.edu/matlab/ | MATLAB implementation by Blair and Dufresne. Cite Crocker & Grier12 if used in publication. |
References
- Friedberg, E. C. DNA Repair and Mutagenesis. , American Society for Microbiology. Washington, DC. (2006).
- Betzig, E., et al. Imaging intracellular fluorescent proteins at nanometer spatial resolution. Science. 313 (5793), 1642-1645 (2006).
- Mortensen, K. I., Churchman, L. S., Spudich, J. A., Flyvbjerg, H. Optimized localization analysis for single-molecule tracking and super-resolution microscopy. Nat. Methods. 7 (5), 377-381 (2010).
- Manley, S., et al. High-density mapping of single-molecule trajectories with photoactivated localization microscopy. Nat. Methods. 5 (2), 155-157 (2008).
- English, B. P., et al. Single-molecule investigations of the stringent response machinery in living bacterial cells. Proc. Natl. Acad. Sci. U.S.A. 108 (31), (2011).
- Subach, F. V., et al. Photoactivatable mCherry for high-resolution two-color fluorescence microscopy. Nat. Methods. 6 (2), 153-159 (2009).
- Uphoff, S., Reyes-Lamothe, R., Garza de Leon, F., Sherratt, D. J., Kapanidis, A. N. Single-molecule DNA repair in live bacteria. Proc. Natl. Acad. Sci. U.S.A. 110 (20), 8063-8068 (2013).
- Datsenko, K. A., Wanner, B. L. One-step inactivation of chromosomal genes in Escherichia coli K-12 using PCR products. Proc. Natl. Acad. Sci. U.S.A. 97 (12), 6640-6645 (2000).
- Reyes-Lamothe, R., Possoz, C., Danilova, O., Sherratt, D. J. Independent positioning and action of Escherichia coli replisomes in live cells. Cell. 133 (1), 90-102 (2008).
- Neidhardt, F. C., Bloch, P. L., Smith, D. F. Culture medium for enterobacteria. J. Bacteriol. 119 (3), 736-747 (1974).
- Tokunaga, M., Imamoto, N., Sakata-Sogawa, K. Highly inclined thin illumination enables clear single-molecule imaging in cells. Nat. Methods. 5 (2), 159-161 (2008).
- Crocker, J. C., Grier, D. G. Methods of digital video microscopy for colloidal studies. J. Colloid. Interface. Sci. 179 (1), 298-310 (1996).
- Holden, S. J., et al. Defining the limits of single molecule FRET resolution in TIRF microscopy. Biophys. J. 99 (9), 3102-3111 (2010).
- Holden, S. J., Uphoff, S., Kapanidis, A. N. DAOSTORM: an algorithm for high-density super-resolution microscopy. Nat. Methods. 8 (4), 279-280 (2011).
- Wieser, S., Schütz, G. J. Tracking single molecules in the live cell plasma membrane-Do's and Don't's. Methods. 46 (2), 131-140 (2008).
- Arnauld, S., Nicolas, B., Hervé, R., Didier, M. Multiple-target tracing (MTT) algorithm probes molecular dynamics at cell surface. Protoc. Exch. , Available from: http://dx.doi.org/10.1038/nprot.2008.128 (2008).
- Lippincott-Schwartz, J., Patterson, G. H. Photoactivatable fluorescent proteins for diffraction-limited and super-resolution imaging. Trends Cell Biol. (11), 555-565 (2009).
- Elmore, S., Müller, M., Vischer, N., Odijk, T., Woldringh, C. L. Single-particle tracking of oriC-GFP fluorescent spots during chromosome segregation in Escherichia coli. J. Struct. Biol. 151 (3), 275-287 (2005).
- Badrinarayanan, A., Reyes-Lamothe, R., Uphoff, S., Leake, M. C., Sherratt, D. J. In vivo architecture and action of bacterial Structural Maintenance of Chromosome proteins. Science. 338 (6106), 528-531 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved