Method Article
تدفق التصاق الفحص لدراسة توظيف الكرية البيضاء لالكبدي الإنسان جيبية البطانة Endothelium تحت ظروف إجهاد القص
In This Article
Summary
التوظيف الكرية البيضاء إلى الكبد يحدث داخل القنوات المتخصصة من الجيوب الكبدية التي تصطف من قبل الخلايا البطانية الجيبية الكبدي فريدة من نوعها. المرحلة المجهر النقيض من التوظيف عبر الكرية البيضاء البشرية البطانة الجيبية كبدي تحت ظروف إجهاد القص الفسيولوجية يمكن أن يسهل توضيح الآليات الجزيئية التي تكمن وراء هذه العملية.
Abstract
الكرية البيضاء التسلل إلى أنسجة الكبد الإنسان هو عملية مشتركة في جميع أمراض الكبد التهابات الكبار. تسلل مزمن يمكن أن تدفع تطور التليف والتقدم إلى تليف الكبد. يمكن فهم الآليات الجزيئية التي تتوسط التوظيف الكرية البيضاء إلى الكبد تحديد الأهداف العلاجية الهامة لمرض الكبد. التفاعل الرئيسية خلال تجنيد الكرية البيضاء هو أن الخلايا الالتهابية مع البطانة تحت ظروف إجهاد القص. التوظيف في الكبد يحدث داخل قنوات القص منخفضة من الجيوب الكبدية التي تصطف من قبل الخلايا البطانية الجيبية كبدي (HSEC). الظروف داخل الجيوب الكبدية يمكن تلخيصها بواسطة perfusing كريات الدم البيضاء من خلال قنوات مبطنة من قبل الطبقات الوحيدة HSEC الإنسان في معدلات تدفق محددة. في هذه الظروف يخضع كريات الدم البيضاء خطوة الربط قصيرة تليها تفعيل والتصاق شركة، تليها خطوة الزحف والتهجير لاحقة عبر البطانيةالطبقة. باستخدام مجهر تباين الطور، كل خطوة من هذا 'تتالي التصاق' يمكن تصور وسجلت تليها تحليل غير متصل. الخلايا البطانية أو كريات الدم البيضاء يمكن سابقة التجهيز مع مثبطات لتحديد دور جزيئات محددة خلال هذه العملية.
Introduction
والآن راسخة بأن التوظيف الكرية البيضاء في العام التالي نموذج للالتصاق سلسلة متعددة الخطوات 1. وهذا ينطوي على الاستيلاء على كريات الدم البيضاء من الدم يتدفق من قبل الخلايا البطانية المبطنة لجدار الوعاء الدموي. في البداية، كريات الدم البيضاء الخضوع خطوة المتداول الذي selectin بوساطة المستقبلات أو أعضاء الفصيلة المناعي. وهذا يسمح أعرب G-بروتين المستقبلات إلى جانب (GPCRs) على سطح الكرية البيضاء ليتم تفعيلها من خلال كيموكينات عرضت على الكنان السكري البطانية. وهذا يؤدي إلى تغيير تأكيد إنتغرين إلى حالة 'تقارب عالية' على سطح الكرية البيضاء واعتقال والتصاق شركة إلى البطانة. ثم تبعتها شركة التصاق بسبب تغير الشكل والزحف من الكرية البيضاء على متن السفينة. والخطوة الأخيرة هي التهجير من خلال أحادي الطبقة البطانية، والتي يمكن أن تحدث عبر طرق paracellular أو العابر للخلايا.
في حين أن تتالي التصاق متعددة الخطوات تصفق الآلية العامة للتوظيف الكرية البيضاء داخل الجسم هناك اختلافات محددة الجهاز. في الكبد غالبية التوظيف الكرية البيضاء يحدث داخل الجيوب الكبدية وعلى النقيض من الأجهزة الأخرى التي يحدث فيها التجنيد عموما داخل الأوردة الشعرية بعد 2. الجيوب الكبدية هي بيئة منخفضة القص وكريات الدم البيضاء الخضوع خطوة الربط وجيزة قبل أن يرسخ التصاق التي selectin مستقلة 2. تصطف هذه القنوات من قبل البطانة الجيبية الكبدي الذي هو متقطع ويحتوي نافذي، المسام مفتوحة 100-200 نانومتر في القطر، وتفتقر إلى الغشاء القاعدي 3. يمكن توضيح الآليات الجزيئية التي تتوسط التوظيف عبر الكرية البيضاء البشرية البطانة الجيبية الكبدي تحديد الجهاز الأهداف العلاجية محددة لأمراض الكبد الالتهابية.
فحوصات التصاق تدفق هي أدوات أساسية في دراسة التجنيد الكرية البيضاء. أنها تسمح إعادة بناء الكرية البيضاء recruitment في وجود إجهاد القص لتحليل التصاق تحت قوات محددة جيدا. الاستخدام الأكثر شيوعا لفحص هو التصاق الكرية البيضاء الدراسة إلى الطبقات الوحيدة البطانية مثقف أو ركائز المنقى. وتستخدم الدوائر تدفق المتاحة تجاريا ليروي الخلايا تحت ظروف تدفق الصفحي بين اثنين من الأسطح المسطحة ثم تصور عملية دينامية للالتصاق على المجهر 4. وقد أثبتت جماعات السابقة أن بعض التفاعلات لاصقة فقط تجري تحت التدفق ولا يمكن دراستها في المقايسات ثابتة 5،6.
وقد استخدمنا هذه التقنية لألخص الجيوب الكبدية ودراسة توظيف الكرية البيضاء تحت ظروف إجهاد القص منخفضة. HSEC الإنسان الأساسية هي تربيتها في microslides وكريات الدم البيضاء ثم يمكن perfused على هذا أحادي الطبقة بمعدل تدفق المحسوبة لإنتاج إجهاد القص داخل الجيوب الكبدية. إجهاد القص هو الإجهاد التي يتم تطبيقها بالتوازي أو عرضية إلى السطح كما مقابلosed الإجهاد الطبيعي الذي هو عمودي. فإن أي السائل الذي يتحرك على طول حدود ممارسة إجهاد القص على تلك الحدود. وقد تبين إجهاد القص لتكون عنصرا أساسيا في الخلايا اللمفاوية التهجير 7. في ظل هذه الظروف كل خطوة من تتالي التصاق يمكن تصور من قبل النقيض من المرحلة المجهري. هذه الطريقة سمحت معلومات هامة عن تجنيد كريات الدم البيضاء داخل الكبد بما في ذلك دراسة جزيئات الالتصاق التقليدية 8، ودور كيموكينات ومستقبلات chemokine 9-11، وجزيئات الالتصاق شاذة مثل التصاق الأوعية الدموية البروتين 1 (VAP-1 ) 8،12 اللمفاوية والأوعية الدموية شيوعا والبطانية مستقبلات 1 (CLEVER-1) 13. في حين تم ذكر هذا الاختبار في العديد من المنشورات مجموعتنا، وقد تم وصفه وجيزة واتخذنا هذه الفرصة لتقديم مفصلة خطوة خطوة الدليل لمساعدتك في استكشاف الأخطاء وإصلاحها ومنع الأخطاء الفنية عند محاولةجي الفحص. وعلاوة على ذلك، ونحن قد تغيرت مؤخرا الحصول على مصادر للغرف شريحة مجهرية الذي يسمح تعديلات دقيقة في إجهاد القص. نحن نعتقد أن هذا يوسع تطبيق الفحص على الخلايا البطانية والمناعية الأخرى. يصف الطريقة التالية إعداد وتقنية لتنفيذ تدفق استنادا التصاق مقايسة مع الخلايا البطانية الجيبية كبدي الإنسان والخلايا الليمفاوية في الدم المحيطي.
Protocol
1. إعداد شريحة مجهرية
- Precoat على شريحة مجهرية ستة قناة مع ذيل فأر نوع الكولاجين الأول (RTC، مخففة في برنامج تلفزيوني 1:100 إعطاء تخفيف العمل من 220 ميكروغرام / مل). يتم تنفيذ هذا عن طريق حقن 30 ميكرولتر من المخفف حل RTC مباشرة في القنوات واحتضان لمدة 2 ساعة على 37 درجة مئوية، تليها ثلاث غسلات مع برنامج تلفزيوني.
2. بذر خلايا في Microslides
- فصل ومتكدسة T75 قارورة من الخلايا الكبدية البشرية المستزرعة الجيبية البطانية (HSEC) (معزولة من أنسجة الكبد كما هو موضح سابقا 13) في التربسين EDTA-، وغسل في برنامج تلفزيوني، و resuspend في 3 × 10 6 خلية / مل في وسائل الإعلام كاملة (البطانية الإنسان وسائل الاعلام القاعدية تستكمل مع 2 مم L-الجلوتامين، و 100 U / مل البنسلين والستربتوميسين 100μg/ml، و 10٪ الحرارة المعطل المصل AB الإنسان، 10 نانوغرام / مل من عامل النمو البطاني الوعائي و 10 نانوغرام / مل من عامل النمو الكبدية). ضخ 30 ميكرولتر من تعليق خلية وخيمةctly في كل قناة.
- ترك خلايا الالتزام لمدة 1 ساعة في حاضنة ترطيب عند 37 ° C مع 5٪ CO 2 الغلاف الجوي على رف الشريحة. بعد السماح للخلايا الالتزام ملء منافذ على جانبي كل قناة مع المتوسطة كاملة (الشكل 1).
3. خلوى تحفيز خلايا
- ترك الخلايا في الحاضنة لمدة 24 ساعة. تقييم نمو الخلايا باستخدام المجهر النقيض من المرحلة مقلوب. 24 ساعة قبل التصاق مقايسة، وتحفيز الطبقات الوحيدة البطانية مع خلوى عن طريق استبدال وسائط النمو مع وسائل الإعلام كاملة تكملها عامل نخر الورم ألفا انترفيرون جاما و، سواء في 10 نانوغرام / مل.
4. عزل الخلايا اللمفاوية في الدم المحيطي
- عزل الخلايا الليمفاوية في الدم المحيطي من الدم الكامل عن طريق تنقية البداية الكسر وحيدات النوى من قبل التدرج الكثافة الطرد المركزي عبر وسائل الإعلام الطرد المركزي فصل الخلية المناسبة لمدة 25 دقيقة في 800ز خ. احتضان الخلايا على البلاستيك لمدة 1 ساعة للسماح للانضمام وحيدات.
- بعد الانضمام إلى نضح البلاستيك اللمفاويات المخصب طاف. غسل الخلايا الليمفاوية و resuspend لهم (عادة 1 × 10 6 خلية / مل في تدفق المتوسطة (وسائل الإعلام القاعدية البطانية تحتوي على 0.1٪ (ت / ت) ألبومين المصل البقري (BSA)).
5. المعالجة من البطانة Endothelium أو كريات الدم البيضاء مع مثبطات
- تحضير التخفيفات الموصى بها من وظيفة حجب الأضداد أو مثبطات جزيء صغير في البطانية media/0.1٪ (V / V) BSA. استبدال المتوسطة كاملة مع عرقلة الحل الضد / المانع في اختيار قناة شريحة مجهرية 30 دقيقة قبل أن تتدفق مقايسة.
- حيث يتم التخطيط المعالجة من المستقبلات chemokine على الخلايا الليمفاوية، في resuspend كريات الدم البيضاء المعزولة في حل RPMI تحتوي على 0.1٪ (ت / ت) BSA واحتضان مع 200 نانوغرام / مل من السعال الديكي السمية لمنع G-البروتين يقترن نشاط مستقبلات مستقبلات chemokine؛ تمييع بدلا محددة وظيفةمنع الأجسام المضادة أو مثبطات جزيء صغير من مستقبلات chemokine في التخفيف الموصى بها. كريات الدم البيضاء احتضان عند 37 درجة مئوية لمدة 30 دقيقة، ثم يغسل و resuspend في تدفق المتوسطة.
6. الإعداد للتدفق نظام الفحص
- Prewarm غرفة شفافة يسيطر حراريا إلى 37 ° C. ينبغي أن يكون للغرفة منافذ لإدخال أنابيب السيليكون والعرض الإلكترونية لصمام الملف اللولبي الإلكترونية التي تمكن التبديل بين الخلايا وسائل الإعلام مع عمليا أي حجم القتلى. هي التي شنت الغرفة على مجهر مقلوب للسماح النقيض من المرحلة المجهري. يوضح الشكل 2 غرفة فحص التدفق والمجهر وشريحة مجهرية وضعت على المسرح المجهر.
- ملء مسبق كوب 50 مل المحاقن مع قفل بالتركيبة مع 10 مل من الماء المقطر المعقم وإرفاق بطول 25 سم أنابيب السيليكون إلى ميناء حقنة. إدراج في ضخ حقنة. تغيير معدل انسحاب ضخ حقنة وفقا لإرشادات الشركة المصنعة شريحة مجهرية في الحفاظ على إجهاد القص من 0.05 باسكال (0.5 داين / سم 2، الشكل 3).
- تأخذ اثنين من 5 مل المحاقن، تجاهل الغطاسون وإرفاق برميل إلى يومين في تدفق موانئ صمام الملف اللولبي الإلكترونية باستخدام أنابيب السيليكون.
- نعلق 12 سم من أنابيب السيليكون إلى خارج صمام التدفق. صمام يسمح التناوب بين خلية عازلة خالية غسل (البطانية media/0.1٪ (V / V) BSA) وتعليق اللمفاويات.
- تدفق صمام الملف اللولبي الإلكترونية عن طريق إدراج غسل العازلة في كل حقنة برميل وضمان عازلة تتدفق من برميل واحد من خلال صمام وإلى خارج تدفق أنابيب السيليكون.
- استخدام مفتاح صمام بالتناوب لبرميل أخرى وضمان عازلة يتدفق وأن تتم إزالة كافة الفقاعات من النظام. إزالة غسل العازلة من أحد البراميل واستبدالها مع الخلايا اللمفاوية تعليق الشكل 4A.
- ربط توبين سيليكونز من ضخ حقنة لمنفذ واحد من قناة شريحة مجهرية اختار عبر محول شريحة مجهرية. ثم قم بتوصيل أنابيب السيليكون من صمام تدفق إلى ميناء المعاكس عبر محول شريحة مجهرية. التأكد من أن أنابيب السيليكون ومحولات تمتلئ غسل العازلة قبل التوصيل لمنع فقاعات الهواء التي تدخل نظام (الشكل 4B).
- مرة واحدة موصولة إلى النظام التدفق، ووضع شريحة مجهرية على المسرح المجهر ونعلق مع مقاطع أو شريط لمنع الحركة. تعيين المجهر لهدف 10X جنبا إلى جنب مع الإعداد المرحلة المناسبة. ضمان تصور أحادي الطبقة البطانية والتركيز باستخدام عدسة العين. ضمان يمكن التقاط الصور عن طريق كاميرا التي تعلق على المجهر، حيث يمكن أن يتم ترحيل الصور إلى جهاز وتسجيلها.
7. تتدفق وتقنيات الفحص وتسجيل من التصاق لتحليل
- يروي الطبقة البطانية مع غسل العازلة لمدة 2 دقيقة من خلال بدء withdrawal من ضخ حقنة لإزالة أي حطام أو غير منضم حجب الأضداد ثم تبديل صمام للسماح بلعة 5 دقائق من حل الكرية البيضاء في جدار القص الإجهاد المستمر لل0.05 بنسلفانيا
- خلال 2 دقيقة الأخيرة من البلعة الكرية البيضاء، وسجل 10 حقول عشوائية على طول من شريحة مجهرية. وهذا يسمح حاليا تحليل الخلايا اللمفاوية المتداول / الربط على أحادي الطبقة البطانية. تسجيل كل حقل لحوالي 10 ثانية قبل الانتقال إلى أخرى، وضمان أن تتم التسجيلات ضد اتجاه تدفق لتجنب تسجيل الخلية المتداول نفسه مرتين في تتابع سريع.
- اتبع بلعة البلعة الكرية البيضاء مع 5 دقائق من غسل العازلة من خلال العودة صمام لموقف بدايته. خلال المباراة النهائية 2 دقيقة من هذا بلعة تنفيذ المرحلة الثانية تسجيل عن طريق اختيار لا يقل عن 10 حقول تم اختيارها عشوائيا على طول من شريحة مجهرية. تسجيل كل حقل لحوالي 5 ثانية قبل الانتقال الى المرحلة التالية وتأكد من أن أحادي الطبقة البطانية وleucoc تمسكاytes في تركيز واضح. وهذا يسمح حاليا تحليل نمط الالتصاق.
النتائج
هذا الاختبار لديه القدرة على تصور متعددة الخطوات التصاق تدفق شلال وتوضيح الآليات الجزيئية الكامنة من خلال مقارنة نتائج التجارب السيطرة على تلك مع مثبطات الجزيئية. سرير مختلف الأوعية الدموية يمكن تلخيصها من خلال دمج الخلايا البطانية محددة وتغيير ظروف إجهاد القص.
كل خطوة من تتالي التصاق يمكن تحليلها حاليا باتباع طريقة التسجيل الواردة في البروتوكول. الخطوة الأولى من تتالي التصاق هو المتداول من كريات الدم البيضاء والتي يمكن التعبير عنها كنسبة مئوية من مجموع الخلايا الملتصقة. تحليل متواجد حاليا يسمح عدد من الخلايا الملتصقة أن المعددة في كل حقل سجلت خلال بلعة الكرية البيضاء. قراءة الصورة يسمح للمقارنة بين الخلايا التي هي ملتصقة بقوة وتلك التي تشهد حركة المتداول عبر البطانة. يمكن تصور الحركة المتداول باستخدام هذه التقنية، يتم تسجيل كل حقل لا يقل عن 10 ثانية. يتم تحديد الخلايا المتداول عن طريق تخفيض سرعتها على سطح البطانية مقارنة تتدفق الخلايا. يجب أن يظهر هذا السلوك لا يقل عن 5 ثوانى دون انفصال. تتالي التصاق داخل الجيوب الكبدية يحدث في بيئة منخفضة القص والدراسات المجراة وقد أكدت الحد الأدنى المتداول مع مجرد خطوة الربط وجيزة. لقد أكد أن فحص التدفق يعكس البيئة في الجيوب الكبدية من خلال إظهار أن أقل من 10٪ من كريات الدم البيضاء ملتصقة لفة باستمرار على حفز HSEC في هذه المقايسات.
الخطوة التالية من تتالي التصاق التصاق الشركة. ويمكن حساب مجموع الالتزام من المرحلة الثانية من خلال تسجيل بلعة غسل العازلة (الخطوة 7.3). تحليل متواجد حاليا يسمح للعدد الكلي للخلايا ملتصقة بقوة لفرزها في كل حقل (الشكل 5). يتم تعريف الخلايا الملتصقة بقوة كما الخلايا التي هي ثابتة أو shapechanged مع السلوك الزحف البطيء.ومن ثم يمكن حساب متوسط عدد الخلايا في الميدان. ويمكن بعد هذا الرقم يمكن استخدامها، بالتزامن مع المساحة الإجمالية للمجال الرؤية (مصرة باستخدام graticule أو ما يعادلها)، وتركيز الخلايا الليمفاوية (عادة 1 × 10 6 خلية / مل) ومعدل التدفق للتعبير عن مدى الالتزام اللمفاويات كما الخلايا الملتصقة / مم 2/10 6 خلايا perfused.
دراسة نمط التصاق ينطوي على تحليل الخطوات الأخيرين من تتالي التصاق بما في ذلك الشكل تغير، والزحف والهجرة transendothelial. تظهر كريات الدم البيضاء ملتصقة على السطح العلوي للأحادي الطبقة HSEC تظهر مرحلة مشرقة في حين تلك التي هاجرت من خلال أحادي الطبقة المرحلة المظلمة (الشكل 6). ويمكن بعد ذلك أن تصنف الخلايا كما نستعرض التصاق 'ثابت' (nonmigrated / جولة)، مورفولوجيا 'تغيير شكل' أو 'هاجر' ومن ثم يتم التعبير عن الفئات الفردية كنسبة مئوية منمجموع السكان لاصقة.

الشكل 1. أحادي الطبقة من الخلايا الكبدية الإنسان الأساسية الجيبية البطانية داخل غرفة التدفق. A) Microslides مليئة سائل الإعلام التي تحتوي على أحادي الطبقة من الخلايا البطانية قبل بدء تدفق التصاق الفحص. ب) المرحلة صورة النقيض من متكدسة البطانية أحادي الطبقة، ينبغي المصنفة الخلايا البطانية في شريحة مجهرية والتي تم precoated (للخلايا البطانية كبدي الإنسان وهذا ينبغي أن يكون مع نوع ذيل فأر الكولاجين 1) وأنه من الضروري أن الخلايا البطانية في صحة جيدة في الثقافة ومتموجة. اضغط هنا لمشاهدة صورة بشكل اكبر .
الشكل 2. تدفق غرفة الفحص. وغرفة فحص تدفق مجموعة المتابعة يمكن أن ينظر إليه هنا، وتتكون من غرفة الشفافة التي شنت على مجهر مقلوب. يتم وضع سخان في الغرفة ويجب أن يسيطر حراريا للحفاظ على درجة حرارة 37 درجة مئوية. ينبغي أن يكون هناك المنافذ المتاحة للاتصال أنابيب السيليكون من شريحة مجهرية داخل غرفة إلى ضخ حقنة الذي يقع خارج. يتم وضع شريحة مجهرية مباشرة على المسرح المجهر. اضغط هنا لمشاهدة صورة بشكل اكبر .

الرقم 3. محقنة مضخة. مضخة الحقنة هو الاتصالإد عبر أنابيب السيليكون إلى غرفة التدفق. يتم تعيين مضخة إلى معدل الانسحاب محددة تبعا لإجهاد القص المطلوب المطلوبة للمقايسة. اضغط هنا لمشاهدة صورة بشكل اكبر .

الشكل 4. ربط صمام لتدفق الغرفة. أ) صمام الملف اللولبي الإلكترونية يسمح التبديل بين اثنين برميل حقنة تحتوي إما خلايا أو وسائل الإعلام مع عمليا أي الفضاء الميت. B) مرة واحدة صمام يتم مسح ويتم تعيين اثنين من البراميل تصل، أنابيب السيليكون من صمام متصلة غرفة التدفق. فمن الأهمية بمكان أن عند توصيل محول على أنابيب السيليكون إلى ميناء على غرفة تدفق هناك واجهة السائل / السائل. <وأ href = "https://www.jove.com/files/ftp_upload/51330/51330fig1highres.jpg" الهدف = "_blank"> اضغط هنا لمشاهدة صورة أكبر.

الرقم 5. قياس مجموع الالتزام الكرية البيضاء. خلال آخر دقيقتين من الخطوة بلعة غسل العازلة (كما هو موضح في البروتوكول)، ينبغي تسجيل ما لا يقل عن عشرة حقول عشوائي. هذه يمكن تحليلها خارج الخط ويمكن الاعتماد على العدد الكلي للخلايا ملتصقة بقوة في كل حقل. التصاق مجموع كريات الدم البيضاء يمكن مقارنة بين غرف التحكم وتلك سابقة التجهيز مع منع الأجسام المضادة، وهنا نعرض حقل ممثل عن شريحة تحكم وشريحة سابقة التجهيز مع التصاق الخلايا جزيء-1 (ICAM-1) منع الأجسام المضادة. تم إضافة الأسهم لتسليط الضوء على الكريات البيض ملتصقة في التمثيلTIVE حقل من الشريحة السيطرة هناك ما مجموعه 25 الكريات البيض التي تم تحديدها وفي كتلة الشريحة ICAM-1 وهناك ما مجموعه 13 الكريات البيض التي تم تحديدها. أشرطة النطاق = 100 ميكرومتر. اضغط هنا لمشاهدة صورة بشكل اكبر .
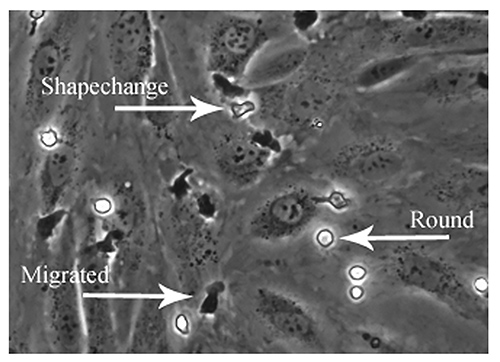
الرقم 6. ويمكن أيضا تحليل نمط الكرية البيضاء على التصاق الطبقات الوحيدة البطانية التي كتبها النقيض من المرحلة المجهري. تحليل غير متصل حقول سجلت استخدامها لدراسة اتجاه وسرعة الكرية البيضاء الالتصاق. خطوات محددة من تتالي التصاق يمكن تصور وكميا باستخدام التصوير النقيض المرحلة. المرحلة الخلايا مشرق التي هي ملتصقة بقوة ولكن لا يمكنهم أن توصف التصاق 'جولة'، والخلايا التي هي تنشيطد والمرحلة مشرق يمكن أن يطلق عليه "تغيير شكل" والخلايا التي هي مرحلة مظلمة هي الخلايا التي خضعت الهجرة transendothelial ويمكن أن يطلق عليه "هاجر". يظهر الصورة أمثلة من كل نمط من الالتصاق. اضغط هنا لمشاهدة صورة بشكل اكبر .
Discussion
الخطوة الأكثر أهمية لأداء بنجاح فحص التدفق هو ضمان أن أحادي الطبقة صحية ومتموجة من الخلايا البطانية مستعدة قبل مقايسة التصاق التدفق. الخلايا البطانية الأولية يمكن أن يكون صعبا للثقافة وحساسية للتغييرات في أساليب زراعة. من المهم أن 1) يتم بشكل كاف وبشكل موحد المغلفة غرف تدفق مع الخلايا البطانية في أحادي الطبقة، لHSEC نستخدم الفئران الذيل نوع الكولاجين أنا ولكن هذا قد تختلف عن السكان البطانية الأخرى، 2) مستنبت مناسب لنوع من الخلايا، ل HSEC التي وصفناها لدينا المتوسطة كاملة في قسم البروتوكول. وتشمل الخطوات الحيوية الأخرى وضع ضخ حقنة بمعدل المناسبة لتعكس مستويات الفسيولوجية للإجهاد القص.
أثناء فحص التدفق فمن الضروري لمنع فقاعات الهواء داخل الدائرة التدفق التي يمكن أن تتلف أحادي الطبقة البطانية أو تجريد الخلايا المناعية من سطح البطانية. هذا يمكن الوقاية منها عن طريق حماماتsuring أن جميع أنابيب السيليكون ومحولات و perfused مع غسل العازلة قبل الصدد، أن تتم إزالة جميع فقاعات الهواء والتي يتم prewarmed وسائل الإعلام قبل استخدامها. عند توصيل محولات لالمنافذ على شريحة مجهرية من المهم جدا أن هناك واجهة السائل / السائلة أثناء الاتصال، إذا كان هناك أي الهواء ثم وهذا سوف يشكل فجوة الهواء داخل النظام الذي سوف تعطل أحادي الطبقة البطانية أثناء الانسحاب حقنة الخطوة. الحل الكرية البيضاء في برميل حقنة يحتاج الانفعالات العادية للتأكد من أن الخلايا لا تسوية، وبالتالي الحفاظ على كثافة خلايا ثابتة طوال التجربة.
خلال خطوات التسجيل فمن المهم لضمان تركيز الصورة من طبقة بطانة الأوعية الدموية على نحو كاف وواضح للسماح حاليا تحليل دقيق، وأنه خلال الخطوة الثانية من فحص تدفق (آخر الكرية البيضاء البلعة) أن يتم ترك ما يكفي من الوقت أثناء غسل العازلة واستأنف المرحلة قبل تسجيل للتأكد من أنتتم إزالة كافة كريات الدم البيضاء غير ملتصق. وبالمثل فإنه من الضروري استخدام الخلايا البطانية في أحادي الطبقة من الكثافة المناسبة لمنع فقدان الخلايا التي يمكن أن تتداخل مع أنماط التدفق في الشعيرات الدموية الضيقة وأيضا يمكن أن يكون من الصعب أن تميز من كريات الدم البيضاء الملتصقة أكبر تحت النقيض من المرحلة المجهري. وصفناها الأمثل كثافة البذر للخلايا البطانية الجيبية كبدي الإنسان، ولكن هذا قد تختلف بين السكان وأنواع مختلفة البطانية.
وقد تم إحراز تقدم كبير في دراسة التجنيد الكرية البيضاء في النماذج الحيوانية مع intravital المجهري. والميزة الرئيسية لطريقة الفحص التصاق تدفق هو أن التوظيف الكرية البيضاء يمكن دراستها في النظام الثنائي مع الخلايا البطانية الإنسان الأساسية. وعلاوة على ذلك، فإن هذه التفاعلات يمكن دراستها تحت المستويات الفسيولوجية ذات الصلة من إجهاد القص. من المهم أن تؤكد نتائج الدراسات حيوي داخلي في الحيوانات مع الأنظمة الخلوية الإنسان ما قد يكون هناك differencوفاق في خصائص البطانية بين الأنواع. واحدة من القيود المفروضة على تدفق مقايسة هو أن التوظيف الكرية البيضاء ويجري درس في بيئة وحيدة الخلية من أحادي الطبقة البطانية. بالإضافة مرة واحدة انضمت في كريات الدم البيضاء وtransmigrated عبر البطانة أنها قد لا تكون في موجودة بأعداد كافية لتكون معزولة وتعرض لعمليات المصب.
على الرغم من هذه القيود، بمجرد يتقن مقايسة التصاق تدفق يمكن وضعها لتنفيذ مزيد من التحليل للتتالي التصاق الكرية البيضاء وتكييفها مع بيئة متعددة الخلايا ألخص. تسجيل فترات طويلة من الحقول واحد واستخدام برامج تتبع يمكن استخدامها لتحليل السلوك الزحف من كريات الدم البيضاء. وعلاوة على ذلك عند الانتهاء من فحص التدفق يمكن استجواب microslides باستخدام المسح الضوئي ليزر متحد البؤر المجهري ووضع العلامات مناعي لدراسة التصاق والتهجير في مزيد من التفاصيل. بالإضافة إلى ذلك، قمنا بتطوير سابقاإد نموذجا في المختبر حيث يمكن كريات الدم البيضاء التي تتدفق التفاعل مع البطانة الكبدي مكيفة من وجود خلايا الكبد. كما يمكن تطوير هذا الفحص لدراسة المجموعات السكانية الفرعية من كريات الدم البيضاء: كان أداء مجموعتنا الدراسات مع مجموعات فرعية مثل الخلايا التنظيمية T والخلايا B، والكبد التسلل كريات الدم البيضاء.
هذه الدراسات هي دليل على أن مقايسة التصاق تدفق هو أداة قوية لدراسة العامة والجهاز التوظيف الكرية البيضاء محددة في النظم البشرية.
Disclosures
الكتاب تعلن أي المصالح المالية المتنافسة
Acknowledgements
ويتم تمويل SS من قبل الزمالة ويلكوم ترست المتوسطة السريرية، CW من قبل ويلكوم ترست برنامج المنح.
Materials
| Name | Company | Catalog Number | Comments |
| Six channel microslide VI 0.4 flow chamber | Ibidi | 80601 | Other channel size and precoated slides are available depending on assay requirements. |
| Flow adaptors microslide VI 0.4 | Ibidi | 80646 | |
| Flow assay chamber | Solent Scientific | 33-3322 | These chambers are custom made by the company dpending on the model of microscope and accessories. |
| Inverted Microscope IX2 | Olympus, UK | Model IX50 | |
| Harvard Syringe Pump | Harvard Apparatus, UK | 702101 | |
| Electronic solenoid valve | Lee Products Limited, UK | Part Number LFYA1226032H | |
| Silicon Tubing large | Fisher Scientific | FB50855 | 2 mm inner diameter, 4 mm outer diameter |
| Silicone Tubing-small | Fisher Scientific | FB50853 | 1 mm inner diameter, 3 mm outer diameter |
| Harvard Glass Syringe | Harvard Apparatus, UK | 55-0962 | |
| Cell separation medium/Lympholyte | VH Bio | CL-5020 | |
| Rat Tail Collagen | Sigma Aldrich | C3867-1VL |
References
- Ley, K., Laudanna, C., Cybulsky, M. I., Nourshargh, S. Getting to the site of inflammation: the leukocyte adhesion cascade updated. Nat. Rev. Immunol. 7, 678-689 (2007).
- Wong, J., et al. A minimal role for selectins in the recruitment of leukocytes into the inflamed liver microvasculature. Clin. Invest. , 2782-2790 (1997).
- Braet, F., Wisse, E. Structural and functional aspects of liver sinusoidal endothelial cell fenestrae: a review. Compar. Hepatol. 1, 1 (2002).
- Lawrence, M. B., Springer, T. A. Leukocytes roll on a selectin at physiologic flow rates: distinction from and prerequisite for adhesion through integrins. Cell. 65, 859-873 (1991).
- Finger, E. B., et al. Adhesion through L-selectin requires a threshold hydrodynamic shear. Nature. 379, 266-269 (1996).
- Lawrence, M. B., Kansas, G. S., Kunkel, E. J., Ley, K. Threshold levels of fluid shear promote leukocyte adhesion through selectins (CD62L,P,E). J. Cell biol. 136, 717-727 (1997).
- Cinamon, G., Shinder, V., Alon, R. Shear forces promote lymphocyte migration across vascular endothelium bearing apical chemokines. Nat. Immunol. 2, 515-522 (2001).
- Lalor, P. F., et al. Vascular adhesion protein-1 mediates adhesion and transmigration of lymphocytes on human hepatic endothelial cells. J. Immunol. 169, 983-992 (2002).
- Aspinall, A. I., et al. CX(3)CR1 and vascular adhesion protein-1-dependent recruitment of CD16(+) monocytes across human liver sinusoidal endothelium. Hepatology. 51, 2030-2039 (2010).
- Curbishley, S. M., Eksteen, B., Gladue, R. P., Lalor, P., Adams, D. H. CXCR 3 activation promotes lymphocyte transendothelial migration across human hepatic endothelium under fluid flow. Am. J. Pathol. 167, 887-899 (2005).
- Oo, Y. H., et al. Distinct roles for CCR4 and CXCR3 in the recruitment and positioning of regulatory T cells in the inflamed human liver. J. Immunol. 184, 2886-2898 (2010).
- Weston, C. J., Shepherd, E. L., Adams, D. H. Cellular localization and trafficking of vascular adhesion protein-1 as revealed by an N-terminal GFP fusion protein. J. Neural Transm. , (2013).
- Shetty, S., et al. Common lymphatic endothelial and vascular endothelial receptor-1 mediates the transmigration of regulatory T cells across human hepatic sinusoidal endothelium. J. Immunol. 186, 4147-4155 (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved