A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
اللجنين أسفل تنظيم
In This Article
Summary
يتم توظيف تدخل الحمض النووي الريبي مزدوج تقطعت بهم السبل (dsRNAi) تقنية لأسفل تنظيم أنزيم الذرة السنامويل واختزال (ZmCCR1) الجينات إلى انخفاض محتوى اللجنين النبات. هو تصور اللجنين أسفل التنظيم من جدار الخلية بواسطة التحليلات المجهرية وكميا من خلال طريقة Klason. يتم تحليل التغيرات التركيبية في هيميسيلولوز والسليلوز البلورية.
Abstract
لتسهيل استخدام الكتلة الحيوية اللجنوسليلوزية كمصدر للطاقة الحيوية البديلة، أثناء عمليات التحويل البيولوجي، هناك حاجة إلى خطوة المعالجة لفتح هيكل جدار الخلية النباتية، وزيادة إمكانية الحصول على الكربوهيدرات جدار الخلية. ومن المعروف اللجنين، والمواد بولفنوليك موجودة في العديد من أنواع جدار الخلية، ليكون عائقا كبيرا لانزيم الوصول. انخفاض في محتوى اللجنين إلى المستوى الذي لا يتعارض مع سلامة والدفاع النظام الهيكلي للمحطة قد تكون خطوة قيمة لتقليل تكاليف الإنتاج الإيثانول. في هذه الدراسة، ونحن قد وراثيا أسفل تنظيم واحد من الجينات ذات الصلة الحيوي اللجنين،-السنامويل جنة الزراعة اختزال (ZmCCR1) الذين تقطعت بهم السبل الحمض النووي الريبي عبر تقنية التدخل مزدوجة. تم دمج بناء ZmCCR1_RNAi في جينوم الذرة باستخدام طريقة الجسيمات القصف. نمت النباتات المعدلة وراثيا الذرة عادة بالمقارنة مع محطات التحكم من النوع البري دون فيterfering مع نمو الكتلة الحيوية أو آليات الدفاع، باستثناء عرض من البني التلون في النباتات المعدلة وراثيا ورقة منتصف الأضلاع، قشور، وينبع. التحليلات المجهرية، بالتزامن مع الفحص النسيجي، وكشفت أن ألياف نسيج خشبي ورقة وضعفت ولكن لم يتم تغييرها هيكل وحجم مكونات نظام الأوعية الدموية الرئيسية الأخرى. تم خفض محتوى اللجنين في الذرة المعدلة وراثيا عن طريق 7-8،7٪، وزيادة محتوى السليلوز البلورية في الاستجابة للحد من اللجنين، وظلت hemicelluloses دون تغيير. قد تشير التحليلات قد تم نقل هذا التدفق الحيوي الكربون من اللجنين إلى السليلوز الحيوي. يحدد هذا المقال الإجراءات المستخدمة لأسفل تنظيم محتوى اللجنين في الذرة عبر تقنية رني، والتركيبية جدار الخلية التحليلات المستخدمة للتحقق من تأثير التعديلات على هيكل جدار الخلية.
Introduction
إنتاج الوقود الحيوي من الكتلة الحيوية اللجنوسليلوزية مرغوب فيه للغاية بسبب وفرة الحالي في الولايات المتحدة 1، وفي حالة الحصاد المستدام للمخلفات الزراعية والغابات، والقدرة على المنافسة وليس مباشرة عن الأراضي الزراعية المستخدمة في إنتاج الأعلاف الغذائية والحيوانية. ولكن، خلافا للحبوب الذرة، والذي هو المصدر الرئيسي للوقود الحيوي ولدت في الولايات المتحدة حاليا، ومواد اللجنوسليلوزية بشكل ملحوظ أكثر تعقيدا وصعوبة لكسر. بالإضافة إلى الكربوهيدرات طويلة السلسلة، السليلوز وهيميسيلولوز، والتي هي المصادر الرئيسية للسكريات أثناء تخمير المواد اللجنوسليلوزية، وأنواع عديدة من جدران الخلايا النباتية تحتوي أيضا على اللجنين، البوليمر phenylpropanoid أن يوفر قوة، والدفاع ضد أي هجوم الممرض، وللا مائية إلى الخلية الجدران. في حين اللازمة لنمو النبات والبقاء على قيد الحياة، ويعرض اللجنين أيضا حاجزا كبيرا أمام تحويل الأنزيمية ناجحة من السليلوز وhemicelluتفقد السكريات قابل للذوبان. مواد ذات محتويات عالية اللجنين عادة مواد اقل من المرغوب فيه لكل من الوقود الحيوي (من خلال مسارات التحويل البيولوجية) والصناعات اللب والورق ويرجع ذلك إلى آثار سلبية على خصائص تجهيز وجودة المنتج. وبالتالي، والتلاعب الجيني للمواد النباتية للحد من اللجنين في المستوى الذي لا يتعارض مع المحاصيل القوة الهيكلية وأنظمة الدفاع قد يكون من المهم للحد من تكاليف الإنتاج لكل من الوقود الحيوي اللجنوسليلوزية والصناعات اللب والورق.
في الذرة (ذرة شامية)، اللجنين هو تساهميا ربط مرجعية إلى هيميسيلولوز في جدار الخلية الأولية عبر ferulate والجسور diferulate 2. مجمع اللجنين-هيميسيلولوز بربط سيليلوز microfibrils من خلال السندات الهيدروجين، وتشكيل المصفوفة المعقدة التي تمنح النزاهة والقوة لجدار الخلية الثانوية. يتم تحديد القوة الميكانيكية من جدران الخلايا النباتية إلى حد كبير من نوع ليثيومgnin مفارز 3-5. في الدراسات السابقة، وتغيير نسب مفارز اللجنين لم يظهر أي اتجاه واضح على هضم الأنزيمية 6-11. ومع ذلك، تخفيضات في محتوى اللجنين تظهر عادة تحسنا في التحويلات 12،13 ويمكن أن يكون المفتاح لزيادة هضم المواد النباتية من الانزيمات حلمهي بما في ذلك endocellulases، cellobiohydrolases، وβ-glucosidases 14.
وقد مارست الهندسة الوراثية لتنظيم مستوى التعبير النصوص على نطاق واسع لتحسين خصائص المحصول. التقنيات المتقدمة، بما في ذلك مكافحة الشعور 15 وشارك في قمع 16 التقنيات وتمكين فعالة أسفل تنظيم الجينات المستهدفة. كما تم تحقيقها كاملة الجين المغلوب من استخدام التركيبات الجين ترميز تقسم إنترون RNA مع هيكل دبوس 17. علاوة على ذلك، ضعف تدخل الحمض النووي الريبي الذين تقطعت بهم السبل (dsRNAi) تقنية، أي وسائل الإعلام التعبير الجيني قوية وفعالةتور التي تعمل إما عن طريق استهداف تدهور نص أو ترجمة القمع، يوفر وسيلة فعالة للحث على مجموعة واسعة من آثار القمع على مرنا 18 هدفا. تظهر تقنيات الجينات إسكات العديد من القيود. هذه التقنيات لا تنظم بدقة مستوى النسخ وأنها يمكن أن تتسبب في آثار غير متوقعة على إسكات الجينات المتماثلة الأخرى.
في هذه الطريقة، ونحن العاملين الجسيمات القصف لحمل dsRNAi يبني في جينوم الذرة. حتى الآن، مجموعة واسعة من الأنواع النباتية تم تحويلها بنجاح باستخدام القصف الجسيمات، الأجرعية بوساطة التحول، التثقيب الكهربائي، وطرق حقن مكروي. في الذرة التحول الوراثي، وطريقة الجسيمات القصف هو مفيد على كل الطرق الأخرى لأنه هو الأكثر كفاءة. الجسيمات القصف لا يتوقف على البكتيريا، لذلك فإن هذه الطريقة خالية من القيود البيولوجية مثل حجم الجينات، نوعا من الجينات أوigin، أو التركيب الوراثي النباتي. نظام تسليم التحوير المادي تمكن عالية الوزن الجزيئي الحمض النووي والجينات متعددة ليتم إدخالها في الجينوم المصنع، وفي بعض الحالات في البلاستيدات الخضراء في ارتفاع كفاءة تحويل 19. يمكن تصور الحد اللجنين في الأوعية الدموية للأوراق منتصف الضلع عبر المسح الضوئي المجهر الإلكتروني (SEM) الذي يفيد في دراسة التضاريس وتكوين العينات.
في النباتات الذرة، وهما من اختزال السنامويل، لجنة الزراعة تم العثور على الجينات في الجينوم الذرة 20 (ZmCCR1: Y15069: X98083 وZmCCR2). السنامويل، لجنة الزراعة اختزال يحفز تحويل استرات hydroxycinnamoyl، لجنة الزراعة في الألدهيدات سيناميل. اخترنا هذا الجين ZmCCR1 إلى أسفل تنظيم هذا الانزيم لأنه أعرب عن الجينات في جميع الأنسجة lignifying. تم اختيار 523 النيوكليوتيدات في محطة 3 'من الجين ZmCCR1 لبناء dsRNAi لأن تسلسل يبدو أنأكثر تنوعا بالمقارنة مع تلك التي ZmCCR2. وبالتالي، فإن بناء dsRNAi ربط بدقة فقط لZmCCR1، وتجنب خارج الهدف إسكات 21. تم تصميم وبناء ZmCCR1_RNAi في هيولي نظام التعبير ImpactVector1.1 علامة (IV 1.1) تحتوي على مروج خضراء محددة الأنسجة، ريبولوز-1، 5 bisphosphate أوكسيجيناز كربوكسيلاز (RuBisCO).
لدراسة الآثار المترتبة على dsRNAi بناء على النباتات المعدلة وراثيا، وكان كميا محتوى اللجنين. ومن المعروف أن Klason (حمض غير قابلة للذوبان) قياس اللجنين أن تكون أكثر دقة بالمقارنة مع الأساليب المنظفات اللجنين الكمي الحمضية التي ذوبان بعض اللجنين 22. لذلك، تم قياس اللجنين Klason في سيقان الذرة المعدلة وراثيا. يتكون هذا الإجراء من التحلل حمض خطوتين الذي يحول الكربوهيدرات إلى البوليمرية القابلة للذوبان السكريات الأحادية 23. ثم مجزأة الكتلة الحيوية تحلل إلى حمض العتاد القابلة للذوبان وغير القابلة للذوبانوقد تم قياس المرض واللجنين غير قابلة للذوبان حمض فقا لدراسات سابقة 23،24. من الناحية المثالية، ينبغي تحليل اللجنين تشمل الاستخراج بالماء والإيثانول قبل الخطوة التحلل، وذلك لإزالة المواد القابلة للذوبان التي يمكن أن تتداخل مع النتائج، واحتراق آخر التحلل من بقايا اللجنين لحساب أي الرماد موجودة في بقايا. من دون هذه الخطوات، ومحتوى اللجنين من العينة يمكن أن يكون مبالغا بشكل مصطنع. ويقدم طريقة كاملة هنا، ولكن لتجاربنا كنا غير قادر على أداء كل من هذه الخطوات نظرا لصغر حجم المواد المتاحة للاختبار
وقد تم تحليل اثنين من غيرها من مكونات جدار الخلية، والسليلوز وهيميسيلولوز أيضا في اللجنين أسفل تنظيم خطوط الذرة المعدلة وراثيا. وقد أفيد أن النباتات المعدلة وراثيا التي تم تنظيمها إلى أسفل إما على الفينيل ألانين الأمونيا لياز (PAL) 25، 4 coumarate: التميم يغاز (4CL) 26، أو سيناميل لنازعة lcohol (CAD) 27 تظهر زيادة في المكونات الهيكلية جدار الخلية الأخرى. كخطوة أولى في دراساتنا، وقد تم قياس البلورية السليلوز باستخدام طريقة Updegraff 28. هذه الطريقة تم وضعها أصلا لتحديد السليلوز في عدد كبير من البكتيريا والفطريات cellulolytic. لفترة وجيزة، تم علاج مخزونات الذرة المطحونة مع Updegraff كاشف (حمض الخليك: حامض النيتريك: الماء) لإزالة هيميسيلولوز، اللجنين، وxylosans. وتحلل السليلوز البلورية تماما إلى جلوكوز عن طريق Saeman التحلل بإضافة H 2 SO 4. ثم يعاير السليلوز البلورية باستخدام طريقة anthrone اللونية 29. للتحقق إذا تم تغيير محتويات هيميسيلولوز، وتحلل مقتطفات من أحادي السكاريد سيقان المضروب باستخدام حمض trifluoroacetic، derivatized باستخدام طريقة خلات alditol ومن ثم تحليلها من قبل اللوني الغاز (GC) 30. الإجراءات التفصيلية لسل البلوريةموصوفة التحليلات تكوين المحتويات lulose والسكريات في مصفوفة فوستر وآخرون (2010) 31.
هنا، نحن تصف الإجراءات المستخدمة لاللجنين أسفل التنظيم في الذرة عن طريق التكنولوجيا رني، الجسيمات تحول القصف، وتحليل اللجنين لتسريع تفكيك الذرة الكتلة الحيوية إلى سكريات قابلة للتخمر اللجنوسليلوزية على الوقود الحيوي.
Protocol
1. إعداد dsRNAi التركيبات المستخدمة لأسفل تنظيم ZmCCR1
- الاشعال محددة بما في ذلك تصميم الجين الضروري تقييد انزيم مواقع لصنع dsRNAi بناء على خروج المغلوب الجينات ZmCCR1. تم تصميم مجموعتين التمهيدي لتضخيم جزأين جزء من ZmCCR1 كدنا]: جزء من 523 سنة مضت النوكليوتيدات 748-1271، و285 نقطة أساس جزء من النوكليوتيدات 986-1271 وزودت ZmCCR1 كدنا] من معهد الجينوم أريزونا (AGI). موصوفة مزيد من التفاصيل في الشكل 1.
- تضخيم شظية كبيرة عن طريق البلمرة سلسلة من ردود الفعل (PCR) من القالب ZmCCR1 كدنا] باستخدام ZmCCR1_748F_BglII الاشعال (5'-AGATCTACATCCTCAAGTACCTGGAC-3 ') وZmCCR1_1271R_NcoI (5'-CCATGGTTTACACAGCAGGGGAAGGT-3). تضخيم جزء أصغر (285 بي بي) باستخدام ZmCCR1_986F_BglII الاشعال (5'-AGATCTGGAAGCAGCCGTACAAGTTC-3 ') وZmCCR1_1271R_SacI (5R17؛ GAGCTCTTTACACAGCAGGGGAAGGT-3).
- ligate فردي شظايا في pGEM-T سهل باتباع إرشادات الشركة المصنعة.
- أداء مصغرة الإعدادية البلازميد عزل الحمض النووي من transformants الفردية، التي تحتوي على كل pGEM-T يبني البلازميد باستخدام عدة مصغرة الإعدادية التجارية.
- هضم كل من pGEM-T :: ZmCCR1 (523 بي بي) وImpactVector (الرابع) -1.1 (السيتوبلازم التعبير ناقلات) مع كل من BglII وراسي.
- Ligate الكبيرة هضمها هلام تنقية ZmCCR1 جزء (523 بي بي) في هلام هضم تنقية IV-1.1.
- هضم pGEM-T :: ZmCCR1 (285 بي بي) وIV-1.1 :: ZmCCR1 (523 بي بي) مع كل من BglII وSACI من أجل إدراج جزء صغير في IV-1.1 :: ZmCCR1 (523 بي بي).
- Ligate الجل هضمها صغيرة تنقية ZmCCR1 جزء (285 بي بي) في هلام هضم تنقية IV-1.1 :: ZmCCR1 (523 بي بي).
- استنساخ كلا 523 نقطة أساس و 285 نقطة أساس fragmenTS في IV-1.1 لجعل ZmCCR1 رني بناء، التي لديها 285 نقطة أساس تسلسل تكرار مقلوب مع 238 نقطة أساس فاصل في منتصف تكرار شظايا مقلوب (انظر الشكل 1).
- نقل هذا بناء في القولونية (E. كولاي)، وتنمو عليها وإجراء البلازميد حجم العزلة الحمض النووي ميدي الإعدادية للحصول على ما يكفي من الحمض النووي البلازميد الذرة التحول الجيني.
2. الذرة التحول الجيني
- إعداد الجسيمات التنغستن
- وضع 60 ملغ من الخرز التنغستن (M10) في أنبوب 1.5 مل وتغسل مع 1 مل من الايثانول 70٪ من قبل vortexing لمدة 2 دقيقة. احتضان لمدة 10 دقيقة في 23 درجة مئوية ثم الطرد المركزي في 18894 x ج لمدة 2 دقيقة وتجاهل طاف.
- غسل 3X مع 1 مل من الإيثانول بنسبة 100٪، الطرد المركزي لمدة 2 دقيقة وتجاهل طاف. إضافة 1 مل من 50٪ معقمة الجلسرين لجعل تركيز microparticle إلى 60 ملغ / مل.
- إعداد الحمض النووي للقصف
- ررالآس 50 ميكرولتر (3 ملغ) من الخرز التنغستن أعد في 50٪ الجلسرين في أنبوب 1.5 مل. إضافة 5 ميكرولتر (1 ميكروغرام) من IV-1.1 :: ZmCCR1 رني البلازميد الحمض النووي، و 50 ميكرولتر من 2.5 M و CaCl 2، و 20 ميكرولتر من 0.1 M سبيرمدين. دوامة لفترة وجيزة بين كل إضافة الكواشف أعلاه.
- دوامة التنغستن الحمض النووي حبة الخليط لفترة وجيزة وأجهزة الطرد المركزي في 18894 x ج لمدة 30 ثانية. تخلصي من طاف و resuspend الكريات في 140 ميكرولتر من الايثانول 70٪. إزالة السائل وتجاهل. إضافة 140 ميكرولتر من الإيثانول بنسبة 100٪. إزالة السائل وتجاهل.
- إضافة 48 ميكرولتر من الإيثانول بنسبة 100٪. استخدامها على الفور أو تخزين على الجليد لمدة تصل إلى 4 ساعات قبل القصف.
- قصف
- وضع 3-5 سم القطر مرحبا-II الذرة تخلقي الكالس (شريطة التحول من مركز الذرة من جامعة ولاية أيوا) في منتصف 100 ملم أطباق بتري تحتوي على وسائل الاعلام N6OSM 32 (كما osmotium) لا يقل عن 4 ساعة قبل القصف.
- Preparه وPSD-1000/He الجهاز الجسيمات التسليم وفقا لتعليمات الشركة الصانعة 33.
- تعقيم جدار الغرفة مع الايثانول 70٪. تحميل العقيمة 650 رطل القرص تمزق في الاحتفاظ غطاء العقيمة. تنتشر 5-6 ميكرولتر من الحل M10-DNA على سطح macrocarrier، لفترة وجيزة الجافة. macrocarrier الحمل ووقف إطلاق الشاشة إلى التجمع microcarrier.
- وضع microcarrier التجمع الاطلاق والذرة الكالس في غرفة على مسافة مختارة من شاشة التوقف (L2 = 6 سم) وباب وثيق. تسريع في فراغ من 27 رطل ضد شاشة شبكة سلكية.
- اضغط على زر اطلاق النار حتى يسقط رشقات نارية تمزق القرص وضغط الهيليوم مقياس من الصفر. الافراج عن زر اطلاق النار.
- احتضان الكالس قصفت في طبق بتري تحتوي N6OSM (متوسطة ناضح) لمدة 16 ساعة 32 في الظلام في 27 درجة مئوية. كسر الكالس إلى حوالي عشر قطع ونقل إلى N6E (الكالس الحث المتوسطة) 32 في أطباق بتري واحتضان لمدة 5 أيام طن الظلام في 27 ° C.
- اختيار
- بعد 5 أيام على N6E، ونقل الكالس على N6S المتوسطة (وسائل الاعلام اختيار) 32. ثقافة فرعية كل الكالس على اختيار المتوسط كل 30 يوما لمدة 8-12 أسابيع من دون إزعاج هيكل الكالس.
- بعد حوالي 8-10 أسابيع، وسوف القطاعات سريعة النمو تنمو بيضاء من غير المتكاثرة والكالس الأم نخرية جزئيا. استئصال الأنسجة سريعة النمو الأبيض وثقافة فرعية منها إلى متوسطة اختيار الطازجة (N6S) 32 وتستمر في احتضان النحو الوارد أعلاه.
- تجديد
- نقل الكالس الجنيني الأبيض وسريعة النمو على تجديد المتوسطة 32 واحتضان على النحو الوارد أعلاه عن 1 في الاسبوع. تبديل الكالس تخلقي تجديد لمدة 16 ساعة والنهار 8 ساعات الظلام في 25-27 درجة مئوية
- نقل تجديد يطلق النار على تأصيل المتوسطة 32 في أنبوب اختبار الزجاج بعد 3-4 أسابيع، والاستمرار في احتضان النحو الوارد أعلاه. بعد ص كبيرةيبدو التنمية أوت، وغسل الجذور بعناية تحت صنبور الماء، ثم زرع شتلات ل4 "الأواني مع التربة. تغطية الأواني مع أكياس البلاستيك للحفاظ على رطوبة. 2 بعد أيام من إجراء ثقوب صغيرة في أكياس بلاستيكية. بعد 5-6 أيام إزالة الأكياس البلاستيكية. الاستمرار في احتضان النحو الوارد أعلاه لمدة 5-6 أيام أخرى.
- دفيئة
- نقل الشتلات إلى 18 الأواني "مع الحفاظ على التربة وضوء الشمس في الصيف كامل أو ضوء المسببة للاحتباس الحراري. وتسمى النباتات مجدد الأولية T 0 بينما تنتمي البذور الأولى للجيل T 1.
3. الفحص النسيجي
- إصلاح الذرة نبات منتصف الأضلاع في 5 مل من 10٪ من الفورمالين مخزنة محايدة.
- عملية التسلل والفراغ مع البارافين على معالج الأنسجة باستخدام معالج الأنسجة.
- تضمين الأنسجة في البارافين باستخدام محطة التضمين HistoCentre الثالث.
- إزالة الزائدة من البارافين حواف الكتلة مرة واحدةيتم تبريد كانساس.
- عينة القسم في 4-5 ميكرون مع مشراح باستخدام مشراح.
- وضع المقاطع على الشرائح المجهر وجاف في حاضنة 56 درجة مئوية لمدة 2-24 ساعة. وانضمت جعل متأكد من أقسام بالكامل إلى الشريحة.
- Deparaffinize المقاطع في تغييرين من الزيلين لمدة 5 دقائق عند 23 درجة مئوية.
- هيدرات الشرائح من خلال تغييرين من الإيثانول بنسبة 100٪ لمدة 2 دقيقة وتغييرين من الإيثانول 95٪ لمدة 2 دقيقة في 23 درجة مئوية.
- شطف المقاطع في تشغيل مياه الصنبور لمدة 2 دقيقة.
- وصمة عار مع 0.05٪ طولويدين يا الأزرق لمدة 1-2 دقيقة وشطف لفترة وجيزة مع DDH 2 O.
- وضع ساترة على العينات مع زيت الغمر والتصور مع المجهر الضوئي.
- المجهر الإلكتروني (SEM)
- إصلاح مقطوع عبر أوراق الذرة منتصف الأضلاع في 4٪ غلوتارالدهيد و 0.1 M العازلة فوسفات الصوديوم (الرقم الهيدروجيني 7.4) في 4 درجات مئوية لمدة 1-2 ساعة.
- شطف لفترة وجيزة العينات في المخزن المؤقت، المجففة لهم فيسلسلة الايثانول (25٪، 50٪، 75٪، و 95٪) لمدة 10-15 دقيقة في كل تدرج والإيثانول بنسبة 100٪ لمدة 10 دقيقة، 3X.
- تجفيف المجففة مقطوع عبر أوراق الذرة منتصف الأضلاع في مجفف نقطة حرجة باستخدام ثاني أكسيد الكربون السائل مثل السوائل الانتقالية.
- جبل العينات المجففة على بذرة الألومنيوم باستخدام علامات التبويب الكربون عالية فراغ
- معطف ورقة الذرة منتصف الأضلاع محمولة على بذرة الألومنيوم مع الذهب (حوالي 20 نانومتر سمك) في المغطي تفل تطهير بغاز الأرجون.
- فحص عينات المغلفة في JEOL JSM-6400V (سداسي بوريد اللانثانم باعث الإلكترون) المجهر الإلكتروني الماسح.
- تم المصورة الصور الرقمية باستخدام تحليل برو البرمجيات (الإصدار 3.2).
4. Klason اللجنين القياس
- مطحنة العينات من خلال الشاشة 2 مم.
- استخدام محلل الرطوبة لتحديد محتوى الرطوبة في كل عينة وتسجيل القيمة.
- تزن 1.5 غرام من ~ من كل عينة وتسجيل الشامل. Extract العينات باستخدام المياه لاستخراج الأولى، تليها لاستخراج الايثانول الثانية باستخدام مستخرج الآلي المذيبات (3 دورات في الاستخراج، ~ 14 دقيقة لكل دورة) أو جهاز سوكسليت (8 ساعات في استخراج). (ملاحظة: هذه الخطوة يزيل الإستخراجية التي يمكن أن تتكثف خلال التحلل الحامض وتتداخل مع قياس اللجنين دقيقة، وزيادة واضحة في محتوى اللجنين Klason.)
- تجفيف العينات المستخرجة في 45 درجة مئوية خلال الليل، ثم السماح لهم لتبرد في المجفف، وتزن مرة أخرى.
- تعيين حاضنة إلى 30 درجة مئوية. قياس 0.3 غرام من كل جاف، استخراج المسمار العينة إلى أعلى أنابيب الضغط العالي (يثلث لكل عينة من المستحسن) وتسجيل الأوزان إلى أقرب 0.1 ملغ. إضافة 3 مل من 72٪ H 2 SO 4 إلى كل أنبوب الضغط.
- مزيج العينة باستخدام الزجاج أو تفلون ضجة قضيب. ترك قضيب ضجة في الأنبوب حتى تتم إضافة المياه بعد الحضانة.
- وضع قارورة في حاضنة حد ذاتهر إلى 30 درجة مئوية و 150 دورة في الدقيقة لمدة 60 دقيقة. بعد 1 ساعة إضافة 84 مل من الماء منزوع الأيونات لتخفيف تركيز حمض إلى 4٪ وتخلط مع قضيب تحريك. يجب الحرص على عدم ترك كميات كبيرة من العينة على جانبي القارورة فوق خط الماء.
- بإحكام ختم سدادات على كل قارورة ووضعها في رف معدني أو الأكواب الكبيرة. الأوتوكلاف في 121 درجة مئوية باستخدام دورة التعقيم السائل لمدة 1 ساعة. تسمح لهم لتبرد إلى درجة حرارة الغرفة قبل فتح.
- قبل الرماد في بوتقة الترشيح في فرن على 575 درجة مئوية لمدة لا تقل عن 4 ساعة. السماح لتبريد البوتقات في مجفف لمدة ساعة على الأقل.
- فراغ تحديد الحل من كل أنبوب من خلال بوتقة منفصلة، وذلك باستخدام محول المطاط لتأمين بوتقة. استخدام الماء منزوع الأيونات لشطف أي جزيئات المتبقية من الأنبوب.
- تجفيف بقايا اللجنين في 105 درجة مئوية لمدة لا تقل عن 4 ساعة. تسجيل وزن بوتقة الجافة وبقايا.
- إذا باستخدام 575 درجة مئوية، قبلإطلاق النار على عينات أكثر من ناسخ بنسن حتى لا يوجد دخان أو الرماد ثم وضع في الفرن لمدة 24 ساعة، أو في حالة استخدام فرن للبرمجة، لا قبل الرماد واستخدام البرنامج التالي:
- المنحدر من درجة حرارة الغرفة إلى 105 درجة مئوية، وعقد لمدة 12 دقيقة.
- الطريق المنحدر إلى 250 درجة مئوية في 10 ° C / دقيقة وعقد لمدة 30 دقيقة.
- الطريق المنحدر إلى 575 درجة مئوية عند 20 درجة مئوية / دقيقة وعقد لمدة 180 دقيقة على الأقل.
- إزالة البوتقات من الفرن وتبرد في مجفف. تزن بوتقة والرماد.
- حساب بقايا غير قابلة للذوبان حمض باستخدام المعادلة التالية:
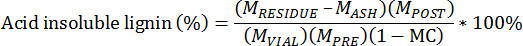
M PRE = كتلة من الكتلة الحيوية المستخرجة مسبقا
M وظيفة = الكتلة الكتلة الحيوية المستخرجة آخر،
M VIAL = كتلة من الكتلة الحيوية المستخرجة تضاف إلى القارورة
M بقايا = كتلة RESID بوتقة واللجنينرق
M ASH = كتلة بوتقة والرماد
MC = محتوى الرطوبة من الكتلة الحيوية المستخرجة مسبقا، مجموع أساس الوزن
5. تحليل الكربوهيدرات
- أداء جدار الخلية الكربوهيدرات يحلل على أساس فوستر وآخرون (2010) البروتوكول 31. باختصار، إعداد الكحول بقايا غير قابلة للذوبان من تجميد المجفف المواد النباتية. ثم يتحلل المادة مع حمض trifluoroacetic وتطابق مشتقات أحادي السكاريد solubilized إلى الأسيتات alditol يناظرها. تحليل هذه المشتقات متقلبة بواسطة كروماتوغرافيا الغاز (GC) متصلة مطياف الكتلة الرباعي.
النتائج
لقد أظهرت انخفاضا في محتوى اللجنين في النباتات الذرة عبر رني. أسفرت عن طريقة التحول الجسيمات القصف حوالي 30٪ كفاءة trnasformation. وقد لوحظ في إسكات الجينات من ZmCCR1 باستمرار في الأجيال T0-T2. نما المعدلة وراثيا اللجنين انخفاض مماثل للنباتات الذرة wildtype باستثناء عرض التلون ا...
Discussion
إمكانية الوصول إلى السليلوزات الميكروبية لزرع السكريات جدار الخلية يعتمد إلى حد كبير على الدرجة التي ترتبط بها مع البوليمرات الفينولية 23. معدل التحويل من الكتلة الحيوية للتخمر السكر اللجنوسليلوزية يرتبط سلبا مع محتوى اللجنين المودعة في جدران الخلايا النباتي...
Disclosures
أعلن عن أي تضارب في المصالح.
Acknowledgements
أجري التصوير المجهري عبر خدمات مركز جامعة ولاية ميشيغان للمتقدم المجهر. تم شراء الذرة الكالس من مركز تحويل الذرة من جامعة ولاية أيوا. فإن الكتاب أود أن أشكر جيفري R. يذرهيد من مختبر أبحاث جامعة ولاية ميشيغان النباتية للحصول على المساعدة الفنية له على تحليل الكربوهيدرات. وقد تم تمويل هذا البحث من قبل برنامج بسخاء الذرة التسويق ميشيغان (CMPM) واتحاد لأبحاث التكنولوجيا الحيوية النباتية (CPBR).
Materials
| Name | Company | Catalog Number | Comments |
| N6OSM (Osmotic medium) | Made in-house | ||
| N6E (Callus induction) | Made in-house | ||
| N6S media (Selection media) | Made in-house | ||
| Regeneration medium | Made in-house | ||
| Rooting medium | Made in-house | ||
| 10% Neutral buffered formalin (1 L) | Made in-house | ||
| Bio-Rad PSD-1000/He Particle Delivery device | Hercules, CA, United States | ||
| Zeiss PASCAL confocal laser scanning microscope | Carl Zeiss, Jena, Germany | For brightfield microscopy, the images were recorded using a Zeiss (Jena, Germany) PASCAL confocal laser scanning microscope with a 488 nm excitation mirror, a 560 nm emission filter, and a 505-530 nm emission filter. Image analysis was performed using Laser scanning microscope PASCAL LSM version 3.0 SP3 software. | |
| Excelsior ES Tissue Processor | Thermo Scientific, Pittsburgh, PA, United States | ||
| HistoCentre III Embedding Station | Thermo Scientific, Pittsburgh, PA, United States | ||
| Microtome Model Reichert 2030 | Reichert, Depew, NY, United States | ||
| Emscope Sputter Coater model SC 500 | Ashford, Kent, England | ||
| JEOL JSM-6400V Scanning Electron Microscope | JEOL Ltd., Tokyo, Japan | ||
| Fitzpatrick JT-6 Homoloid mill | Continental Process Systems, Inc., Westmont, IL | ||
| MA35 Moisture Analyzer | Sartorius | ||
| Critical point dryer, Balzers CPD | Leica Microsysstems Inc, Buffalo Grove, IL, United States | ||
| Screw-top high pressure tubes | Ace Glass, Vineland, NJ | #8648-27 | |
| Screw-top high pressure tube plugs | Ace Glass, Vineland, NJ | #5845-47 |
References
- Ralph, J., Grabber, J. H., Hatfield, R. D. Lignin-ferulate cross-links in grasses - Active incorporation of ferulate polysaccharide esters into ryegrass lignins. Carbohydrate research. , 275-178 (1995).
- Park, S. -. H. . Expediting cellulosic biofuels agenda: Production of high value-low volume co-products and lignin down-regulation of bioenergy crops [Ph.D. thesis]. , (2011).
- Boerjan, W., Ralph, J., Baucher, M. Lignin biosynthesis. Annual review of plant biology. 54, 519-546 (2003).
- Gibson, L. J. The hierarchical structure and mechanics of plant materials. Journal of the Royal Society, Interface / the Royal Society. 9, 2749-2766 (2012).
- Dien, B. S., et al. Enhancing alfalfa conversion efficiencies for sugar recovery and ethanol production by altering lignin composition. Bioresource technology. , 102-6486 (2011).
- Fu, C. X., et al. Downregulation of Cinnamyl Alcohol Dehydrogenase (CAD) Leads to Improved Saccharification Efficiency in Switchgrass. Bioenerg Res. 4, 153-164 (2011).
- Grabber, J. H., Ralph, J., Hatfield, R. D., Quideau, S. p-hydroxyphenyl, guaiacyl, and syringyl lignins have similar inhibitory effects on wall degradability. Journal of agricultural and food chemistry. 45, 2530-2532 (1997).
- Li, X., et al. Lignin monomer composition affects Arabidopsis cell-wall degradability after liquid hot water pretreatment. Biotechnology for biofuels. 3, (2010).
- Mansfield, S. D., Kang, K. Y., Chapple, C. Designed for deconstruction--poplar trees altered in cell wall lignification improve the efficacy of bioethanol production. The New phytologist. 194, 91-101 (2012).
- Studer, M. H., et al. Lignin content in natural Populus variants affects sugar release. Proceedings of the National Academy of Sciences of the United States of America. 108, 6300-6305 (2011).
- Chen, F., Dixon, R. A. Lignin modification improves fermentable sugar yields for biofuel production. Nature. 25, 759-761 (2007).
- Ziebell, A., et al. Increase in 4-coumaryl alcohol units during lignification in alfalfa (Medicago sativa) alters the extractability and molecular weight of lignin. The Journal of biological chemistry. 285, 38961-38968 (2010).
- Park, S. -. H., et al. The quest for alternatives to microbial cellulase mix production: corn stover-produced heterologous multi-cellulases readily deconstruct lignocellulosic biomass into fermentable sugars. Journal of Chemical Technolog., and Biotechnology. 86, 633-641 (2011).
- Mol, J. N., et al. Regulation of plant gene expression by antisense RNA. FEBS letters. 268, 427-430 (1990).
- Adamo, A., et al. Transgene-mediated cosuppression and RNA interference enhance germ-line apoptosis in Caenorhabditis elegans. Proceedings of the National Academy of Sciences of the United States of America. 109, 3440-3445 (2012).
- Smith, N. A., et al. Total silencing by intron-spliced hairpin RNAs. Nature. 407, 319-320 (2000).
- Park, S. -. H., et al. Downregulation of Maize Cinnamoyl-Coenzyme A Reductase via RNA Interference Technology Causes Brown Midrib and Improves Ammonia Fiber Expansion-Pretreated Conversion into Fermentable Sugars for Biofuels. Crop Sci. 52, 2687-2701 (2012).
- Altpeter, F., et al. Particle bombardment and the genetic enhancement of crops: myths and realities. Mol Breeding. 15, 305-327 (2005).
- Pichon, M., Courbou, I., Beckert, M., Boudet, A. M., Grima-Pettenati, J. Cloning and characterization of two maize cDNAs encoding cinnamoyl-CoA reductase (CCR) and differential expression of the corresponding genes. Plant molecular biology. 38, 671-676 (1998).
- Mansoor, S., Amin, I., Hussain, M., Zafar, Y., Briddon, R. W. Engineering novel traits in plants through RNA interference. Trends in plant science. 11, 559-565 (2006).
- Hatfield, R. D., Jung, H. -. J. G., Ralph, J., Buxton, D. R., Weimer, P. J. A comparison of the insoluble residues produced by the Klason lignin and acid detergent lignin procedures. J Sci Food Agr. 65, 51-58 (1994).
- Sluiter, J. B., Ruiz, R. O., Scarlata, C. J., Sluiter, A. D., Templeton, D. W. Compositional analysis of lignocellulosic feedstocks. 1. Review and description of methods. Journal of agricultural and food chemistry. 58, 9043-9053 (2010).
- Sluiter, A., Hames, B., Ruiz, R., Scarlata, C., Sluiter, J., Templeton, D., Crocker, D. Determination of structural carbohydrates and lignin in biomass. Laboratory Analytic Procedure. , (2008).
- Bate, N. J., et al. Quantitative Relationship between Phenylalanine Ammonia-Lyase Levels and Phenylpropanoid Accumulation in Transgenic Tobacco Identifies a Rate-Determining Step in Natural Product Synthesis. Proceedings of the National Academy of Sciences of the United States of America. 91, 7608-7612 (1994).
- Hu, W. J., et al. Repression of lignin biosynthesis promotes cellulose accumulation and growth in transgenic trees. Nature. 17, 808-812 (1999).
- Lapierre, C., et al. Signatures of cinnamyl alcohol dehydrogenase deficiency in poplar lignins. Phytochemistry. 65, 313-321 (2004).
- Updegraff, D. M. Semimicro determination of cellulose in biological materials. Anal Biochem. 32, 420-424 (1969).
- Yemm, E. W., Willis, A. J. The estimation of carbohydrates in plant extracts by anthrone. The Biochemical journal. 57, 508-514 (1954).
- Filomena, A. P., Cherie, W., Geoffrey, B. F., Antony, B. Determining the polysaccharide composition of plant cell walls. Nature. 7, 1590-1607 (2012).
- Foster, C. E., Martin, T. M., Pauly, M. Comprehensive Compositional Analysis of Plant Cell Walls (Lignocellulosic biomass) Part II: Carbohydrates. J. Vis. Exp. (e1837), (2010).
- Department of Agronomy, Iowa State University. Particle bombardment of Hi II immature zygotic embryos and recovery of transgenic maize plants. , (2005).
- Cano-Delgado, A., Penfield, S., Smith, C., Catley, M., Bevan, M. Reduced cellulose synthesis invokes lignification and defense responses in Arabidopsis thaliana. The Plant journal : for cell and molecular biology. 34, 351-362 (2003).
- Boudet, A. M., Kajita, S., Grima-Pettenati, J., Goffner, D. Lignins and lignocellulosics: a better control of synthesis for new and improved uses. Trends in plant science. 8, 576-581 (2003).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved