Method Article
المعدلة وراثيا القوارض الفحص لقياس ذكر جرثومة خلية متحولة التردد
In This Article
Summary
De novo mutations in the male germline may contribute to adverse health outcomes in subsequent generations. Here we describe a protocol for the use of a transgenic rodent model for quantifying mutations in male germ cells induced by environmental agents.
Abstract
De novo mutations arise mostly in the male germline and may contribute to adverse health outcomes in subsequent generations. Traditional methods for assessing the induction of germ cell mutations require the use of large numbers of animals, making them impractical. As such, germ cell mutagenicity is rarely assessed during chemical testing and risk assessment. Herein, we describe an in vivo male germ cell mutation assay using a transgenic rodent model that is based on a recently approved Organisation for Economic Co-operation and Development (OECD) test guideline. This method uses an in vitro positive selection assay to measure in vivo mutations induced in a transgenic λgt10 vector bearing a reporter gene directly in the germ cells of exposed males. We further describe how the detection of mutations in the transgene recovered from germ cells can be used to characterize the stage-specific sensitivity of the various spermatogenic cell types to mutagen exposure by controlling three experimental parameters: the duration of exposure (administration time), the time between exposure and sample collection (sampling time), and the cell population collected for analysis. Because a large number of germ cells can be assayed from a single male, this method has superior sensitivity compared with traditional methods, requires fewer animals and therefore much less time and resources.
Introduction
الطفرات الحمض النووي متفرقة في سلالة الجرثومية يمكن أن يؤدي إلى انخفاض النجاح التناسلي، وإذا ورثت، قد تسبب مرض وراثي أو استعداد لتزايد سرطان في النسل 1-3. يوضح أدلة قوية على أن نسبة كبيرة من دي نوفو طفرات موروثة من سلالة الجرثومية الأب 4، وأن عدد من الطفرات في النسل يرتبط ارتباطا إيجابيا مع سن الأب في وقت الحمل 5. ويعتقد أن نسبة أعلى من الذكور الطفرات أن تكون نتيجة للفارق في السن أثناء عملية تكوين الأمشاج بين الجنسين، وعدد أكبر من انقسامات الخلية المنوية بالمقارنة مع عدد من انقسامات الخلية oogenic في سلالة الجرثومية الإناث 2، والانخفاض التدريجي في DNA إصلاح الكفاءة مع التقدم في السن عند الذكور. كل هذه العوامل تساهم في زيادة احتمال من أخطاء النسخ المتماثل في سلالة الجرثومية الذكور 6. ومع ذلك، فإن تأثير التعرض الأب إلى بيئىالعوامل nmental على وتيرة دي نوفو الطفرات لا تزال غير مؤكدة. ومع ذلك، ومن المعروف أن عددا كبيرا من العوامل البيئية للحث على الطفرات الخلية الجرثومية في 7 القوارض، وهناك أدلة متزايدة على أن بعض هذه العوامل يمكن أن تؤثر أيضا على سلالة الجرثومية الإنسان 8. على الرغم من هذه المخاوف، ويتم اختبار المواد الكيميائية بشكل روتيني لقدرتها على إحداث الطفرات في الخلايا الجسمية لأغراض تنظيمية ويفترض عموما أن اختبارات جسدية كافية لحماية سلالة الجرثومية. لذا، نادرا ما يتم فقط بتقييم المواد الكيميائية لقدرتها على إحداث الطفرات الخلية الجرثومية.
وقد سبب واحد اختبار طفرات الخلية الجرثومية أغفل إلى حد كبير من عملية صنع القرار التنظيمية هو عدم وجود منهجيات عملية. الأساليب التقليدية القائمة على القوارض، مثل المهيمنة قاتلة 9 و 10 محددة موضع الاختبارات، وتقدر معدلات طفرة الخلية الجرثومية بتسجيله الظواهر متحولة في الأجنة أو ذريةالآباء المكشوفة. هذه المقايسات تتطلب استخدام عدد كبير جدا من الحيوانات والوقت والموارد للحصول على نتائج ذات مغزى إحصائيا.
على الرغم من أن العديد من الطرق الحديثة لقياس طفرة الخلية الجرثومية ظهرت مؤخرا، ويعاني العديد القصور من حيث التطبيق العملي، والكفاءة، وأهميتها البيولوجية. على سبيل المثال، تكرار الطفرات في توسيع طول تكرار جنبا إلى جنب بسيط (ESTR) مواضع يمكن قياسها كميا في الخلايا التناسلية الذكرية باستخدام جزيء واحد PCR النهج 15. ومع ذلك، يمكن تنفيذ هذه الطريقة أن يكون تحديا فنيا وشاقة، وعلى عكس الطفرات نقطة، والأهمية البيولوجية والصحية للتغيرات في طول تكرار ESTR مواضع غير مستقر للغاية لا تزال غير واضحة 16. يمكن للتكنولوجيات الحديثة تسلسل الجينوم كله توفر ثروة من البيانات ذات مغزى من الناحية البيولوجية عند تطبيقها على مشكلة الطفرات الوراثية 4،17، ولكن التكلفة عالية، ومعدلات خطأ عالية، والمصادقة المرتبطة مطلوبةلتأكيد الطفرات، والمعلوماتية الحيوية التحديات لا تزال تحد من التطبيق الروتيني لهذا الخيار في اختبار القدرات التنظيمية 18.
هنا، نحن تصف طريقة عملية لقياس الطفرات المستحثة مباشرة في الخلايا التناسلية للذكور الفئران المعدلة وراثيا. يوصف هذا البروتوكول لنموذج MutaMouse المعدلة وراثيا، التي لديها نسخ متسلسلة متعددة من المؤتلف ناقلات λgt10 فج تحتوي على الجين مراسل القولونية lacZ دمجها في كلا نسخ من كروموسوم 19 3 (الشكل 1).
هذا البروتوكول وثيقة الصلة أيضا القوارض المعدلة وراثيا (TGR) نماذج أخرى تقوم على نفس المبادئ (BigBlue الفأر والجرذ، أو lacZ بلازميد الماوس، الخ) أو الجينات مراسل مختلفة قليلا (GPT الماوس الدلتا والفئران، ونماذج TGR في تاريخ لامبرت وآخرون ال 20). ويستند هذا الأسلوب على الفحص طفرة TGR صفها في صدر مؤخراوالمنقحة OECD اختبار التوجيهي 21 ونحن على وضع الاعتبارات الخاصة المطلوبة لاستيعاب تقييم طفرات في سلالة الجرثومية الذكور بسبب الخصائص الفريدة من الحيوانات المنوية. لفترة وجيزة، وفحص يشمل تعريض الفئران الذكور المعدلة وراثيا إلى مادة مطفرة، تليها وقت أخذ العينات حيث يتم إصلاحها الآفات ما قبل طفرية في الطفرات مستقرة. في ذلك الوقت أخذ العينات المختارة، يصرح باستخدامها الفئران وتجمع الخلايا الجرثومية من أي ذيل البربخ أو الأنابيب المنوية. كما هو مبين أدناه، والآثار المطفرة في مراحل مختلفة من الحيوانات المنوية يمكن تحديدها عن طريق تحديد الوقت بين التعرض وجمع العينات. إدراج المعدلة وراثيا، التي تضم نسخ متعددة من جينوم λ فج لكل خلية، يتم عزل الحمض النووي الجيني من الخلايا الجرثومية وتعبئتها في فارغة capsids فج λ λ المعدية خلق جزيئات الفيروس التي تستخدم بعد ذلك لتصيب E. المضيف القولونية. وتزرع البكتيريا المصابة على SELECوسائل الإعلام TIVE يمكن أن تميز الخلايا التي تحتوي على ناقل بنسخة من lacZ تحور من خلايا إيواء البرية من نوع lacZ. يتم تحديد تأثير طفرات التعرض على الذكور سلالة الجرثومية بمقارنة تواتر الجينات المحورة متحولة بين السيطرة والفئران التي عولجت (الشكل 2، استعرض في لامبرت وآخرون 20). يمكن أن يعاير عدد كبير من الخلايا الجرثومية من ماوس واحدة، وإعطاء هذه الحساسية الفائقة الفحص على الطرق التقليدية، مع تقليل عدد الحيوانات اللازمة. ولأن مطلوب أي معدات متخصصة أو التدريب، ويوفر هذا الاختبار خيارا عمليا وكفاءة الخلية الجرثومية لاختبار تحور في معظم مختبرات البيولوجيا الجزيئية وعلم السموم / الحديثة.
أحد المتطلبات الأساسية لتطبيق الفعال للTGR طفرة الخلية الجرثومية الاختبار هو فهم دورة المنوية (الشكل 3). الوقت للخلايا الجرثومية الماوس على التقدم من شارعم في خلايا الأنابيب المنوية لأمهات المني، الخلايا المنوية، spermatids، وأخيرا إلى أن تنضج الحيوانات المنوية في البربخ (أي الحيوانات المنوية) ما يقرب من 49 يوما. يمكن أن تحدث طفرة في مختلف مراحل هذه الدورة وغالبا ما تكون محددة مركب. اثنين من السمات الرئيسية التي هي ذات أهمية خاصة لالطفرات في الخلايا التناسلية الذكرية هي وقف توليف الحمض النووي خلال الانقسام المنصف في وقت مبكر، والفقدان التدريجي للقدرة إصلاح الحمض النووي 6 في أواخر مرحلة ما بعد الانقسام المنصف، واثنين من العمليات التي مطلوبة من أجل تحريض وتثبيت لل معظم الطفرات.
بسبب هذه الخصائص الفريدة من الحيوانات المنوية، وهناك ثلاثة متغيرات تجريبية حاسمة لسير TGR طفرة الخلية الجرثومية الفحص: (1) إدارة الوقت مركب الاختبار؛ (2) وقت أخذ العينات. و (3) اختيار من السكان الخلية الجرثومية لجمع لتحليل (الشكل 3 والجدول 1). إدارة الوقت هو experimeمتغير ntal التي تحدد كيفية تتعرض الخلايا المستهدفة طويلة لمركبات الاختبار. ويمكن أيضا طول الوقت إدارة أن تستخدم لاستهداف التعرض لأنواع معينة من الخلايا أو مراحل تكوين الحيوانات المنوية. على سبيل المثال، يمكن أن تستخدم إدارة يوم واحد لتحديد الآثار المترتبة على التعرض الحاد على واحد نوع من الخلايا معين. وبالمثل، يمكن أن تركز التعرض لمرحلة المنوية بأكملها، على سبيل المثال من خلال استهداف الخلايا المنوية فقط تقسيم meiotically، أو تقسيم ميتوتيكلي أمهات المني باستخدام إدارة الوقت 2 الاسبوع والوقت المناسب لأخذ العينات. وتستخدم مرة الادارة المزمنة وشبه المزمنة لتقييم آثار التعرض على المدى الطويل، لضمان التوزيع الدوائية كاف من مجمع الاختبار، أو السماح تراكم كاف من الطفرات من المطفرة ضعيفة (على سبيل المثال إدارة الوقت 28 يوم أوصى في اختبار OECD التوجيهي).
وقت أخذ العينات هو المتغير الحاسم لتحديد الذيكانت مرحلة من مراحل تكوين الحيوانات المنوية الخلايا المستهدفة في وقت التعرض. الوقت أخذ العينات يملي كيف الكثير من الوقت، وبالتالي مدى أبعد على طول دورة المنوية، والخلايا تمر بعد التعرض. على سبيل المثال، للتحقيق في الآثار أمهات المني الخلايا الجذعية، وهو وقت أخذ العينات> 49 يوما مطلوب إذا جمع الحيوانات المنوية نضجت تماما، أو> 42 يوما إذا جمع الخلايا الجرثومية غير ناضجة من الأنابيب المنوية، لضمان أن جميع الخلايا التي تم جمعها وكان الوقت كافيا ل تطوير يتعرض ينبع من الخلايا. من المهم أن نلاحظ أن وقت أخذ العينات من 70 يوما على الأقل يكون من الأفضل لكى يبرهن على وجود تأثير الخلايا الجذعية وفيا لتوفير الوقت الكافي لتوزيعها الدوائية من السموم، للقضاء على الخلايا المعرضة في مراحل لاحقة من الحيوانات المنوية، وتمثل فترة العقم المؤقت التي قد تحدث ~ 6 أسابيع بعد التعرض للمركبات مطفرة غاية 22. وبالمثل، فإن وقت أخذ العينات من 21 يوما ضمان كولي الحيوانات المنويةأن المديرية التنفيذية من ذيل البربخ قد أكملت للتو الانقسام المنصف في اليوم الأخير من التعرض.
الخلايا الجرثومية يمكن جمعها لتصبح حيوانات منوية ناضجة من ذيل البربخ، أو على شكل مزيج من مختلف أنواع الخلايا المنوية من الأنابيب المنوية. تبقى الحيوانات المنوية الناضجة في ذيل ل~ 3 أيام، مما يجعل من الممكن لتحديد بدقة نسبية نوع من الخلايا أو مرحلة من مراحل تكوين الحيوانات المنوية من الحيوانات المنوية التي نشأت عن أي تصميم تجريبي معين. وهكذا، وتحليل تصاريح الحيوانات المنوية ذيل استهدفت غاية التحقيقات في مرحلة معينة آثار طفرية. من ناحية أخرى، تعليق خلية تم جمعها من الأنابيب المنوية تحتوي على مزيج من مختلف أنواع الخلايا الجرثومية في مراحل مختلفة من التنمية، وبالتالي توفر قرار فقرا المرحلة المنوية التي نشأت الطفرات. بالإضافة إلى ذلك، تعليق خلية تعافى من الأنابيب المنوية تميل لاحتواء التمثيل على من spermatids، تليها الخلايا المنوية، والاصدارذ القليلة أمهات المني والخلايا الجذعية (يتم تمثيل هذه النسب عن طريق أشرطة بيضاء تخرج في الشكل 3). وعلاوة على ذلك، تعليق أعدت من الأنابيب المنوية قد تحتوي أيضا على خلايا جسدية مختلفة. وهكذا، وذلك لأن العديد من أنواع الخلايا موجودة، آثار طفرية يمكن أن تتأثر مجموعة متنوعة من الخلايا غير المستهدفة. ومع ذلك، وجمع عينات من الأنابيب المنوية يوفر خيارا اقتصاديا لفحص في وقت واحد أنواع الخلايا الجرثومية متعددة، والتكامل السهل تحليل الخلية الجرثومية في معيار OECD بروتوكول اختبار للطفرة الجسدية.
أن أكرر، اعتمادا على احتياجات المحقق، إدارة الوقت، والوقت أخذ العينات والسكان الخلية التي تم جمعها يمكن تعديلها لاستجواب آثار التعرض في مختلف أنواع الخلايا، وفي مختلف مراحل تكوين الحيوانات المنوية. عن طريق اختيار بعناية هذه المتغيرات، ويمكن تصميم التجارب للدراسات الآلية المستهدفة، أو لاختبار تنظيمي أكثر المعممأغراض جي.
لتحقيق الكفاءة في الفحص، من المستحسن استخدام لتناوله عن طريق الفم الحادة من 100 ملغ / كغ N-إيثيل-N-نتروزويوريا (ENU)، تليها 70 يوما وقت أخذ العينات ومراقبة إيجابية. تحليل ذيل الحيوانات المنوية وبالتالي يستهدف الخلايا الجذعية النطفة (الشكل 3)، والتي تظهر عادة 4-5 أضعاف الزيادة في وتيرة متحولة (MF) أكثر من الضوابط التالية هذه الجرعة العالية من ENU المطفرة. تجدر الإشارة إلى أن هذه الجرعة هو معروف للحث على العقم 6 أسابيع بعد التعرض، وبالتالي قد لا يكون جرعة تحكم مناسبة لأخذ العينات أقصر الأوقات. هذه الجرعة سوف تنتج أيضا زيادة في كشف MF في معظم الأنسجة الجسدية 20. تم إنشاء نتائج ممثلة الواردة أدناه بعد التعرض الحاد +70 باستخدام نظام ثلاث جرعات من ENU وبما يصل إلى 100 ملغ / كغ.
Protocol
وتمت الموافقة على جميع البروتوكولات التي تنطوي على تربية الحيوانات والصيانة والمناولة من قبل لجنة الرعاية الصحية الحيوانية في كندا.
1. التعرض الحيوانية
- عشوائيا توزيع ذكور الفئران المعدلة وراثيا (8-12 أسابيع من العمر) للسيطرة على المجموعات ومجموعات العلاج (دقيقة = 5 لكل مجموعة) الفئران .Treat مع مجمع اختبار والتحكم ذات الصلة بطريق التعرض المناسب لإدارة الوقت المحدد. اختيار الوقت المناسب لأخذ العينات وفقا لنوع الخلية النطافي الفائدة (الشكل 3).
- بعد وقت أخذ العينات، والموت ببطء الفئران عن طريق التفكك عنق الرحم تحت التخدير isofluorane (أو طريقة أخرى مناسبة). رسم بعناية الخصيتين من شق في البطن أو كيس الصفن واستئصال epididymides ذيل. (الشكل 4، لمشاهدة فيديو تفصيلي لجمع البربخ يرى آخرون Duselis 24). بدلا من ذلك، جمع الخصيتين إذا تحليل النبيبات المنويةخلايا ق. تجميد في النيتروجين السائل وتخزينها في -80 درجة مئوية لاستخدامها لاحقا.
2. عزل وهضم بمعدل الحيوانات المنوية
- تذويب ذيل البربخ على الجليد. نقل ذيل إذابة إلى طبق بتري واللحم المفروم جيدا مع مشرط أو شفرة الحلاقة.
- إضافة 700 ميكرولتر من درجة حرارة الغرفة D-PBS إلى طبق بيتري. باستخدام واسع الجوف 1،000 ميكرولتر ماصة، وإطلاق سراح الحيوانات المنوية من الفرس عن طريق رسم والافراج عن تعليق حتى يصبح D-PBS غائما مع الحيوانات المنوية (حوالي 10 مرات). ملاحظة: لإعداد واسعة الجوف ماصة قطع 2-3 ملم من نهاية ماصة غيض من البلاستيك.
- فلتر من خلال تعليق غير القابل للصدأ شبكة الصلب مرشح في أنبوب 1.5 مل الطازجة. غسل طبق بيتري مع 700 ميكرولتر إضافية من D-PBS ونقل إلى نفس أنبوب 1.5 مل من خلال تصفية شبكة. إزالة شبكة، ووضع أنبوب على الجليد.
- كرر الخطوات من 2،1-2،3 للعينات المتبقية.
- تدور samplesat 11،000 x ج لمدة 3 دقائق. طاف صب بعناية. تجنب إزعاج بيليه.
- إضافة 1.0 مل الباردة 1X سيترات الصوديوم المالحة (SSC). دوامة حتى بيليه والانتهاء من إعادة تعليق. هذا وسوف يستغرق أحيانا عدة جولات من vortexing ل.
- إضافة 15 ميكرولتر من 10٪ SDS. عكس / هزة بقوة لمدة 30 ثانية لتعطيل خلايا الحيوانات المنوية غير. سوف يهز بلطف جدا يؤدي إلى عدم كفاية انقطاع وسوف بيليه لا تشكل بشكل صحيح في الخطوة التالية.
- تدور 11،000 x ج لمدة 2 دقيقة. وفضفاضة، "رقيق" بيليه يدل على اضطراب غير مكتملة من الخلايا الجسدية غير كافية بسبب الهز في الخطوة 2.7. إذا حدث هذا، ببساطة يهز عينة مرة أخرى، وrespin حين تشكيل بيليه مشددة. صب بعناية طاف. تجنب إزعاج بيليه. باختصار تدور مرة أخرى وإزالة ما تبقى طاف مع ماصة 200 ميكرولتر.
- إضافة 940 ميكرولتر 0.2x SSC البارد ودوامة حتى يتم معلق بيليه. قد يكون هذا بيليه الصعب جدا اعادة تعليق قد يستغرق عدة جولات من vortexing ل. أحيانا كتل من قبيرم لا يمكن تجنبها.
- إضافة 120 ميكرولتر β-المركابتويثانول، و 100 ميكرولتر 10٪ SDS، 20 ميكرولتر 0.5M EDTA، ودرجة الحموضة 8 و 20 ميكرولتر بروتين K (60 ملغ / مل، أعد الطازجة). تخلط جيدا وهضم ليلة وضحاها مع دوران عند 37 درجة مئوية. الشروع في استخراج الفينول / الكلوروفورم.
3. الفينول / الكلوروفورم استخراج الحمض النووي من ذيل الحيوانات المنوية
ملاحظة: نظرا لأن المعقد الحمض النووي النووي في spermatids المرحلة المتأخرة والحيوان المنوي الناضج مع protamines، ويتم تكثيف للغاية مقارنة الحمض النووي للخلايا الجسدية والأساليب التقليدية عزل الحمض النووي DNA لن تولد ما يكفي من العائد والنقاء للمقايسة طفرة في العمل كفاءة. ويلزم متعددة الاستخراج الفينول كلوروفورم بعد الهضم العدواني لاطلاق سراح وتنقية الحمض النووي الحيوانات المنوية (على أساس أساليب من 15).
- خلية الحيوان المنوي نقل هضم لأنبوب البولي بروبلين 15 مل.
- إضافة 2 مل من الفينول: خليط الكلوروفورم (1: 1). تدوير الأنبوب في 22 دورة في الدقيقةلمدة 3 دقائق.
- الطرد المركزي في 1600 x ج لمدة 10 دقيقة ونقل الطبقة العليا مائي مع طبقة واجهة غامض إلى أنبوب 15 مل الطازجة.
- كرر الخطوات من 3.1.2 و 3.1.3 3X، ولكن تغيير الأوقات التناوب على 3 دقائق، 4 دقائق و 6 دقائق، على التوالي. على تكرار النهائي، وتجنب نقل أي من "غامض" طبقة واجهة.
- بعد استخراج ال 4، إضافة 70 ميكرولتر من 3M NaAc، ودرجة الحموضة 5.2 لكل 1 مل من المستخلص المائي و 2 مل من الكلوروفورم: كحول أيزو أميلي (24: 1). تدوير الأنبوب في 22 دورة في الدقيقة لمدة 12 دقيقة.
- الطرد المركزي في 1600 x ج لمدة 10 دقيقة ونقل الطبقة العليا مائي لأنبوب 15 مل الطازجة.
- ترسيب الحمض النووي عن طريق إضافة 2 مجلدات من الايثانول المطلق وتناوب بلطف أنبوب على جانبها مع هزاز لطيف.
- جمع الحمض النووي عن طريق التخزين المؤقت على غيض من المراعي ماصة حرارة مختومة. يشطف الحمض النووي عن طريق يحوم طرف الماصة في الايثانول 70٪ والهواء الجاف لمدة 5 دقائق.
- بعد استخراج، ويحل راسب الحمض النووي في 40-100 ميكرولتر تريS-EDTA العازلة، ودرجة الحموضة 8. مخزن في 4 درجات مئوية. السماح للDNA بحل عند 4 درجة مئوية لمدة لا تقل عن يومين قبل الانتقال إلى lacZ طفرة الفحص. إذا واجهت قضايا الذوبان، الحمض النووي يمكن حله مرة أخرى في 65 درجة مئوية لمدة 15 دقيقة قبل الاستخدام. تحديد تركيز الحمض النووي مع spectrophotometre في A 260 وضمان تركيز الحمض النووي المذاب بين 200-2،000 نانوغرام / ميكرولتر.
4. عزل والهضم من الخلايا الجرثومية من المنوية نبيبات
- إذا جمدت، تذويب الخصية على الجليد (حوالي 1 ساعة). نقل الخصية إلى لوحة زجاج الأرض.
- عقد واحدة من نهاية الخصية مع زوج من ملقط. في الطرف الآخر من الخصية، ثقب ثقب في كبسولة الظهارية استخدام زوج آخر من ملقط أو مقص تشريح (الشكل 5A). ضغط على الأنابيب المنوية من خلال ثقب وتجاهل كبسولة الظهارية (الشكل 5B).
- وDD 500 ميكرولتر من درجة حرارة الغرفة D-PBS إلى الأنابيب المنوية decapsulated.
- زاوية الأسطوانة النسيج (مطاط السيليكون تركيبها بإحكام على الدورية بحرية 5 مم أنبوب الفولاذ المقاوم للصدأ، أو جهاز مماثل) حتى نهاية واحدة هي على اتصال مع لوحة في زاوية التقريبية من 5-10 درجة (الشكل 5C). دون تطبيق أي ضغط، نقل الأسطوانة بلطف ذهابا وإيابا عبر الأنابيب حتى يتم بالارض هم وD-PBS يصبح غائما مع خلايا صدر (حوالي 5-10x).
- إضافة 500 ميكرولتر آخر من D-PBS خلال الأنابيب ولفة بلطف على الأنابيب عدة مرات إضافية.
- نقل تعليق خلية إلى أنبوب 1.5 مل microfuge مع التقليل من كمية الأنابيب منفصلة نقله (الشكل 5D).
- كرر الخطوات من 4،5-4،6 لجمع المزيد من الخلايا إذا لزم الأمر.
- تسمح 1 - 2 دقيقة لأي الأنابيب التي تم جمعها عن طريق الخطأ لتستقر في قاع الأنبوب. نقل D-PBS إلى الابالعش 1.5 مل أنبوب تاركا وراءه الأنابيب استقر (حوالي 100 ميكرولتر من D-PBS). وقسامة صغيرة من هذا تعليق يمكن التحقق تحت المجهر (المرحلة النقيض) لتقييم تركيبة السكان الخلية.
- تدور باستمرار في الخلايا 11،000 x ج لمدة 30 ثانية. صب بعناية طاف دون الإخلال بيليه. بيليه الخلية يمكن تجميد في -80 درجة مئوية في هذه المرحلة إذا لزم الأمر.
- ذوبان الجليد الخلايا إذا لزم الأمر. نقل إلى أنبوب 15 مل البولي بروبلين و resuspend الخلايا في 5 مل من تحلل العازلة (10 ملي تريس درجة الحموضة 7.6، 10 ملي EDTA، 100 مم كلوريد الصوديوم، 1 ملغ / مل K بروتين، 1٪ SDS). دايجست بين عشية وضحاها في حاضنة مع دوران عند 37 درجة مئوية.
- الشروع في استخراج الفينول / الكلوروفورم.
5. الفينول / كلوروفورم استخراج الحمض النووي من الخلايا المنوية الأنبوب الصغير جرثومة
ملاحظة: يتم استخدام استخراج أقل عدوانية لعزل DNA الخلية الجرثومية الأنابيب المنوية، حيث أن أنواع الخلايا هذه لم يتقدم بعد من خلال نالتكثيف uclear.
- إضافة 5 مل من الفينول: خليط الكلوروفورم (1: 1) لالمنوية بين عشية وضحاها الهضم خلية الأنابيب. تدوير الأنبوب في 22 دورة في الدقيقة لمدة 20 دقيقة.
- الطرد المركزي في 1600 x ج لمدة 10 دقيقة ونقل الطبقة العليا مائي، مع تجنب "غامض" طبقة واجهة، إلى أنبوب 15 مل الطازجة.
- إضافة 100 ميكرولتر من كلوريد الصوديوم M 5 لكل 5 مل المستخلص المائي (عادة يتم استرداد 5 مل)
- إضافة 5 مل من الكلوروفورم: isoamylalcohol (24: 1). تدوير الأنبوب في 22 دورة في الدقيقة لمدة 12 دقيقة.
- الطرد المركزي في 1600 x ج لمدة 10 دقيقة ونقل الطبقة العليا مائي لأنبوب 15 مل الطازجة.
- ترسيب الحمض النووي عن طريق إضافة 2 مجلدات من الايثانول المطلق وبلطف الدورية وعكس أنابيب.
- جمع الحمض النووي عن طريق التخزين المؤقت على غيض من ماصة أغلقت المراعي. يشطف الحمض النووي عن طريق يحوم طرف الماصة في الايثانول 70٪ والهواء الجاف لمدة 5 دقائق.
- حل DNA في 40-100 ميكرولتر تريس، EDTA العازلة، ودرجة الحموضة 8. مخزن في 4 درجات مئوية. سماح DNA بحل عند 4 درجة مئوية لمدة لا تقل عن سنتينقبل أيام الشروع في lacZ طفرة فحص (انظر الخطوة 3.9). إذا واجهت قضايا الذوبان، الحمض النووي يمكن حله مرة أخرى في 65 درجة مئوية لمدة 15 دقيقة قبل الاستخدام. تحديد تركيز الحمض النووي مع spectrophotometre في A 260 وضمان تركيز ما بين 200 و 2،000 نانوغرام / ميكرولتر.
6. LacZ طفرة الفحص
التلوث الجرثومي أو الفطري يمكن أن تتداخل مع كفاءة التعبئة والتغليف، فضلا عن النمو البلاك والتهديف. لذلك من المهم لإجراء فحص lacZ باستخدام تدابير العقيم المناسبة لمنع التلوث من رد فعل والتغليف، وثقافة البلد المضيف ونمو وسائل الإعلام.
- قبل يوم الفحص: إعداد أسفل آجار والثقافة بين عشية وضحاها
- ثمانية لوحات (4 لوحات ليسجل المسوخ، 4 لوحات لحساب عيار) التي تحتوي على 8 مل أسفل أجار مطلوبة في كل عينة (أي، 64 مل لكل عينة). آغار أسفل مطابق لكلالوحات عدد متحولة وعيار. إعداد كافية أجار أسفل لعدد من العينات التي يتم معالجتها. تصب في جو معقم و مطهر 90 ملم أطباق بتري (8 مل لكل طبق) والسماح أجار ليصلب. ملاحظة: يمكن إعداد لوحات أجار القاع تصل إلى 1 أسبوع مقدما.
- في أنبوب 50 مل إضافة 10 مل مرق LB، 100 ميكرولتر من 20٪ محلول مالتوز، 25 ميكرولتر الأمبيسيلين (20 ملغ / مل) و 20 ميكرولتر كاناميسين (5 ملغ / مل). تطعيم مع E. القولونية (lacZ - / غيل -) 25 وتنمو بين عشية وضحاها في 37 درجة مئوية مع اهتزاز عند 240 دورة في الدقيقة.
- يوم 1: خلايا الثقافة الفرعية
- خلايا الثقافة الفرعية من خلال إعداد 1: 100 التخفيف من الثقافة بين عشية وضحاها في LB الطازجة (أي المضادات الحيوية). وهناك حاجة إلى حجم 8 مل من ثقافة فرعية لكل عينة. احتضان عند 37 درجة مئوية مع اهتزاز عند 240 دورة في الدقيقة لمدة 3.5 ساعة حتى OD 600 = 1.
- عندما OD 600 = 1، الانقسام الخلوي تعليق بالتساوي إلى 50 مل أنابيب وأجهزة الطرد المركزي في 1،300 x ج عند 15 درجة مئوية لمدة 10دقيقة. إزالة طاف واعادة تعليق الخلايا في نصف الحجم الأصلي (أي، 4 مل لكل عينة) من LB تحتوي على 10 ملي MgSO 4. وضع خلايا جانبا لحين الحاجة إليها [خطوة 6.2.4.3].
- يوم 1: تغليف الحمض النووي في لامبدا فج الجسيمات
- الاحماء حمام مائي إلى 30 درجة مئوية.
- باستخدام واسع الجوف 10 ميكرولتر ماصة، ونقل 4 ميكرولتر الحمض النووي لأنبوب 1.5 مل. ملاحظة: هذه الخطوة يمكن أن يؤديها يوميا أو أكثر في وقت مبكر للحد من إعداد الوقت.
- الاحماء الأنبوب الأول (الأحمر) من مجموعة فج استخراج التعبئة والتغليف (1 أنبوب لكل عينات 2). تدور لفترة وجيزة لجمع استخراج في أسفل الأنبوب.
- نقل 4.8 ميكرولتر من استخراج التعبئة والتغليف من الأنبوب الأول إلى عينة من الحمض النووي وتخلط بواسطة التحريك لطيف مع طرف ماصة. تدور لفترة وجيزة أسفل العينات في الأنابيب. احتضان لمدة 1.5 ساعة في 30 ° C حمام الماء.
- الاحماء الثاني (الازرق) استخراج التعبئة والتغليف أنبوب (1 أنبوب لل~ 15 عينة). تدور لفترة وجيزة لجمع استخراج في القاعمن الأنبوب.
- نقل 4.8 ميكرولتر من استخراج التعبئة والتغليف من الأنبوب الثاني لعينة من الحمض النووي وتخلط بواسطة التحريك لطيف. تدور لفترة وجيزة أسفل العينات في الأنابيب. احتضان لمدة 1.5 ساعة إضافية في 30 ° C حمام الماء.
- إعادة تعليق جسيمات فج تعبئتها في 500 ميكرولتر عازلة SM ومزيج من قبل الدورية لمدة 30 دقيقة في 20 دورة في الدقيقة.
- بعد بالتناوب، وعينات لفترة وجيزة دوامة والطرد المركزي في 11،000 x ج لمدة 30 ثانية لجمع عينات في اسفل الأنابيب. جسيمات فج جاهزة للعدوى [خطوة 6.2.4].
- اليوم 1: إعداد آجار الأعلى
- إعداد أعلى أجار منفصل لوحات ولوحات عيار اختيار متحولة. تتطلب كل عينة 4 لوحات عيار، و 4 لوحات متحولة. كل لوحة يتطلب 8 مل أجار أعلى. إضافة عامل انتقائي فينيل-β-D-galactopyranoside (P-غال) إلى الأعلى اختيار متحولة أجار فقط. إعداد كل من أعلى agars مقدما (يوم الفحص) والحفاظ على 50 درجة مئوية قبل إضافة MgSO 4 إلى أعلى حد سواء agars، وPGالقاعدة لمتحولة اختيار أجار.
- يوم 1: تصيب الخلايا مع فج تعبئتها والتصفيحات
- تسمية اثنين من 50 مل أنابيب لكل عينة: 1 "المسخ" أنبوب لكل عينة و1 "عيار" أنبوب لكل عينة
- تسمية 8 أجار لوحات لكل عينة: 4 "المسخ" لوحات لكل عينة و4 "عيار" لوحات لكل عينة
- قسامة 2 مل من الخلايا معلق [من الخطوة 6.2.1.2] لكل أنبوب.
- إضافة 500 ميكرولتر من جزيئات فج تعبئتها [من الخطوة 6.2.2.8] إلى "متحولة" أنبوب 50 مل (الخلايا التي تحتوي على). مزيج بلطف والسماح جسيمات فج لتصيب الخلايا لمدة 30 دقيقة في درجة حرارة الغرفة.
- بعد 30 دقيقة، لفترة وجيزة دوامة الخلايا المصابة ونقل 15 ميكرولتر من الخلايا المصابة إلى 50 مل المناسبة "عيار" أنبوب (التي تحتوي على خلايا).
- لوحة عينة عيار، إضافة 30 مل من دافئ (50 درجة مئوية) "عيار" أجار أعلى (لا تحتوي على P-غال) إلى "عيار" أنبوب 50 مل. DISTRIB فورايوت خليط أجار / خلية بين 4 لوحات "عيار" (~ 8 مل لكل لوحة). العمل بسرعة حتى يتسنى للأجار أعلى لا تبرد في الماصات، وليس محاولة لإدخال فقاعات الهواء.
- لوحة العينات "متحولة" المقبل. يضاف P-غال على "اختيار متحولة" أعلى أجار ضمان. إضافة 30 مل من الحارة "اختيار متحولة" أجار (التي تحتوي على P-غال) إلى "متحولة" أنبوب 50 مل. توزيع فورا خليط أجار / خلية بين 4 لوحات "المسخ" (~ 8 مل لكل لوحة).
- السماح لوحات ليصلب (~ 15 دقيقة) ثم قلب واحتضان عند 37 درجة مئوية خلال الليل.
- يوم 2: عد اللوحات
- بعد مرور فترة الحضانة بين عشية وضحاها، حساب عدد لويحات على متحولة وعيار لوحات. لأعداد كبيرة من اللوحات، عد سوى جزء من لوحة لتقدير العدد الكلي (على سبيل المثال، غالبا ما ¼ من لوحة عيار سيكون بين 100-200 لويحات). ينبغي أن يحسب ما لا يقل عن 100 لوحات في لوحة عند فصول التوجيه الجامعيnting جزء من اللوحة.
- حساب عدد الوحدات وحة تشكيل (PFUs) لكل ميكرولتر من الخلايا. يتم ذلك عن طريق قسمة عدد لويحات على لوحات "عيار" حسب حجم خلايا مطلي (15 ميكرولتر).
- استخدام عدد من PFUs / ميكرولتر لتقدير العدد الإجمالي للPFUs في حجم الكلي للخلايا المصابة مطلية على لوحات "متحولة" (PFUs / ميكرولتر * [2 مل خلايا + 0.5 مل حزم جسيمات فج - 15 ميكرولتر لوحات عيار] ).
- تقدير MF بقسمة العدد الكلي لويحات متحولة يعول على 4 "المسخ" لوحات من العدد الإجمالي المقدر لPFUs في إجمالي حجم الخلايا المصابة تحديد من لوحات "عيار".
- عندما تكون عفوية lacZ MF هو في حدود 3 × 10 -5 في المجموعة الضابطة، كما للخلايا الجرثومية MutaMouse، يوصي التوجيهي OECD ما لا يقل عن 125،000 إلى 300،000 PFUs غير متحولة للحيوان الواحد تكون الشاشةإد لطفرة من أجل الحصول على إشارة خط الأساس يمكن الاعتماد عليها. قد يكون النماذج المعدلة وراثيا أخرى أقل عفوية MF، وفي هذه الحالة لن تكون هناك حاجة إلى عدد أكبر من PFUs. اختبار القوة الإحصائي يمكن القيام بها من أجل تحديد الحد الأدنى لعدد PFUs والحيوانات المطلوبة للحصول على الدقة المطلوبة. يمكن تجميع البيانات من مكررات متعددة لتلبية هذا الشرط الحد الأدنى PFU، شريطة أن لا تنتج الترددات متحولة مختلفة إلى حد كبير.
7. الاحصائيات
وحدة تجريبية لتحليل هو الماوس. عموما لا توزع عادة البيانات التي تنتج من هذا الاختبار. على هذا النحو، وحدد طريقة إحصائية لتحليل يستند إلى خاصية توزيع البيانات.
ملاحظة: معيار التحليلات المعلمية (على سبيل المثال، ANOVA) يمكن أن تستخدم إذا تم تطبيق تحويل البيانات المناسب لمعادلة التباين في الاستجابة عبر مجموعة من observaنشوئها. بواسون أو تحليلات الانحدار ذات الحدين وغالبا ما تكون أكثر ملاءمة. ويمكن أيضا أن تستخدم تحليل اللامعلمية. نحن عادة استخدام بواسون الانحدار باستخدام الإجراء النموذج الخطي المعمم (أي.، بروك GENMOD) في SAS v.9.2 (معهد ساس، كاري، NC) كما وصفها يميو وآخرون 26.
النتائج
مع عدد متوسط من 200،000 وحة ويحات لكل حيوان، نلاحظ عادة يعني خلفية MF حوالي 2.8 × 10 -5 في الخلايا التناسلية الذكرية مع انحراف معياري 1.7 × 10 -5 في مجموعات سيطرتنا (استنادا إلى بيانات من ثمانية مستقلة تجارب). مع هذا العدد لوحة، الخلفية ومستوى التباين والجماعات مع جرعة ن = 5 الحيوانات كل تكفي للكشف عن زيادة بنسبة 2 أضعاف في MF مع السلطة> 0.8.
عادة يتم الإبلاغ عن النتائج في جداول أو رسوم بيانية الأشكال. الجدول 2 والشكل 6 تظهر نتائج ممثلة من ذيل الحيوانات المنوية من الذكور MutaMouse (ن = 5 لكل مجموعة) يتعرض لجرعة واحدة عن طريق الفم الحادة من 0، 25، 50، و 100 ملغم / كغم N-إيثيل-N-نتروزويوريا (ENU)، يليه وقت أخذ العينات 70 يوم. هذه الفترة 70 يوما تسمح بقياس طفرية الأحداث التي وقعت في الحيوانات المنوية التي كانت الخلايا الجذعية النطفة في وقت التعرض (الشكل 3). وتظهر كثافة وحة نموذجية على لوحات متحولة وعيار في الشكل 7. كما هو مبين في الجدول 2 والشكل (6)، والتعرض ENU الحادة يسببها زيادة كبيرة تعتمد على الجرعة في MF الخلايا الجذعية النطفة. جرعة منخفضة بفعل بنسبة كبيرة 2.6 أضعاف أكثر من الضوابط، التي كان لها خط الأساس MF 2.6 × 10 -5. وقع أقصى التعريفي في الجرعة العالية، والتي أثارت زيادة 4.4 أضعاف أكثر من الضوابط.
مثال على هذا الاختبار تجرى على الخلايا الجرثومية النبيبات المنوية يمكن العثور عليها في دوغلاس وآخرون 27، حيث تم تحديد MF في الخلايا الجرثومية أنبوب صغير على فترات زمنية مختلفة بعد 5 أيام تكرار الحقن داخل الصفاق من 50 ملغ / كغ ENU. في تلك الدراسة، زادت الترددات الطافرة في الخلايا المنوية تصل إلى 15 أيام بعد العلاج وظلت ثابتة بعد ذلك.
| المعرضمتأكد نظام | الأنسجة التي تم جمعها | نوع من الخلايا التي تم جمعها (الخلية المستهدفة) | مرحلة الخلية المستهدفة في بداية التعرض | مراحل مرت خلال التعرض |
| الحادة + 70 | ذيل | الحيوانات المنوية الناضجة | الخلايا الجذعية | الخلايا الجذعية |
| 14 + 21 | ذيل | الحيوانات المنوية الناضجة | أمهات المني | Spermatid |
| 14 + 35 | ذيل | الحيوانات المنوية الناضجة | الخلايا الجذعية | خلية نطفية |
| 28 + 3 | ذيل | الحيوانات المنوية الناضجة | خلية نطفية | خلية نطفية Spermatid الحيوانات المنوية الناضجة |
| الأنابيب | الخلايا الجذعية | الخلايا الجذعية | الخلايا الجذعية | |
| أمهات المني | سermatogonia | أمهات المني | ||
| خلية نطفية | خلية نطفية | |||
| Spermatid | Spermatid | |||
| 28 + 49 | ذيل | الحيوانات المنوية الناضجة | سل الجذعية | الخلايا الجذعية |
| الأنابيب | الخلايا الجذعية أمهات المني خلية نطفية Spermatid | الخلايا الجذعية | الخلايا الجذعية |
الجدول 1. أنواع الخليوي ومراحل تكوين الحيوانات المنوية التي يستهدفها المعدلة وراثيا فحص طفرة القوارض بواسطة تصاميم تجريبية مختلفة.
| مجموعة الجرعة | # الحيوان | متحولة PFU | إجمالي PFU | MF (خ10 -5) | متوسط MF (× 10 -5) | تغيير أضعاف | ف القيمة |
| السيطرة | 1 | 5 | 180245 | 2.8 | 2.6 | 1.0 | - |
| 2 | 4 | 137835 | 2.9 | ||||
| 3 | 11 | 385672 | 2.9 | ||||
| 4 | 2 | 431396 | 0.5 | ||||
| 5 | 6 | 152413 | 3.9 | ||||
| 25 مغ / كغ | 6 | 17 | 162353 | 10.5 | 6.9 | 2.6 | 0.0002 |
| 7 | 14 | 150094 | 9.3 | ||||
| 8 | 4 | 154401 | 2.6 | ||||
| 9 | 9 | 154401 | 5.8 | ||||
| 10 | 12 | 196978 | 6.1 | ||||
| 50 مغ / كغ | 11 | 17 | 155727 | 10.9 | 9.3 | 3.6 | <0.0001 |
| 12 | 11 | 135847 | 8.1 | ||||
| 13 | 25 | 193499 | 12.9 | ||||
| 14 | 12 | 133859 | 9.0 | ||||
| 15 | 14 | 252807 | 5.5 | ||||
| 100 ملغ / كغ | 16 | 26 | 170968 | 15.2 | 11.5 | 4.4 | <0.0001 |
| 17 | 28 | 234584 | 11.9 | ||||
| 18 | 10 | 145289 | 6.9 | ||||
| 19 | 35 | 292236 | 12.0 | ||||
| 20 | 22 | 190848 | 11.5 |
الجدول 2. تردد متحولة lacZ في ذيل الحيوانات المنوية من الذكور المعدلة وراثيا مكريم يتعرض تماما لENU عندما كانت خلايا النطفة الجذعية (إدارة الوقت = 1 يوم، وقت أخذ العينات = 70 يوما). PFU = البلاك تشكيل وحدة، MF = التردد متحولة.
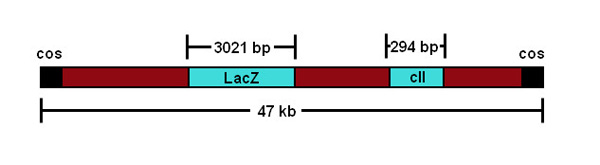
الشكل 1. التمثيل التخطيطي لبناء λgt10 فج.
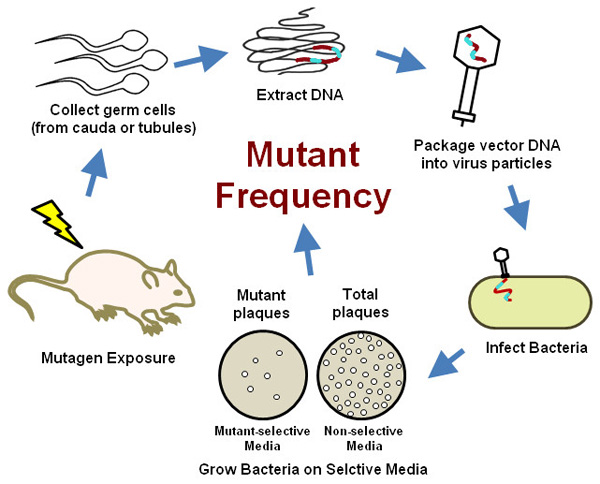
الشكل 2. مخطط من القوارض المعدلة وراثيا طفرة الخلية الجرثومية الفحص.
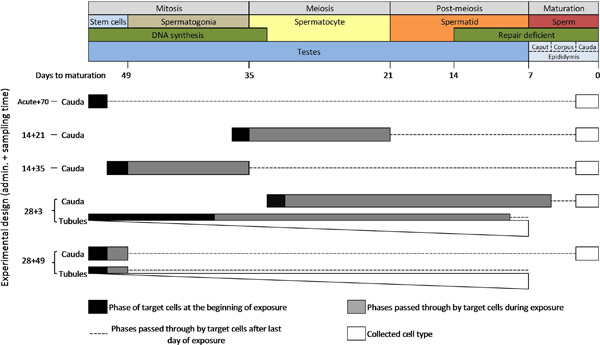
الرقم 3. رسم تخطيطي لتكوين الحيوانات المنوية في الماوس وأنواع الخلايا وphas العناوين التي استهدفتها المعدلة وراثيا فحص طفرة القوارض بواسطة تصاميم تجريبية مختلفة ملاحظة: أشرطة بيضاء تخرج وتمثل الحصة النسبية من أنواع الخلايا الموجودة في تعليق خلية أعدت من الأنابيب المنوية (أي spermatids> المنوية> أمهات المني> الخلايا الجذعية). الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
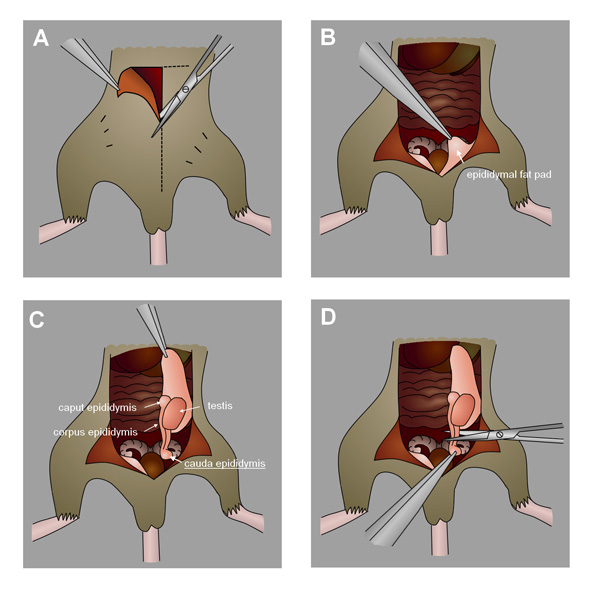
الرقم 4. مجموعة من البربخ ذيل الماوس. أ) إجراء شق في البطن نحو كيس الصفن. B) تحديد بربخي الدهون سادة. C) برفق لوحة الدهون لاستخلاص الخصيتين والبربخ. D) موقع واستئصال البربخ ذيل.
ق ق = "jove_content" FO: المحافظة على together.within الصفحات = "دائما"> 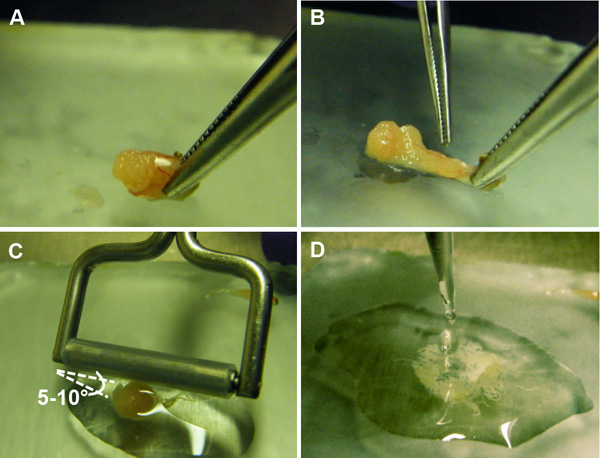
الرقم 5. إعداد تعليق الخلايا الجرثومية من الأنابيب المنوية. A) يتم إجراء شق في كبسولة الظهارية من الخصية، وتعريض الأنابيب المنوية. B) وتقلص الأنابيب المنوية للخروج من الكبسولة. C) يتم تمرير بكرة الأنسجة برفق فوق الأنابيب في زاوية 5-10 درجة ل الافراج عن الخلايا الجرثومية الواردة في. D) يتم جمع الخلايا الجرثومية تعليق لمزيد من المعالجة.
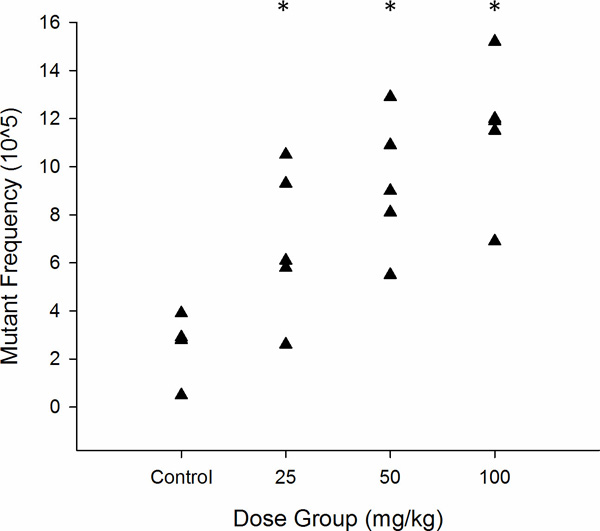
الرقم 6. التمثيل البياني للlacZ تردد متحولة في MutaMouse الحيوانات المنوية يتعرض تماما كما خلايا الجذعية لENU (ن = 5). كليمثل مثلث MF من حيوان واحد. * P <0.05 على النحو الذي يحدده بواسون الانحدار.
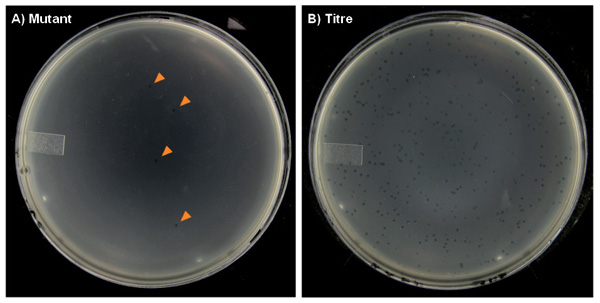
الرقم 7. لوحات أجار التمثيلية من القوارض المعدلة وراثيا مع تحور فحص ويحات شكلت على العشب من E. البكتيريا القولونية المضيف. أ) لوحات "متحولة" سيكون لها عدد قليل جدا من لويحات (يتسم مع سهم)، وخاصة في مجموعات جرعة السيطرة، والتي سيكون لها أحيانا الصفر لويحات على بعض لوحات. B) يمكن للوحات "عيار" لديها المئات من اللوحات.
Discussion
بالمقارنة مع الأساليب التقليدية، يوفر TGR طفرة الخلية الجرثومية فحص وسيلة أسرع وأكثر اقتصادية، وأكثر حساسية لقياس يسببها في الجسم الحي الطفرات الخلية الجرثومية. من خلال تقييم التحوير MF مباشرة في الحيوانات المنوية، على عكس ذرية، وعدد من الحيوانات، يتم تقليل الوقت والموارد اللازمة لتقييم الطفرات الجرثومية في أي مجمع واحد كبير. من حيث الحساسية، تمكنا من الكشف عن زيادة كبيرة 2.6 أضعاف في الخلايا الجذعية أمهات المني MF بعد التعرض إلى 25 مغ / كغ ENU فقط باستخدام 5 حيوانات لكل مجموعة الجرعة. في المقابل، لم يتمكن من اكتشاف أي تغيير كبير في MF عند هذه الجرعة نفسها باستخدام> 3،000 الفئران في المجموعة المكشوفة و> 500،000 السيطرة على الفئران 28 فحص موضع معين.
بالإضافة إلى ملاءمتها لكلا التحقيقات الميكانيكية والتنظيمية، وهذه الطريقة توفر فرصة لإجراء دراسات مقارنة بين جسدية والجرثومية خط mutatiعلى أسعار الفائدة. وتشير الأدلة الحديثة إلى أن بعض وكلاء قد يسببها الطفرات الخلية الجرثومية في أقل تركيز من المطلوب للطفرة الجسدية. على سبيل المثال، التعرض لفترات طويلة لN-hydroxymethylacrylamide، وهو المستقلب من الأكريلاميد مادة مسرطنة الغذاء 12، ويزيد من وتيرة المهيمنة قاتلة الطفرات الخلية الجرثومية في الفئران دون التأثير على تردد النواة الصغرى في خلايا الدم الحمراء، وهو مقياس تقليدي من خلية جسدية الضرر الوراثي الخلوي 13. بالإضافة إلى ذلك، تعرض الفئران لكلا الترددات طفرة التيار الرئيسي والجانبي التبغ يسبب الدخان ترتفع في ترادف تكرار مواضع الحمض النووي في الحيوانات المنوية في الجرعات التي لا زيادة تردد النواة الصغرى الدم 14. هذه النتائج تتحدى الافتراض أن اختبار السمية الوراثية الجسدية هو دائما واقية من سلالة الجرثومية، وتعزز الطلب على وسيلة أكثر كفاءة وفعالية من حيث التكلفة لتحديد الجرثومة تردد طفرة الخلية. ومع ذلك، فإن الأدلة لتفضيلية المطفرة الخلية الجرثومية لا يزال ضعيفا، إلى حد كبير بسبب نقص البيانات المتوفرة لمقارنة معدلات طفرة في أنسجة الخلايا الجسدية والجرثومية. يسمح الطفرة فحص TGR اختبار مواز ومقارنة معدلات الطفرات المستحثة في أنسجة متعددة باستخدام نفس التحوير. وبالتالي، طفرة المقارنة اختبار باستخدام الفحص TGR من شأنه أن يساعد ملء الثغرات في البيانات المحيطة إمكانية آثار الخلية الجرثومية تفضيلية.
ان تقييم المتزامن لطفرة الخلية الجسدية والجرثومية لاختبار التنظيمي أيضا تحسين الكفاءة من خلال تقليل عدد الحيوانات اللازمة. المبادئ التوجيهية لمنظمة التعاون والتنمية طفرة جسدية يوصي وقت الإدارة 28 يوما، تليها فترة أخذ العينات لمدة ثلاثة أيام (28 + 3). تحليل ذيل الحيوانات المنوية قد تقدم الفقيرة حساسية عند هذه النقطة الزمن، لأنه يستهدف الخلايا المعرضة معظمها خلال خلية نطفية وspermatid مراحل تكوين الحيوانات المنوية (الشكل 3). الخلايا في هذه المراحل لا توليف الحمض النووي وتفقد تدريجيا قدرتها على إصلاح الحمض النووي 6 </ سوب>. وعلاوة على ذلك، فإن الحيوانات المنوية ذيل أخذ العينات عند هذه النقطة مرة تفشل في الكشف عن الطفرات التي تحدث في الخلايا الجذعية وأمهات المني. وهكذا، على الاندماج في تصميم 28 + 3، يوصي التوجيهي OECD جمع الخلايا الجرثومية من الأنابيب المنوية. يحتوي هذا يقطنها خليط سكاني الخلايا المشتقة من تخليق DNA وإصلاح يتقن أنواع الخلايا، بما فيها الخلايا الجذعية، وتتعرض في معظم مراحل المنوية. ولكن نظرا لطبيعة مختلطة من هذه الخلايا، الخلايا المنوية تحليل الأنابيب لا يقدم معلومات مرحلة محددة. وعلاوة على ذلك، هناك قلق من أن وجود خلايا غير المستهدفة يمكن أن تؤثر على MF احظ (مثل المكالمات إيجابية كاذبة المغير الخلية الجرثومية بسبب تلوث تحور الخلايا الجسدية، أو التخفيف من إشارة الخلية الجرثومية من تحور الخلايا الجرثومية إصلاح الحمض النووي التي تعاني من نقص) . هناك بيانات كافية لإبرام حاليا ما إذا كانت النتائج من خلايا الأنابيب المنوية عند 28 + 3 عرض نفس حساسية وخصوصية وق ذيل الحيوانات المنوية في نقاط زمنية لاحقة. لدينا مختبر ويقارن حاليا MFS يسببها في خلايا الأنابيب المنوية وذيل الحيوانات المنوية التي تم جمعها بعد أوقات لأخذ العينات المختلفة لمعالجة هذه النقطة. ونلاحظ أن المبدأ التوجيهي OECD يشير وقت أخذ العينات بديل من 28 يوما لتقسيم ببطء الأنسجة مثل الكبد التي قد تكون مناسبة أيضا لتحليل الخلية الجرثومية. ومع ذلك، فإن البيانات المتاحة لا يزال غير كاف ونحن غير قادرين حاليا على تصميم واحد يوصي تجريبي واحد في وقت واحد لتحليل الخلايا الجسدية والخلايا الجرثومية باستخدام فحص طفرة TGR للاختبار التنظيمي.
واحدة من سمات هذا الاختبار الذي وتجدر الإشارة أن يتم تقييم الأحداث طفرية على التحوير غير الفئران. ومع ذلك، هناك أدلة كثيرة تشير إلى أن التحوير يستجيب لالمطفرة البيئية بطريقة مشابهة لجينات الذاتية 20. بالإضافة إلى ذلك، لأن أصول دقيقة من الأحداث طفرية مستقلة يصعبحل، يتم الإبلاغ عن النتائج بصفة عامة تردد متحولة (على النقيض من تردد طفرة). يمكن حل تردد طفرة الفعلي إذا كان يتم تصحيح النتائج للتوسع نسيلي (أي الانقسام والتكاثر من الخلايا المتحولة واحدة يمكن أن تسهم في وتيرة الملحوظ من المسوخ التحوير) من خلال تسلسل الحمض النووي. تسلسل الجينات المحورة متحولة يمكن أداؤها لتوصيف الطفرات lacZ، وتحديد المسوخ التي قد تكون مستمدة من الأحداث التوسع نسيلي، على الرغم من أن هذا يضيف إلى حد كبير في الوقت والتكلفة من التحليل. بالإضافة إلى الجين lacZ، theλgt10 ناقلات المعدلة وراثيا والمرافئ التي تعتمد على درجة حرارة بديل تحور الجين مراسل-: البديل من الجين λ اخي، وهو أقصر (294 نقطة أساس في مقابل 3021 نقطة أساس lacZ، الشكل 1) وأسهل للتسلسل 29. تسلسل يسمح أيضا تحليل الطيف الطفرات المستحثة، وتوفير نظرة ثاقبة على mutatioآلية نال من المجمع المذكور. مثالا صارخا على التوسع النسيلي هو حدوث "بالجائزة الكبرى" الطفرة (أي.، والطفرات التحوير في مرحلة مبكرة جدا من التطور جهازا أن تسهم في MF مرتفعة بشكل كبير، وأحيانا مئات الآلاف من المرات أكبر من الخلفية). يجب إزالة أنسجة الحيوانات أو مع "بالجائزة الكبرى" طفرة من التحليل.
الفحص التي وصفناها ينطبق على نطاق واسع لنماذج TGR الأخرى مثل BigBlue الماوس والفئران، والبلازميد الماوس lacZ، والتي تؤوي مماثلة ناقلات مراسل طفرة (استعرضت في 20). الغالبية العظمى من الدراسات الخلية الجرثومية التي أجريت حتى الآن أن استخدام أساليب مماثلة ركزت المطفرة تتميز تقريبا حصرا على ما يرام مثل ENU والإشعاع (استعرضت في 30). ومن المتوقع أنه مع الإفراج مؤخرا عن اختبار OECD التوجيهي للمقايسة TGR، هذا الاختبار سيكونشعبية متزايدة للفحص الكيميائي والتقييم التنظيمي. سيتم إدراج TGR الخلية الجرثومية طفرة في فحص بطارية اختبار التنظيمية ملء الفجوة القائمة من خلال السماح تقييم كفاءة طفرة في تحريض الخلايا الجرثومية 11. وعلاوة على ذلك، هذا الاختبار يمكن أن تستخدم لقياس MF في أي نسيج تقريبا، وتوفير وسيلة مناسبة لمقارنة الحساسيات النسبية للخلايا الجسمية والخلايا الجرثومية في استحثاث الطفرات التي كتبها العوامل البيئية في النهاية جينية متطابقة.
Disclosures
The authors declare that they have no competing financial interests.
Acknowledgements
This research was funded by the Canadian Regulatory System for Biotechnology (CRSB) and Chemicals Management Plan (CMP) initiatives.
Materials
| Name | Company | Catalog Number | Comments |
| MutaMouse | Covance | - | |
| E. coli (lacZ-/galE-) | Covance | - | See reference 25 in manuscript |
| Chloroform | Caledon | 3001-2-40 | |
| Dulbecco's phosphate-buffered saline (D-PBS) | Gibco | 14190-250 | |
| Ethylenediaminetetraacetic acid (EDTA), 0.5 M, pH 8 | Sigma-Aldrich | 03690 FLUKA | |
| Isoamyl alcohol | Caledon | 2/10/7900 | |
| Lennon LB broth base | Invitrogen | 12780-029 | |
| Stainless steel mesh filter | Sigma-Aldrich | S3770 | |
| Transpack packaging extract | Agilent Technologies | 200220 | |
| β-mercaptoethanol | Sigma-Aldrich | M3148 | |
| Ethyl alcohol, anhydrous (EtOH) | Commercial Alcohols | - | |
| Ampicilin | Gibco | 11593-027 | prepare 20 mg/ml in dH2O |
| Kanamycin | Gibco | 11815-024 | prepare 5 mg/ml in dH2O |
| Phenol | Invitrogen | 15509-097 | Saturate in 0.1 M Tris-HCl as per manufacturers direction |
| Phenyl-β-D-galactopyranoside (P-Gal) | Sigma-Aldrich | P6501 | dissolve 3 g per 10 ml of dimethylformamide |
| Proteinase K | Invitrogen | 25530-031 | prepare 60 mg/ml solution dH2O just before use, 20 µl per sample |
| Sodium acetate (NaAc) | Fisher Scientific | BP333-500 | prepare 3 M solutution, pH 5.2 |
| Sodium dodecyl sulfate (SDS) | Sigma-Aldrich | L4390 | prepare 10% solution in dH2O |
| 1 M MgSO4 | 24.6 g MgSO4·7H2O per 100 ml dH2O, autoclave, store at room temperature up to 1 year | ||
| LB Broth | 5.0 g LB base, 6.4 g NaCl per 1 L dH2O. Autoclave and cool | ||
| Saline sodium citrate (SSC) | 150 mM NaCl, 15 mM trisodium citrate, pH 7.0 | ||
| SM Buffer | 5.8 g NaCl, 2.0 g MgSO4·7H2O, 50 ml 1 M Tris-HCl (pH 7.5), 5.0 ml of gelatin (2% w/v), per 1 L dH2O, autoclave, store at room temperature up to 1 year | ||
| TE buffer | 10 mM Tris, 1 mM EDTA, pH 8 |
References
- Ahmadi, A., Ng, S. C. Fertilizing ability of DNA-damaged spermatozoa. J. Exp. Zool. 284 (6), 696-704 (1999).
- Crow, J. F. The origins, patterns and implications of human spontaneous mutation. Nat. Rev. Genet. 1 (1), 40-47 (2000).
- Nelson, K., Holmes, L. B. Malformations due to presumed spontaneous mutations in newborn infants. N. Engl. J. Med. 320 (1), 19-23 (1989).
- Kong, A., et al. Rate of de novo mutations and the importance of father's age to disease risk. Nature. 488 (7412), 471-475 (2012).
- Michaelson, J. J., et al. Whole-genome sequencing in autism identifies hot spots for de novo germline mutation. Cell. 151 (7), 1431-1442 (2012).
- Marchetti, F., Wyrobek, A. J. DNA repair decline during mouse spermiogenesis results in the accumulation of heritable DNA damage. DNA Repair (Amst). 7 (4), 572-581 (2008).
- Marchetti, F., Wyrobek, A. J. Mechanisms and consequences of paternally-transmitted chromosomal abnormalities. Birth Defects Res. C. Embryo. Today. 75 (2), 112-129 (2005).
- Demarini, D. M. Declaring the existence of human germ-cell mutagens. Environ. Mol. Mutagen. 53 (3), 166-172 (2012).
- Epstein, S. S. Use of the dominant-lethal test to detect genetic activity of environmental chemicals. Environ. Health. Perspect. 6, 23-26 (1973).
- Russell, W. L. X-ray-induced mutations in mice. Cold Spring Harb. Symp. Quant. Biol. 16, 327-336 (1951).
- Singer, T. M., Yauk, C. L. Germ cell mutagens: Risk assessment challenges in the 21st century. Environ. Mol. Mutagen. 51 (8-9), 919-928 (2010).
- Tareke, E., Rydberg, P., Karlsson, P., Eriksson, S., Tornqvist, M. Acrylamide: A cooking carcinogen. Chem. Res. Toxicol. 13 (6), 517-522 (2000).
- Witt, K. L., et al. Mouse bone marrow micronucleus test results do not predict the germ cell mutagenicity of N-hydroxymethylacrylamide in the mouse dominant lethal assay. Environ. Mol. Mutagen. 41 (2), 111-120 (2003).
- Marchetti, F., Rowan-Carroll, A., Williams, A., Polyzos, A., Berndt-Weis, M. L., Yauk, C. L. Sidestream tobacco smoke is a male germ cell mutagen. Proc. Natl. Acad. Sci. U.S.A. 108 (31), 12811-12814 (2011).
- Yauk, C. L., Dubrova, Y. E., Grant, G. R., Jeffreys, A. J. A novel single molecule analysis of spontaneous and radiation-induced mutation at a mouse tandem repeat locus. Mutat. Res. 500 (1-2), 147-156 (2002).
- Niwa, O. Indirect mechanisms of genomic instability and the biological significance of mutations at tandem repeat loci. Mutat. Res. 598 (1-2), 61-72 (2006).
- Campbell, C. D., et al. Estimating the human mutation rate using autozygosity in a founder population. Nat. Genet. 44 (11), 1277-1281 (2012).
- Beal, M. A., Glenn, T. C., Somers, C. M. Whole genome sequencing for quantifying germline mutation frequency in humans and model species: Cautious optimism. Mutat. Res. 750 (2), 96-106 (2012).
- Shwed, P. S., Crosthwait, J., Douglas, G. R., Seligy, V. L. Characterisation of MutaMouse lambdagt10-lacZ transgene: Evidence for in vivo rearrangements. Mutagenesis. 25 (6), 609-616 (2010).
- Lambert, I. B., Singer, T. M., Boucher, S. E., Douglas, G. R. Detailed review of transgenic rodent mutation assays. Mutat. Res. 590 (1-3), 1-280 (2005).
- OECD. . OECD Guideline for the testing of chemicals: Transgenic rodent somatic and germ cell gene mutation assays. , (2011).
- Rodriguez, M., Panda, B. B., Ficsor, G. Testes weight reflect ethylnitrosourea induced histopathology in mice. Toxicol. Lett. 17 (1-2), 77-80 (1983).
- Russell, L. B. Effects of male germ-cell stage on the frequency, nature, and spectrum of induced specific-locus mutations in the mouse. Genetica. 122 (1), 25-36 (2004).
- Duselis, A. R., Vrana, P. B. Harvesting sperm and artificial insemination of mice. J. Vis. Exp. (3), 184 (2007).
- Gossen, J. A., Molijn, A. C., Douglas, G. R., Vijg, J. Application of galactose-sensitive E. coli strains as selective hosts for LacZ- plasmids. Nucleic Acids Res. 20 (12), 3254 (1992).
- Lemieux, C. L., et al. Simultaneous measurement of benzo[a]pyrene-induced pig-a and lacZ mutations, micronuclei and DNA adducts in muta mouse. Environ. Mol. Mutagen. 52 (9), 756-765 (2011).
- Douglas, G. R., Jiao, J., Gingerich, J. D., Gossen, J. A., Soper, L. M. Temporal and molecular characteristics of mutations induced by ethylnitrosourea in germ cells isolated from seminiferous tubules and in spermatozoa of lacZ transgenic mice. Proc. Natl. Acad. Sci. U.S.A. 92 (16), 7485-7489 (1995).
- Russell, W. L., Hunsicker, P. R., Raymer, G. D., Steele, M. H., Stelzner, K. F., Thompson, H. M. Dose--response curve for ethylnitrosourea-induced specific-locus mutations in mouse spermatogonia. Proc. Natl. Acad. Sci. U.S.A. 79 (11), 3589-3591 (1982).
- Swiger, R. R., Cosentino, L., Shima, N., Bielas, J. H., Cruz-Munoz, W., Heddle, J. A. The cII locus in the MutaMouse system. Environ. Mol. Mutagen. 34 (2-3), 201-207 (1999).
- Singer, T. M., Lambert, I. B., Williams, A., Douglas, G. R., Yauk, C. L. Detection of induced male germline mutation: Correlations and comparisons between traditional germline mutation assays, transgenic rodent assays and expanded simple tandem repeat instability assays. Mutat. Res. 598 (1-2), 164-193 (2006).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved