Method Article
استيعاب ومراقبة من نيون جزيئات حيوية في الكائنات الدقيقة الحية عبر Electroporation لل
In This Article
Summary
Studies of biomolecules in vivo are crucial for understanding molecular function in a biological context. Here we describe a novel method allowing the internalization of fluorescent biomolecules, such as DNA or proteins, into living microorganisms. Analysis of in vivo data recorded by fluorescence microscopy is also presented and discussed.
Abstract
The ability to study biomolecules in vivo is crucial for understanding their function in a biological context. One powerful approach involves fusing molecules of interest to fluorescent proteins such as GFP to study their expression, localization and function. However, GFP and its derivatives are significantly larger and less photostable than organic fluorophores generally used for in vitro experiments, and this can limit the scope of investigation.
We recently introduced a straightforward, versatile and high-throughput method based on electroporation, allowing the internalization of biomolecules labeled with organic fluorophores into living microorganisms. Here we describe how to use electroporation to internalize labeled DNA fragments or proteins into Escherichia coli and Saccharomyces cerevisiæ, how to quantify the number of internalized molecules using fluorescence microscopy, and how to quantify the viability of electroporated cells. Data can be acquired at the single-cell or single-molecule level using fluorescence or FRET. The possibility of internalizing non-labeled molecules that trigger a physiological observable response in vivo is also presented. Finally, strategies of optimization of the protocol for specific biological systems are discussed.
Introduction
تعتمد معظم الدراسات مضان داخل الخلايا الحية على اندماج بروتين مع البروتينات الفلورية (FPS)، مثل GFP 1. هذه العلامات الفلورية تسمح دراسات في عدد النسخ، ونمط نشر أو توطين البروتينات المشاركة في عمليات مثل التعبير الجيني أو النقل غشاء 2-7. ضباط الإتصال توفر عالية خصوصية وضع العلامات، وسهل التنفيذ، وتتوفر في مخزون كبير من المتغيرات مع مختلف photophysical والخصائص الكيميائية 1. ومع ذلك، لا تزال fluorophores العضوية في اختيار رئيس للفي التجارب المختبرية نتيجة لزيادة صمود الخاصة بهم (تصل إلى 100 أضعاف أكثر استقرارا من FPS) 8،9، وصغر حجمها (تصل إلى 100 أضعاف حجم أصغر من FPS) وسهولة وضع العلامات ضمجزيئي عامل ضمن الجزيئ (بشكل رئيسي من خلال استخدام بقايا السيستين). كل هذه العوامل أهمية خاصة لجزيء واحد مضان والحنق يدرس 10.
عدة طرق استيعاب تنافسيةجي مزايا العضوية ووضع العلامات في الكشف فيفو أدخلت على مدى العقد الماضي. ومع ذلك، فإن مثل هذه الأساليب إما توظف البروتينية علامات كبيرة نسبيا (العلامات على سبيل المثال، TMP، HALO، أو 20 كيلو دالتون SNAP) 11-14، تتطلب استخدام الأحماض الأمينية غير طبيعية 15، أو تقتصر على الخلايا حقيقية النواة كبيرة، واحدة غشاء (على سبيل المثال. ، كشط التحميل، حقنة التحميل، حقن مكروي) 16-19.
يصف هذا البروتوكول رواية، واضحة وعالية الإنتاجية طريقة استيعاب أن الأزواج مزايا العضوية fluorophores مع الملاحظة في الجسم الحي. لتطوير هذه التقنية، فإننا تكييفها الإجراء Electroporation لليشيع استخدامها لتحويل الخلايا مع البلازميدات DNA 20،21 من أجل تحميل الكائنات الحية الدقيقة، مثل E. كولاي أو S. الخباز مع الجزيئات الحيوية وصفت عضويا. يتكون البروتوكول من 4 خطوات بسيطة: حضانة الخلايا مع الجزيئات الحيوية المسمى،Electroporation لل، والانتعاش الخلية، وغسل الخلايا لإزالة الجزيئات الحيوية غير المنضوية. هنا، نقدم هذا البروتوكول Electroporation لل، فضلا عن عمليات التصوير الخلية وتحليل البيانات لدراسة مضان القائم على خلية واحدة جزيء والحنق الإشارات.
يعتمد على Electroporation للتفريغ حقل كهربائي عالي الجهد عبر انخفاض الأيونية تعليق خلية قوة لتشكيل غشاء المسام عابرة من خلالها يمكن الجزيئات الحيوية دخول الخلايا (الشكل 1) 20،21. كما هو الحال مع التحول من البكتيريا أو الخميرة مع DNA البلازميد، والخلايا يجب أن تكون مستعدة قبل Electroporation لللضمان electrocompetency بهم. هذا الإجراء، تتكون من عدة خطوات غسل بالماء، ويزيد من نفاذية الغشاء ويقلل من القوة الأيونية من الحل خلية لتجنب الانحناء في كفيت Electroporation لل. في هذا البروتوكول، وخلايا يمكن أن تكون على استعداد كما هو موضح أدناه (انظر بروتوكول: 1.1) أو تم شراؤها من مزود التجاري الصورة.
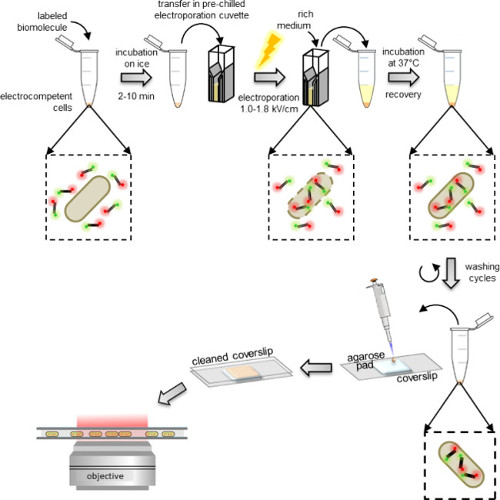
الشكل 1: تمثيل تخطيطي للبروتوكول استيعاب من اليسار إلى اليمين: إضافة بضع ميكرولتر من الجزيئات الحيوية المسمى إلى قسامة من الخلايا electrocompetent (شظايا الحمض النووي المسمى مضاعف والبكتيريا في هذا المثال)؛ احتضان 1 إلى 10 دقيقة على الجليد ونقل إلى كفيت electroporation قبل المبردة. electroporate ثم قم بإضافة 0.5-1 المتوسطة الغنية مل إلى الخلايا بعد فورا؛ احتضان عند 37 ° C (أو على درجة الحرارة المطلوبة من قبل كائن، على سبيل المثال، 29 درجة مئوية لمدة الخميرة) للسماح للخلايا التعافي. أداء 5 غسل خطوات لإزالة أي المنضوية غير جزيئات الزائدة المسمى. resuspend الكرية النهائي في 100-200 ميكرولتر من برنامج تلفزيوني العازلة وماصة 10 ميكرولتر على لوحة الاغاروز. تغطية لوحة مع ساترة تنظيفها والصورة على المجهر مضان (في وضع حقل واسع أو وضع HILO).
الحمار = "jove_content"> يتم تحضين الخلايا Electrocompetent مع الجزيئات الحيوية وصفت قبل Electroporation لل، والتي يمكن تنفيذها باستخدام electroporators القياسية وجدت في معظم المختبرات الكيمياء الحيوية. مباشرة بعد Electroporation لل، يتم تحضين الخلايا في المتوسط الغني السماح شفائهم قبل الغسل (الشكل 1). تتم إزالة الفائض من غير المنضوية-الجزيئات الحيوية وصفت لأول مرة عن طريق الغسيل في العازلة التي تحتوي على نسبة عالية نسبيا من الملح وبعض المنظفات (انظر بروتوكول: 3.3). وجود الملح يعطل التفاعلات كهرباء غير محددة شكلتها غير المنضوية-الجزيئات الحيوية التي وصفت إلا قد عصا على الغشاء الخارجي. وبالمثل، فإن وجود المنظفات في المخزن المؤقت غسل يعطل التفاعلات مسعور غير محددة.
في حين استيعاب DNA واضح ومباشر (الشكل 2)، تحتاج الاحتياطات الواجب اتخاذها عند استيعاب البروتينات المسماة باستخدام Electroporation لل. أولا، قد لا تزال تحتوي على عينة الأسهم من البروتين المسمى عضويا نسبة مئوية صغيرة من الصبغة مجانا. جزيئات الصبغة الحرة هي أصغر بكثير من البروتينات، وبالتالي قد يكون داخليا تفضيلي. للتأكد من أن الغالبية العظمى من احظ جزيئات الفلورسنت المنضوية تتوافق مع البروتين من الفائدة، وينبغي أن تتضمن العينة البروتين الأولية أقل من ~ 2٪ صبغ الحرة (الشكل 5) 22. فائض غير المنضوية-البروتينات وصفت ويمكن أيضا عصا لغشاء الخلية الخارجي بعد Electroporation لل. هذه الظاهرة هو البروتين محددة وتحتاج إلى أن يتم التحقق لكل بروتين جديد. نقترح العديد من الخيارات التي تسمح بإزالة البروتينات غير المنضوية من عينة الخلايا المحملة (انظر بروتوكول: 3.3.3).
وأخيرا، ومعلق الخلايا في حجم صغير من العازلة الفوسفات وpipetted على لوحة agarose، والسماح التصوير على المجهر مضان. تجميد على منصات الاغاروز هو simplالبريد وسيلة فعالة لتصوير الخلايا على ساترة دون الإضرار سلامتها. وينبغي أن تتضمن لوحة ثقافة المتوسط المنخفض مضان.
التصوير الخلية لا يمكن أن يؤديها إما في widefield، ومجموع مضان انعكاس الداخلي (TIRF) أو باستخدام HILO (شديدة الميل ورقة مغلفة البصرية) المجهري. في تكوين HILO، شعاع الليزر تخترق أعمق في عينة مما كان عليه في TIRF، ولكن لا إلقاء الضوء على عينة برمتها لwidefield، والسماح لأكبر نسبة الإشارة إلى الضوضاء 23. اعتمادا على القرار قوة الليزر والوقت المستخدم، الجزيئات الحيوية المنضوية يمكن الاعتماد (باستخدام تحليل photobleaching من تدريجي، الشكل 3)، المترجمة، أو 24-28 تتبعها. تدخيل يبني المسمى مضاعف مع زوج الحنق من fluorophores يسمح الكمي من الحنق على حد سواء في خلية واحدة أو مستويات جزيء واحد (الشكل 6).
يمكن أن تختلف معايير مختلفةاعتمادا على النتيجة المرجوة والنظام البيولوجي دراستها. أولا، كمية المواد المنضوية في كل خلية يمكن ضبطها عن طريق تغيير تركيز الجزيئات الحيوية وصفت تضاف إلى الخلايا Electroporation للالسابقة (الشكل 2). سوف قوة المجال Electroporation للتؤثر أيضا على حد سواء كفاءة التحميل وبقاء الخلية. كما هو متوقع، في حين أن زيادة كفاءة التحميل مع زيادة قوة المجال، وبقاء خلايا electroporated النقصان (الشكل 4A). يمكن قياسها كميا كل من المعلمات عن طريق تسجيل نسبة تحميلها وتقسيم الخلايا بعد Electroporation لل. هذا الاختبار بقاء إلى جانب التصوير مضان أيضا يتحقق مراقبة الجزيئات الحيوية المنضوية في الخلايا الحية، والسماح المراقبة المستمرة على مدى عدة أجيال (الشكل 4B).
باختصار، هذا البروتوكول يسمح تدخيل fluorescently المسمى DNA والبروتين جزيئات فيكولاي أو S. الخباز 26. يمكن تتبع الجزيئات الفردية المسمى مع fluorophores العضوية لقرار الزمانية المكانية عالية لفترات زمنية أمر من حجم أطول من الثانية. وأخيرا، وهذا الأسلوب هو متوافق مع widefield، TIRF والكشف متحد البؤر، فضلا عن برامج الإثارة نابض، مثل ALEX (بالتناوب الليزر الإثارة 28،29).
Protocol
1. إعداد خلية
- إعداد البكتيريا electrocompetent من صنع مختبر
- إعداد preculture 5-10 مل بين عشية وضحاها من مستعمرة واحدة من سلالة القولونية من الفائدة في المتوسط المنخفض مضان مثل M9 أو EZ ريتش تعريف متوسط.
- في الصباح، تطعيم جديدة ثقافة 400 مل مع preculture بين عشية وضحاها بحيث OD 600 نانومتر يبدأ في 0.02. إضافة إلى 400 مل المنخفضة مضان 2.5 مل من 1 M MgSO 4 و 2.5 مل من 1 M MgCl 2 متوسطة.
- ينمو بمعدل 37 درجة مئوية و 250 دورة في الدقيقة حتى OD 600 نانومتر تصل إلى 0،4-0،6.
- وقف النمو من خلال تقشعر لها الأبدان الثقافة في حمام الماء المثلج لمدة 10-15 دقيقة.
ملاحظة: من الآن فصاعدا، تنفيذ جميع الخطوات في 4 درجات مئوية (على الجليد). - أجهزة الطرد المركزي لثقافة 15 دقيقة في 1000 ز س. تجاهل طاف و resuspend بيليه خلية في 250 مل المبردة والعقيمة المقطر H 2 O.
- كرر الطرد المركزي وإعادة تعليق الخطوات رأورده، وخفض حجم المياه إلى 100 مل و 50 مل ثم.
- الطرد المركزي دقيقة الثقافة 10 في 1000 ز س. تجاهل طاف و resuspend بيليه خلية في 25 مل المبردة والمعقم المقطر H 2 O + 10٪ الجلسرين.
- كرر الطرد المركزي وإعادة تعليق الخطوات ثلاث مرات، وخفض حجم 10٪ محلول الجلسرين إلى 10 مل، 5 مل، وأخيرا إلى 500 ميكرولتر.
- قسامة الخلايا في aliquots من 20 ميكرولتر لكل منهما، فلاش للتجمد في النيتروجين السائل وتخزينها في -80 ° C.
- الخلايا البكتيرية electrocompetent التجارية
- تمييع خلية قسامة التجارية 1: 1 مع الماء المقطر المعقم المبردة. جعل مأخوذة 20 ميكرولتر وتخزينها في -80 ° C.
- إعداد الخميرة electrocompetent
ملاحظة: Electrocompetent S. يتم إعداد خلايا خميرة قبل كل تجربة Electroporation للوالتي لا يمكن تخزينها في -80 ° C كما لE. القولونية.- للبدء، وتطعيم 5المتوسط 0 مل YPD مع مستعمرة واحدة من سلالة المطلوب من الفائدة.
- احتضان عند 30 ° C و 250 دورة في الدقيقة حتى OD 600 نانومتر تصل إلى 0،6-0،8.
- خلايا الطرد المركزي في 1000 x ج لمدة 5 دقائق في 4 درجات مئوية.
- Resuspend وبيليه في 25 مل المبردة والعقيمة المقطر H 2 O.
- كرر الخطوات غسل إعادة التعليق مرتين في 25 مل من الماء وإعادة التعليق مرتين في 2 مل من محلول مبرد من السوربيتول في 1 M.
- resuspend الخلايا في 250 ميكرولتر من 1 M السوربيتول وتقسيم الخلايا في 50 مكل.
2. الاغاروز سادة إعداد
- لإزالة خلفية جزيئات الفلورسنت، وحرق ساترة في فرن على 500 درجة مئوية لمدة 1 ساعة. "النظيفة حرق" ويمكن تخزين coverslips لمدة أسابيع في درجة حرارة الغرفة مغطاة بورق الألمنيوم.
ملاحظة: طرق التنظيف الشائعة الأخرى مثل التنظيف البلازما أو حل سمكة البيرانا قد تكون استخدمت لفترة طويلة كما كخلفيةمضان من الشرائح تنظيفها يبقى-شبه فارغة. - يعد حل الاغاروز المنخفض مضان من قبل ذوبان في المايكرويف لالاغاروز 2٪ - حل الماء المقطر (70 ° C). إضافة على الفور 500 ميكرولتر من الواضح 2٪ محلول الاغاروز إلى 500 ميكرولتر من 2X الثقافة مضان المتوسط والمنخفض المزيج بلطف.
- قبل أن يبرد وتتصلب، ماصة على الفور هذا الاغاروز - حل المتوسط على ساترة المجهر (لا سمك 1.5) من أجل تشكيل لوحة من ما يقرب من 2 سم أقطار وعلى ارتفاع بضعة ملليمترات. تجنب الفقاعات وموسيقى البوب لهم مع نصائح ماصة إذا لزم الأمر.
- تتسطح لوحة مع الثانية "حرق" ساترة (لا يوجد 1.5 سماكة، انظر الشكل 1).
ملاحظة: تساعد هذه ساترة العليا تشكيل لوحة متجانسة مسطحة وحماية من الغبار والتجفيف في حين يجري حاليا إعداد الخلايا. وقد تم اختبار المتوسطة الحد الأدنى من مثل M9 أو متوسطة غنية مثل EZ ريتش تعريف متوسط لمضان المتدني.
3. Electroporatأيون
- حضانة
- تضيف ما يصل الى 5 ميكرولتر من الجزيئات المسمى تخزينها في منطقة عازلة قليل الملح (<50 ملي الملح) لقسامة واحدة من الخلايا المختصة (البكتيريا أو 20 ميكرولتر 50 ميكرولتر الخميرة)، واحتضان 10 دقيقة على الجليد.
ملاحظة: إن تركيز جزيئات fluorescently المسمى في الحلول الأسهم وبالتالي سيقلل تدفق الجزيئات المسمى تضاف إلى الخلية قبل Electroporation للويرتبط مباشرة مع كفاءة تحميل (الشكل 3، ومناقشة). لأن بعض البروتينات هي أقل تلاؤما مع انخفاض حالة الملح، يمكن زيادة تركيز الملح في المخزن المؤقت التخزين ولكن حجم الجزيئات المسمى تضاف إلى الخلايا Electroporation للمسبق ثم يحتاج إلى تناقص. - نقل خليط من الخلايا والجزيئات الحيوية وصفت في كفيت Electroporation للما قبل المبردة (0.1 و 0.2 سم تباعد عن البكتيريا والخميرة، على التوالي). اضغط برفق كفيت على مقاعد البدلاء لإزالة أي فقاعات المحتملة من الحل.
- ضع مكعبكورفيت في electroporator وتطبيق نبضة كهربائية عالية الجهد في حل (0،9-1،8 كيلو فولت / سم، انظر المناقشة لمزيد من التفاصيل حول اختيار الجهد). مثل هذا النبض يشكل مسام عابرة في أغشية الخلايا مما يسمح الجزيئات الحيوية وصفت لمنتشر في الخلايا.
- تأكد من أن ثابت الوقت للظهور في electroporator ما بين 4 إلى 6 مللي ثانية. الثوابت الوقت أقل وغالبا ما تكون بسبب عالية جدا تركيز الملح و / أو وجود فقاعات في كفيت، وسوف تؤدي إلى منخفضة جدا أو معدومة التحميل من الخلايا.
- تضيف ما يصل الى 5 ميكرولتر من الجزيئات المسمى تخزينها في منطقة عازلة قليل الملح (<50 ملي الملح) لقسامة واحدة من الخلايا المختصة (البكتيريا أو 20 ميكرولتر 50 ميكرولتر الخميرة)، واحتضان 10 دقيقة على الجليد.
- انتعاش
- مباشرة بعد Electroporation لل، إضافة 500 ميكرولتر من المتوسطة الغنية مثل SOC، EZ ريتش تعريف المتوسطة، YPD أو أي وسيلة غنية للخلايا.
- احتضان العينة على 37 درجة مئوية لمدة البكتيريا و 29 درجة مئوية لمدة الخميرة لمدة 2 إلى 10 دقيقة. لقياس جدوى، حيث يريد المستخدم لتقييم النسبة المئوية للخلايا النمو وتقسيم بعد Electroporation لل، استخدم وقت الانتعاش أطول (تصل إلى 1 ساعة) كما ثالبريد مراقبة مثل هذه الأوقات تأخر قبل انقسام الخلية الأولى.
- خطوات الغسيل
- غسل الخلايا لإزالة أي الجزيئات الحيوية غير المنضوية قبل الغزل أسفل الخلايا لمدة 1 دقيقة في 3300 x ج و 4 ° C. تجاهل طاف و resuspend الخلايا في 500 ميكرولتر PBS.
ملاحظة: للحصول على كل عينة، وإعداد سيطرة سلبية الخلايا المحتضنة مع نفس الكمية من الجزيئات الحيوية وصفت ولكن ليس electroporated وغسلها بنفس الطريقة تماما كما العينة الرئيسية. - كرر الخطوات السابقة 3 مرات.
- في حالة من البروتين الداخلي، وتحسين إجراءات الغسل اعتمادا على خصائص وسلوك هذا البروتين المسمى من الفائدة. الخطوات التالية هي مثال من التحسينات الممكنة:
- إجراء أول 3 دورات الغسيل باستخدام PBS تحتوي على 100 ملي كلوريد الصوديوم و 0.005٪ تريتون X100 لإزالة البروتينات غير المنضوية التي قد التمسك غشاء الخلية الخارجي 22، <سوب> 26.
- تصفية الخلايا electroporated مع 0.22 ميكرون فلتر قطر المسام تركيبها داخل أنبوب microcentrifuge 1.5 مل من قبل pipetting الخلايا electroporated في التصفية. تدور باستمرار لمدة 3 دقائق في 800 x ج و 4 ° C. تجاهل التدفق من خلال. إضافة PBS 500 ميكرولتر الجديد على الخلايا وتدور لهم مرة أخرى كما كان من قبل، وتكرار هذه الخطوات مرة واحدة (22).
- إضافة كمية صغيرة من البروتيني K (10 نانوغرام في 500 ميكرولتر PBS) خلال دورة الغسيل الأولى للسماح للهضم أي بروتين غير المنضوية.
- إجراء أول 3 دورات الغسيل باستخدام PBS تحتوي على 100 ملي كلوريد الصوديوم و 0.005٪ تريتون X100 لإزالة البروتينات غير المنضوية التي قد التمسك غشاء الخلية الخارجي 22، <سوب> 26.
- تدور باستمرار الخلايا لمدة 1 دقيقة في 3300 x ج و 4 ° C. تجاهل وطاف resuspend الخلايا في 150 ميكرولتر من برنامج تلفزيوني.
- نشر حل الخلية محملة على لوحة الاغاروز عن طريق إزالة ساترة العليا ونشر 10 ميكرولتر من قطرات تعليق الخلية التي كتبها قطرة. استبدال ساترة غير مستخدمة نظيفة حرق (لا يوجد 1.5 سمك، مطابقة للمواصفات موضوعية المجهر) على رانه أعلى لوحة واضغط بلطف شديد على الشريحة.
- حماية الخلايا electroporated من الضوء عن طريق تخزين منصات في مربع مبهمة في حين التصوير عينات مختلفة.
- غسل الخلايا لإزالة أي الجزيئات الحيوية غير المنضوية قبل الغزل أسفل الخلايا لمدة 1 دقيقة في 3300 x ج و 4 ° C. تجاهل طاف و resuspend الخلايا في 500 ميكرولتر PBS.
4. الحصول على البيانات المجهر
ملاحظة: وحيد الخلية واحد جزيء مضان المجهري في الكائنات الحية الدقيقة التي تعيش يمكن أن يؤديها على أي المجهر مضان المناسب (أو تجارية مبنية خصيصا).
- الإعدادات
- Widefield أو HILO الإضاءة
- عينات صورة مع أي المجهر TIRF / جزيء واحد.
ملاحظة: وكمثال على ذلك، ونحن نستخدم في المختبر المجهر المقلوب مخصصة مع TIRF مجموعة المتابعة. يتم الجمع بين الحزم من نانومتر 532 و637 نانومتر ليزر ديود وموازى قبل التركيز على المستوى البؤري الخلفي من الهدف. يتم جمع مضان من العينة من خلال نفس الهدف، وفصلها عن ضوء الإثارة باستخدام تمريرة طويلة ومرشح الشق، وتنقسم إلى إعادةد والأخضر القنوات باستخدام مرآة مزدوج اللون. يتم تصوير القناتين على نصفين منفصلة من رقاقة من (EM-CCD) وكاميرا الجهاز إلى جانب تهمة ضرب الإلكترون. يتم تسجيل الفيديو باستخدام وضع الحركي. ويتم الحصول على الصور الضوء الأبيض باستخدام مصباح الضوء الأبيض ومكثف تعلق على المجهر كمصدر للإضاءة. - لعامة الملاحظة جزيء واحد، تعيين وضع إضاءة المجهر لTIRF أو HILO 23 (انظر مناقشة لمزيد من التفاصيل حول TIRF مقابل HILO التصوير). لوضع وضع HILO على المجهر TIRF، وانخفاض طفيف في زاوية السقوط من ضوء الإثارة إلى تحويل التركيز أعلى قليلا من سطح ساترة (صورة الخلية الداخلية بدلا من غشاء أقل في اتصال مع ساترة، انظر 4.5.4 ).
- للتحليل على مستوى الخلية، واحد طويل جزيء تتبع التجارب أو خطوة حكيمة تحليل photobleaching من، تعيين وضع إضاءة المجهر إلى ensuri وضع widefieldنانوغرام المراقبة المستمرة من حجم الخلية كله وبالتالي جميع الجزيئات المسمى المنضوية.
- عينات صورة مع أي المجهر TIRF / جزيء واحد.
- عادة، القوى استخدام الإثارة حول 0.5-3 ميغاواط (~ 50-400 W / سم 2).
ملاحظة: القوى الليزر انخفاض مفيدة لتحقيق الملاحظة مضان المعمرة وتتبع (أكثر من 1 دقيقة)، في حين قد تكون مطلوبة القوى الليزر أعلى لقرار الزماني المكاني العالي أو تحليل photobleaching من تدريجي. - استخدام مرات التعرض تتراوح بين 15 مللي ثانية لتتبع التجارب إلى 100 مللي ثانية للمراقبة أكثر عمومية وشدة الكمي. ملاحظة: معدلات الإطار الأخرى وسائط يمكن استخدام مثل الإضاءة اصطرابي، وخاصة لدراسة نشرها بسرعة الأنواع 30.
- في المجهر TIRF، تسجيل قناة مضان على CCD-بضرب الإلكترون (EMCCD) وكاميرا في التكبير مما أدى إلى طول بكسل ~ 100 نانومتر / بكسل. الإعداد TIRF هو وصف في تفاصيل أكبر في اشارة 26.
- Widefield أو HILO الإضاءة
- الحصول على البيانات
- إيقاف أو منع إضاءة ليزر حتى بداية التجربة. تبديل EMCCD مكاسب الكاميرا لمنع تلف الكاميرا بسبب التعرض المفرط.
- ضع الاغاروز لوحة شطيرة رأسا على عقب على المسرح المجهر، مع الجانب المغطاة الخلية التي تواجه هبوطا، من أجل تحقيق الخلية قريبة من الهدف. تعيين التركيز على الخلايا في ضوء المنقولة وضع المجهري 28. تسجيل صورة من كل خلية نظر تحت التصوير الضوء الأبيض من أجل تحديد موقع الخلية تحدد قبل إطفاء الضوء الأبيض.
- حماية عينة من الضوء مختبر المحيطة.
- لوضع الإثارة HILO، وضبط زاوية شعاع الإثارة إلى كل نسبة القصوى إشارة إلى الضوضاء التي كتبها إلقاء الضوء فقط على قسم من العينة قريبة من سطح ساترة.
- لتحقيق HILO الإضاءة، والتركيز على شعاع الليزر إلى البؤري الخلفي من 100X NA 1.4 موضوعي 28 (أعلى numeفتحات rical مثل 1.45 أو 1.49 هي أيضا مناسبة). عن طريق تحويل عدسة التركيز عمودي على شعاع، ينتقل التركيز بعيدا عن مركز موضوعي بحيث شعاع يخرج الهدف مع زاوية.
- ضبط الموقف عدسة من أجل تعظيم نسبة الإشارة إلى الضوضاء، وكثافة مضان داخل الخلايا مقابل إشارة الخلفية خارج الخلية.
- التبديل الربح الكاميرا والبدء في الحصول على البيانات قبل التبديل على الليزر.
- في حين تم تسجيل البيانات، والحصول على صورة بيضاء ضوء كل FOV قبل أو بعد تسجيل البيانات مضان. هذا يساعد على تحديد حدود الخلية في القنوات مضان.
- لتقدير جدوى
- استخدام المنخفض مضان المتوسطة الغنية في لوحة الاغاروز للسماح للخلايا أن تنمو بعد Electroporation لل.
- تتوازن المجهر لدرجة الحرارة المثلى لالكائنات الحية الدقيقة درس (37 درجة مئوية لمدة كولاي، 29 ° C لS. الخباز) مع نظام سخان موضوعي.
- سجل كل من الضوء ومضان الصور البيضاء كل 30 دقيقة، والتأكد من أن تبقى على بالضبط نفس مجال الرؤية خلال تسجيل البيانات بالكامل. وعادة ما لوحظ تأخر من ≈1 قبل ساعة تبدأ الخلايا على الانقسام.
- إحصاء عدد الجزيئات الحيوية المنضوية لكل خلية
- تعيين قوة الليزر إلى القيم العالية (2-3 ميغاواط) ووقت التعرض الطويل (100 مللي ثانية).
- ضبط الإضاءة لwidefield وضع من أجل تسليط الضوء على الخلية بأكملها.
- تسجيل الأفلام كما هو موضح في الخطوة 4.2 مع التأكد من تسجيل إطارات إضافية (50-100 إطارات) بعد الانتهاء من photobleaching من مضان.
5. تحليل البيانات
- تحليل عام
- تحليل الصور والأفلام المسجلة، سواء في الضوء ومضان الإثارات البيضاء، وذلك باستخدام برامج التصوير، مثل برنامج يماغيج مجانا.
- في يماغيج، فتح الصور أو الأفلام المسجلة على المجهر (تنسيق TIF) في ملف> فتح> موقع الملف الخاص بك.
- لمقارنة نوعيا شدة مضان على شاشة الكمبيوتر، تأكد من أن يتم عرض جميع الصور مضان مع نفس إعدادات السطوع والتباين في صورة> ضبط> السطوع / التباين. ضبط الإعدادات يدويا أو تلقائيا للحصول على صورة مختارة، اضغط على "تعيين" الزر وحدد "نشر إلى جميع الصور الأخرى" الخيار.
- تعيين نوع من المعلومات لاستخراج: تحليل> تعيين القياسات، وحدد (على الأقل) "المنطقة"، "الانحراف المعياري"، "مين & قيمة الرمادية ماكس" و "يعني قيمة الرمادية".
- للمقارنة بين شدة مضان الخلية، وتحديد منطقة الصورة التي تهم باستخدام زر اختيار حر من يماغيج واستخراج شدة خلية في تحليل> قياس. يحتوي الجدول الناتج قيم القياس ويمكن انقاذه و / أو نسخها إلى البرامج الأخرى. في "المتوسط" قيمة يتوافق مع متوسط كثافة لكل بكسل في المنطقة المحددة، ويمكن مقارنة مباشرة بين الخلايا أو بين خلية والخلفية.
- في عينة الخلايا electroporated، خلية ويعتبر تحميل إذا كان متوسط كثافة لكل بكسل أكبر من متوسط كثافة لكل بكسل من السيطرة السلبية بالإضافة إلى 3 مرات الانحراف المعياري (AV (أنا حملت خلية)> شارع (I -EP) + 3 * StdDev (I -EP)).
- بناء كاذبة الملونة الصور مضان تراكب والأفلام من أجل تقييم جودة والتحميل من العينات.
- في يماغيج، تراكب الصور مثل صورة الضوء الأبيض وصورة مضان المقابلة لنفس FOV في صورة> الألوان> دمج القنوات. حدد لونا لكل صورة (C4 (رمادي) للضوء الأبيض، C1 (الأحمر) للقناة الحمراء، C2 (الأخضر للقناة الخضراء ... الخ.).
- الاختيارعلى تراكب الصور التي مضان يقع داخل حدود الخلية (صورة الضوء الأبيض) والتي مضان خلفية منخفضة ومتجانس (لا نقاط مضيئة خارج حدود الخلية).
- قبل تحليل عدد كبير من الخلايا، والتحقق نوعيا الصور المقابلة لعينة سلبية وعلى غرار الصور خلية فارغة وعرض شدة أقل بكثير من خلايا electroporated.
- للتجارب جدوى، عد يدويا النسب المئوية للتقسيم، وعدم التقسيم، ولكن سليمة واضح (متطابقة) والتالفة (قتيلا) خلايا من نفس مجال الرؤية تزايد مع مرور الوقت (انظر 4.2.6).
- تقييم جدوى لا يقل عن 200 خلية لكل عينة (electroporated، سيطرة سلبية وخلايا فارغة) من أجل جمع ما يكفي من الإحصاءات.
- تحليل الصور والأفلام المسجلة، سواء في الضوء ومضان الإثارات البيضاء، وذلك باستخدام برامج التصوير، مثل برنامج يماغيج مجانا.
- التحليل القائم على خلية
- إحصاء عدد الجزيئات الحيوية المنضوية في الخلية عن طريق تحليل photobleaching من خطوة حكيمة
- خلايا جزء من خلال selectiنانوغرام مجال الاهتمام باستخدام زر اختيار حر من يماغيج ورسم شكل المحيطة بدقة الخلية (أي ما يعادل الخلية غشاء).
- استخراج شدة الخلية على مر الزمن في صورة> الأكوام> الملف مؤامرة Z-المحور. يمثل الرسم البياني الناتج متوسط كثافة لكل بكسل للمنطقة ضمن حدود الخلية مقابل كل إطار الفيلم مما أدى إلى منحنى photobleaching من أجل ذلك خلية معينة. أنه يحتوي على انخفاض الأسي الأولي من كثافة الخلايا التوصل إلى الخط المقارب أقل (مضان الخلفية). يمكن حفظ قيم القياس وو / أو نسخها إلى البرامج الأخرى من خلال النقر على "حفظ" أو "نسخ".
- نسخ ولصق القيم تبيض في عمود جدول (I الخام).
- حساب متوسط تألق ذاتي لكل بكسل المتبقية بعد photobleaching من (I السيارات) عن طريق حساب متوسط قيم I الخام التي تم الحصول عليها عن الأطر 50-100 الماضية (أقل الخط المقارب).
- Subtract متوسط تألق ذاتي لكل بكسل المتبقية بعد photobleaching من لتلك الخلية من منحنى photobleaching من الأولي: I تبيض = I الخام - I السيارات.
- استخدام photobleaching من timetraces (I تبيض مقابل الإطار) تظهر أقل من 10 خطوات الكم لتقييم متوسط حجم الخطوة (شدة fluorophore وحدوية) نتيجة لتبيض من fluorophore واحد 26-طرح خط الأساس.
- تقييم عدد من جزيئات المنضوية لكل خلية بقسمة كثافة الخلية تطرح الأساسية الأولية (I تبيض في ر = 0) من شدة fluorophore وحدوية.
- الكفاءات الحنق-خلية واحدة
- قياس متوسط كثافة خلايا لكل بكسل في القنوات الانبعاثات المانحة ومتقبل على حد سواء (على الإثارة المانحة) وداخل حدود خلية لكل قناة كما شرح في 5.1.1.4.
- قياس متوسط كثافة بكسل لخلفية في كل الفصلannel من منطقة خالية في الشريحة.
- طرح هذا كثافة الخلفية من متوسط كثافة لكل بكسل. استخدام هذه كثافات مضان طرح خلفية لحساب الحنق لكل خلية عن طريق حساب كثافة متقبل-طرح الخلفية مقسومة على مجموع (متقبل + المانحة) الكثافة طرح الخلفية على الإثارة المانحة: أنا متقبل / (I + I متقبل المانحة)
- إحصاء عدد الجزيئات الحيوية المنضوية في الخلية عن طريق تحليل photobleaching من خطوة حكيمة
- تحليل جزيء واحدة
- تتبع جزيء واحد وتحليل نشر
ملاحظة: تم وصف بروتوكول لتتبع نشرها جزيئات الفلورسنت في الخلايا الحية، وتقييم معامل الانتشار الواضح على 26، 28.- لفترة وجيزة، وتناسب الصور من fluorophores واحدة في كل إطار من التمويه بيضاوي الشكل 2D. رابط المترجمة الجزيئات إلى مسار إذا ظهرت في إطارات متتالية ضمن إطار من 5-7 بكسل (0،48-0،67 ميكرون). استخدام الذاكرةذ المعلمة من 1 الإطار لحساب اختفاء عابرة من fluorophore بسبب تطرف أو توطين تفويتها.
- في الجسم الحي تحليل smFRET
- تحديد يدويا جزيئات محلية داخل الخلايا من الأفلام عن طريق الذهاب من خلال فيلم في يماغيج وتحديد جزيئات متحركة (أو غير متحرك إلى حد ما) في الحنق (المتقبلة) القناة.
- لاستخراج شدة في متقبل والجهات المانحة قناة المقابلة لجزيء متحرك، حدد المنطقة المحيطة جزيء في كل قناة باستخدام "البيضاوي" زر اختيار يماغيج (دائرة حول كل fluorophore واحد، وذلك باستخدام دائرة نصف قطرها ~3 بكسل) و استخراج شدة جزيء في تحليل> قياس. يحتوي الجدول الناتج قيم القياس ويمكن حفظ و / أو نسخها إلى البرامج الأخرى.
- حساب القيم الأساسية لكل قناة من متوسط كثافة بكسل من دائرة من نفس الحجم في منطقة خالية في الشريحة على جميع الأطر تحليلها.
- استخدام القيم مضان طرح الخلفية في القنوات المانحة ومتقبل (عند الاستثارة المانحة) لمضان والحنق آثار الزمن، كما في خلية واحدة الحنق الحالة (انظر 5.2.1.7).
ملاحظة: تم وصفها الآلي وقوية تحليل والخوارزميات في المراجع 26-28، 31.
- تتبع جزيء واحد وتحليل نشر
النتائج
إعداد عينة
يتم عرض الخطوات المختلفة من البروتوكول والخطط في الشكل 1. وكمثال على ذلك، قمنا بتمثيل تحميل البكتيريا مع المسمى مضاعف (المانحة والأصباغ متقبل) شظايا الحمض النووي. وتظهر نتائج ممثلة لاستيعاب DNA في الشكل 2. لكل عينة electroporated، تم تسجيل البيانات للخلايا فارغة والخلايا غير electroporated أيضا (الشكل 2). "خلايا فارغة" تتوافق مع electrocompetent الخلايا المحتضنة لا مع الجزيئات الحيوية الفلورسنت ولا electroporated. كثافتها في القناة الفلورسنت تعكس مستوى تألق ذاتي في ظل ظروف مماثلة التجريبية (قوة الليزر، القرار الوقت ودرجة الحرارة، وغيرها). "خلايا غير electroporated" (وتسمى أيضا -EP، أي ناقص EP) تتوافق مع عنصر تحكم السلبية التي electrocompetent تم تحضين الخلايا مع biomolec الفلورسنتules ولكن ليس electroporated. هذه الخلايا غير electroporated يجب أن تظهر مستوى مضان مماثل لتألق ذاتي للخلايا فارغة وأقل بكثير من كثافة مضان عرضها من قبل، وخلايا electroporated المحملة. وهذا يؤكد على إزالة أي الجزيئات الحيوية المسمى غير المنضوية التي يمكن أن انضمت إلى غشاء الخلية الخارجي.
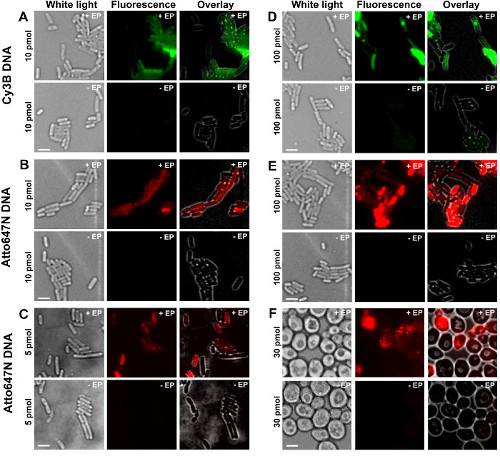
الشكل 2: ممثل النتائج لاستيعاب dsDNA المسمى مع fluorophores مختلفة في تركيزات مختلفة في البكتيريا (AE) والخميرة (F) من اليسار إلى اليمين: الأبيض الخفيف، مضان وتراكب الصور. - / + EP يدل حضانة بدون / مع Electroporation لل. الحانات النطاق: 3 ميكرون. A. Cy3B dsDNA، 10 بمول، E. القولونية. B. ATTO647N dsDNA، 10 بمول، E. القولونية. C. Alexa647 dsDNA، 5 بمول، E. القولونية. D. Cy3B dsDNA، 100 بمول، E. القولونية. E. س ATTO647NDNA، و 100 بمول، E. القولونية. F. ATTO647N dsDNA، 30 بمول، الخميرة. تم تعديل هذا الرقم من 26 إشارة. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
إحصاء عدد الجزيئات الحيوية المنضوية لكل خلية
الإجراء لتقدير عدد المنضوية الجزيئات الحيوية وصفت في الخلية باستخدام photobleaching من تحليل يرد في الشكل 3 والتكميلية فيلم 2، جنبا إلى جنب مع نتائج ممثلة تم الحصول عليها مع تركيزات مختلفة من الحمض النووي المسمى. خلية تحميل الزيادات كفاءة مع المبلغ الأولي من الحمض النووي المسمى المحتضنة، مما يتيح للمستخدم ضبط عدد من الجزيئات المسمى لكل خلية من مستوى "جزيء واحد" (<10، التكميلية الفيلم 2B) إلى مستوى "الفرقة" (> 10 ، 2A الفيلم التكميلي). وهناك طريقة قوية لتقدير النسبة المئوية للخلايا المحملة هي رس حساب عدد الخلايا electroporated عرض كثافة الخلية أعلى من متوسط كثافة خلية من خلايا غير electroporated بالإضافة إلى 3 مرات الانحراف المعياري لها (أي شارع (I-EP) + 3 * StdDev (I-EP) حيث شارع = المتوسط، I = شدة لكل بكسل، الأمراض المنقولة جنسيا. ديف. = الانحراف المعياري و-EP = غير electroporated) كما هو مبين في الشكل (3).
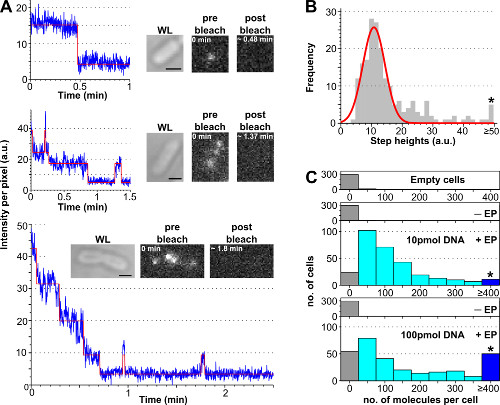
الرقم 3: عد عدد الجزيئات المنضوية باستخدام photobleaching من تحليل (A) وحيدة الخلية photobleaching من التحليل. أمثلة من timetraces كثافة مضان (الأزرق: البيانات الخام، أحمر: صالح، إدراجات: WL والصور مضان من E. القولونية محملة المسمى ATTO647N dsDNA قبل وبعد التبييض). الأعلى: الحدث تبيض خطوة واحدة. الأوسط: الخلية التي تحتوي ± 3 جزيئات تظهر تبيضوامض. أسفل: الخلية التي تحتوي> 10 خطوات الموافق 10 على الأقل جزيئات (B) الرسم البياني من شدة ارتفاع خطوة واحدة من الآلي خوارزمية تركيب خطوة من 57 الخلايا التي تحتوي على أقل من 6 خطوات مميزة. وتتركز تناسب وحيد جاوس في 11 ± 3 الاتحاد الافريقي، المقابلة لشدة fluorophore وحدوية من 8100 الفوتونات في الثانية الواحدة. وتمثل النجمة بن جمع كل مرتفعات خطوة أعلاه أو يساوي 50 الاتحاد الافريقي (C) الرسم البياني للجزيئات المنضوية لكل خلية electroporated مع كميات مختلفة من ATTO647N dsDNA، وتحسب بعد تقسيم كثافة مضان الأولية من شدة fluorophore وحدوية. أعلى إلى أسفل: خلايا فارغة (أي ليس المحتضنة مع الجزيئات الفلورسنت وليس electroporated)، غير electroporated (ولكن حضنت مع جزيئات الفلورسنت، واسمه -EP)، والخلايا electroporated حضنت مع 10 و 100 بمول dsDNA (المسمى + EP). خلايا فارغة وغير electroporated تتوافقإلى تألق ذاتي، تظهر خلايا حين electroporated توزيع واسعة من الجزيئات المنضوية، مع نسبة أعلى من خلايا تحميل للغاية في 100 بمول (≥ 4 جزيئات، راجع بعلامات النجمة بن). كفاءة استيعاب (جزء من الخلايا مع كثافة العمليات.> يعني + 3X الأمراض المنقولة جنسيا. ديف. من عينة غير -EP) للعينات 10 و 100 بمول كان 94٪ و 90٪ على التوالي. متوسط عدد جزيئات المنضوية لكل خلية: 121 ± 106 الجزيئات لمدة 10 بمول dsDNA، و 176 ± 187 الجزيئات عن 100 بمول dsDNA. الإعدادات: 100 مللي التعرض، والإضاءة widefield. الحانات النطاق: 1 ميكرون. تم تعديل هذا الرقم من 26 إشارة. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
تحميل خلية وقدرتها على البقاء
بالإضافة إلى تغيير كمية الجزيئات الحيوية وصفت تضاف إلى الخلايا قبل Electroporation لل، ويمكن للمستخدم ضبط كمية من جزيئات المنضوية باختيار شدة المجال مختلفة خلال Electroporation لل(الشكل 4، الفيلم التكميلي 1). شدة المجال أعلى تؤدي إلى مزيد من الكفاءة الداخلي، ولكن تؤدي إلى انخفاض طفيف في بقاء الخلية. للبروتين استيعاب، واستخدام خطوة الترشيح قد يساعد في إزالة البروتينات غير المنضوية المسمى (انظر 3.3.3.1.1). في مثل هذه الحالات، والترشيح خلية يضمن أن البروتينات الفلورية المرصودة والمنضوية في الواقع داخل السيتوبلازم البكتيري. نلاحظ، مع ذلك، أن لديها الترشيح أيضا تأثير سلبي على بقاء الخلية (لمزيد من التفاصيل، انظر REF 22).
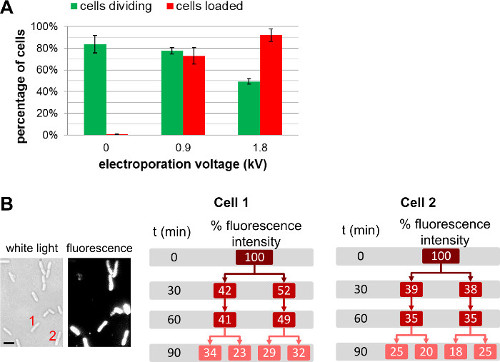
الشكل 4: تأثير الجهد Electroporation للتحميل على خلية وقدرتها على البقاء (A) بار الرسم البياني الذي يمثل تأثير قوة المجال Electroporation للفي effic التحميل.iency (الحانات الحمراء) وقابلية الخلايا (الحانات الخضراء). 84 ± 8٪ من الخلايا غير electroporated (0 كيلو فولت / سم) الفجوة بعد 1 ساعة على وسادة الاغاروز عند 37 درجة مئوية. في ظل نفس الظروف، 78 ± 3٪ و 49 ± 3٪ من الخلايا electroporated عند 0.9 كيلو فولت / سم و 1.8 كيلو فولت / سم يقسم على التوالي بعد 1 ساعة. لكفاءة التحميل، يتم تحميل 73 ± 8٪ من الخلايا في 0.9 كيلو فولت / سم، في حين يتم تحميل 92 ± 6٪ من الخلايا في 1.8 كيلو فولت / سم. وأشرطة الخطأ تمثل الانحراف المعياري يحسب من ثلاثة قياسات مستقلة؛ وقد تم تحليل أكثر من 200 خلية لكل عينة وكل تكرار. عموما زيادات كفاءة تحميل مع Electroporation للالجهد على حساب طفيف في بقاء الخلية. (B) القياسات مضان القائم على خلية على مدى عدة أجيال تبين أن كثافة مضان الشاملة ومناصفة بين كل من الخلايا الوليدة. خلية 1 و 2 يشير إلى عدد الخلايا في صورة الضوء الأبيض (يسار) وصورة مضان في ر = 0. مقياسشريط: 1 ميكرون). تم تعديل هذا الرقم من إشارة 26.
استيعاب البروتين
النتائج تمثيلية للبروتين تدخيل هي في أرقام 5A & B. ومن المهم بصفة خاصة لإزالة أكبر قدر من تبقى حرة (غير المتفاعل) صبغة من العينة البروتين ممكن قبل Electroporation لل. في الأمثلة في أرقام 5A & B، وCy3b المسمى عينة Klenow جزء (Cy3b-KF، حيث KF هو جزء Klenow من E. القولونية البلمرة DNA I، 66 كيلو دالتون) يحتوي فقط صبغ مجانا 1٪. هذه المساهمة صبغ للتحميل خلية العام لا يكاد يذكر. مقارنات بين عينة electroporated في المصالح مع كل من خلايا غير electroporated (حضنت مع نفس الكمية من البروتين المسمى) وكذلك خلايا electroporated مع كمية مساوية من صبغ الحرة تشكل اثنين من الضوابط اللازمة لضمان أن جزيئات الفلورسنت لاحظوالمنضوية في الواقع البروتينات المسمى.
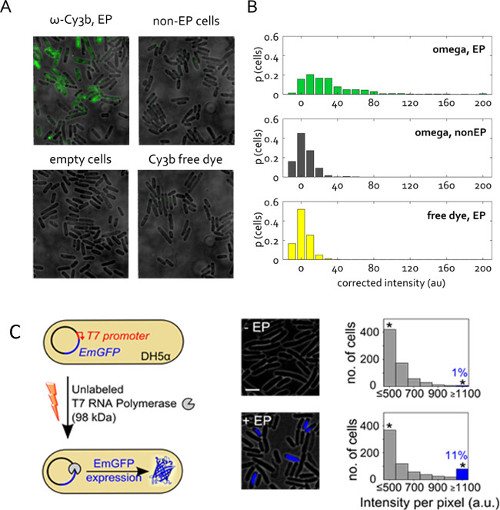
الشكل 5: استيعاب البروتين في البكتيريا الحية (A) الممثل الحقل تراكب مضان في وجهات النظر. خلايا electroporated 1.4 كيلو فولت الجهد مع الوحدة الفرعية 50 بمول RNAP ω من حل الأسهم البروتين التي تحتوي على 1٪ فقط مجانا Cy3b صباغة. غير electroporated (غير -EP) وخلايا فارغة يتم تعريفها كما سبق. تم المنضوية صبغ مجاني في نفس التركيز كما في RNAP ω عينة electroporated. التصوير في وضع حقل واسع، 532 نانومتر الإثارة في 1 ميغاواط، 50 مللي التعرض. (ب) توزيع الكثافات-بلغ متوسط خلية غير المصححة للعينات في (A)، وبالنظر في نسبة عدد خلايا الكلي. تم مجزأة أكثر من 400 خلية لكل عينة. تم تعديل هذا الرقم من إشارة 22. (C) تدخيل unlabeled T7 RNA البلمرة (T7 RNAP، 98 كيلو دالتون) في electrocompetent DH5α تحمل pRSET-EmGFP ترميز البلازميد الزمرد GFP (EmGFP) تحت سيطرة المروج T7. اليسار: رسم تخطيطي للفحص. الأوسط: تراكب مضان. اليمين: رسوم بيانية من شدة مضان القائم على خلية للعينة غير electroporated (أعلى) والخلايا المحتضنة و electroporated مع T7 RNAP (القاع)؛ ما يقرب من 11٪ من الخلايا electroporated تظهر كثافة عالية مضان (جزء من الخلايا مع كثافة العمليات.> يعني + 3X الأمراض المنقولة جنسيا. ديف. من عينة غير -EP) مما يدل التعبير عن EmGFP. العلامات النجمية تشير إلى صناديق جمع كل شدة أعلى أو يساوي 1،100 الاتحاد الافريقي شريط مقياس: 3 ميكرون. تم تعديل هذا الرقم من إشارة 26.
الشكل 5C يقدم تطبيق آخر من البروتين Electroporation لل. هنا، البروتين electroporated هو الخالي من الملصقات، ولكن استيعاب لها يطلق استجابة الفلورسنت ملاحظتها. هذه التجربة بالتحقق من قبلالعمالي وظائف بروتينات electroporated في السيتوبلازم الخلية. وقد استوعبت البلمرة الخالي من الملصقات T7 RNA (98 كيلو دالتون) في E. القولونية سلالة DH5α تحتوي على ترميز البلازميد لبروتين فلوري EmGFP تحت سيطرة أحد المروجين T7 26. كما جين T7 RNA البلمرة غائب في DH5α، EmGFP التعبير في تجاربنا يتطلب أن يتم إدخال وظيفية البلمرة T7 RNA في الخلايا عن طريق Electroporation لل(الشكل 5C). وبعد Electroporation للمع 1 بمول T7 RNAP،> 11٪ من الخلايا (الشريط الأزرق، الشكل 5C) عرضت مضان أعلى من السيطرة السلبية (حضنت مع نفس الكمية من T7 RNAP، ولكن ليس electroporated). هذه النتيجة تنص على أن نسبة من جزيئات T7 RNAP المنضوية بواسطة Electroporation للتحتفظ سلامتها في الجسم الحي، ويمكن أن تؤدي وظائفها المقصود في السيتوبلازم الخلية.
في الجسم الحي الحنق على جزيء واحدومستويات وحيدة الخلية
وأخيرا، يتم تقديم استيعاب وتحليل الأنواع المسمى مضاعف في البكتيريا التي تعيش في الشكل (6) وفيلم التكميلي 3. اندماج بروتين كما الفلورسنت ليست مثالية لفي الدراسات المجراة smFRET، والقدرة على تقديم الجزيئات الحيوية وصفت مضاعف في الخلايا الحية باستخدام Electroporation للهي واحدة من الأصول العظيمة لهذا الأسلوب. ويعرض الشكل 6A وحيدة الخلية الحنق تحليل البكتيريا محملة معايير الحنق DNA مختلفة (باستخدام Cy3B وfluorophores Atto647N متبرع-متقبل زوج الحنق). وelectroporated الخلايا مع 20 بمول من ثلاثة قصيرة معايير dsDNA الحنق وصفت مضاعف مع الكفاءات الحنق واضحة (E *) 0.17، 0.48، و 0.86 في المختبر (سابقا تحدد 26). جميع السلطات الوطنية المعينة تدخل خلايا بكفاءة (6A الشكل، الأيسر) وذروة الرئيسية لكل خلية واحدة-E * توزيع يوافق بشكل جيد مع النتائج في المختبر (الشكل 6A، أليس كذلك). في عينات المتوسطة والعالية الحنق، سكان الخلية مع انخفاض E * لوحظ، ويفترض نتيجة لمزيج من تبييض متقبل والخمول photophysical، تحميل خلية متغيرة مما كان متوقعا (وبالتالي، ونسبة متغيرة إشارة إلى الضوضاء) وتدهور DNA .
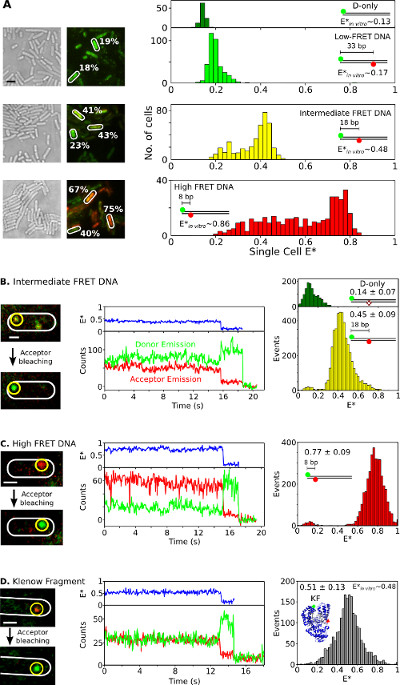
الشكل (6):.. ممثل النتائج لخلية واحدة واحدة جزيء الحنق المراقبة في البكتيريا التي تعيش فرقة وsmFRET دراسات في البكتيريا واحدة (A) تحليل خلايا محملة 20 بمول كل من ثلاثة معايير DNA الحنق واظهار منخفضة (~ 0.17)، وسيطة (~ 0.48)، وعالية (~ 0.86) الحنق (كما تقاس باستخدام القياسات جزيء واحد في المختبر؛ انظر REF 26). اليسار: الضوء الأبيض والأخضر / أحمر الصور (الحنق) مضان تراكب (شريط مقياس: 3 ميكرون). يشار إلى أمثلة من القيم الحنق من خلايا مختلفة (الأبيض). تلاعب حزب التحرير (الأعلى إلى الأسفل): دون تصحيح الحنق القائم على الخلية (E *) رسوم بيانية للمانحين فقط (الأخضر الداكن)، وانخفاض (الضوء الأخضر) والمتوسط (الصفراء)، وارتفاع (الحمراء) الحنق معايير DNA (B-D) في الجسم الحي smFRET. يتم تحميل الخلايا مع 0.25 بمول متوسطة الحنق DNA (لوحة B)، 0.25 بمول عالية الحنق DNA (لوحة C)، و 5 بمول مضاعف صفت-KF (لوحة D). العمود الأيسر: أخضر / أحمر تراكب مضان من إطار واحد قبل وبعد photobleaching من متقبل. العمود الأوسط: آثار الوقت المقابلة لجزيء في دائرة صفراء. يتم عرض الكفاءات الحنق، شدة الانبعاثات المانحة، وشدة الانبعاثات متقبل في الأزرق والأخضر، والأحمر، على التوالي. العمود الأيمن: رسوم بيانية الحنق من الجهات المانحة فقط جزيئات (الخضراء) وجزيئات المانحين متقبل (الأصفر والأحمر، والرمادي) من 20 آثار الوقت لكل عينة. الحانات النطاق: 3 ميكرون لA، 1 ميكرون لB-D. تم تعديل هذا الرقم من إشارة 26.208fig6large.jpg "الهدف =" _ فارغة "> الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
لمراقبة smFRET في الجسم الحي لDNA أو البروتين العينات، وكميات منخفضة (0.25 بمول) من المعايير DNA المتوسطة والعالية الحنق (الشكل 6B، C) أو 5 بمول المزدوج المسمى fluorophores KF (Alexa647 / Cy3B كما زوج الحنق، الشكل 6D) وelectroporated إلى E. القولونية. وأدت مثل هذه التركيزات إلى العديد من الخلايا محملة قليلة (ن = 1-10) جزيئات المسمى، مما يسمح للتوطين المباشر، وتتبع، والحنق مراقبة للجزيئات واحدة. بعض جزيئات منتشر بحرية، بينما يبدو البعض الآخر متحرك أو منتشر ببطء (الفيلم التكميلي 3). Timetraces من يجمد الجزيئات الحيوية وصفت مضاعف (الشكل 6، وسط) الماضي لمدة 1 إلى 30 ق وتظهر بصمات smFRET: التغييرات anticorrelated في مضان المانحة ومتقبل على متقبل تبيض (على سبيل المثال، ر ~ 16 ثانية؛ الشكل 6B، وسط )، تليها واحدةتبيض -step المانحة (على سبيل المثال، ر ~؛ 19 ثانية؛ الشكل 6B). توزيعات الحنق الناتجة عن مثل timetraces (الشكل 6، يمين) النتيجة في القيمة المتوسطة التي هي في الاتفاق ممتازة مع المنشورة في الدراسات المختبرية 26،31،32. هذه النتائج تثبت القدرة على دراسات smFRET الكمية على السلطات الوطنية المعينة المنضوية والبروتينات، وتشير إلى أن البروتينات المحافظة على سلامتها وهيكل على Electroporation للواستيعاب (كما تدعمها التجارب T7 RNAP الداخلي).
الفيلم التكميلي 1: بقاء الخلية اليسار: صور الضوء الأبيض. الصور مضان: الصحيح. الرسوم المتحركة GIF الرسوم المتحركة التي تبين تقسيم بعد Electroporation لل(1.8 كيلو فولت / سم) من البكتيريا محملة DNA وصفت 10 بمول Atto647. ويرجع ذلك إلى التخفيف من الحمض النووي المسمى على انقسام الخلايا وكذلك الانخفاض الواضح العام للمضان جزئيا إلى photobleaching من الذي يحدث خلال كلالقياس.
الفيلم التكميلي 2: دراسات photobleaching من خلية القاعدة A.. مثال ممثل خلية محملة بالسلاح (التي تحتوي على> 100 جزيئات الحمض النووي المسمى Atto647N). أعلى اليسار، صورة الضوء الأبيض للخلية من الفائدة (مستطيل أحمر). أعلى اليمين، الفيلم من الخلايا تحميل يظهر تسوس مضان على مدى عدة دقائق. القاع، والوقت أثر للالشامل تسوس كثافة مضان الخلية من الفائدة. يمكن fluorophores العضوية المعرض photobleaching من عمر 2 أوامر من حجم أعلى من ضباط الإتصال (هنا، ~ 41 ثانية لAtto647N). B. سبيل المثال الممثل خلية محملة أقل من 10 الجزيئات المسمى (3 في هذه الحالة). الأعلى، نفس لوحة A. القاع، والوقت أثر للكثافة مضان الشاملة للخلية من الفائدة التي تبين واحد خطوة تبيض و / أو امض الموافق fluorophores العضوية واحدة. ارتفاع متوسط من هذه الخطوات يتوافق مع شدة وحدوية واحدة جزيء (هنا ~12 الاتحاد الافريقي) المستخدمة لتقدير العدد الأولي من جزيئات المنضوية لكل خلية. الأفلام تحت الحمراء مستمرة الإثارة ليزر في 300 μW السلطة و 100 ميللي ثانية لكل إطار.
الفيلم التكميلي 3: أنا ن فيفو جزيء واحد الحنق الأعلى: خلايا محملة 0.25 بمول عالية الحنق الحمض النووي (كما في الشكل 6C) رصد مستمر في 50 مللي ثانية لكل إطار تحت nTIRF الإضاءة باستخدام 1 ميغاواط الأخضر (532 نانومتر) الليزر. كل إطار هو أخضر / أحمر تراكب (الحنق) مضان من كل قناة. نشرها ويمكن ملاحظتها الأحمر متحرك (سليمة) والأخضر (التسمية النشطة واحدة) جزيئات DNA. أثر الوقت المقابلة لجزيء في دائرة صفراء: أسفل. يتم عرض الكفاءات الحنق، شدة الانبعاثات المانحة، وشدة الانبعاثات متقبل في الأزرق والأخضر، والأحمر، على التوالي. الحدث مكافحة المترابطة تبييض متقبل (التحولات الحمراء إلى الخضراء) يتوافق مع توقيع جزيء واحد الحنق.
Discussion
يمكن أن تختلف العديد من المعلمات أثناء Electroporation للخلية والحصول على البيانات اعتمادا على النظام البيولوجي للاهتمام والطبيعة الدقيقة للتجربة (على مستوى الخلية أو تحليل جزيء واحد). على سبيل المثال، عندما electroporating الحمض النووي في البكتيريا، ،25-5 بمول من شظايا dsDNA المسمى يؤدي إلى كفاءة استيعاب منخفضة، مما يسمح المباشر الكشف عن جزيء واحد (أي.، من دون الحاجة ل photobleaching مسبقا). فوق 5 بمول dsDNA، وخلايا تميل الى ان تكون محملة بالسلاح، وهو نظام أكثر ملاءمة للتحليل وحيدة الخلية. وينبغي أيضا أن تكون جميع السلطات الوطنية المعينة وصفت سابقا من أجل إزالة أي أثر للصبغة خالية من تنقية جل (fluorophore غير رد فعل) من محلول المخزون DNA. الى جانب ذلك، المشاكل المحتملة مع تدهور الحمض النووي، وخاصة للتجارب smFRET، يمكن معالجتها باستخدام السلطات الوطنية المعينة مع الأحماض النووية غير طبيعية، أو الزخارف التي تحمي-نوكلياز خارجية يمكن الوصول إليها مصطلحات مثل الحلقات القاسي.
adjustabl آخرالمعلمة الإلكترونية في Electroporation للهي قوة المجال تطبيقها خلال Electroporation لل. انخفاض قوة المجال (~ 1 كيلو فولت / سم) سوف يؤدي إلى انخفاض كفاءة تحميل المناسبة للدراسات جزيء واحد. سوف شدة المجال أعلى (تصل إلى 1.8 كيلو فولت / سم) زيادة كفاءة تحميل. ومع ذلك، هناك علاقة عكسية بين قوة المجال وبقاء الخلية بعد Electroporation لل(انظر الشكل 4). للإشارة، قوة الحقل العادية المستخدمة للبكتيريا والخميرة Electroporation للهي ~ 1.5 كيلو فولت / سم. ثابت الوقت، وهو ما يمثل طول هذا الاضمحلال، معلمة مريحة لمتابعة، ومنذ ذلك الوقت قطرات مستمرة في أقرب وقت يحدث أي ظاهرة الانحناء في كفيت. ضمن إعدادات العادية، يجب أن تكون ثابتة الوقت أكبر من 4 مللي ثانية. وانخفاض القيم يؤدي إلى انخفاض كفاءة التحميل أو الخلايا التالفة حتى غير المحملة. العرض الأكثر electroporators درجة أخرى من الحرية (مثل "اقتطاع النبض" أو "نبض شكل") التي يمكن تعديلها لضبط كلاتحميل الخلايا وقدرتها على البقاء. طبقنا هذه الطريقة على كل من البكتيريا والخميرة، ولكن يجب أن إجراءات مماثلة تسمح أيضا تدخيل الجزيئات الحيوية وصفت في خلايا الثدييات باستخدام إعدادات electroporator المناسبة منذ الغشاء هو في الواقع أقل تعقيدا (طبقة ثنائية الدهن واحدة) ومنذ Electroporation للتم بالفعل استخدام مع مثل هذه الخلايا 21.
عندما استيعاب البروتينات المسمى، يحتاج الى كل صبغة مجانا ليتم إزالتها من Electroporation للسابق وصفت حل الأسهم البروتين. جزيئات الصبغة الحرة، نظرا لحجم أصغر، ويمكن المنضوية تفضيلي على البروتينات من الفائدة، ويصعب التمييز خلال تحليل البيانات (على الرغم من المتوقع أسرع نشرها). كدليل، لعينة من البروتين المسمى عضويا تكون مناسبة ل electroporation، وينبغي أن تكون كمية المتبقية صبغ الحرة أقل من 2٪ (الكشف عنها باستخدام المسح الضوئي فلوري من SDS-PAGE) 22. هذه العملية أهمية خاصة،حيث أن بعض الجزيئات قد التمسك الأغشية الخارجية للبكتيريا electroporated أو الخميرة. وفي هذا الصدد، ينبغي أن عينة السيطرة السلبية عرض كثافة مضان لكل خلية أقل وضوحا من خلايا electroporated، من الناحية المثالية منخفضة تصل إلى مستوى تألق ذاتي للخلايا فارغة (الخلايا التي لم المحتضنة مع أي الجزيئات الحيوية fluorescently المسمى ولا electroporated، الشكل 2).
كما هو الحال مع dsDNA، ترتبط كفاءة استيعاب البروتينات وصفت لكمية الجزيئات الحيوية تضاف إلى الخلايا قبل Electroporation لل. ومع ذلك، غيرها من المعالم، مثل الحجم وتهمة، تلعب دورا في استيعاب. بروتينات صغيرة يحمل الكفاءة استيعاب عالية، في حين أن البروتينات أكبر (تصل إلى 98 كيلو دالتون) يمكن المنضوية بنجاح ولكن مع انخفاض كفاءة (الشكل 5) 26. نقطة isolelectric من البروتين، والتفاعلات المحتملة مع غشاء الخلية وغيرها من المعلمات الفيزيائية أيضاتأثير تحميل خلية أثناء Electroporation لل. ونتيجة لذلك، يحتاج المستخدمون لتحسين تجارب لنظامهم الخاص، مع العلم أن تركيز أولي عالية من البروتين المسمى (> 50 ميكرومتر) سوف يعطي أفضل فرصة لتحميل ناجحة. كما يقدم Electroporation للأداة جديدة لالتشويش وتحليل وظيفة الخلوية عن طريق إدخال البروتينات والجزيئات الحيوية الأخرى إلى خلايا (إما المسمى أو غير المسماة). التجارب T7 RNA البلمرة (الشكل 5C) الحالية مثل هذا المثال على تجربة حيث يمكننا إدخال جزيء حيوي التي يمكن أن تغير التعبير الجيني في الجسم الحي باستخدام Electroporation لل.
عند إجراء التجارب مضان جزيء واحد، وعادة ما فضلت TIR إنارة فوق وسائط الإضاءة الأخرى، حيث أنها توفر أفضل نسبة الإشارة إلى الضوضاء التي كتبها fluorophores الوحيدة المثيرة داخل قسم رقيقة فوق سطح ساترة (~ 100 نانومتر). ومع ذلك التصوير المسمى الجزيئات الحيوية نشرها داخل الكائنات الحية الدقيقة التي تعيش قد تعيدكراس الإضاءة أعمق (ما يصل إلى 0.8 ميكرون لكولاي). ويتحقق الإضاءة أعمق في وضع HILO، مع الحفاظ على نسبة عالية إشارة إلى الضوضاء. من ناحية أخرى، والتصوير حقل واسع مهم بشكل خاص لتحليل photobleaching من خطوة حكيمة، حيث كان المستخدم تقدير عدد جزيئات المنضوية بواسطة photobleaching من خلية محملة بالكامل مع قوة الليزر عالية وتقسيم كثافة مضان الخلايا الأولية من شدة وحدوية المنتجة من جزيء واحد (الخطوة photobleaching من واحدة، الشكل 3). مطلوب Widefield التصوير أيضا لتتبع جزيء طويل الأجل من أجل توطين الجزيئات نشرها من الاهتمام حتى لو تغطي مساراتها حجم الخلية بأكمله.
في هذا البروتوكول، نقدم كيف Electroporation لل، وهي تقنية قياسية لعلماء الأحياء والكيمياء الحيوية لتقديم الأحماض النووية في خلايا، يشكل طريقة بسيطة لتقديم الجزيئات الحيوية الفلورسنت في مختلف أنواع الخلايا. عشرهو الرواية، وتقنية عالية الإنتاجية وتوفر أداة فريدة من نوعها لمراقبة الجزيئات المسمى في بيئتها الأصلية. في الجزيئات الحيوية بالإضافة المسمى مع fluorophores التي تغطي مجموعة واسعة من الأطوال الموجية، Electroporation للجزيئات يمكن أن يحقق المعدلة مع العديد من المجموعات الكيميائية، مثل النيوكليوتيدات غير طبيعية والأحماض الأمينية، وchelators المعدنية، crosslinkers، والجماعات تتم محاصرة. إذا كان النظام البيولوجي للاهتمام ليست ضرورية في تطوير الخلايا، وترميز الجين للبروتين الهدف يمكن أيضا أن يتم حذف (أو طرقت إلى أسفل)، وضمان أن البروتينات وحظ بعد استيعاب وتمثل جميع (أو أكثر) من تجمع البروتين داخل الخلايا . في جوهرها، Electroporation للأن "زراعة" مرونة في المختبر bioconjugates في الخلايا الحية وبالتالي تستفيد الجهود في مجال البيولوجيا الاصطناعية، وبيولوجيا الأنظمة، والحية الكشف عن جزيء واحد.
Disclosures
The authors have nothing to disclose.
Acknowledgements
We thank Stephan Uphoff for discussions.
R.C. was supported by Linacre College, Oxford University. A.P. was supported by the German Academic Exchange Service (DAAD), the German National Academic Foundation and EPSRC. M.S. was supported by the Wellcome Trust. A.N.K. was supported by a UK BBSRC grant (BB/H01795X/1), and a European Research Council Starter grant (261227).
Materials
| Name | Company | Catalog Number | Comments |
| ElectroMax DH5-alpha Comptent cells | Invitrogen | 11319-019 | or any other commercial or lab-mage electrocompetant bacteria or yeast. |
| EZ Rich Defined Madia | Teknova | M2105 | low fluorescence rich media |
| MicroPulser Electroporation Apparatus | Biorad | 165-2100 | or any classical electroporator for microorganism transformation |
| Certified Molecular Biology agarose | Biorad | 161-3100 | low fluorescence agarose for agarose pad |
| Microscope coverslips No 1.5 thickness | Menzel | BB024060SC | remove background particles by heating slides in furnace at 500 °C for 1h |
| Single-molecule fluorescence microscope | Home-built | described in REFs | |
| Localization software | Custom-written, available online | MATLAB and C++ software package that can be adapted for localization analysis. | |
| Tracking software | Available online | MATLAB implementation by Blair and Dufresne. |
References
- Tsien, R. Y. The green fluorescent protein. Annu Rev Biochem. 67, 509-544 (1998).
- Leake, M. C., et al. Stoichiometry and turnover in single, functioning membrane protein complexes. Nature. 443, 355-358 (2006).
- Taniguchi, Y., Kawakami, M. Application of HaloTag protein to covalent immobilization of recombinant proteins for single molecule force spectroscopy. Langmuir. 26, 10433-10436 (2010).
- Xie, X. S., Choi, P. J., Li, G. W., Lee, N. K., Lia, G. Single-molecule approach to molecular biology in living bacterial cells. Annual review of biophysics. 37, 417-444 (2008).
- Lee, J. H., et al. Highly multiplexed subcellular RNA sequencing in situ. Science. 343, 1360-1363 (2014).
- Miesenbock, G., De Angelis, D. A., Rothman, J. E. Visualizing secretion and synaptic transmission with pH-sensitive green fluorescent proteins. Nature. 394, 192-195 (1998).
- Sauer, M. Localization microscopy coming of age: from concepts to biological impact. J Cell Sci. 126, 3505-3513 (2013).
- Dempsey, G. T., Vaughan, J. C., Hao Chen, K., Zhuang, X. Evaluation of fluorophores for optimal performance in localizationbased super-resolution imaging. Nat Meth. 8, 1027-1041 (2011).
- Shaner, N. C., Steinbach, P. A., Tsien, R. Y. A guide to choosing fluorescent proteins. Nat Meth. 2, 905-909 (2005).
- Landgraf, D., Okumus, B., Chien, P., Baker, T. A., Paulsson, J. Segregation of molecules at cell division reveals native protein localization. Nat. Methods. 9, 480-482 (2012).
- Jaitin, D. A., et al. Massively Parallel Single-Cell RNA-Seq for Marker-Free Decomposition of Tissues into Cell Types. Science. 343, 776-779 (2014).
- Aldridge, S., et al. AHT-ChIP-seq: a completely automated robotic protocol for high-throughput chromatin immunoprecipitation. Genome Biol. 14, R124 (2013).
- Keppler, A., et al. A general method for the covalent labeling of fusion proteins with small molecules in vivo. Nat Biotechnol. 21, 86-89 (2003).
- Wombacher, R., et al. Live-cell super-resolution imaging with trimethoprim conjugates. Nat. Methods. 7, 717-719 (2010).
- Zhang, Z., et al. A new strategy for the site-specific modification of proteins in vivo. Biochemistry. 42, 6735-6746 (2003).
- McNeil, P. L., Murphy, R. F., Lanni, F., Taylor, D. L. A method for incorporating macromolecules into adherent cells. J Cell Biol. 98, 1556-1564 (1984).
- Clarke, M. S., McNeil, P. L. Syringe loading introduces macromolecules into living mammalian cell cytosol. J Cell Sci. 102, 533-541 (1992).
- Sakon, J. J., Weninger, K. R. Detecting the conformation of individual proteins in live cells. Nat. Methods. 7, 203-205 (2010).
- Taylor, L. S. Electromagnetic syringe. IEEE Trans. Biomed. Eng. 25, 303-304 (1978).
- Dower, W. J., Miller, J. F., Ragsdale, C. W. High efficiency transformation of E. coli by high voltage electroporation. Nucleic Acids Res. 16, 6127-6145 (1988).
- Neumann, E., Schaefer-Ridder, M., Wang, Y., Hofschneider, P. H. Gene transfer into mouse lyoma cells by electroporation in high electric fields. EMBO J. 1, 841-845 (1982).
- Sustarsic, M., et al. Optimized delivery of fluorescently labeled proteins in live bacteria using electroporation. Histochem Cell Biol. , (2014).
- Tokunaga, M., Imamoto, N., Sakata-Sogawa, K. Highly inclined thin illumination enables clear single-molecule imaging in cells. Nat. Methods. 5, 159-161 (2008).
- Sinha, A., et al. A cascade of DNA-binding proteins for sexual commitment and development in Plasmodium. Nature. 000, 1-5 (2014).
- English, B. P., et al. Single-molecule investigations of the stringent response machinery in living bacterial cells. Proc Natl Acad Sci U S A. 108, E365-E373 (2011).
- Crawford, R., et al. Long-lived intracellular single-molecule fluorescence using electroporated molecules. Biophys J. 105, 2439-2450 (2013).
- Uphoff, S., Reyes-Lamothe, R., Garza de Leon, F., Sherratt, D. J., Kapanidis, A. N. Single-molecule DNA repair in live bacteria. Proc Natl Acad Sci U S A. 110, 8063-8068 (2013).
- Uphoff, S., Sherratt, D. J., Kapanidis, A. N. Visualizing Protein-DNA Interactions in Live Bacterial Cells Using Photoactivated Single-molecule Tracking. J Vis Exp. , (2014).
- Hohlbein, J., Gryte, K., Heilemann, M., Kapanidis, A. N. Surfing on a new wave of single-molecule fluorescence methods. Phys Biol. 7, 031001 (2010).
- Xie, X. S., Yu, J., Yang, W. Y. Perspective - Living cells as test tubes. Science. 312, 228-230 (2006).
- Santoso, Y., et al. Conformational transitions in DNA polymerase I revealed by single-molecule FRET. Proc Natl Acad Sci U S A. 107, 715-720 (2010).
- Hohlbein, J., et al. Conformational landscapes of DNA polymerase I and mutator derivatives establish fidelity checkpoints for nucleotide insertion. Nature communications. 4, 2131 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved