A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
التمهيدي لالمناعية على نسيج Cryosectioned دماغ الفئران: مثال تلطيخ لالدبقية الصغيرة والخلايا العصبية
In This Article
Summary
This introductory level protocol describes the reagents, equipment, and techniques required to complete immunohistochemical staining of rodent brains, using markers for microglia and neuronal elements as an example.
Abstract
المناعية هو أسلوب يستخدم على نطاق واسع للكشف عن وجود، والموقع، والوفرة النسبية للمستضدات في الموقع. يصف هذا البروتوكول المستوى التمهيدي الكواشف والمعدات والتقنيات اللازمة لاستكمال تلطيخ المناعى أنسجة الدماغ القوارض، وذلك باستخدام علامات لالخلايا الدبقية الصغيرة والعناصر العصبية كمثال على ذلك. على وجه التحديد، فإن هذه الورقة هي بروتوكول خطوة بخطوة لرؤية فلوري من الخلايا الدبقية الصغيرة والخلايا العصبية عن طريق المناعية للIba1 وعموم العصبية، على التوالي. مضان مزدوج وضع العلامات مفيد بشكل خاص للتوطين بروتينات متعددة داخل نفس العينة، وتوفير الفرصة لمراقبة بدقة التفاعلات بين أنواع الخلايا، والمستقبلات، بروابط، و / أو المصفوفة خارج الخلية في علاقتها ببعضها البعض وكذلك البروتين المشارك توطين داخل خلية واحدة. على عكس تقنيات التصوير الأخرى، مضان المناعية كثافة تلطيخ قد ينخفض فيمن أسابيع إلى أشهر التالية تلطيخ، ما لم تتخذ الاحتياطات المناسبة. على الرغم من هذا القيد، في العديد من التطبيقات ويفضل مضان مزدوج وضع العلامات على بدائل مثل tetrahydrochloride 3،3'-diaminobenzidine (DAB) أو الفوسفاتيز القلوية (AP)، ومضان هو المزيد من الوقت الفعال ويسمح للتمايز أكثر دقة بين دولتين أو أكثر علامات. وتشمل المناقشة نصائح استكشاف الأخطاء وإصلاحها والمشورة لتعزيز النجاح.
Introduction
المناعية هي عملية للكشف عن المستضدات (أي البروتينات) في أقسام الأنسجة باستخدام الأجسام المضادة الأولية التي تربط خصيصا لمولدات المضادات من الفائدة. كان رائدا المناعية التي كتبها JR ماراك في عام 1934 عندما قرر أن الأجسام المضادة يمكن أن توطين مستضدات مع خصوصية كبيرة 1. ابتداء من عام 1942، ونشرت بعض من أولى الدراسات في المختبر باستخدام الأجسام المضادة فلوري لتصور المناعية 2،3، وبعد ذلك لأول مرة في الجسم الحي الدراسة النسيجية تم نشره 4. خلال عام 1960، بعد ثلاثة عقود من إنشائها أساليب المناعى، بدأت الأجسام المضادة انزيم مترافق لاستخدامها الكواشف الثانوية. تم في وقت واحد وبشكل مستقل وضعت هذه الأساليب في فرنسا والولايات المتحدة 5،6. اليوم، مجموعة واسعة من الأجسام المضادة تقدم احتمالات لا نهاية لها للدراسات المناعية 7.
"> ويتمثل الهدف العام من هذه المراسلات هو توفير مقدمة موجزة إلى تلطيخ المناعى، وليس المقصود أن يكون استعراضا شاملا وكاملا لهذه التقنية في الأسلوب المبين، وتعرض تقنيات المناعى لمدة المستضدات (علامات على الخلايا الدبقية الصغيرة و. الخلايا العصبية) لتلطيخ من امتصاص العرق perfused ل، السكروز cryoprotected، cryosectioned الدماغ الفئران. تلطيخ المناعى يبدأ حجب المستضد غير محددة ملزمة للحد من تلوين الخلفية. بعد ذلك، الحضانة مع الأجسام المضادة الأولية تسمح للربط لمستضد معين في الأنسجة. وبعد الأجسام المضادة الأولية، الأجسام المضادة آخر، وصف الأجسام المضادة الثانوية، يتم تطبيقها على ربط الأجسام المضادة الأولية إلى إشارة التصور مترافق 8. والضد الثانوية يستهدف المناعي G (مفتش) مجال معين إلى الأنواع التي أثيرت الأجسام المضادة الأولية. يضخم الجسم المضاد الثانوي إشارة من الأجسام المضادة الأولية منذ المناطق فاب رانه الثانوي ربط الأجسام المضادة لمواقع متعددة في المجال مفتش من الأجسام المضادة الأولية. إما الإنزيمات أو جزيئات فلوري مترافق إلى ج مناطق F من الأجسام المضادة الثانوية تمكن التصور. على سبيل المثال، أرنب الأجسام المضادة الأولية مكافحة Iba1 هو أرنب جزيء مفتش محددة لIba1. عندما يتم تطبيق حمار المضادة للأرنب مفتش بمثابة الضد الثانوية، انها لن تعترف وربط مناطق متعددة من الأرانب مكافحة Iba1 مفتش (انظر الشكل 1). الأجسام المضادة حمار يمكن تصور بطرق مختلفة. وتركز هذه المراسلات على الكشف عن fluorophore مترافق الأجسام المضادة الثانوية، الذي يعترف الأجسام المضادة الأولية، لتصور بواسطة المجهر الفلورسنت. في المناعية الفلورسنت، وصمة عار النووية مثل هويشت أو دابي يمكن استخدامها لتصور كل نواة.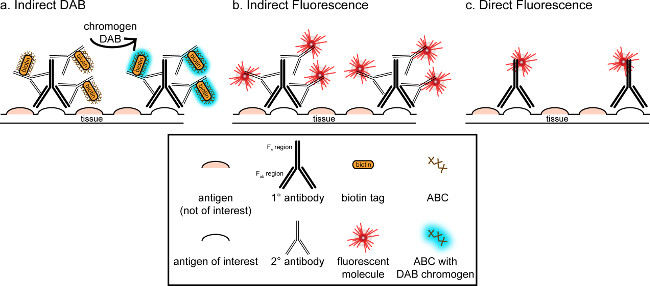
الشكل 1: شوبتمثيل ematic من مقابل المباشر تقنيات وضع العلامات الأجسام المضادة غير المباشر. الأجسام المضادة ربط المستضد من الفائدة ويمكن تضخيمها من قبل الأجسام المضادة الثانوية التي أثيرت ضد أنواع من الأجسام المضادة الأولية. هذه التقنية يمكن القيام بها باستخدام مجمع أفيدين البيوتين (ABC) لتضخيم وDAB التصور (A) أو الأجسام المضادة الثانوية فلوري مترافق مباشرة (B). بدلا من ذلك، الأجسام المضادة الأولية يمكن مترافق مباشرة مع العديد من العلامات المختلفة، بما في ذلك البيوتين أو fluorophore (C). الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
طريقة بديلة لرؤية تلطيخ المناعى يستخدم 3،3'-diaminobenzidine tetrahydrochloride (DAB؛ انظر الشكلين 1 و 2). هذا يختلف عن مضان باستخدام البيروكسيديز أوالغلوثانيون الحصان الفجل (HRP) الأجسام المضادة الثانوية مترافق، التي تنص على انزيم تحويل DAB إلى راسب التي مرئيا تحت مشرق المجهري الميدان. في الحالات التي تكون فيها مستضد واحد هو من مصلحة أو مطلوب تلطيخ أن تكون طويلة الأمد، قد يكون DAB أكثر ملاءمة من تلطيخ الفلورسنت. ومع ذلك، لا مناسبة تماما DAB تلطيخ للتمايز بين علامات متعددة، لا سيما إذا كان اثنان من المستضدات النووية المثيرة للاهتمام. للحصول على معلومات عن المواد DAB وتعديلات بروتوكول، راجع الجدول 1. بالتناوب، نيترو الأزرق كلوريد نتروبلو / 5-برومو-4-كلورو-3-indolyl الفوسفات (NBT / BCIP) يمكن استخدامها لتصور والفوسفاتيز القلوية (ا ف ب) مترافق الثانوية الأجسام المضادة.
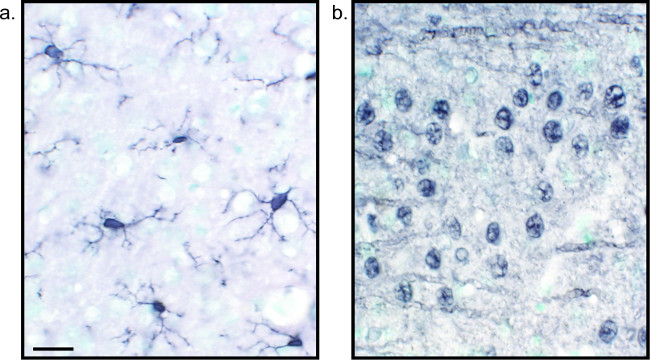
الشكل 2: صور الممثل DAB الفئران أقسام محسنة النيكل أنسجة المخ واحدة وصفت حد ذاتها دماغ الفئرانctions التي وصفت مع محسنة النيكل DAB لIba1 (A) وعموم العصبية (B) يسمح للتحليل طويل الأمد من الخلايا الدبقية الصغيرة أو الخلايا العصبية وحدها. مقياس شريط 20 ميكرون. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
يجب على المرء أن ينظر في وفرة المقدرة للمستضد المصالح داخل الأنسجة التي يجري تحليلها. وسائل غير مباشرة (كما هو موضح أعلاه) هي مفيدة للأهداف مع وفرة منخفضة. عندما مستضد من الفائدة في وفرة عالية، ويمكن تطبيقها الأساليب المباشرة. طرق المباشرة تنطوي على الأجسام المضادة الأولية التي مترافق مباشرة إلى إشارة التصور، وبالتالي لا يلزم الضد الثانوية. هذه الطريقة يبسط عملية التلوين، ولكن يلغي التضخيم من قبل وسائل غير مباشرة تحقيقها. باستخدام الأجسام المضادة الأولية مترافق مباشرة كما يلغي عبر التفاعل من الأجسام المضادة الثانويةعند النقر المزدوج وضع العلامات.
هذا التواصل تفاصيل بروتوكول لمضاعفة وضع العلامات مع Iba1 وعموم العصبية (التفاصيل في الجدول 1). Iba1 بقع الخلايا الدبقية الصغيرة في العديد من الدول التنشيط، بما في ذلك متشعب، فرط متشعب، تنشيط، أميبية، وقضيب. البقع عموم العصبية محاور الخلايا العصبية، التشعبات، وسوما. منذ Iba1 البقع معظم الخلايا الدبقية الصغيرة والأهداف عموم العصبية في الخلايا العصبية، وهذا مزيج من البقع مفيد في الحصول على فهم واسع من التفاعلات الخلايا الدبقية الصغيرة الخلايا العصبية.
باختصار، يعتمد تلطيخ المناعى على الاختيار الدقيق للأجسام. كما يصبح السؤال البحثي أكثر تحديدا، قد يكون المطلوب الأجسام المضادة التي أثيرت لمستضدات بديلة. استهداف دولة تفعيل دبقية محددة، يمكن للمرء أن يختار استخدام CD45 CD68 أو الأجسام المضادة، بدلا من Iba1. وعلاوة على ذلك، في العمل مع الفئران، F4 / 80 قد توفر النتائج اللازمة. وبالمثل، عناصر الخلايا العصبية يمكن أن تستهدف على وجه التحديد مع الأجسام المضادة راISED ضد النواة، المشبك (قبل أو ما بعد)، المحور، ومخروط النمو. بالإضافة إلى ذلك، هناك علامات أخرى والتي تفرق عمر الخلايا العصبية (انقر نقرا مزدوجا كورتين، NeuN)، وتجديد الخلايا العصبية (GAP-43).
Access restricted. Please log in or start a trial to view this content.
Protocol
ملاحظة: تم تنفيذ جميع الإجراءات في الامتثال مع اللجنة المؤسسية رعاية الحيوان واستخدام (IACUC) من جامعة ولاية اريزونا. ويمكن الاطلاع على قائمة المواد والمعدات الموصى بها في الجدول 1.
1. إعداد الأنسجة
- نضح
- الموت ببطء القوارض مع جرعة زائدة من الصوديوم بنتوباربيتال (25 ملغ / كغ، IP)، ويروي transcardially مع الفوسفات مخزنة المالحة (PBS) حتى exsanguinated تماما (3-5 دقيقة) بمعدل تدفق 8 مل / دقيقة. للحصول على تعليمات نضح في العمق، انظر غيج وآخرون 2012 9.
- مباشرة بعد PBS دافق، وإصلاح الأنسجة عن طريق perfusing مع بارافورمالدهيد 4٪ في برنامج تلفزيوني لمدة 15-20 دقيقة بمعدل تدفق 8 مل / دقيقة.
- إزالة الدماغ ووضعه في 4٪ امتصاص العرق لمدة 24 ساعة، تليها حلول السكروز متدرج (15٪، 30٪، 30٪، في التسلسل؛ أعدت في تريس مخزنة المالحة) في 4 ° C. نقل الدماغ لاحقا السكروز حل سنلي بعد الدماغ قد غرقت في كل حل. ملاحظة: عادة، 5 أيام في كل حل هو الوقت الكافي للأنسجة لتغرق.
- تجميد الأنسجة وCryosectioning
- وضع الدماغ في تضمين المتوسطة، مثل أكتوبر المجمع ويغرق في isopentane عند درجة حرارة -35 درجة مئوية. السماح للدماغ لتجميد مدة لا تقل عن 10 دقيقة، ومن ثم تخزين في -80 ° C. مشاكل يمكن أن تنشأ إذا لم يتم اتخاذ الحرص على درجة الحرارة؛ الرجاء انظر المناقشة لاستكشاف المعلومات.
- قطع أقسام الاكليلية التسلسلية في سمك 20 ميكرون ودرجة حرارة -20 درجة مئوية. جمع الأنسجة على الشرائح ذات شحنة موجبة. قد تكون وضعت أقسام الدماغ في مربع الشريحة ملفوفة في احباط في كيس الرمز البريدي أعلى وتخزينها على المدى الطويل في -80 ° C. هذه الطريقة في التخزين يخلق الحدود مزدوجة لمنع التعرض للهواء والصقيع.
2. معالجة الأنسجة
ملاحظة: المعدات والمواد مثال صequired لتلطيخ في الشكل 3. هي البدائل المتاحة، ومع ذلك، فإن هذه الصور تساعد أولئك جديدة لتلطيخ المناعى لتصور العناصر المناسبة قبل الشراء.

الرقم 3: مثال العناصر المطلوبة لتلطيخ المناعى مربع أسود هو مبين في (A) هو غرفة الرطوبة مثالية لالمناعي، كما يتم حماية الشرائح من الضوء دون الحاجة إلى التفاف مربع على احباط. بعد باجتزاء، والشرائح يمكن تخزينها في صندوق مثل المربع الأصفر هو مبين في (B). التفاف مربع بإحكام في احباط ووضع في كيس الرمز البريدي أعلى قبل الثلاجة يساعد على حماية عينات الأنسجة من حرق المجمد. تم اعطاء مثال من الشرائح في (C)، مع أطباق تلطيخ مختلفة صورت في (D) و (E ). يمكن Coverslips تختلف في الحجم والسمك (F)، ومع ذلك توفر 1.2 coverslips سميكة نتائج التصوير لطيفة على معظم المجاهر تستقيم ومتحد البؤر. قلم رصاص مثل تلك المبينة في (G) يمكن استخدامها لتسمية الشرائح. وينبغي تجنب علامات دائمة مثل الحبر يمكن تشغيل، مما يؤثر على تلطيخ والقدرة على تحديد ما هي العينة. قلم حلمة الثدي صغيرة مثل تلك التي تظهر في (H) تمكن الحدود طارد التي يمكن استخلاصها على الشرائح.
- إعداد الشريحة
- إزالة الشرائح من الفريزر وذوبان الجليد في درجة حرارة الغرفة.
- اختياري: إذا أقسام قد طرحت في وقت سابق من الشرائح، ووضع الشرائح إذابة في فرن عند 60 درجة مئوية لمدة لا تزيد على 4 ساعات للمساعدة في منع المقاطع النسيجية من عائمة قبالة الشرائح.
- مكان الشرائح في رفوف الشريحة وطبق المقابلة.
- غسل الشرائح ثلاث مرات في برنامج تلفزيوني لمدة 5 دقائق لكل منهما، وتغيير الحل بين يغسل. من هذه الخطوة إلى الأمام، وتجنب وجود sectiإضافات دون السائل لفترات طويلة من الزمن. ملاحظة: إذا أقسام تجف، يتم زيادة تلوين الخلفية، ولا يمكن أن يعتمد عليه الحصول على بيانات ذات مغزى.
- إزالة الشرائح من الفريزر وذوبان الجليد في درجة حرارة الغرفة.
- الأنسجة تلطيخ
- في مربع تلطيخ ضوء محكم، إنشاء "غرفة الرطوبة" مع الأنسجة خالية من الوبر ينقع بالماء منزوع الأيونات.
- تجف حواف الشريحة بمنديل خالية من الوبر، واستخدام PAP القلم مصغرة لجعل الحدود طارد السائل على حافة جدا من الشرائح، بعيدا عن أقسام الأنسجة. وينبغي أن تكفل هذه الحدود حيزا واسعا بين الغضروف المفصلي للسائل وحافة النسيج بحيث التوتر السطحي لا يؤثر تلطيخ.
ملاحظة: يمكن تطبيق الحدود طارد حلمة الثدي من ركلة جزاء قبل 2.1.3 إذا كانت الأجسام المضادة التي تهم لا تتطلب الميكروويف استرجاع مستضد. إذا تم تطبيق القلم حلمة الثدي قبل الغسيل في برنامج تلفزيوني، يجب أن يتم التحقق من سلامة الحدود السائل طارد في هذه الخطوة. استخدام قلم مصغرة حلمة الثدي لملء أي ثغرات في الحدود. - مع الشرائح وضعت أفقيا، كتلة المستضد غير محددة ملزمة التي يحتضنها في 4٪ ت / ت مصل في برنامج تلفزيوني (حل كتلة). ماصة 300 ميكرولتر من حل كتلة لكل شريحة ل1hr في درجة حرارة الغرفة. تأكد من حل كتلة يمتد إلى القلم حلمة الثدي عند حافة الشريحة ويغطي تماما الأنسجة لتجنب تلطيخ متفاوتة الناجمة عن التوتر السطحي بالقرب من الأنسجة.
- استخدام المصل من نفس الأنواع التي يتم فيها الأجسام المضادة الثانوية. ملاحظة: في هذا الإجراء، يتم إجراء الأجسام المضادة الثانوية في الحمار، وبالتالي يستخدم المصل حمار. إذا تم استخدام الأجسام المضادة الثانوية من اثنين أو أكثر من الأنواع المختلفة، وتشمل المصل من كل الأنواع.
- ماصة الأجسام المضادة الأولية على الشرائح. ملاحظة: لقد تم تحسين تركيز الأجسام المضادة لهذا تلطيخ في 1: 5000 و 1: 500 للIba1 وعموم العصبية، على التوالي. تم العثور على هذه التركيزات لإظهار تلطيخ هادف مع غياب تلوين الخلفية.
- تمييع الحل كتلة ل1٪ مصل في برنامج تلفزيوني وإضافة الأجسام المضادة الأولية. ماصة 300 ميكرولتر من محلول الأجسام المضادة الأولية في 1٪ مصل لكل شريحة. مرة أخرى، وضمان السائل إلى حافة القلم حلمة الثدي. احتضان بين عشية وضحاها في 4 درجات مئوية.
- تشمل ثلاث شرائح التحكم: واحد يحتوي على لا Iba1 ولا عموم العصبية الأجسام المضادة، واحدة مع Iba1 دون الأجسام المضادة عموم العصبية، واحدة مع الأجسام المضادة عموم العصبية دون Iba1. وصمة عار هذه الشرائح في نفس المدى مع نفس الحلول، ولكن حذفت الأجسام المضادة الأولية لاختبار ملزمة من الأجسام المضادة الثانوية غير محددة.
- في صباح اليوم التالي، وغسل الشرائح ثلاث مرات في برنامج تلفزيوني لمدة 5 دقائق لكل منهما، وتغيير الحل بين يغسل.
- الأجسام المضادة الفلورسنت هي حساسة للضوء، وبالتالي، من هذه الخطوة إلى الأمام، والحد من التعرض للضوء عن طريق ضمان يتم تغليف الحاويات غسل في احباط والتهجين صناديق إما أسود أو المحتضنة في الظلام. ماصة الأجسام المضادة الثانوية المناسبة على كافة الشرائح واحتضان ل60 دقيقة في درجة حرارة الغرفة بتركيز 1: 250 في حل كتلة (راجع الخطوة 2.2.3) في "غرفة الرطوبة" الخفيفة محكم (راجع الخطوة 2.2.1).
- استخدام الأجسام المضادة الثانوية من أطوال موجية مختلفة. هنا، للأرنب الأجسام المضادة الأولية ومكافحة Iba1، استخدم الحمار أرنب مكافحة 594 كما الأجسام المضادة الثانوية المناسب. الماوس الأجسام المضادة الأولية مكافحة عموم العصبية، استخدم الحمار مكافحة فأر 488 كما الأجسام المضادة الثانوية المناسب. بالتناوب، استخدم المضادة للأرنب 488 ومكافحة فأر 594.
- غسل الشرائح ثلاث مرات في برنامج تلفزيوني لمدة 5 دقائق لكل منهما.
- اختياري: أداء تلطيخ النووي.
- مكان في هويشت (أو وصمة عار النووية الأخرى) بتركيز 0.03 ميكروغرام / مل في ضعف H المقطر 2 0 بالضبط 60 ثانية.
- غسل الشرائح ثلاث مرات في برنامج تلفزيوني لمدة 5 دقائق لكل منهما.
- يغسل في ده 2 0.
- Coverslipping
- شرائح ساترة مع وسط مائي التركيب، مثل فلورomount-G أو ProlongGold. الحرص على إزالة جميع الفقاعات باستخدام قضيب من القطن ذات الرؤوس.
ملاحظة: يمكن أن تستخدم عوامل أخرى تصاعد مستمر، وقد لوحظ مع ذلك عالية تنزف من خلال بين الأصباغ من قبل بعض غضون أيام من coverslipping. - استخدام طلاء الأظافر واضحة لختم الحواف، ومنع المقاطع من الجفاف بسبب التبخر. السماح طلاء الأظافر لتجف في وعاء محكم الخفيفة في حين تبقى الشرائح مسطحة وعند درجة حرارة الغرفة، ومن ثم تخزينها في حاوية للضوء ضيق ملفوفة في احباط في 4 ° C.
- شرائح ساترة مع وسط مائي التركيب، مثل فلورomount-G أو ProlongGold. الحرص على إزالة جميع الفقاعات باستخدام قضيب من القطن ذات الرؤوس.
3. تصوير الأنسجة الملون
- المجهر
- السماح للطلاء الأظافر لتجف لمدة ساعة واحدة على الأقل قبل البدء المجهري، والتي ينبغي أن تتم في غرفة مظلمة.
- الحصول photomicrographs باستخدام متحد البؤر أو المجهر البحث مع مصدر ضوء الفلورسنت ومرفق الكاميرا الرقمية. استخدام البرمجيات المصاحبة لها، تعيين التعرض لكل طول موجي - 405، 488، و 594 - على حدة. ملاحظة: في عمق ينبغي أن تكون تعليمات التصوير على شبكة الإنترنت من الشركة المصنعة المجهر.
- الحصول photomicrographs في كل قناة دون تحريك الفروع أو ضبط التركيز البؤري. التقاط صور في اللون، أو بالتناوب في الرمادي وتحويله إلى اللون بعد ذلك.
ملاحظة: اللون أو الصور الرمادية من كل قناة يمكن ترتيبها في مرحلة ما بعد المعالجة. - ضمان عدم تعرض تلك المقاطع النسيجية للضوء المحيط أو ضوء المجهري لفترات طويلة من الزمن، كما قدم صورة تبيض الأقسام سيحدث. لتجنب هذا، وزيادة التعرض الوقت بدلا من زيادة شدة الضوء / ليزر.
- لا إيقاف مصدر ضوء الفلورسنت غضون 30 دقيقة من التعرض للتشغيل.
ملاحظة: التبديل المصدر وإيقاف في تتابع سريع قد يقلل من العمر الافتراضي للمصباح الفلورسنت.
Access restricted. Please log in or start a trial to view this content.
النتائج
هذه النتائج بروتوكول تلطيخ في أقسام الأنسجة دماغ الفئران التي الخلايا الدبقية الصغيرة fluorescently المسمى في 594 قناة (الحمراء)، والخلايا العصبية المسماة في 488 قناة (الأخضر؛ انظر الشكل 4). إذا كان قد تم القيام به وصمة عار النووية، وسوف تظهر في القناة 405 (أزرق). يمكن ال...
Access restricted. Please log in or start a trial to view this content.
Discussion
وكان الهدف العام من هذه الاتصالات لإدخال إجراءات المناعية للقارئ. لهذا، مثال مزدوج وضع العلامات مع Iba1 ومولدات المضادات عموم العصبية لمراقبة الخلايا الدبقية الصغيرة والخلايا العصبية في امتصاص العرق perfused ل، تم استخدام السكروز الدماغ cryoprotected، الفئران cryosectioned.
Access restricted. Please log in or start a trial to view this content.
Disclosures
The authors have nothing to disclose.
Acknowledgements
The authors would like to thank Mr. Ryan Hart and Mr. Arriz Lucas for their invaluable feedback on this communication. This work was supported by NIH NINDS R01 NS065052 and Phoenix Children’s Hospital Mission Support Funds.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| Fisherbrand Superfrost Plus Glass Slides | Fisher Scientific | 22-034-979 | Used for tissue mounting (1.2.2) |
| Oven | Thermo Scientific | 51028112 | Used for tissue drying (2.1.1) |
| Mini Pap pen | Life Technologies | 00-8877 | Used in step 2.2.2 |
| Andwin Scientific Tissue-tek Slide Staining Dish | Fisher Scientific | 22-149-429 | Used for all washes during staining (2.2), as well as the Hoechst step (2.2.8) |
| Kimwipes | Fisher Scientific | 06-666-A | Used for drying slides (2.2) |
| Black Staining Box | Ted Pella | 21050 | Used for blocking and staining steps (2.2) |
| Normal Donkey Serum | Fisher Scientific | 50-413-253 | Used for block and antibody incubation (2.2) |
| Mouse α-Pan-neuronal | Millipore | MAB2300 | Used for primary antibody (2.2.4) |
| Rabbit α-Iba1 | Wako Chemical | 019-19741 | Used for primary antibody (2.2.4) |
| Donkey α-rabbit 594 | Jackson ImmunoResearch | 711-585-152 | Used for secondary antibody (2.2.6) |
| Donkey α-mouse 488 | Jackson ImmunoResearch | 715-545-150 | Used for secondary antibody (2.2.6) |
| Caterer's foil | Any | N/A | Used in steps 1.2.2 and 2.3.2 |
| Fluoromount-G | Southern Biotech | 0100-01 | Used for coverslipping (2.2.8) |
| Coverslips | Fisher Scientific | 12544E | Used for coverslipping (2.2.8) |
| Clear Nail Polish | Any | N/A | Used for coverslipping (2.2.8) |
| Axio Observer.Z1 and LSM 710 (laser scanning, confocal) | Carl Zeiss | N/A | Used for imaging (3) |
| Axioskop A2 | Carl Zeiss | N/A | Used for imaging (3) |
| CitriSolv | FisherScientific | For DAB protocol | |
| ABC | Vector Laboratories | PK-6100 | For DAB protocol |
| DAB Peroxidase kit | Vector Laboratories | SK-4100 | For DAB protocol |
| Biotinylated horse α-rabbit IgG | Vector Laboratories | BA-1100 | For DAB protocol |
| Biotinylated horse α-mouse IgG | Vector Laboratories | BA-2001 | For DAB protocol |
| 30% Hydrogen Peroxide | FisherScientific | H325-500 | For DAB protocol |
| Wheaton slide racks and staining dishes | TedPella | 21043 | For DAB protocol |
| Masterflex perfusion pump and tubing | Cole-Parmer | Used for perfusion (1.1.1 and 1.1.2) | |
| Andwin scientific tissue-tek CRYO-OCT compound (case of 12) | Fisher Scientific | 14-373-65 | Used for tissue freezing (1.2.1) |
| Thermometer (-50 to 50 C) | Fisher Scientific | 15-059-228 | Used for tissue freezing (1.2.1) |
| Cryostat | Leica | CM3500S | Used for tissue sectioning (1.2.2) |
| Staining Dish, Plastic with 2 Lids | Grale Scientific | 353 | For antigen retrival |
| 20 Place Staining Rack, Slides Horizontal | Grale Scientific | 354 | For antigen retrival |
| Microwave | Any | N/A | For antigen retrival |
References
- Marrack, J. R. Chemistry of antigens and antibodies. Nature. 134, 468-469 (1934).
- Coons, A. H., Creech, H. J., Jones, R. N., Berliner, E. The demonstration of pneumococcal antigen in tissues by the use of fluorescent antibody. J Immunol. 45, 159-170 (1942).
- Marshall, J. M. Localization of adrenocorticotropic hormone by histochemical and immunochemical methods. The Journal of experimental medicine. 94, 21-30 (1951).
- Mellors, R. C. Histochemical demonstration of the in vivo localization of antibodies: antigenic components of the kidney and the pathogenesis of glomerulonephritis. The journal of histochemistry and cytochemistry : official journal of the Histochemistry Society. 3, 284-289 (1955).
- Nakane, P. K., Pierce, G. B. Enzyme-labeled antibodies: preparation and application for the localization of antigens. The journal of histochemistry and cytochemistry : official journal of the Histochemistry Society. 14, 929-931 (1966).
- Avrameas, S., Uriel, J. Method of antigen and antibody labelling with enzymes and its immunodiffusion application. Comptes rendus hebdomadaires des seances de l'Academie des sciences. Serie D: Sciences naturelles. 262, 2543-2545 (1966).
- Cuello, A. C. Immunohistochemistry. , Wiley. (1983).
- Junqueira, L. C. U., Mescher, A. L. Junqueira's basic histology : text and atlas. , Thirteenth edition / edn, (2013).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of visualized experiments : JoVE. , (2012).
- Christensen, N. K., Winther, L. Education Guide: Immunohistochemical (IHC) staining methods. Kumar, G. L., Rudbeck, L. , DAKO North America. Carpinteria, California. 103-108 (2009).
- Wang, G., Achim, C. L., Hamilton, R. L., Wiley, C. A., Soontornniyomkij, V. Tyramide signal amplification method in multiple-label immunofluorescence confocal microscopy). Methods. 18, 459-464 (1999).
- Feldengut, S., Del Tredici, K., Braak, H. Paraffin sections of 70-100 mum: a novel technique and its benefits for studying the nervous system. Journal of neuroscience methods. 215, 241-244 (2013).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved