A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
رصد في الوقت الحقيقي من ردود الفعل تنفيذها باستخدام معالجة التدفق المستمر: إعداد 3-Acetylcoumarin كمثال
In This Article
Summary
رصد في الوقت الحقيقي يسمح لتعظيم الاستفادة السريعة من ردود الفعل تنفيذها باستخدام معالجة الدفق المستمر. هنا يتم استخدام إعداد 3-acetylcoumarin كمثال على ذلك. يوصف جهاز لأداء في الموقع رامان الرصد، وكذلك الخطوات المطلوبة لتحسين التفاعل.
Abstract
باستخدام الرصد مضمنة، فمن الممكن لتحسين ردود الفعل تنفيذها باستخدام معالجة الدفق المستمر في طريقة بسيطة وسريعة. ومن الممكن أيضا لضمان جودة المنتج بما يتفق مع مرور الوقت باستخدام هذه التقنية. نعرض هنا كيفية التفاعل وحدة تدفق المتاحة تجاريا مع مطياف رامان. يتم وضع خلية تدفق رامان بعد منظم الضغط الخلفي، وهذا يعني أنه يمكن تشغيلها في الضغط الجوي. وبالإضافة إلى ذلك، فإن حقيقة أن تيار المنتج يمر من خلال طول الأنبوب قبل دخول الخلية التدفق يعني أن المواد في RT. ومن المهم أن يتم الحصول على أطياف تحت ظروف متساوي منذ رامان كثافة إشارة على درجات الحرارة. وقد اجتمعنا الجهاز، نحن ثم تظهر كيفية مراقبة تفاعل كيميائي، والتوليف المحفز تأكسد من 3 acetylcoumarin من ساليسيلالدهيد وإيثيل acetoacetate تستخدم كمثال على ذلك. لا يمكن أن يؤديها في رد فعل على مجموعة من معدلات التدفق لد درجات الحرارة، وأداة رصد في الموقع تستخدم لتحسين الظروف ببساطة وسهولة.
Introduction
باستخدام معالجة الدفق المستمر والكيميائيين وتجد أنها يمكن أن تؤدي مجموعة من التفاعلات الكيميائية بشكل آمن وفعال، وبكل سهولة 1،2. ونتيجة لذلك، معدات الكيمياء تدفق أصبحت أداة متكاملة لتشغيل ردود الفعل على حد سواء في المواقع الصناعية وكذلك مختبرات الأبحاث في المؤسسات الأكاديمية. وقد أجريت مجموعة واسعة من التحولات الكيميائية الاصطناعية في المفاعلات تدفق 3،4. في حالات محددة، وقد أظهرت ردود الفعل التي لا تعمل في دفعة للمضي قدما بسلاسة في ظل ظروف الدفق المستمر 5. لكل الأمثل رد فعل ومراقبة الجودة، وإدماج تراقب رد فعل في خط مع تجهيز تدفق يوفر مزايا هامة. في خط يوفر الرصد التحليل المستمر مع الاستجابة في الوقت الحقيقي لظروف عينة الفعلية. هذا هو أسرع و، في بعض الحالات، أكثر موثوقية من مقارنة خارج الخط التقنيات. وقد تم ربطه عدد من في خط التقنيات التحليلية مع fمفاعلات منخفضة 7. وتشمل الأمثلة بالأشعة تحت الحمراء 8،9، الأشعة فوق البنفسجية مرئية 10،11، 12،13 NMR، رامان الطيفي 14،15، وقياس الطيف الكتلي 16،17.
وقد ربطه مجموعتنا البحثية مطياف رامان مع وحدة الميكروويف العلمية 18. باستخدام هذا، وقد تم رصد مجموعة من ردود الفعل من كل من النوعية والكمية 20 19 وجهة. بناء على هذا النجاح، قمنا ربطه مؤخرا لدينا مطياف رامان مع واحدة من وحدات الدفق المستمر لدينا وتستخدم من أجل رصد رد فعل من عدد من التحولات العضوية طبي ذات الصلة الأساسية في الخط. 21 وفي كل حالة كان من الممكن لمراقبة ردود الفعل وأيضا في مثال واحد، عن طريق منحنى المعايرة، استطعنا تحديد تحويل المنتج من البيانات الطيفية رامان. في هنا وصفنا كيفية إعداد الجهاز واستخدامه لرصد ردود الفعل. نستخدم التوليف المحفز تأكسد من 3 تيارetylcoumarin (1) من ساليسيلالدهيد مع acetoacetate الإيثيلي (الشكل 1) كرد فعل النموذج هنا.
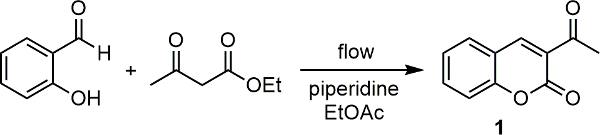
الشكل 1. قاعدة حفزت رد فعل التكثيف بين ساليسيلالدهيد وإيثيل acetoacetate لانتاج 3-acetylcoumarin (1). الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
Protocol
1. البحث عن إشارات مناسبة لمراقبة التفاعل
- الحصول على أطياف رامان لجميع المواد الأولية والمنتجات.
- تراكب أطياف والتعرف على الفرقة الشديدة التي هي فريدة من نوعها لهذا المنتج.
- استخدام هذه الفرقة رامان لرصد التقدم المحرز في رد الفعل. -1 تم اختيار الفرقة في 1608 سم في هذه الحالة.
2. إعداد خلية تدفق
- الحصول على خلية تدفق مناسبة. هنا استخدم واحد مع الأبعاد التالية: عرض 6.5 ملم، وارتفاع 20 مم، وطول الطريق من 5 مم (الشكل 2A).
- وضع خلية تدفق في وعاء الذي يوفر بيئة خالية من الإضاءة المحيطة.
- ربط الأنابيب لمدخل ومخرج الخلية التدفق (في هذه الحالة 1 مم ID PFA الأنابيب).
3. واجهة رامان الطيفي مع خلية تدفق
- الحصول على مطياف رامان مناسبة مع جمعية البصرية المرنة التي يمكن وضعها في جتفقد القرب من الخلية التدفق.
- وضع التجميع البصري من خلال فتحة بحجم مناسب في صندوق يحتوي على تجميع خلية تدفق (الشكل 2B).
- حرك التجميع البصري حتى يلمس خلية تدفق ثم تسحبه إلى الوراء تاركا فجوة ~ 2 مم.
- ملء الخلية التدفق مع 100٪ الأسيتون.
- بدوره على مطياف رامان واكتساب الأطياف في الوضع المستمر المسح.
- تركيز الليزر عن طريق تحريك بلطف أنبوب الخفيفة جزء في وقت واحد. مواصلة التحرك أنبوب الخفيفة حتى إشارة على أكبر كثافة وقمم حادة واضحة المعالم.

الشكل 2. (A) تدفق الخلايا واجهة (B) رامان المستخدمة. الرجاء انقر هنا لعرض أكبر وهاءrsion من هذا الرقم.
4. إعداد الكاشف وحلول المذيبات
- إضافة ساليسيلالدهيد (6.106 غرام، 50 ميلي مول، 1 EQUIV) وacetoacetate الإيثيلي (6.507 غرام، 50 ميلي مول، 1 EQUIV) إلى 50 مل قارورة حجمية.
- إضافة خلات الإيثيل إلى وحدة تخزين ما مجموعه 50 مل ثم تخلط جيدا محتويات.
- نقل قسامة 10 مل من محلول المخزون إلى كوب 20 مل قارورة تحتوي على شريط مغناطيسي. تسمية هذه القارورة "الكاشف".
- في مكان زجاجة 100 مل 90 مل من خلات الإيثيل. تسمية هذه الزجاجة "المذيب". في مكان زجاجة 100 مل 90 مل من الأسيتون. تسمية هذه الزجاجة "اعتراض المذيبات".
5. إعداد جهاز التدفق
- تأكد من أن وحدة تدفق اثنين على الأقل المضخات ووصفها "P1" و "P2". تحديد المذيبات وكاشف خطوط مدخل لكل مضخة. وضع خطوط الخروج من وخطوط "النفايات" "جمع" إلى قسمين الأولndividual 100 مل الزجاجات المسمى "منتج" و "النفايات"، على التوالي.
- كما مفاعل، استخدم 10 مل قدرة PFA لفائف قادرة على تسخينها.
- توصيل أنبوب الخروج P1 إلى مدخل لفائف مفاعل PFA.
- تثبيت ثلاثة الميناء الأثير البولي كيتون (نظرة خاطفة) نقطة الإنطلاق خلاط بعد فائف المفاعل.
- توصيل أنبوب الخروج P2 إلى خلاط نقطة الإنطلاق، 180 درجة من لفائف المفاعل خروج الأنابيب. ربط قطعة من الأنابيب إلى ميناء الثالث للخلاط المحملة. على الطرف الآخر من هذا الأنبوب وضع منظم الضغط الخلفي.
- بتوصيل خط من إخراج منظم الضغط الخلفي لإدخال الخلية التدفق. بتوصيل خط من إخراج خلية تدفق إلى "مخلفات / جمع" التبديل.
- رئيس الخطوط المذيبات لكلا P1 و P2 وكذلك خط كاشف للP1 مع المذيب. نقل خط كاشف للP1 من زجاجة مذيب لزجاجة الكاشف.
- باستخدام P1، تمرير خلات الإيثيل من خلال المفاعللفائف في 2 مل / دقيقة حتى يتم ملأها. تمرير الأسيتون من خلال P2 بمعدل تدفق 2 مل / دقيقة لمدة 2 دقيقة.
- ضبط معدلات تدفق المذيبات لكلا P1 و P2 إلى 1 مل / دقيقة. ضبط منظم الضغط الخلفي للضغط 7 بار. ضبط درجة الحرارة لفائف المفاعل إلى درجة الحرارة المطلوبة.
- انقر نقرا مزدوجا التحقق من تكوين المعدات كما هو مبين في التخطيطي في الشكل 3.
- وبمجرد وصول نظام درجة الحرارة والضغط المستمر، والتحقق من وجود تسرب ثم قم بتشغيل رد فعل.
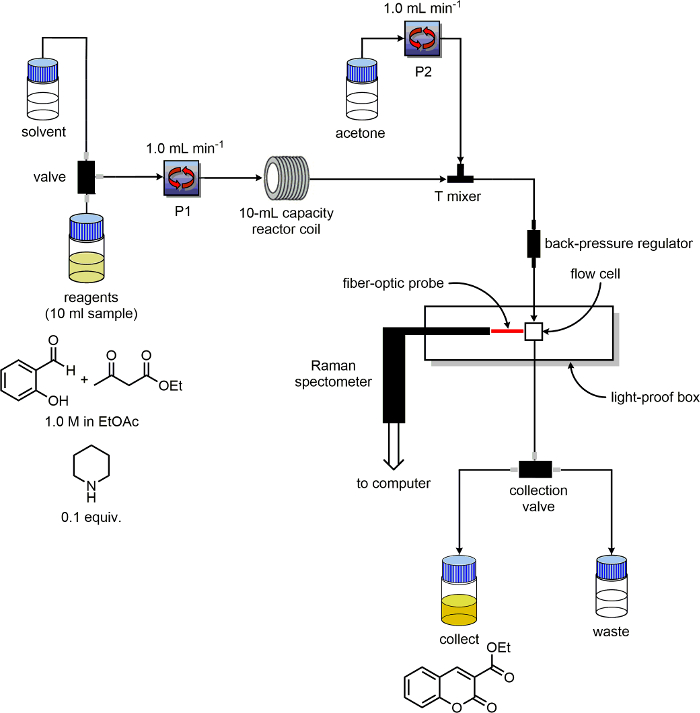
الشكل 3. تخطيطي لتكوين المعدات المستخدمة للتجارب رصد رد الفعل. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
6. مراقبة رد الفعل
- تاكعصام فحص خلفية خلات الإيثيل / الأسيتون نظام المذيبات أثناء مروره من خلال خلية تدفق. هذا وسيتم طرح تلقائيا من جميع بالاشعة لاحقة.
- تكوين مطياف لاتخاذ بمسح كل 15 ثانية (في هذه الحالة تم تعيين مطياف رامان إلى وقت التكامل 10 ثانية، وعربة النقل = 3، ومتوسط = 1).
- حقن تأكسد (0.05 مل، 0.05 ملمول، 0.1 EQUIV) في كل مرة في قارورة زجاجية المسمى "الكاشف".
- بعد خلط دقيق، والتبديل P1 من "المذيب" إلى "الكاشف". تعيين تيار الخروج إلى "جمع".
- عندما تكون جميع المواد يتم تحميل تماما، والتبديل P1 من "الكاشف" إلى "المذيب". متابعة تتدفق المذيب من خلال لفائف المفاعل لمدة 30 دقيقة أخرى. وبعد انقضاء هذا الوقت، إيقاف تشغيل التدفئة.
- مضخات بدوره P1 و P2 قبالة عندما يبرد في درجة الحرارة لفائف المفاعل إلى أقل من 50 درجة مئوية.
7. تحليل البيانات
- تصدير البيانات مطياف رامان إلى جدول بيانات ومؤامرة كثافة رامان في 1608 سم -1 مقابل وقت.
- لتحسين الأوضاع، نفذ رد فعل في عدد من معدلات التدفق ودرجات حرارة المفاعل على نحو متكرر.
- قطع تراكب من شدة رامان في 1608 سم -1 مقابل وقت.
ملاحظة: كثافة رامان العالي يرتبط مع ارتفاع تحويل المنتج.
8. تشغيل رد الفعل عن طريق شروط محسن
- وبعد فحص مختلف الظروف (متفاوتة معدلات تدفق / درجات حرارة المفاعل)، تشغيل رد الفعل باستخدام الظروف الأمثل لتحمل أعلى تحويل المنتج.
9. عزل المنتج
- تأخذ محتويات القارورة المنتجات وسكبه في دورق يحتوي على 100 مل من الجليد و 20 مل من حمض الهيدروكلوريك 2 M.
- شطف القارورة المنتج مع الحد الأدنى من خلات الإيثيل (2 مل)، ونقل إلى الدورق.
- يحرك الخليط المتجمدحتى ذاب كل الجليد تماما.
- اقامة نظام الترشيح مع قمع هيرش، جنبا إلى الذراع القارورة، طوق المطاط وبطول فراغ المطاط أنابيب.
- تصفية الراسب الناتج تحت فراغ، وشطف مع ايثر الباردة (10 مل)، واتركه حتى يجف تحت مصباح الحرارة (2-3 ساعة) أو O جاف / N تحت فراغ.
- تأكيد هوية المنتج من قبل 1 H النووي بالرنين المغناطيسي (NMR) الطيفي باستخدام CDCl 3 مثل المذيبات. ل500 ميغاهيرتز NMR الطيف، و1 البيانات H NMR من 3 acetylcoumarin هي على النحو التالي: δ = 2.73 (ق، 3 H) 7،31-7،40 (م، 2 H) 7.65 (DDD، J = 7.53، 4.37، 2.60 هرتز (2)، H) 8.51 (ق، 1 H) جزء في المليون، 13 C NMR البيانات: δ = 30.84 (CH 3) 117.00 (CH) 118.56 (C) 124.86 (CH) 125.27 (CH) 130.51 (CH) 134.68 (C) 147.74 (CH) 155.64 (C) 159.52 (C) 195.77 (C) جزء في المليون.
النتائج
وقد تم اختيار إعداد الدفق المستمر من 3 acetylcoumarin كرد فعل تمثيلي للرصد في الخط. دفعة واحدة، رد فعل العائدات بشكل جيد عند استخدام خلات الإيثيل مثل المذيبات. ومع ذلك، فإن المنتج (1) غير قابل للذوبان تماما في RT. لمنع انسداد محتمل من منظم الضغط الخلفي، فضلا عن التخفيف ...
Discussion
سهولة التي مطياف رامان يمكن ربطه مع وحدة تدفق يجعل هذه التقنية مضمنة قيمة لرصد رد الفعل. يمكن سبر عدد من المتغيرات رد فعل بطريقة عاجلة، مما يتيح للمستخدم للوصول إلى ظروف التفاعل الأمثل أسرع مما كانت عليه عندما تستخدم حاليا الأساليب. تطبيق التقنيات الموصوفة هنا كما يس...
Disclosures
The authors have nothing to disclose.
Acknowledgements
Financial support provided by National Science Foundation (CAREER award CHE-0847262. We thank Vapourtec Ltd and Enwave Optronics for equipment support, and Daniel Daleb of the University of Connecticut for his assistance in construction of the flow cell apparatus.
Materials
| Name | Company | Catalog Number | Comments |
| Salicylaldehyde | Sigma-Aldrich | S356 | Reagent Grade, 98% |
| Ethyl acetoacetate | Acros Organics | 117970010 | 99% |
| Piperidine | Sigma-Aldrich | 104094 | Reagent Plus, 99% |
| Hydrochloric acid | Sigma-Aldrich | 320331 | ACS Reagent, 37% |
| Ethyl acetate | Sigma-Aldrich | 34858 | CHROMASOLV, for HPLC, >99.7% |
| Acetone | Sigma-Aldrich | 650501 | CHROMASOLV, for HPLC, >99.9% |
| Flow cell | Starna Cells | 583.65.65-Q-5/Z20 | |
| Flow unit | Vapourtec | E-series system | |
| Raman spectrometer | Enwave Optronics Inc | Model EZRaman-L |
References
- Wiles, C., Watts, P. . Micro Reaction Technology in Organic Synthesis. , (2011).
- van den Broek, S. A. M. W., et al. Continuous Flow Production of Thermally Unstable Intermediates in a Microreactor with Inline IR-Analysis: Controlled Vilsmeier–Haack Formylation of Electron-Rich Arenes. Org. Process Res. Dev. 16 (5), 934-938 (2012).
- Baxendale, I. R. The integration of flow reactors into synthetic organic chemistry. J. Chem. Technol. Biotechnol. 88 (4), 519-552 (2013).
- Malet-Sanz, L., Susanne, F. Continuous Flow Synthesis. A Pharma Perspective J. Med. Chem. 55 (9), 4062-4098 (2012).
- Hartwig, J., Metternich, J. B., Nikzad, N., Kirschning, A., Ley, S. V. Continuous flow chemistry: a discovery tool for new chemical reactivity patterns. Org. Biomol. Chem. 12 (22), 3611-3615 (2014).
- De Beer, T., et al. Near infrared and Raman spectroscopy for the in-process monitoring of pharmaceutical production processes. Int. J. Pharm. 417, 32-47 (2001).
- McMullen, J. P., Jensen, K. F. Integrated microreactors for reaction automation: New approaches to reaction development. Annu. Rev. Anal. Chem. 3, 19-42 (2010).
- Moore, J. S., Jensen, K. F. Automated multitrajectory method for reaction optimization in a microfluidic system using online IR analysis. Org. Process Res. Dev. 16 (8), 1409-1415 (2012).
- Carter, C. F., et al. ReactIR Flow Cell: A New Analytical Tool for Continuous Flow Chemical Processing. Org. Process Res. Dev. 14 (2), 393-404 (2010).
- Ferstl, W., et al. Inline Analysis in Microreaction Technology: A Suitable Tool for Process Screening and Optimization. Chem. Eng. Technol. 30 (3), 370-378 (2007).
- Benito-Lopez, F., et al. Optical fiber-based on-line UV/Vis spectroscopic monitoring of chemical reaction kinetics under high pressure in a capillary microreactor. Chem. Commun. (22), 2857-2859 (2005).
- Gökay, O., Albert, K. From single to multiple microcoil flow probe NMR and related capillary techniques: a review. Anal. Bioanal. Chem. 402 (2), 647-669 (2012).
- Jones, C. J., Larive, C. K. Could smaller really be better? Current and future trends in high-resolution microcoil NMR spectroscopy. Anal. Bioanal. Chem. 402 (1), 61-68 (2012).
- Mozharov, S., et al. Improved Method for Kinetic Studies in Microreactors Using Flow Manipulation and Noninvasive Raman Spectrometry. J. Am. Chem. Soc. 133 (10), 3601-3608 (2011).
- Chaplain, G., Haswell, S. J., Fletcher, P. D. I., Kelly, S. M., Mansfield, A. Development and evaluation of a Raman flow cell for monitoring continuous flow reactions. Aust. J. Chem. 66 (2), 208-212 (2013).
- Browne, D. L., et al. Continuous flow reaction monitoring using an on-line miniature mass spectrometer. Rapid Comm. Mass. Spectrosc. 26 (17), (1999).
- Koster, S., Verpoorte, E. A decade of microfluidic analysis coupled with electrospray mass spectrometry: An overview. Lab Chip. 7 (11), 1394-1412 (2007).
- Leadbeater, N. E., Schmink, J. R., Hamlin, T. A., de la Hoz, A., Loupy, A. Tools for Monitoring Reactions Performed Using Microwave Heating. Microwaves in Organic Synthesis. 1, 327-376 (2012).
- Leadbeater, N. E., Schmink, J. R. Use of Raman spectroscopy as a tool for in situ. monitoring of microwave-promoted reactions. Nature Protoc. 3 (1), 1-7 (2008).
- Schmink, J. R., Holcomb, J. L., Leadbeater, N. E. Use of Raman spectroscopy as an In Situ. Tool to Obtain Kinetic Data for Organic Transformations. Chem. Eur. J. 14 (32), 9943-9950 (2008).
- Hamlin, T. A., Leadbeater, N. E. Raman spectroscopy as a tool for monitoring mesoscale continuous-flow organic synthesis: Equipment interface and assessment in four medicinally-relevant reactions. Beilstein J. Org. Chem. 9, 1843-1852 (2013).
- Kelly, C. B., Lee, C., Leadbeater, N. E. An approach for continuous-flow processing of reactions that involve the in situ. formation of organic products. Tetrahedron Lett. 52 (2), 263-265 (2011).
- Wren, S. N., Donaldson, D. J. Glancing-angle Raman spectroscopic probe for reaction kinetics at water surfaces. Phys. Chem. Chem. Phys. 12, 2648-2654 (2010).
- Leadbeater, N. E., Smith, R. J. Real-Time Monitoring of Microwave-Promoted Suzuki Coupling Reactions Using in Situ. Raman Spectroscopy. Org. Lett. 8 (20), 4589-4591 (2006).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved