Method Article
الظهرية جذر العقد الخلايا العصبية والخلايا الجذعية المتباينة الدهنية المشتقة: ل
In This Article
Summary
العقد الجذرية الظهرية (DRG) والهياكل التي تحتوي على الخلايا العصبية الحسية في الجهاز العصبي المحيطي. عندما فصلها، فإنها يمكن أن تكون شارك في تربيتها مع الخلايا الجذعية الدهنية المشتقة مثل SC (ASC)، وتوفير نموذجا قيما للدراسة في المختبر تجديد الأعصاب وتكون الميالين، ومحاكاة البيئة في الجسم الحي في موقع الإصابة.
Abstract
Dorsal root ganglia (DRG) neurons, located in the intervertebral foramina of the spinal column, can be used to create an in vitro system facilitating the study of nerve regeneration and myelination. The glial cells of the peripheral nervous system, Schwann cells (SC), are key facilitators of these processes; it is therefore crucial that the interactions of these cellular components are studied together. Direct contact between DRG neurons and glial cells provides additional stimuli sensed by specific membrane receptors, further improving the neuronal response. SC release growth factors and proteins in the culture medium, which enhance neuron survival and stimulate neurite sprouting and extension. However, SC require long proliferation time to be used for tissue engineering applications and the sacrifice of an healthy nerve for their sourcing. Adipose-derived stem cells (ASC) differentiated into SC phenotype are a valid alternative to SC for the set-up of a co-culture model with DRG neurons to study nerve regeneration. The present work presents a detailed and reproducible step-by-step protocol to harvest both DRG neurons and ASC from adult rats; to differentiate ASC towards a SC phenotype; and combines the two cell types in a direct co-culture system to investigate the interplay between neurons and SC in the peripheral nervous system. This tool has great potential in the optimization of tissue-engineered constructs for peripheral nerve repair.
Introduction
إصابات الأعصاب الطرفية شائعة مع ما يقرب من 9،000 حالة في المملكة المتحدة التي تحدث كل عام في الغالب الشباب والسكان 1 العامل. وعلى الرغم من تقنيات إصلاح العصبية المجهرية، واستعادة وظيفة طبيعية مستحيلة التحقيق مع ما يترتب على ضعف الإحساس جهة، وانخفاض وظيفة الحركة وآلام متكررة والتعصب الباردة 2. مثل هذه الإصابات يكون لها تأثير عميق ودائم على المريض وقدرتها على أداء أنشطة الحياة اليومية، مع أقل من 60٪ العودة إلى العمل 3.
بعد الإصابة، النمط الظاهري ومورفولوجيا الخلايا العصبية وخلايا شوان (SC) التغيير من أجل خلق بيئة مناسبة للسماح للتنتشر محور عصبي. في حالة transection، وينقسم العصب إلى الداني والقاصي جذوعها. الجدعة الداني كونها نقطة من عملية التجدد التي تجري، في حين أن الجدعة البعيدة يخضع ولري انحطاط فتقوم SC فصلمن محاور عصبية المصاب، دي يفرق وتتكاثر. وهذا أمر أساسي من أجل إزالة الحطام الميلين وإعداد الجدعة البعيدة عن العصبية إعادة الجيل 4،5. ويدعم أكسون تنتشر عن طريق إنتاج العوامل وكيموكينات عصبية الصادرة عن SC في الجدعة البعيدة، وتسترشد الصفيحة القاعدية تركت وراءها التالية انحطاط ولري 6،7. SC محاذاة إلى جانب محور عصبي تجديد تشكيل عصابات من Büngner، التي تساعد على نمو محور عصبي تجاه الجهاز المستهدف، والحد من المتفرعة خارج الأنبوب غمد الليف العصبي. وبعد عودة التعصيب، SC تشكيل غمد المايلين جديد التفاف المحاور مجدد، ولكن فقط استعادة الوظيفة الحسية والحركية جزئيا 8.
العقد الجذرية الظهرية (DRG) والهياكل الموجودة في الثقب فقرات العمود الفقري، التي تحتوي على الخلايا العصبية الحسية التعصيب الأجهزة الطرفية. عندما ينفصل، ويمكن استخدامها بوصفها مناسبة في المختبر وزارة الدفاعشرم لدراسة العصبية تجديد 9-11، بما في ذلك التحقيقات في تشكيل المايلين. على وجه الخصوص، الخلايا العصبية DRG الكبار تحاكي خصائص في الجسم الحي من هذه الخلايا وتوفر أداة هائلة لدراسة استراتيجيات جديدة لإصلاح الأعصاب الطرفية في هندسة الأنسجة.
شارك في الثقافات تمثل النظام الديناميكي الذي يحاكي في المختبر التفاعل بين اثنين (أو أكثر) أنواع الخلايا في بيئة خاصة في الجسم الحي. واحدة من المزايا من هذه النماذج خلية ثقافة مشتركة هي المرونة والتحكم العالية التي يمكن أن تمارس على البيئة خارج الخلية. وقد استخدمت الخلايا العصبية DRG في كثير من الأحيان في النظم شارك في الثقافة مع SC لمحاكاة التفاعلات الفعلية التي تحدث بين أنواع الخلايا اثنين في الجهاز العصبي المحيطي 10،12 - 14. وقد تبين أن SC تفرز المصفوفة خارج الخلية (ECM) البروتينات وعوامل النمو التي يمكن بشكل ملحوظ تحسينقدرة الخلايا العصبية DRG من أجل البقاء وتنبت neurites التي 15،16. ومع ذلك، SC تتطلب فترات طويلة من الزمن لتتكاثر وعلى الرغم من التقدم في تقنية زراعة الخلايا، فإنه لا يزال من الصعب على توليد عدد مناسب من الخلايا لتطبيقات هندسة الأنسجة. وبالإضافة إلى ذلك، هناك ضرورة للتضحية من العصبية صحي لموسم الحصاد SC ذاتي. ولذلك، فإن الاختلاف في مصادر SC مهم لكلا هندسة الأنسجة واختبار المختبر من تجديد الأعصاب. في طريقة العرض هذه، يمكن اعتبار ASC بديلا قيما للتنمية بناء الأنسجة المهندسة لاستخدامها في إصلاح الأعصاب الطرفية 17،18. أظهرت الأعمال السابقة من قدرة هذه الخلايا على التمايز إلى مثل SC ASC، معربا مميزة الدبقية-علامات، مثل S-100، P75 وييفي الدبقية البروتين الحمضية (GFAP) 19، وكذلك البروتين المايلين صفر (P0) 20 . إفراز عوامل النمو الدبقية، مثل المشتقة من الدماغ عامل التغذية العصبية (BDNF)، لوحظ عامل نمو الأعصاب (NGF) والدبقية مشتقة من خلية عصبية عامل (GDNF) أيضا 21،22. لذلك، مثل SC ASC يمكن استخدام مروج للتجديد الأعصاب الطرفية، كما يتبين من على حد سواء في التجارب المختبرية والدراسات المجراة 23-26. وبالإضافة إلى ذلك، يمكن أن تحصد ASC من خلال إجراءات الحد الأدنى الغازية في عدد أكبر بالمقارنة مع أنواع الخلايا الجذعية الأخرى؛ تردد للخلايا الجذعية في الأنسجة الدهنية غير 100- إلى 1،000 أضعاف عما كانت عليه في نخاع العظم 27 عاما، وكان لديهم معدل انتشار أعلى مقارنة مع SC ونخاع العظم الخلايا الجذعية الوسيطة.
ويهدف هذا العمل إلى توفير بروتوكول مفصلة لأداء المحاصيل كفاءة عالية من الخلايا العصبية DRG فصل وASC على التوالي، وهذا الأخير يجري متباينة إلى خلايا تشبه SC. لذا فإن الثقافة المشتركة من هذه أنواع الخلايا اثنين من توفير نظام عملي جدا والتي يمكن استخدامها للدراسات المستقبلية على قدرة DRG شمال شرقurons لتنبت neurites التي وآليات تشكيل المايلين على سقالة مختلفة لهندسة الأنسجة العصبية.
Protocol
تم تنفيذ جميع التجارب التي تنطوي على الحيوانات وفقا للحيوانات في المملكة المتحدة (إجراءات علمية) لعام 1986 م: ملاحظة.
1. التجريبية مجموعة المتابعة
- قبل أن تبدأ الأنسجة والخلايا الحصاد، والتحقق من أن جميع الأدوات معقمة. ما إذا لزم الأمر، الأوتوكلاف زوج من مقص جراحي حادة، ملقط دقيق جدا وملقط غرامة قياسية. تعقيم أيضا كل الركيزة قبل البذر الخلية باستخدام التعقيم بالأشعة فوق البنفسجية، والتعرض الإيثانول أو التعقيم بالبخار حسب مقتضى الحال.
- إعداد وسائل الاعلام للحصاد الخلايا الجذعية وتمايز
- إعداد المتوسطة نمو الخلايا الجذعية، والتي تحتوي على الحد الأدنى الضروري المتوسطة (α-MEM) تستكمل مع 10٪ مصل الجنين البقري (FBS)، 200 ملي L-الجلوتامين، و 1٪ للبنسلين الستربتومايسين (PS).
- إعداد 10 ملي حل الأوراق المالية من forskolin عن طريق إذابة 10 ملغ من forskolin في 2.436 مل من ثنائي ميثيل العقيمة sulfoxyde. استخدامها في تركيز النهائي من 14 ميكرومتر.
- إعداد 35 ملغ / مل محلول المخزون من حمض الريتينويك عن طريق إذابة 50 ملغ في 1.43 مل من ثنائي ميثيل العقيمة sulfoxyde. استخدامها في تركيز النهائي من 350 نانوغرام / مل.
- إعداد صفائح المستمدة عامل النمو (PDGF) الأسهم (100 ميكروغرام / مل) عن طريق إذابة 10 ميكروغرام من مسحوق مجفف بالتجميد في 100 ميكرولتر من الماء المعقم المقطر. استخدامها في تركيز النهائي من 5 نانوغرام / مل.
- إعداد الأساسي عامل نمو الخلايا الليفية (bFGF) الأسهم (100 ميكروغرام / مل) عن طريق إذابة 50 ميكروغرام من مسحوق مجفف بالتجميد في 500 ميكرولتر من الماء المعقم المقطر. استخدامها في تركيز النهائي من 10 نانوغرام / مل.
- إعداد المتوسطة الجذعية تمايز الخلايا، تحتوي على المتوسط نمو الخلايا الجذعية تستكمل مع 14 ميكرومتر forskolin، 126 نانوغرام / مل نمو الدبقية عامل 2 (GGF-2)، و 5 نانوغرام / مل المشتقة من الصفائح الدموية عامل النمو (PDGF)، و 10 نانوغرام / مل عامل نمو الخلايا الليفية الأساسية (bFGF).
- إعداد وسائل الاعلام والحلول الأسهم للحصاد الخلايا العصبية والتفكك
- إعداد Bottenstعين وساتو (BS) المتوسطة 28، وذلك بإضافة 1٪ PS و 1٪ ملحق N2 إلى هام في F12 المتوسطة. حساب الحجم النهائي حاجة إلى 500 ميكرولتر لكل بئر (في حالة استخدام لوحة 24-جيدا).
- إعداد الأسهم كولاجيناز الرابع في هام في F12 المتوسطة في تركيز 1.25٪ بالوزن / ت. فلتر تعقيم الحل وتخزينها في -20 ° C إلى 200 مكل.
- إعداد الأسهم التربسين البنكرياس البقري في هام في F12 المتوسطة في تركيز 2.5٪ وزن / الخامس، فلتر تعقيم وتخزينها في -20 ° C إلى 200 مكل.
- إعداد عامل نمو الأعصاب (NGF) حل السهم عند تركيز 5 ميكروغرام / مل في فلتر تعقيم 1 ملغ / مل الدهنية خالية من حمض ألبومين المصل البقري (BSA) حل في F12 المتوسطة وتخزينها في -20 C إلى 200 ميكرولتر مأخوذة. لا تصفية NGF بعد إعادة.
- في حال تم إجراء أي تعديل السطح، coverslips معطف / لوحات مع بولي-D-ليسين (0.1 ملغ / مل لمدة 15 دقيقة في RT) و / أو laminin (2-10 ميكروغرام / سم 2 لمدة 2 ساعة على 37 درجة مئوية) لدعم مرفق الخلايا العصبية وثمرة neurite حسب مقتضى الحال.
- تدفئة دائما حتى وسائل الإعلام في حمام مائي عند 37 درجة مئوية قبل استخدام.
2. الدهنية المشتقة الخلايا الجذعية (ASC) الحصاد والتمايز إلى النمط الظاهري SC
- ASC الحصاد من الدهون الحشوية والإربي من الذكور البالغين سبراغ داولي الفئران
- قبل أن تبدأ، وإعداد أنبوب مع 10-15 مل من هانكس "المتوازن محلول ملحي (HBSS) تستكمل مع 1٪ ت / v من PS حل ومتجر على الجليد حتى الحصاد الدهون.
- إنهاء الفئران عن طريق التفكك عنق الرحم وقطع الرأس. حلق الفئران وإجراء شق خلال الجلد في منطقة البطن، وتعريض الأعضاء الداخلية وتجنب النزيف. إزالة الدهون الحشوية التغليف المعدة والأمعاء (تتميز عادة عن طريق الاتساق الدهنية الأصفر) والدهون الإربي المحيطة الخصيتين من الذكور البالغين سبراغ داولي الفئران. عشر نقلالبريد الدهون في أنبوب يحتوي HBSS على الجليد.
- في خزانة السلامة البيولوجية (الدرجة الثانية) فرم ناعما الدهون باستخدام زوج من مقص وشفرة حلاقة معقمة حتى الاتساق غرامة وصلت وتحويلها إلى أنبوب يحتوي على 15 مل من 0.2٪ وزن / V نوع كولاجيناز I حل استعداد طازجة و تعقيمها تصفية-في اليوم.
- نقل الأنبوب في حمام مائي عند 37 درجة مئوية وتترك الأنسجة الدهنية لهضم في وجود الإنزيم لمدة 30 دقيقة، 1 ساعة في إطار التحريض المستمر. مراقبة الهضم بشكل وثيق ووقف قبل فصل الأنسجة تماما، وهذا سيؤدي إلى تحسين بقاء الخلية والعائد الخلية. -فصلها ثيون مرشح النسيج من خلال خلية مصفاة 100 ميكرون.
ملاحظة: سوف الهضم الأنسجة جيد يؤدي إلى الاتساق متجانسة من الدهون، مرئية بالعين عندما يحوم بلطف الأنبوب، والحصول على مظهر البيج. - تحييد انزيم بإضافة 15 مل من نمو الخلايا الجذعية المتوسطة المحتوية على مصل بقري جنيني عند 37 درجة مئوية وأجهزة الطرد المركزي لالحل في 160 غ لمدة 10 دقيقة من أجل جمع انسجة جزء الأوعية الدموية، بما في ذلك الخلايا الجذعية، في الجزء السفلي من الأنبوب.
- في هذه المرحلة، يمكن أن يكون بيليه معلق في 1 مل من خلايا الدم الحمراء الاحتياطي تحلل لإزالة التلوث خلايا الدم. بعد إعادة تعليق وpipetting لمدة 1 دقيقة، وإضافة 10 مل من الطازجة المتوسطة نمو الخلايا الجذعية والطرد المركزي في 160 غ لمدة 10 دقيقة.
- نضح بعناية طاف من الأنبوب، مع الحرص على بيليه الخلية المودعة في الأسفل. resuspend الخلايا في 10 مل من الخلايا الجذعية المتوسطة النمو، ونقلها إلى 75 سم 2 قوارير واحتضان عند 37 درجة مئوية، 5٪ CO 2. الحفاظ على الخلايا على المستويات دون متموجة حتى مرور 1-2، وتغيير المتوسطة كل 3 أيام.
- ASC التمايز إلى النمط الظاهري SC
- في مرور 1-2، وإزالة المتوسطة نمو الخلايا الجذعية من 75 سم 2 قارورة واستبدالها مع 10 مل من المتوسط الطازجة التي تحتوي على 1 ملم β المركابتويثانول حديثا prepaالأحمر وفلتر تعقيم-في اليوم. احتضان الخلايا عند 37 درجة مئوية، و 5٪ CO 2 لمدة 24 ساعة. في هذه المرحلة، من المهم أن الخلايا هي المصنفة في منخفض الكثافة (30٪) قبل بدء التمايز.
- غسل الخلايا بعناية مع HBSS، نضح واستبدالها مع 10 مل من المتوسط تحتوي على 350 نانوغرام / مل حمض الريتينويك. احتضان الخلايا عند 37 درجة مئوية، و 5٪ CO 2 لمدة 72 ساعة. محاولة للحد من التعرض متوسطة خلية للضوء.
- بعد 3 أيام، وغسل خلايا بعناية مع HBSS، نضح واستبدالها مع 10 مل من تمايز الخلايا الجذعية المتوسطة (راجع الخطوة 1.2.6). الحفاظ على الخلايا على المستويات دون متموجة، وتغيير المتوسطة كل 3 أيام.
ملاحظة: بعد 2 أسابيع من الحضانة، يتم التمييز ASC في مثل SC ASC، معربا عن النمط الظاهري على سمة (كما يتبين من Kingham آخرون 5). أنها يمكن استخدامها بعد ذلك حتى مرور 10 دون تغييرات ملحوظة في السلوك 29.
- إنهاء الفئران عن طريق التفكك عنق الرحم وقطع الرأس. حلق الفئران ورفع الجلد لفضح العمود الفقري. باستخدام مقص حاد، excide العمود الفقري رعاية إضافية من أجهزة المحصورة والأوعية الدموية. نقل العمود الفقري في خزانة السلامة البيولوجية (الدرجة الثانية) باستخدام طبق بتري وإزالة أي جزء الظهرية.
- تقسيم العمود الفقري في نصف طول المحور الطولي باستخدام مقص جراحي معقم وحاد لفضح الأنسجة الحبل. في هذه المرحلة، فإنه من المفيد لخفض العمود الفقري في جزأين أصغر دون مستوى القفص الصدري، لجعله أسهل للتعامل خلال موسم الحصاد DRG الخلايا العصبية. باستخدام ملقط غرامة، وإزالة بلطف كل نسيج الحبل، مع إيلاء اهتمام لعدم سحب وإزالة الجذور DRG. بهذه الطريقة سوف يتعرض للDRG والجذور داخل القنوات الفقري، لا يزال المغطى في العمود. مراقبة DRG كما بيضاء خيوط سهم البنك التجارى الدولىنانوغرام خارج مباشرة من القنوات.
- سحب الجذر DRG بأكمله (وليس فقط DRG) من القنوات الفقري باستخدام ملقط دقيق جدا، والذهاب في عمق القنوات الفقري والاهتمام لا يلحق الضرر جذور العقد. نقل DRG في طبق بتري صغير (60 مم 2) التي تحتوي على 3-4 مل من F12 المتوسطة هام لتستكمل مع 1٪ PS. في حالة استخدام الحيوانات المختلفة، واستخدام أطباق منفصلة.
- تحت المجهر تشريح، وتنظيف DRG من أي فائض من جذور الأعصاب المحيطة العقد باستخدام ملقط معقم ومشرط للحد من تلوث الخلية الدبقية. نقل DRG في طبق بتري صغير (35 مم 2) مع 1.8 مل من المتوسط F12 الطازجة.
- إضافة 200 ميكرولتر من 1.25٪ حل وزن / V نوع كولاجيناز IV الأسهم (تركيز النهائي من 0.125٪) واحتضان DRG عند 37 درجة مئوية، و 5٪ CO 2 لمدة 1 ساعة. نضح بعناية المتوسطة مع ماصة الزجاج، مع إيلاء الاهتمام ليس لنضح أو تلف DRG. إضافة المتوسطة F12 جديدة نضرةmented مع 0.125٪ وزن / V نوع كولاجيناز الرابع انزيم واحتضان لمدة 1 ساعة كما هو موضح سابقا.
- نضح المتوسطة ويغسل بلطف DRG مع F12 المتوسطة. إضافة ثم 1.8 مل من F12 المتوسطة و 200 ميكرولتر من التربسين (تركيز النهائي من 0.25٪ بالوزن / ت) واحتضان عند 37 درجة مئوية، و 5٪ CO 2 لمدة 30 دقيقة.
- إزالة التربسين وإضافة 1 مل من F12 المتوسطة تستكمل مع 500 ميكرولتر من FBS لإلقاء القبض على رد فعل الأنزيمية. نضح المتوسطة ويغسل بلطف DRG مع F12 المتوسطة لمدة ثلاث مرات لإزالة آثار مصل.
- إضافة 2 مل من المتوسط F12 الطازجة ونقل بعناية DRG مع المتوسط في أنبوب 15 مل باستخدام ماصة الزجاج. فصل بلطف الخلايا العصبية DRG من قبل pipetting صعودا وهبوطا (حوالي 8-10 مرات) مع ماصة الزجاج (نصائح البلاستيك يمكن أن تستخدم كبديل).
- السماح بيليه ليستقر على الجزء السفلي من أنبوب وجمع المتوسطة في أنبوب جديد. إضافة 2 مل من المتوسط F12 جديدة لالأنبوب الذي يحتوي على بيليه وكرر مالتفكك echanical مع ماصة الزجاج. كرر هذه الخطوة حتى يصبح تعليق متجانسة (حوالي 3-4 مرات) وجمع كل DRG فصلها في أنبوب جديد. هذه الطريقة يقلل من الإجهاد الناجمة عن التفكك الميكانيكية ويحسن من بقاء الخلايا العصبية.
- تعليق تصفية المتجانس مما أدى إلى أنبوب جديد 15 مل باستخدام مصفاة 100 ميكرون خلية لإزالة الخلايا العصبية الامم المتحدة نأت وغيرها من الحطام. في هذه المرحلة، قد تكون مريحة لتصفية أول تعليق الخلية في أنبوب 50 مل ثم نقل الحل في أنبوب أصغر باستخدام ماصة الزجاج. الطرد المركزي تعليق في 110 غ لمدة 5 دقائق.
- إعداد 15٪ ألبومين المصل البقري (BSA) وذلك بإضافة 500 ميكرولتر من حل BSA 30٪ إلى 500 ميكرولتر من F12 المتوسطة. ماصة ببطء الحل أسفل جدار أنبوب 15 مل لخلق البروتين درب تدريجيا. في هذه المرحلة، فإنه من المفيد لعقد الأنبوب في زاوية 45 درجة وببطء الافراج عن BSA باستخدام الأرقام علىأنبوب الصقر كمرجع لتشكيل "المسار".
- نضح طاف من الخطوة 3.10 مغادرة 500 ميكرولتر في الجزء السفلي من الأنبوب و resuspend بيليه خلية في نفس المتوسطة. ماصة ببطء تعليق على طول درب البروتين أعدت مسبقا في الخطوة 3.11 (استخدام الأرقام على أنبوب كمرجع) وأجهزة الطرد المركزي في 500 غ لمدة 5 دقائق.
- نضح طاف و resuspend بيليه في 1 مل من المعدل المتوسط BS (أو المتوسطة المختلطة للASC / DRG شارك في ثقافة مثل SC، كما هو موضح أدناه في الخطوة 4.5.
ملاحظة: حجم لاعادة تعليق الخلايا العصبية DRG يمكن أن تتكون لحجم الفعلي المطلوب، اعتمادا على تركيز الخلية النهائي المطلوب وعدد العينات المراد المصنف. وسيكون أحد الحيوانات توفر ما يكفي من الخلايا لإجراء تجربة لوحة 24-جيدا. - احتضان العينات المصنفة عند 37 درجة مئوية، و 5٪ CO 2 لمدة 2 ساعة للسماح مرفق الخلية، وأخيرا إضافة المتوسطة BS جديدة تستكمل مع 50 نانوغرام / مل من اتحاد كرة القدم نمو الأعصابالمنشئ (NGF).
4. المباشر المشارك ثقافة تشبه SC ASC وDRG الخلايا العصبية
- الحفاظ على مثل SC ASC في الثقافة على المستويات دون متموجة كما هو موضح في الخطوة 2.2.3. أربع وعشرين ساعة قبل الحصاد DRG، نضح الخلايا الجذعية التمايز المتوسطة وغسل الخلايا مع HBSS. نضح واحتضان في 3 مل من التربسين في 37 ° C، 5٪ CO 2 لمدة 3 دقائق.
- الاختيار تحت المجهر ضوء أن جميع الخلايا قد فصل من القارورة. اضغط برفق القارورة للمساعدة في انفصال. إضافة 7 مل من المتوسط لوقف رد الفعل التربسين، وجمع تعليق خلية في أنبوب 15 مل وأجهزة الطرد المركزي في 110 غ لمدة 5 دقائق.
- نضح في وطاف resuspend الكرية خلية في 5 مل من تمايز الخلايا الجذعية المتوسطة. عد الخلايا باستخدام عدادة الكريات وتمييع تعليق خلية وفقا لتركيز النهائي المطلوب. من الناحية المثالية، بذر 20،000 تشبه SC ASC / سم 2 سيضمن طبقة متموجة من الخلايا.
- بذر مثل SCASC على الركيزة واحتضان عند 37 درجة مئوية، و 5٪ CO 2 لمدة 24 ساعة للسماح مرفق الخلية.
- بعد 24 ساعة الحضانة، ونضح المتوسطة وإضافة الخلايا العصبية DRG على أعلى من الخلايا كما هو موضح في الخطوة 3.14 و3.15. تغيير متوسطة إلى المتوسطة المختلطة التي تحتوي على 50٪ من الخلايا الجذعية التمايز المتوسطة و 50٪ من BS المتوسطة. وبالإضافة إلى ذلك، والحد من تركيز FBS إلى 1-2.5٪ في المتوسط مختلط النهائي يساعد على تجنب انتشار تلويث الخلايا الأقمار الصناعية المستمدة من التفكك DRG.
- احتضان العينات المشارك مثقف عند 37 درجة مئوية، و 5٪ CO 2 والحفاظ في الثقافة للفترة الزمنية المطلوبة للاختبارات المستقبلية.
النتائج
ثقافات الخلايا العصبية DRG فصلها تمثل مناسبة في نموذج المختبر لدراسة تجديد الأعصاب. ومع ذلك، لا ركائز غير المعالجة لا توفر بيئة مناسبة لمرفق DRG وتمديد neurites التي. -SC مثل ASC قادرون على إنتاج عوامل النمو وكيموكينات 19 التي يمكن أن تحسن قدرة الخلايا العصبية DRG تنبت neurites التي عندما يتم اطلاق سراحهم في مستنبت. وبالتالي يمكن وجود مثل SC ASC في نظام الثقافة تلعب دورا هاما في تنظيم وظائف DRG.
يوضح هذا البروتوكول (الشكل 1) الإجراء لإجراء المباشرة المشارك ثقافة ASC وDRG الخلايا العصبية تشبه SC خلالها الخلايا العصبية في الحصول على اتصال مباشر مع المصنف سابقا مثل SC ASC. والصعوبة الرئيسية المرتبطة بهذا الإجراء هو تباين عال من عدد من الخلايا العصبية DRG تحصد من الحيوانات المختلفة. لهذا السبب، يمكن أن تكون النتائج في بعض الأحيان من الصعب comparوينبغي إيلاء البريد واهتماما خاصا أثناء إجراء البذر من أجل الحصول دائما على كثافة الخلايا المماثلة في كل تجربة. وقد تم تحسين بروتوكول للحد على الأقل من عدد الخلايا الأقمار الصناعية المتبقية من التفكك DRG الخلايا العصبية باستخدام التدرج BSA (الخطوة 3.11). وبالإضافة إلى ذلك، يمكن إضافة السيتوزين-أرابينوز (ARA-C) ملحق المتوسطة BS من أجل مواصلة تقليل السكان الخلية الأقمار الصناعية، كما وصفها Kingham وآخرون. 11. ومع ذلك، واختيار الوقت العلاج يحتاج إلى أن تكون متوازنة بعناية مع DRG وتشبه SC ASC حيوية، تضررت أيضا من وجود ARA-C الملحق في مستنبت. ولذلك، فمن الصعب جدا إنجاز خلية الأقمار الصناعية نظام حر.
ويبين الشكل (2) وأهمية مثل SC ASC لDRG محوار تنتشر في نموذج التعاون ثقافة استخدام بولي غير المعالجة ومعدلة كيميائيا - caprolactone (PCL) الأفلام بمثابة ركائز. وكانت الخلايا العصبية DRG مايntained في الثقافة لمدة 3 أيام في وجود أو عدم وجود مثل SC ASC، وذلك باستخدام حل مختلط يحتوي على 50٪ من BS المتوسطة و 50٪ من الخلايا الجذعية التمايز المتوسطة، كما هو موضح في الخطوة 4.5. وبعد هذه الفترة، كانت ثابتة الخلايا في بارافورمالدهيد 4٪ وملطخة β-III تويولين (الخلايا العصبية DRG) وS100 (مثل SC ASC) للتحقيق في مورفولوجيا الخلايا ودراسة قدرة الخلايا العصبية DRG لتبرز neurites التي. لم يلاحظ أي neurites التي على الأسطح غير المعالجة في غياب مثل SC ASC (الشكل 2A)، في حين تشكيل neurites التي تم تحسين واضح في النظام شارك في ثقافة (الشكل 2C). في المتوسط، وعدد من neurites التي في جسم الخلية زيادة كبيرة 0-3 في وجود الخلايا الجذعية. أعطيت تأكيد هذه النتائج أيضا عن طريق المجهر الإلكتروني (SEM) التحليل، كما هو موضح في الشكل (3). وعلى وجه الخصوص، وتظهر الصور SEM أن قدرة الخلايا العصبية DRG تنبت neurites التي تحدث بشكل تفضيلي بالتزامنمع مثل SC ASC، كما يتضح من الأسهم الصفراء في الشكل 3C.
وتجدر الإشارة إلى أن استخدام ركائز المعدلة laminin (بما في ذلك الببتيدات المستمدة laminin) في نظم الاستزراع التي تحتوي على الخلايا العصبية DRG تم في كثير من الأحيان يعرف بأنه حالة مناسبة لزراعة الخلايا العصبية، وجود آثار ملحوظة على تشكيل Neurite النوعي والإرشاد 30-32 . ومع ذلك، فإن النتائج هو مبين في الشكل 2D و 3D الشكل يدل على أن الجمع بين الاشارات الكيميائية والبيولوجية يمكن من تعزيز استجابة الخلايا العصبية DRG.
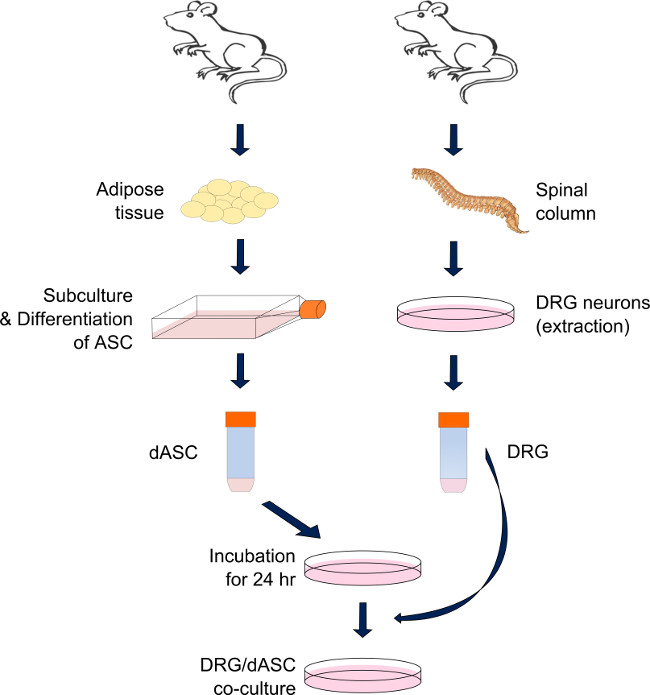
وتستمد الشكل 1. إعداد مثل DRG-SC نظام ASC شارك في ثقافة المباشر. DRG الخلايا العصبية وASC التوالي من العمود الفقري والدهون الحشوية والإربي من سوء الكبارالفئران البريد سبراغ داولي. بعد الهضم من الأنسجة الدهنية من خلال سلسلة من التفاعلات الإنزيمية، يتم التمييز ASC إلى خلايا تشبه SC وحافظت في ظروف شبه متموجة لحين الحاجة إليها. مثل SC ASC هي ما قبل المصنف على كل الركيزة 24 ساعة قبل الحصاد DRG. في اليوم، يتم استخراج الخلايا العصبية DRG وفصلها من خلال سلسلة من الإجراءات الأنزيمية والميكانيكية. ثم هي المصنفة الخلايا العصبية في الجزء العلوي من المصنف سابقا مثل SC ASC والحفاظ عليها في الثقافة حتى يعاير (متوسطة مختلطة: تحتوي على 50٪ من تمايز الخلايا الجذعية المتوسطة و 50٪ من المعدل المتوسط BS). الرجاء انقر هنا لعرض أكبر نسخة من هذا الرقم.

الشكل 2. صور الإسفار من الخلايا العصبية DRG في ظروف ثقافة متنوعة.(A) الأفلام PCL غير المعالجة؛ (ب) الأفلام PCL تعديل RGD؛ (C) المشارك مثقف مع مثل SC ASC على الأفلام PCL غير المعالجة؛ (د) التعاون مع مثقف مثل SC ASC على الأفلام PCL تعديل RGD. واستمرت الخلايا في الثقافة لمدة 3 أيام باستخدام حل مختلط يحتوي على 50٪ من المعدل BS المتوسطة و 50٪ من الجذعية تمايز الخلايا المتوسطة. بعد هذا الوقت، كانت ثابتة الخلايا في بارافورمالدهيد 4٪، permeabilized في حل تريتون-X، وسدت مواقع الربط غير محددة مع 1٪ BSA. الخلايا العصبية ثم تم ملطخة ضد β-III تويولين (FITC؛ الخضراء) وتشبه SC ASC ضد S-100 (AlexaFluor568، الحمراء) الأجسام المضادة. وأخيرا كانت ملطخة النوى مع دابي (الأزرق). تم الحصول على الصور باستخدام مجهر مضان (أوليمبوس BX60، اليابان). (إعادة طباعة بإذن من دي لوكا وآخرون. 30. الرجاء انقر هنا لعرض أكبر قيود التصدير الطوعيةأيون من هذا الرقم.
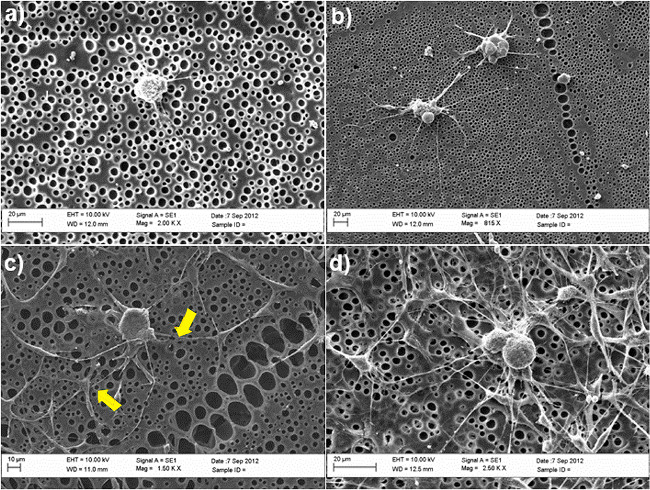
الشكل 3. الصور SEM من الخلايا العصبية DRG في ظروف ثقافة متنوعة (A) الأفلام PCL غير المعالجة (B) الأفلام PCL تعديل RGD؛. (C) المشارك مثقف مع مثل SC ASC على الأفلام PCL غير المعالجة، (D) المشارك مثقف مع مثل SC ASC على تعديل RGD الأفلام PCL. الأسهم الصفراء تشير إلى نقاط الاتصال بين تشبه SC ASC وDRG، مؤكدا تفاعلها المباشر في نظام المشاركة في الثقافة. واستمرت الخلايا في الثقافة لمدة 3 أيام وثابتة في 2.5٪ غلوتارالدهيد. وبعد الجفاف في سلسلة متدرجة الايثانول (50٪، 70٪، 90٪، 100٪)، وتشطف الخلايا أخيرا في hexamethyldisilazane وتجفيفها قبل التركيب على بذرة والذهب الاخرق لتحليل SEM. تم الحصول على الصور باستخدام SEM (زايس EVO60، المملكة المتحدة) مع المجلد تسريعالمئوية من 10KV. (إعادة طباعة بإذن من دي لوكا وآخرون. 30. يرجى النقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
Discussion
وكثيرا ما تستخدم الخلايا العصبية DRG بين الخلايا العصبية للثقافة الأولية لدراسة تجديد الخلايا العصبية بعد axotomy في الجسم الحي. هنا يرد بروتوكول دقيقة لDRG الحصاد من الفئران الكبار، تهدف إلى الحد من عدد السكان من الخلايا الأقمار الصناعية في البيئة المحيطة دون المساومة على بقاء الخلايا العصبية. كما ASC متباينة في النمط الظاهري مثل SC هي بديل صالح لSC لعلاجات الخلايا، كما وصف أحد ASC / DRG نظام المشاركة في ثقافة تشبه SC بالتفصيل.
ومن المعروف على نطاق واسع أن laminin (أو تسلسل الببتيد laminin المشتقة) يكون لها تأثير مفيد على بقاء الخلايا العصبية وتشكيل محوار 31-33. ولذلك عند تنفيذ الثقافات الخلايا العصبية DRG ينصح لمعطف من قبل كل الركيزة مع laminin من أجل تجنب أي خسارة في الأداء الوظيفي للخلايا العصبية. ينطبق عليها مفهوم الطلاء laminin أيضا إلى ركائز بيولوجية لتصميميبني هندسة الأنسجة، مثل بولي - caprolactone (PCL) كثيرا ما تستخدم لتصنيع خطوط الأنابيب العصبية 30. أيضا، تظاهر الأعمال السابقة التي المصفوفات الفيبرين هي المواد المناسبة للثقافات العصبية في ثلاثة أبعاد 11.
بالإضافة إلى البروتين والطلاء، وشارك في نماذج من الثقافة توفر الظروف ثمينة للبقاء DRG الخلايا العصبية وبيئة مناسبة لدراسة التفاعلات التي تحدث بين الخلايا العصبية وSC في الجهاز العصبي المحيطي التالية الإصابة. ويمكن أيضا أن خلايا زرعها في الجسم الحي باستخدام الأجهزة العصبية من أجل اختصار الوقت تجنيد خلايا ذاتي في موقع الإصابة. هذا مهم بشكل خاص في إصابات خطيرة، والتي يمكن أن تؤدي إلى الشيخوخة خلية / الموت وضمور العضلات. على الرغم من أن SC هي الخلايا الدبقية أهم المشاركين في عملية تجديد الطرفية العصبية وتكون الميالين، توافرها محدود ومعدل انتشار بطيء بهم يجعلها غير صالحةلتطبيقات هندسة الأنسجة (34). ASC هي بديل صالح بسبب وفرة وقدرتها على التمايز إلى النمط الظاهري للSC، معربا عن علامات الدبقية محددة وإظهار أوجه التشابه وظيفية لالأصلي SC 19. ASC هي أيضا قادرة على انتاج البروتينات ونمو العوامل 5 التي يمكن أن تكون مفيدة لتكوين وتمديد neurites التي كتبها الخلايا العصبية DRG في نظام المشاركة في الثقافة. ومع ذلك، يمكن تعيين نظامين مختلفين ثقافة مشتركة على النحو ظيفة احتياجات التجريبية. الطريقة المقترحة في هذه الورقة هو نسخة منقحة من بروتوكول راسخة في مختبرنا 11 وأنها تنطوي على اتصال مباشر بين أنواع الخلايا اثنين (شارك في ثقافة مباشرة)، والتي هي نوع من الخلايا المصنف الثاني (الخلايا العصبية DRG) في الجزء العلوي من الآخرين (مثل SC ASC). ويستند هذا النهج على النتائج السابقة التي أظهرت أهمية وجود طبقة الخلايا الدبقية على الركيزة عندما البذر الثقافات العصبية 35 - 37. ومن المرجح بسبب التفاعلات خلية خلية من خلال integrins DRG والجزيئات ECM المودعة من ASC والعظة أخرى على سطح الخلايا الجذعية هذا التأثير. ولوحظ أيضا أن خفض البروتين في الدم على المدى المتوسط خفض انتشار تلويث الخلايا الأقمار الصناعية التي يمكن أن تجنيها من تفكك الخلايا العصبية DRG، دون التأثير على وظائف ASC. ومع ذلك، الخلايا الأقمار الصناعية، بما في ذلك عدد صغير من السكان SC، من الصعب القضاء نهائيا من الثقافات من الخلايا العصبية DRG وعدد قليل من الخلايا المتبقية ستكون أيضا موجودة في نظام المشاركة في الثقافة. ولذلك فمن المهم أن نلاحظ أن هؤلاء السكان الفرعي صغير يمكن أن يشارك أيضا في العمليات تكون الميالين خلال الدراسات في المختبر، إذ يشير إلى الخلايا ذاتي التي تكون موجودة في الجسم الحي بعد الاصابة. النهج الثاني (وليس المقدمة هنا) ينطوي على استخدام إدراج ثقافة الخلية، تجنب الاتصال المباشر بين اثنين من أنواع مختلفة من الخلايا (غير المباشرة المشارك الثقافة). Howevإيه، فإنه ليس ممثل الأوضاع في الجسم الحي خلال تجديد الأعصاب (خفض قدرة الخلايا العصبية لتطوير neurites التي طويلة)، ولكن يتم استخدامه لدراسة تأثير العوامل إنتشاري صدر في المتوسط من السكان خلية معينة على 38 آخرين .
Disclosures
The authors confirm that there are no conflicts of interest associated with this publication.
Acknowledgements
This work is supported by the National Institute for Health Research, Academy of Medical Sciences and the British Society for Surgery of the Hand. We also gratefully acknowledge the continuing supply of GGF-2 from Acorda Therapeutics, USA. The authors would finally like to acknowledge Prof. Giorgio Terenghi for his valuable support and guidance in our group over the past years that led to the development and optimization of this protocol.
Materials
| Name | Company | Catalog Number | Comments |
| 100 µm cell strainer | BD Biosciences | 352360 | 70 μm strainers (ref. 352350) can be used as alternative |
| 15 ml plastic tubes | Sarstedt | 62.554.002 | |
| 50 ml plastic tubes | Sarstedt | 62.547.004 | |
| 75 cm2 flasks | Corning | BC301 | |
| Retinoic Acid >98% HPLC | Sigma | R2625 | |
| ARA-C supplement | Sigma | C6645 | |
| Recombinant Human FGF-basic (154 aa) | Peprotech | 100-18B | |
| Bovine Serum Albumin (BSA) | Sigma | A9205 | |
| Collagenase type I | Gibco | 17100-017 | Note: this collagenase is only used for fat tissue digestion |
| Collagenase type IV | Worthington Biochemical | LS004188 | Note: this collagenase is only used to dissociate DRG explants |
| Foetal Bovine Serum (FBS) | Biosera | FB-1001 | |
| Forskolin | Sigma | F3917 | |
| Glass pipettes | Fisher Scientific | FB50253 | Sharp material to be disposed accordingly |
| Glial Growth Factor-2 (GGF-2) | Acorda Therapeutics | GGF-2 was kindly donated by Acorda Therapeutics. For a commercially available alternative, we recommend NRG1-β1 (R & D Systems, Abingdon) for stem cell differentiation to be used at the final concentration of 200 ng/ml | |
| Nutrient Mix F12 HAM | Sigma | N6658 | Warm at 37 °C in a water bath unless specified |
| Hank’s Balanced Salt Solution (HBSS) | Sigma | H9394 | Warm at 37 °C in a water bath unless specified |
| N-2 supplement (100x) | Invitrogen | 17502 | |
| Nerve Growth Factor 2.5s Protein, Mouse Submaxillary Glands (NGF) | Millipore | NC011 | |
| Penicillin-Streptomycin (PS) | Sigma | P0781 | |
| [header] | |||
| Petri dishes | Corning | 430165 | |
| Recombinant Human PDGF-AA | Peprotech | 100-13A | |
| Trypsin | Invitrogen | 25200-056 | Warm at 37 °C in a water bath. This is used for cell detachment from tissue culture flasks |
| Trypsin (2x bovine pancreatic) | Worthington Biochemical | LS003703 | This is used for DRG dissociation |
| Minimum Essential Medium Eagle (MEM) | Sigma | M8042 | Warm at 37 °C in a water bath unless specified |
| 2-mercaptoethanol | Sigma | M3148 | Prepare the solution in the biological cabinet |
References
- Wiberg, M., Terenghi, G. Will it be possible to produce peripheral nerves. Surg Technol Int. 11, 303-310 (2003).
- Terzis, J. K., Sun, D. D., Thanos, P. K. Historical and basic science review: past, present, and future of nerve repair. J Reconstr Microsurg. 13 (3), 215-225 (1997).
- Bruyns, C. N., Jaquet, J. B., Schreuders, T. A., Kalmijn, S., Kuypers, P. D., Hovius, S. E. Predictors for return to work in patients with median and ulnar nerve injuries. J Hand Surg Am. 28 (1), 28-34 (2003).
- Geuna, S., Raimondo, S., et al. Chapter 3: Histology of the peripheral nerve and changes occurring during nerve regeneration. Int Rev Neurobiol. 87 (09), 27-46 (2009).
- Kingham, P. J., Kalbermatten, D. F., Mahay, D., Armstrong, S. J., Wiberg, M., Terenghi, G. Adipose-derived stem cells differentiate into a Schwann cell phenotype and promote neurite outgrowth in vitro. Exp Neurol. 207 (2), 267-274 (2007).
- Stoll, G., Jander, S., Myers, R. R. Degeneration and regeneration of the peripheral nervous system: From Augustus Waller’s observations to neuroinflammation. J Peripher Nerv Syst. 7 (1), 13-27 (2002).
- Schmidt, C. E., Leach, J. B. Neural tissue engineering: strategies for repair and regeneration. Annu Rev Biomed Eng. 5, 293-347 (2003).
- Johnson, E. O., Zoubos, A. B., Soucacos, P. N. Regeneration and repair of peripheral nerves. Injury. 36S (4), S24-S29 (2005).
- Liu, R., Lin, G., Xu, H. An efficient method for dorsal root ganglia neurons purification with a one-time anti-mitotic reagent treatment. PloS One. 8 (4), e60558(2013).
- Stettner, M., Wolffram, K., et al. A reliable in vitro model for studying peripheral nerve myelination in mouse. J Neurosci Meth. 214 (1), 69-79 (2013).
- Kingham, P. J., Mantovani, C., Terenghi, G. Stem cell and neuron co-cultures for the study of nerve regeneration. Method Mol Biol. 695, 115-127 (2011).
- Nissinen, M., et al. Myelination in mouse dorsal root ganglion/Schwann cell cocultures. Mol Cell Neurosci. 37 (3), 568-578 (2008).
- Daud, M. F. B., Pawar, K. C., Claeyssens, F., Ryan, A. J., Haycock, J. W. An aligned 3D neuronal-glial co-culture model for peripheral nerve studies. Biomaterials. 33 (25), 5901-5913 (2012).
- Lewallen, K. a, Aa Shen, Y. -, De la Torre, A. R., Ng, B. K., Meijer, D., Chan, J. R. Assessing the role of the cadherin/catenin complex at the Schwann cell-axon interface and in the initiation of myelination. J Neurosci. 31 (8), 3032-3043 (2011).
- Evans, G. R. Challenges to nerve regeneration. Semin Surg Oncol. 19 (3), 312-318 (2000).
- Webber, C., Zochodne, D. The nerve regenerative microenvironment: early behavior and partnership of axons and Schwann cells. Exp Neurol. 223 (1), 51-59 (2010).
- Tobita, M., Orbay, H., Mizuno, H. Adipose-derived stem cells: current findings and future persperctives. Discov Med. 11 (57), 160-170 (2011).
- Faroni, A., Terenghi, G., Reid, A. J. Adipose-derived stem cells and nerve regeneration: promises and pitfalls. Int Rev Neurobiol. 108, 121-136 (2013).
- Strem, B. M., Hicok, K. C., et al. Multipotential differentiation of adipose tissue-derived stem cells. Keio J Med. 54 (3), 132-141 (2005).
- Xu, Y., Liu, L., et al. Myelin-forming ability of Schwann cell-like cells induced from rat adipose-derived stem cells in vitro. Brain Res. 1239, 49-55 (2008).
- Tomita, K., Madura, T., Sakai, Y., Yano, K., Terenghi, G., Hosokawa, K. Glial differentiation of human adipose-derived stem cells: implications for cell-based transplantation therapy. Neuroscience. 236, 55-65 (2013).
- Clauser, L., Tieghi, R., Palmieri, A., Carinci, F. Adipose-derived stem cells secrete neurotrophic factors. Annals of Oral and Maxillofacial Surgery. 1 (2), 1-5 (2013).
- Di Summa, P. G., Kingham, P. J., Raffoul, W., Wiberg, M., Terenghi, G., Kalbermatten, D. F. Adipose-derived stem cells enhance peripheral nerve regeneration. Journal of Plastic, Reconstructive & Aesthetic Surgery. 63 (9), 1544-1552 (2010).
- Di Summa, P. G., Kalbermatten, D. F., Pralong, E., Raffoul, W., Kingham, P. J., Terenghi, G. Long-term in vivo regeneration of peripheral nerves through bioengineered nerve grafts. Neuroscience. 181, 278-291 (2011).
- Sun, F., Zhou, K., Mi, W., Qiu, J. Combined use of decellularized allogeneic artery conduits with autologous transdifferentiated adipose-derived stem cells for facial nerve regeneration in rats. Biomaterials. 32 (32), 8118-8128 (2011).
- Zhang, Y., Luo, H., et al. A nerve graft constructed with xenogeneic acellular nerve matrix and autologous adipose-derived mesenchymal stem cells. Biomaterials. 31 (20), 5312-5324 (2010).
- Gomillion, C. T., Burg, K. J. L. Stem cells and adipose tissue engineering. Biomaterials. 27 (36), 6052-6063 (2006).
- Bottenstein, J. E., Sato, G. H. Growth of a rat neuroblastoma cell line in serum-free supplemented medium. Proc Natl Acad Sci U S A. 76 (1), 514-517 (1979).
- Mantovani, C., Raimondo, S., et al. Morphological, molecular and functional differences of adult bone marrow- and adipose-derived stem cells isolated from rats of different ages. Exp Cell Res. 318 (16), 2034-2048 (2012).
- Luca, A. C., Faroni, A., Downes, S., Terenghi, G. Differentiated adipose-derived stem cells act synergistically with RGD-modi fi ed surfaces to improve neurite outgrowth in a co-culture model. J Tissue Eng Regen Med. , (2013).
- Summa, P. G., Kalbermatten, D., Raffoul, W., Terenghi, G., Kingham, P. J. Extracellular Matrix Molecules Enhance the Neurotrophic Effect of Schwann Cell-Like Differentiated. Tissue Eng. 19 (3-4), 368-379 (2013).
- Fudge, N. J., Mearow, K. M. Extracellular matrix-associated gene expression in adult sensory neuron populations cultured on a laminin substrate. BMC Neurosci. 14 (15), 1-19 (2013).
- Stabenfeldt, S. E., LaPlaca, M. C. Variations in rigidity and ligand density influence neuronal response in methylcellulose-laminin hydrogels. Acta Biomater. 7 (12), 4102-4108 (2011).
- Terenghi, G., Wiberg, M., Kingham, P. J. Chapter 21: Use of stem cells for improving nerve regeneration. Inl Revi Neurobiol. 87 (09), 393-403 (2009).
- Richardson, J. a, Rementer, C. W., Bruder, J. M., Hoffman-Kim, D. Guidance of dorsal root ganglion neurites and Schwann cells by isolated Schwann cell topography on poly(dimethyl siloxane) conduits and films. J Neural Eng. 8 (4), 046015(2011).
- Seggio, aM., Narayanaswamy, A., Roysam, B., Thompson, D. M. Self-aligned Schwann cell monolayers demonstrate an inherent ability to direct neurite outgrowth. J Neural Eng. 7 (4), 046001(2010).
- Xu, F. J., Wang, Z. H., Yang, W. T. Surface functionalization of polycaprolactone films via surface-initiated atom transfer radical polymerization for covalently coupling cell-adhesive biomolecules. Biomaterials. 31 (12), 3139-3147 (2010).
- Armstrong, S. J., Wiberg, M., Terenghi, G., Kingham, P. J. ECM molecules mediate both Schwann cell proliferation and activation to enhance neurite outgrowth. Tissue Eng. 13 (12), 2863-2870 (2007).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved