A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
نظام جل متحدة المركز لدراسة دور الفيزيائية الحيوية من مصفوفة المكروية في 3D خلية الهجرة
In This Article
Summary
الخواص الميكانيكية والمجهرية من المصفوفة خارج الخلية تؤثر بقوة الهجرة 3D من الخلايا. طريقة في المختبر لدراسة السلوك الزماني المكاني هجرة الخلايا في بيئات متغيرة biophysically، في كل من السكان ومستويات الخلايا الفردية، يوصف.
Abstract
قدرة الخلايا على الهجرة أمر بالغ الأهمية في مجموعة واسعة من وظائف الخلية في جميع مراحل الحياة من التطور الجنيني والتئام الجروح إلى الورم والانبثاث السرطان. وعلى الرغم من الجهود البحثية المكثفة، لا تزال غير مفهومة مبادئ الكيمياء الحيوية والفيزياء الحيوية الأساسية للهجرة الخلية بالكامل، وخاصة في ثلاثية الأبعاد (3D) microenvironments ذات الصلة من الناحية الفسيولوجية. هنا، نحن تصف مقايسة في المختبر يهدف إلى إتاحة الفحص الكمي لل3D السلوكيات الهجرة الخلية. طريقة يستغل القدرة mechanosensing الخلية والميل إلى الهجرة إلى المصفوفة خارج الخلية غير مأهولة سابقا (ECM). نحن نستخدم غزو خلايا سرطان الثدي الغازية للغاية، MDA-MB-231، في المواد الهلامية الكولاجين كنظام نموذج. انتشار السكان الخلية وديناميات الهجرة من الخلايا الفردية خلال الأسابيع الثقافة يمكن رصدها باستخدام التصوير الخلية الحية وتحليلها لاستخراج البيانات حل spatiotemporally. علاوة على، فإن هذه الطريقة قابلة للتكيف بسهولة للمصفوفات خارج الخلية متنوعة، مما يتيح وسيلة بسيطة لكنها قوية للتحقيق في دور العوامل الفيزيائية الحيوية في المكروية على الهجرة الخلية.
Introduction
هجرة الخلايا تلعب دورا رئيسيا في مختلف الاستجابات الفسيولوجية مثل التطور الجنيني، تخثر الدم، والاستجابة المناعية وكذلك في العمليات المرضية مثل أمراض الأوعية الدموية، والالتهابات، والسرطان 1. تشريح العوامل الكيميائية الحيوية والفيزياء الحيوية الكامنة وراء الهجرة الخلية لذا فمن المهم أساسي ليس فقط لفهم المبادئ الأساسية للالوظائف الخلوية، ولكن أيضا لتعزيز مختلف التطبيقات الطبية الحيوية، كما هو الحال في هندسة الأنسجة، ومكافحة ورم خبيث وتطوير الأدوية المضادة للالتهابات. منذ المراقبة في الجسم الحي يمثل تحديا تقنيا، وقد تركز الكثير من الجهود في المختبر على خلاصة الهجرة الخلية.
في أساليب المختبر لدراسة الهجرة الخلية إلى حد كبير تصميم لفحوصات على اثنين من الأبعاد (2D) الأسطح، وأبرزها الصفر أو التئام الجروح فحص 2. هذه المقايسات تقدم الإعداد التجريبية بسيطة وسهلة live-التصوير الخلية، وتوفير معلومات مفيدة في مختلف الآليات البيوكيميائية الكامنة وراء الهجرة الخلية. ومع ذلك، فإن هذه المقايسات لا تمثل مصفوفة خارج الخلية (ECM) والهندسة المعمارية وإعادة عرض، والتي هي جوانب هامة في فهم الهجرة في الجسم الحي. في الآونة الأخيرة، فقد كان موضع تقدير متزايد أن نموذج الثقافة 3D، وغالبا في مصفوفات القائم على الكولاجين 3، ويوفر منصة يشبه الوضع على نحو أفضل في الجسم الحي. في الواقع، وخلايا يحمل ديناميات migrational التي تختلف عن تلك التي على الأسطح 2D، خصوصا بسبب أبعاد مختلفة من البيئة 4. وعلاوة على ذلك، الخصائص الفيزيائية الحيوية والميكانيكية للمصفوفة تؤثر بحساسية الهجرة الخلية 5، بما في ذلك في سياق غزو الخلايا السرطانية 6.
هنا، فإننا نقدم وسيلة لدراسة السلوك 3D الهجرة خلية في ECM مع خصائص الفيزيائية الحيوية التي يمكن أن تكون متنوعة بسهولة مع ظروف التحضير. الخلايا هيالمصنف في "هلام الداخلي" ويسمح للهروب من وغزو في البداية اخلوي "هلام الخارجي". ويعتمد هذا الأسلوب على قدرة الخلايا على التعرف على وجود، والميل إلى الهجرة إلى أقاليم خالية من الخلايا في هلام الخارجي، والذي يرتبط ارتباطا وثيقا خلية mechanosensing 7. في هذه الدراسة، ونحن توظيف شبكات الكولاجين باسم موبينيل غزتها خلايا سرطان الثدي الغازية للغاية، MD-MBA-231. الخواص الميكانيكية والمجهرية من كل من المواد الهلامية الداخلية والخارجية يمكن ضبطها 8 و 9 تتميز لتحقيق الشروط ذات الصلة من الناحية الفسيولوجية. إعادة الإعمار وتحليل المسارات خلية تسمح الفحص الكمي مفصلا للسلوك الهجرة الزماني المكاني على المستويين السكان ومستوى الخلية الفردية. الأهم من ذلك أن الإعداد للنظام هلام متحدة المركز يحاكي في الجسم الحي طوبولوجيا الأنسجة التي تواجهها الخلايا المهاجرة، وخاصة غزو الخلايا السرطانية، وبالتالي تقديم رؤى مهمة فيإلى الآليات المادية للهجرة الخلايا والانبثاث.
Protocol
حصاد 1. خلية
- الحصول MD-MBA-231 الخلايا من 37 درجة مئوية، 5٪ CO 2 الحاضنة. فصل الخلايا من لوحة زراعة الأنسجة باستخدام 0.5٪ التربسين-EDTA الحل. استخدام 1 مل من محلول التربسين-EDTA لخلايا مستنبتة في قارورة T25.
- خلايا بيليه في 15 مل أنبوب مخروطي بواسطة الطرد المركزي في 200 × ز لمدة 4 دقائق، ونضح طاف، وخلايا resuspend في 5 مل من وسائل الإعلام الثقافة.
- عد كثافة الخلايا، ρ، وذلك باستخدام عدادة الكريات.
ملاحظة: لتحضير هلام خلية المصنفة الداخلي، وسوف وقت لاحق أن تضعف تعليق الخلية 10 × للوصول إلى النهائي كثافة البذر الخلية. ولذلك، مطلوب 10 × تعليق خلية مركزة. - حساب حجم المتوسطة المطلوبة لتحقيق تركيز × 10 خلية:
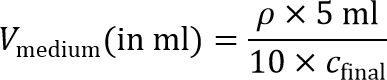
ملاحظة: النهائية كثافة البذر الخلية، ج نهائي، من حوالي 215؛ 10 6 خلية / مل ويوصى لMD-MBA-231 الخلايا ويستخدم في هذا البروتوكول. ويمكن أيضا كثافة البذر أخرى يتم استكشافها لأنواع الخلايا الأخرى. - خلايا بيليه واحد المزيد من الوقت في 15 مل أنبوب مخروطي بواسطة الطرد المركزي في 200 × ز لمدة 4 دقائق، ونضح طاف.
- resuspend الخلايا في المبلغ المطلوب (V المتوسطة المحسوبة في الخطوة 1.3) من المصل خالية مستنبت الخلية بدقة للحد من التثاقل الخلية.
ملاحظة: الفينول الأحمر هو لصناعة السيارات في الفلورسنت، ويمكن أن تتداخل مع التصوير مضان / الانعكاس. ويمكن اعتبار استخدام الفينول خالية من اللون الأحمر المتوسطة لتحقيق أفضل جودة الصورة.
2. إعداد حلول الكولاجين
- الحصول على محلول المخزون الكولاجين، 10 × PBS العازلة، ميلي-Q H 2 O، 0.1 M هيدروكسيد الصوديوم، وعدة أنابيب microcentrifuge. إبقاء كل شيء على الجليد لمنع سابق لأوانه الكولاجين البلمرة، والحفاظ على حالة معقمة.
- تتوازن على glass- عقيمةطبق السفلي من قبل الاحترار في C حاضنة 37 درجة.
ملاحظة: وقد تم تحسين كافة وحدات التخزين في هذا البروتوكول لطبق من الزجاج السفلي مع 12 ملم جيدا. إذا تم استخدام نوع آخر طبق، وضبط كميات تبعا لذلك. - حساب حجم المطلوبة اللازمة لإعداد 50 ميكرولتر من 2.4 ملغ / مل حل الكولاجين لهلام الداخلي (الحل I) على أساس تركيز الأسهم الكولاجين.
ملاحظة: يمكن أيضا تركيزات الكولاجين أخرى للهلام الداخلي استخدامها. - في بيئة معقمة (عادة غطاء السلامة الأحيائية)، إضافة ببطء 5 ميكرولتر من 10 × PBS عازلة لالمبلغ المطلوب من محلول المخزون الكولاجين (المحسوبة في الخطوة 2.3) مع يحوم طيف. الحرص على تجنب تشكيل فقاعة الهواء.
- ضبط درجة الحموضة من الخليط إلى 7.4 باستخدام 0.1 M هيدروكسيد الصوديوم باستخدام معايرة درجة الحموضة متر. كدليل الخام، استخدم حوالي 5 ميكرولتر لجلب وثيقة الرقم الهيدروجيني إلى 7.4 (قد تختلف كمية اعتمادا على تركيز الأسهم ودرجة الحموضة).
ملاحظة: لاحظ أن حجم المشاركة في هذاخطوة صغيرة جدا لاستخدام معيار درجة الحموضة متر. استخدم إحدى الحيل التالية:- إعداد الحلول الكولاجين لعينات متعددة. ضبط درجة الحموضة بكميات كبيرة باستخدام معيار درجة الحموضة متر وتوزيع حلول الكولاجين عبر العينات.
- بدلا من ذلك، وضبط درجة الحموضة من حل الكولاجين في حجم أكبر (ط. ه.، وحدة التخزين التي تسمح باستخدام معيار درجة الحموضة متر). لاحظ مقدار هيدروكسيد الصوديوم اللازمة لتحقيق درجة الحموضة إلى الرقم الهيدروجيني النهائية. تقليص أحجام واستخدام كمية مناسبة من هيدروكسيد الصوديوم للتجربة. تأكيد قيمة الرقم الهيدروجيني باستخدام ورقة عباد الشمس.
- خلاف ذلك، واستخدام القطب درجة الحموضة الجزئي لضبط أكثر دقة الرقم الهيدروجيني للكميات الصغيرة.
- تقديم حل لحجم 45 ميكرولتر باستخدام H 2 O. تنفيذ جميع الخطوات على الجليد لمنع سابق لأوانه الكولاجين بلمرة.
3. تشكيل المركزة جل الثقافة
- خذ طبق من الزجاج السفلي قبل تحسنت (راجع الخطوة 2.2) من الالبريد الحاضنة.
- إضافة 5 ميكرولتر من تعليق خلية تتركز 10 × (المعد في الخطوة 1.5) إلى حل I. و resuspend بدقة. الحرص على تجنب تشكيل فقاعة الهواء. الخليط لديها الآن حجم 50 ميكرولتر ويحتوي على التركيز النهائي الكولاجين (2.4 ملغ / مل)، وكثافة الخلية (ج النهائي = 2 × 10 6 خلية / مل).
- إضافة 20 ميكرولتر من الحل التي تحتوي على خلية I ببطء الى وسط البئر، بحيث تشكل قطرة (الشكل 1A) على شكل قبة. الحرص على تجنب تشكيل فقاعة في هذه الخطوة. إذا كان أشكال فقاعة، بعناية ولكن سرعان ما حاول أي تمزق أو تمتص بها باستخدام طرف ماصة. وضع بلطف الطبق مرة أخرى في حاضنة للسماح للهلام الداخلي تتبلمر لمدة 45 دقيقة.
- يعد حل O (لالخارجي، لا خلوي جل الكولاجين) حوالي 15 دقيقة قبل نهاية هذه الخطوة الحضانة.
ملاحظة: يمكن أن تختلف وحالة هلام الخارجية من حيث تركيز الكولاجين والبلمرة درجة الحموضة لالحصول على شبكات مع المجهرية مختلفة 10. في هذا البروتوكول، والتركيز على 1،5-4،0 ملغ / مل جل الكولاجين بلمرة في الرقم الهيدروجيني من 7.4.- استنادا إلى تركيز الأسهم الكولاجين، وحساب حجم المطلوبة اللازمة لإعداد 200 ميكرولتر من الكولاجين حل O في التركيز النهائي.
- إضافة 20 ميكرولتر من 10 × PBS عازلة ببطء إلى المبلغ المطلوب من محلول المخزون الكولاجين (المحسوبة في الخطوة 3.4) مع يحوم طيف. ضبط درجة الحموضة من هذا المزيج على درجة الحموضة النهائية باستخدام 0.1 M هيدروكسيد الصوديوم مع استخدام معايرة درجة الحموضة متر. انظر الملاحظة إلى الخطوة 2.5 بشأن تعديل درجة الحموضة.
- تحقيق الحل إلى الحجم النهائي من 200 ميكرولتر باستخدام H 2 O. تنفيذ جميع الخطوات على الجليد لمنع سابق لأوانه الكولاجين بلمرة.
- خذ طبق من الحاضنة بعد 45 دقيقة البلمرة من هلام الداخلي (راجع الخطوة 3.3). بلطف إضافة 180 ميكرولتر من حل يا على الجزء العلوي من هلام الداخلي، حتى أن الحل يغطي تماما الداخليةهلام ويملأ البئر (الشكل 1B).
- تنفيذ هذه الخطوة بعناية دون اثارة الحل، والتي يمكن أن تؤدي إلى توجهات الألياف غير موحدة في هلام الخارجي. الحرص على تجنب لمس هلام الداخلي مع طرف ماصة، وتجنب تشكيل فقاعات أو جيوب الهواء. إذا كان أشكال فقاعة، بعناية ولكن سرعان ما حاول أي تمزق أو تمتص بها باستخدام طرف ماصة. وضع بلطف الطبق مرة أخرى في حاضنة للسماح للبلمرة هلام الخارجي.
- خذ طبق من الحاضنة بعد 45 دقيقة من البلمرة. يجب بالفعل أن يتعزز هلام إلى حد ما في هذه المرحلة، على الرغم من أنه لا يزال من فصل من السطح السفلي إذا ما تم تناوله تقريبا.
- صب بلطف 2 مل من درجة حرارة متوسطة ثقافة الخلية إلى الطبق (الشكل 1C). تأكد من أن الجل وغمرت تماما في المتوسط. تحديث المتوسطة كل 2 - 3 أيام طوال مدة الثقافة.
4. تعيش خلية التصوير
- أداء التصوير باستخدام مجهر متحد البؤر المقلوب مجهزة قدرة التصوير الخلية الحية على المدى الطويل. يتضمن المدمج في غرفة الحضانة في درجة حرارة (37 درجة مئوية) وCO 2 (5٪) السيطرة. التبديل على المجهر والاحماء المرحلة لا يقل عن 1 ساعة قبل بدء التجربة.
ملاحظة: استخدام عدسة الهدف مع مسافة العمل طويلة لتحسين المراقبة وتوطين الخلايا في المواد الهلامية 3D. - احتضان الجل في المتوسط تحتوي على 5 ميكرولتر من الفلورسنت تعقب خلية الصبغة لمدة 30 دقيقة للسماح للتوطين دقيقة من الخلايا في نظام 3D. وفي وقت لاحق، وإزالة صبغة غير منضم عن طريق الغسيل ثلاث مرات مع 1 × PBS. بعد ذلك، إضافة مستنبت الخلية إلى الطبق.
- خذ طبق من الحاضنة ووضعه على المسرح المجهر (الشكل 1D).
ملاحظة: التصوير الخلية الحية يمكن أن تبدأ من حيث المبدأ الحق بعد البلمرة من هلام الخارجي. لكن في هذه المرحلة، والخلايا طن جل الداخلية لم ينتشر بعد. لدراسة هجرة الخلايا الأولى التي غزت جل الخارجي، ويمكن تصوير الخلايا الحية تبدأ 24 ساعة (اعتمادا على نوع من الخلايا) بعد الشروع في الثقافة. كدليل الخام، وحوالي 12 - هناك حاجة إلى 14 يوما للثقافة لمعظم الخلايا في هلام الداخلي لدخول هلام الخارجي. - حدد وحدات التخزين من عرض (في VOV) في مناطق في هلام الخارجي المحيطة هلام الداخلي. بعد 24 ساعة من الحضانة، وانتشرت سكان الخلية، عبر واجهة بين المواد الهلامية الداخلية والخارجية، والتي لغزو هلام الخارجي.
- لفي VOV، وتشمل المناطق هلام فورا بجانب واجهة جل والمناطق المتوسطة، والمناطق القريبة من ضواحي من هلام الخارجي 7. استبعاد مناطق أقرب من 50 ميكرون من القاع والجانب السطوح، وكذلك من الجزء العلوي من هلام، لتجنب الآثار حافة الممكنة. كل VOV عادة تدابير 647 × 647 × 100 ميكرون 3 (في العاشر، ذ، ض والاتجاهات، على التوالي)، مع فاصل 5 ميكرومتر في Z -stack.
- ويتم اختيار ضمان وسائل التصوير، وقنوات / المرشحات، والتعرض مرات، والقرارات الصورة بشكل صحيح. للتصوير خالية من التسمية من شبكة الكولاجين، واستخدام متحد البؤر الانعكاس المجهري في وقت واحد خلال الوقت الفاصل بين التصوير الخلية الحية.
- أخذ عينة من الصور، رسم المدرج الاحصائي كثافة، وضبط المكاسب والتعويضات لمراقبة إشارة كافية وتجنب الإشباع عن طريق ضمان أن الرسم البياني يقع بين الصفر وأقصى كثافة. لا تغيير هذه الإعدادات أي أكثر من ذلك طوال مدة التجربة.
- خذ الوقت الفاصل بين الصور من ال VOV مختارة، مع فاصل زمني، Δ ر، من 10 دقيقة لمدة 8 ساعات (أو أكثر إذا لزم الأمر).
5. تتبع خلية وتحليل البيانات
- تنفيذ صورة الكمية مرحلة ما بعد المعالجة من الصور -stack ض باستخدام appropria الشركة المصرية للاتصالات ومعالجة الصور البرمجيات.
- جزء من الوقت الفاصل بين الصور لتحديد مواقع خلية 3D في (س، ص، ض، ر) تلقائيا.
- لكل إطار، والتحقق يدويا من دقة الترجمة وإزالة ايجابيات كاذبة بسبب الحطام الخلية ونتوءات الخلوية التي قد تكون مخطئا للخلايا. إزالة الخلايا التكاثري من التحليل والخلايا المتداخلة أو متصلة تقسيم إلى أشياء مختلفة.
- توليد مسارات خلية الوقت الفاصل 3D من إحداثيات الخلية (س، ص، ض، ر) التي تم الحصول عليها في الخطوة السابقة من خلال ربط موقع كل خلية في التسلسل الزمني.
- القضاء على الضجيج العشوائي والنظام عن طريق إزالة المسارات أقصر من طول عتبة المسار (عادة 20 دقيقة).
- تصحيح عينة الانجراف من خلال طرح نزوح الصافية الإجمالية من المسارات إذا لزم الأمر.
- حساب تشريد الخلية،ديزيل / ftp_upload / 52735 / 52735eq2.jpg "العرض =" 80 "/>، والمسافة الهجرة الخلية،
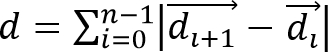 ، من مسارات خلية الملحوظة، حيث هو متجه يمثل الموقع 3D خلية في وقت وهو العدد الإجمالي من النقاط الوقت.
، من مسارات خلية الملحوظة، حيث هو متجه يمثل الموقع 3D خلية في وقت وهو العدد الإجمالي من النقاط الوقت. - حساب سرعة خلية كما S = د / (ن • Δ ر)، حيث Δ t هو الفاصل الزمني بين الإطارات. حساب الاتجاهية الهجرة الخلية (أو استمرار) باستخدام P = Δd / د. هذا الإجراء البسيط للاستمرار يعني أن لP = 0 تشريد الصافي هو صفر وP = 1 مسار هو خط الاتجاه المستقيم.
النتائج
تم إجراء فحص هلام متحدة المركز المقدمة هنا باستخدام خلايا سرطان الثدي الغازية للغاية، MDA-MB-231، مع 2.4 ملغ / مل الداخلي جل الكولاجين وكثافة البذر خلية = 2 × 10 6 خلية / مل، وكمثال على ذلك. كما هو مبين في الشكل 2، وعادة بعد بضعة أيام من الثقافة، خرقت الخلايا واجهة...
Discussion
In this protocol we describe an in vitro assay to study the 3D migrational behavior of cells in matrix environments that topologically resemble ECMs encountered in vivo. There are three main strengths of this assay as compared to other currently available methods. First, this assay allows one to simultaneously examine the cell migration mechanisms at both population level and individual cell level. This opens up possibilities of studying collective cell migration13, which has to date been lar...
Disclosures
الكتاب ليس لديهم ما يكشف.
Acknowledgements
الكتاب أشكر W. الشمس وK. يانسن للمناقشات حاسمة، وتقر الدعم من الميكانيكا الحيوية مختبر النانو في جامعة سنغافورة الوطنية. يعترف NAK الدعم من معهد التمويل الدولي زمالة ماري كوري.
Materials
| Name | Company | Catalog Number | Comments |
| Cell culture incubator | Fisher Scientific Pte Ltd | Model: 371, S/No 318854-6055 | |
| Confocal microscope | Nikon A1R | Inverted confocal laser scanning microscope equipped with incubator chamber | |
| Dulbecco's Modified Eagle's Medium (DMEM) | Life Technologies | 11965-092 | |
| Fetal Bovine Serum (FBS) | Life Technologies | 10082-147 | |
| Fluorescent CellTracker dye CMTMR | Life Technologies | C2927 | |
| Glass-bottom dish | IWAKI Cell Biology | 3931-035 | 35 mm diameter dish with 12 mm diameter glass-bottom well |
| Hemocytometer | iN CYTO | DHC-N01 (Neubauer Improved) | |
| Microprocessor pH meter | Hanna Instruments | pH 211 | |
| Nutragen Collagen | Advanced BioMatrix | #5010-D | Acid-solubilized bovine collagen type I (stock pH ~ 2) |
| Objective lens | Nikon | CFI Super Plan Fluor ELWD ADM 20XC, W.D. 8.2-6.9mm, NA 0.45. | |
| Penicillin-Streptomycin | Life Technologies | 15140-122 | |
| pH meter | Sartorius | S/No 29153352 | Basic pH Meter PB-11 |
| Trypsin-EDTA | Life Technologies | 15400-054 |
References
- Horwitz, R., Webb, D. Cell migration. Curr Biol. 13 (19), R756-R759 (2003).
- Liang, C. C., Park, A. Y., Guan, J. L. In vitro scratch assay: a convenient and inexpensive method for analysis of cell migration in vitro. Nat. Protoc. 2 (2), 329-333 (2007).
- Provenzano, P. P., Eliceiri, K. W., Inman, D. R., Keely, P. J. Engineering three-dimensional collagen matrices to provide contact guidance during 3D cell migration. Curr. Prot. Cell Biol. 10, 10-17 (2010).
- Friedl, P., Sahai, E., Weiss, S., Yamada, K. M. New dimensions in cell migration. Nat. Rev. Mol. Cell Biol. 13 (11), 743-747 (2012).
- Grinnell, F., Petroll, W. M. Cell motility and mechanics in three-dimensional collagen matrices. Annu. Rev. Cell. Dev. Biol. 26, 335-361 (2010).
- Wirtz, D., Konstantopoulos, K., Searson, P. C. The physics of cancer: the role of physical interactions and mechanical forces in metastasis. Nat. Rev. Cancer. 11 (7), 512-522 (2011).
- Sun, W., Kurniawan, N. A., Kumar, A. P., Rajagopalan, R., Lim, C. T. Effects of migrating cell-induced matrix reorganization on 3D cancer cell migration. Cell. Mol. Bioeng. 7 (2), 205-217 (2014).
- Achilli, M., Mantovani, D. Tailoring mechanical properties of collagen-based scaffolds for vascular tissue engineering: the effects of pH, temperature and ionic strength on gelation. Polymers. 2 (4), 664-680 (2010).
- Kurniawan, N. A., Wong, L. H., Rajagopalan, R. Early stiffening and softening of collagen: interplay of deformation mechanisms in biopolymer networks. Biomacromolecules. 13 (3), 691-698 (2012).
- Sun, W., Lim, C. T., Kurniawan, N. A. Mechanistic adaptability of cancer cells strongly affects anti-migratory drug efficacy. J. R. Soc. Interface. 11 (99), 20140638 (2014).
- Guzman, A., Ziperstein, M. J., Kaufman, L. J. The effect of fibrillar matrix architecture on tumor cell invasion of physically challenging environments. Biomaterials. 35 (25), 6954-6963 (2014).
- Wolf, K., et al. Physical limits of cell migration: control by ECM space and nuclear deformation and tuning by proteolysis and traction force. J. Cell Biol. 201 (7), 1069-1084 (2013).
- Friedl, P., Gilmour, D. Collective cell migration in morphogenesis, regeneration and cancer. Nat. Rev. Mol. Cell Biol. 10 (7), 445-457 (2009).
- Vedula, S. R. K., Ravasio, A., Lim, C. T., Ladoux, B. Collective cell migration: a mechanistic perspective. Physiology. 28 (6), 370-379 (2013).
- Petrie, R. J., Doyle, A. D., Yamada, K. M. Random versus directionally persistent cell migration. Nat. Rev. Mol. Cell Biol. 10 (8), 538-549 (2009).
- Miron-Mendoza, M., Seemann, J., Grinnell, F. The differential regulation of cell motile activity through matrix stiffness and porosity in three dimensional collagen matrices. Biomaterials. 31 (25), 6425-6435 (2010).
- Mouw, J. K., et al. Tissue mechanics modulate microRNA-dependent PTEN expression to regulate malignant progression. Nat. Med. 20 (4), 360-367 (2014).
- Wolf, K., et al. Collagen-based cell migration models in vitro and in vivo. Semin. Cell Dev. Biol. 20 (8), 931-941 (2009).
- Wong, L. H., Kurniawan, N. A., Too, H. -. P., Rajagopalan, R. Spatially resolved microrheology of heterogeneous biopolymer hydrogels using covalently bound microspheres. Biomech. Model. Mechanobiol. 13 (4), 839-849 (2014).
- Gupton, S. L., Waterman-Storer, C. M. Spatiotemporal feedback between actomyosin and focal-adhesion systems optimizes rapid cell migration. Cell. 125 (7), 1361-1374 (2006).
- Provenzano, P. P., Inman, D. R., Eliceiri, K. W., Trier, S. M., Keely, P. J. Contact guidance mediated three-dimensional cell migration is regulated by Rho/ROCK-dependent matrix reorganization. Biophys. J. 95 (11), 5374-5384 (2008).
- Wolf, K., et al. Multi-step pericellular proteolysis controls the transition from individual to collective cancer cell invasion. Nat. Cell Biol. 9 (8), 893-904 (2007).
- Jansen, K. A., Bacabac, R. G., Piechocka, I. K., Koenderink, G. H. Cells actively stiffen fibrin networks by generating contractile stress. Biophys. J. 105 (10), 2240-2251 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved