Method Article
الهندسة 3D Cellularized الهلام الكولاجين لتجديد الأنسجة الوعائية
In This Article
Summary
In this work, we present a technique for the rapid fabrication of living vascular tissues by direct culturing of collagen, smooth muscle cells and endothelial cells. In addition, a new protocol for the mechanical characterization of engineered vascular tissues is described.
Abstract
ومن المعروف أن المواد الاصطناعية لبدء المضاعفات السريرية مثل التهاب، تضيق، والتهابات عندما زرعت كبدائل الأوعية الدموية. وقد الكولاجين تستخدم على نطاق واسع لمجموعة واسعة من التطبيقات الطبية الحيوية، ويعتبر بديلا صالحا للمواد الاصطناعية نظرا لتوافق مع الحياة الأصيل (أي استضداد منخفضة، والالتهابات، والاستجابات السامة للخلايا). ومع ذلك، فإن الخواص الميكانيكية المحدودة والمتعلقة منخفضة اليد قدرة المواد الهلامية الكولاجين أعاقت استخدامها كمواد سقالة لهندسة الأنسجة الوعائية. وبالتالي، فإن الأساس المنطقي وراء هذا العمل الأول لهندسة المواد الهلامية الكولاجين cellularized إلى الهندسة على شكل أنبوبي والثانية لتعزيز خلايا العضلات الملساء إعادة تنظيم مدفوعة الكولاجين مصفوفة للحصول على أنسجة صلبة بما فيه الكفاية ليتم التعامل معها.
وتستند الاستراتيجية الموصوفة هنا على تجميع مباشرة من الكولاجين وخلايا العضلات الملساء (بناء) في cyli 3Dالهندسة ndrical مع استخدام تقنية الصب. تتطلب هذه العملية فترة النضج، وخلالها يبني يتم تربيتها في مفاعل حيوي في ظل ظروف ثابتة (بدون قيود الميكانيكية الحيوية الخارجية التطبيقية) لمدة 1 أو 2 أسابيع. في "مفاعل حيوي ثابت" يوفر بيئة معقمة المراقبة والتحكم (درجة الحموضة، ودرجة الحرارة، وتبادل الغازات، توريد المواد الغذائية والتخلص من النفايات) إلى بنيات. خلال الفترة الثقافة، أجريت قياسات سمك لتقييم إعادة مدفوعة خلايا المصفوفة الكولاجين، وتم قياس استهلاك الجلوكوز ومعدلات إنتاج اللاكتات لرصد الخلايا النشاط الأيضي. وأخيرا، تم تقييم الخواص الميكانيكية واللزجة ليبني أنبوبي الناتجة عن ذلك. تحقيقا لهذه الغاية، بروتوكولات محددة ومركزة الدراية (التلاعب، تجتاح، والعمل في بيئة المائية، وهلم جرا) وضعت لتوصيف الأنسجة هندسيا.
Introduction
هندسة الأنسجة الوعائية تتصور الاستراتيجيات المختلفة التي تهدف إلى تصنيع السفن هندسيا، بما في ذلك الطعوم بناء على السقالات الاصطناعية، والأوعية الدموية الأنسجة المهندسة أساس ورقة خلايا (TEBVs)، والمصفوفة خارج الخلية (ECM) على مكونات TEBVs. من بين هذه المناهج، والبوليمرات الاصطناعية يحمل خصائص ميكانيكية جيدة، ولكنها تشترك في العيب المشترك لأنها تفتقر إلى النشاط الحيوي 1. طريقة أساس ورقة خلايا يسمح للإنتاج بدائل الأوعية الدموية هندسيا مع خصائص ميكانيكية عالية، ولكن الوقت اللازم لإنتاج مثل هذه الطعوم هو ما يقرب من 28 أسابيع 2. البوليمرات الحيوية الطبيعية للECM، مثل الكولاجين، والإيلاستين، الفيبرين 3 أو مزيج منها، تبقى المواد المعيار الذهبي لالسقالات هندسة الأنسجة. هذا هو في المقام الأول وذلك لسبب أن هذه المواد تمتلك توافق مع الحياة جيدة عموما في حين التمكن من إحداث الاستجابات الخلوية وظيفية 4-5. ومن بين هذه البوليمر الحيويالصورة، النوع الأول الكولاجين هو واحد من البروتين الحاملة الأكثر وفرة والسائد من ECM في العديد من الأنسجة مثل الجلد والأوعية الدموية والأوتار. وقد أجريت عمل واسع النطاق على الخواص الميكانيكية للالكولاجين 6-8، ولكن لم يكن هناك سوى عدد قليل من الدراسات على إعادة عرض الخلوية من المواد الهلامية الكولاجين أثناء نضوج ثابت. يشير إعادة عرض الخلوية إلى التعديلات الهيكلية للمصفوفة الكولاجين الناجم عن الخلايا التي يمكن أن تؤثر على استقرار الشبكة الألياف الكولاجين 9. كما سقالة الطبيعية، كميات كبيرة نسبيا من النوع الأول الكولاجين يمكن أن تكون معزولة، تعقيمها وتخزينها من مصادر مختلفة مثل الأوتار الفئران الذيل 10. فهم التفاعلات الخلوية مع الكولاجين والسلوكيات الميكانيكية العامة ذات الصلة السقالات الكولاجين cellularized (بنيات) هو خطوة أساسية لبناء الأنسجة. يمكن معالجتها TEBVs القائم على الكولاجين عن طريق خلط الخلايا مباشرة مع الكولاجينأثناء إعداد جل ومصبوب الى مزيد من الأشكال محددة مثل أنبوبي ومستو 11. خلايا الأوعية الدموية داخل الهلام تتكاثر واعادة تشكيلها نوع I الكولاجين 12. وهكذا، وهذه الطريقة تتجاوز الحاجة إلى macroporosity المحددة التي تمثل واحدة من القضايا الهامة في تطوير الاطر لتطبيقات هندسة الأنسجة. ومع ذلك، فإن العوائق الرئيسية من المواد الهلامية الكولاجين هي الخواص الميكانيكية منخفضة وذلك مقارنة مع المواد الاصطناعية (13).
في هذه الدراسة، تم تصميم الأنسجة قابلة للحياة مع توزيع متجانس من الخلايا عن طريق الاختلاط المباشر الكولاجين مع الخلايا في عملية من خطوة واحدة. واستخدمت "المفاعلات الحيوية الثابتة" ل1 أو 2 أسابيع من النضج ثابت من المواد الهلامية الكولاجين cellularized (بدون قيود الميكانيكية الحيوية الخارجية التطبيقية). خلال الثقافة، وقعت الكولاجين مصفوفة إعادة عرض، وبالتالي توفير التعزيز الهيكلي إلى بنيات. وعلاوة على ذلك، كانت هذه التركيبات صإيدي على أن يتم تحويلها إلى مفاعل حيوي الدورية الجدار وتم التوصل إلى البطانة متجانسة. بالإضافة إلى ذلك، في هذا العمل يقترح بروتوكول معين الاختبارات الميكانيكية أيضا إلى توفير نهج الرواية المناسب في وصف الخواص الميكانيكية للأنسجة الرخوة الأنبوبية.
وباختصار، فإن هذا العمل وسيلة لتصنيع ونضوج الأنسجة الوعائية التي هي قوية بما فيه الكفاية ليتم التعامل معها ليس فقط لالتوصيفات البيولوجية والميكانيكية، ولكن أيضا لمزيد من تكييف الميكانيكية في مفاعل حيوي ديناميكي، والتي تعتبر حاسمة السريع في المختبر خطوة في تجديد الأنسجة.
Protocol
1. تصنيع وجمعية ثابت مفاعل حيوي
- تصنيع خزان
- تجهيز 50 مل أنابيب الطرد المركزي كمستودع مستنبت للمفاعل حيوي.
- جعل اثنين من الموانئ من خلال حفر اثنين 5 مم قطر الثقوب في 20 ملم من الجزء السفلي والجزء العلوي من الخزان، على التوالي. ثم إدراج اثنين من التجهيزات بالتركيبة في 5 ملم أنابيب بطول السيليكون. الصحافة تناسب هذه التجهيزات بالتركيبة من خلال الثقوب، وختم كافة الاتصالات مع سيليكون الصف الطبية الغراء.
- إدراج مرشح 0.22 ميكرون في منفذ العلوي من الخزان (الشكل 1A).
- اضافة الى وجود الحاجز بالتركيبة إلى انخفاض ميناء الخزان (الشكل 1A).
- الجمعية مغزل الحد الأقصى
- حفر حفرة قطرها 4.5 ملم في وسط غطاء التهوية للأنبوب خزان دون الإضرار غشاء مرشح الذي يغطي فتحات تهوية.
- إعداد بقضيب (القطر = 4.5 ملم، وطول = 100 مم) كما مغزل للبناء.
- إعداد اثنين سدادات سيليكون المخروطية (طول = 10 ملم، حفرة قطرها المتوسط = 4.5 ملم).
- تجميع مغزل والحد الأقصى (مجمع مغزل الحد الأقصى) كما هو موضح في الشكل 1B.
- الصحافة تناسب مغزل في حفرة. إدراج سدادات 2 على مغزل بحيث يتم تركيب الغطاء بينهما. ضبط الموقف من مغزل بحيث طوله المفيد هو 78 ملم.
- تطبيق التمهيدي ثم الطبية الصف سيليكون الغراء على الأسطح التي سوف تكون على اتصال قبل أن ينضم إلى الحد الأقصى وسدادات سيليكون المخروطية معا. إزالة الغراء الزائد على الحد الأقصى.
- اتركها لتجف في درجة حرارة الغرفة لمدة 1-3 أيام.
- تلفيق من شاش-السيطرة
- إعداد 3 أنابيب السيليكون (أنبوب 1: القطر الداخلي = 6.4 ملم، وطول = 5 مم؛ أنبوب 2: قطر = 6.4 ملم، وطول = 10 ملم، وأنبوب 3: قطر = 3.1 ملم، وطول = 12 ملم).
- تجميع الشاش-السيطرة وصفهد في الشكل 1C.
- قطع أنبوب 1 طوليا، وفتحه على أنبوب 2. التمسك بها جنبا إلى جنب مع الغراء السيليكون.
- قطع الشاش المعقم الجراحي إلى 5 سم x سم ورقة 7، ثم يلف بإحكام الشاش فوق أنبوب 3 على طول الجانب الأطول من الشاش. إدراج أنبوب 1 أنبوب 2 مجمع على الشاش.
- إضافة سيليكون الغراء العصا معا الشاش، مجمع أنبوب 1 أنبوب (2) وقطع أنبوب 3. الشاش بطول 8 ملم.
- التجمع والتعقيم
- تجميع المجمع مغزل الحد الأقصى والشاش-السيطرة كما هو موضح في الشكل (2).
- معطف مغزل مع الشحوم الصف الطبية (الشكل 2A). وضع الشاش-السيطرة على مغزل (الشكل 2B). إبعاد السيطرة على قيمة ثابتة من 35 ملم من بعضها البعض.
- إعداد قالب أنبوبي عن طريق إزالة الجزء السفلي من حقنة 10 مل باستخدام منشار طاولة (النهائي طول = 8 مم) ( الشكل 2B).
- إدراج قالب خلال التجمع مغزل الحد الأقصى مجهزة السيطرة الشاش (مجمع سكني العفن)، والعفن على سدادة سيليكون (الشكل 2C) تركيب الأداة الإضافية.
- الأوتوكلاف الخزان والمجمع السكني العفن.
ملاحظة: كن حريصا على الاستمرار على سدادة السيليكون بإحكام عند إدراج قالب لتجنب انفصال لها.
- تجميع المجمع مغزل الحد الأقصى والشاش-السيطرة كما هو موضح في الشكل (2).
2. هندسة السلس الخلايا العضلية التركيبات القائمة على جل الكولاجين وثابت نضوج
- التركيبات الهندسية
- توسيع الخنزير خلايا العضلات الملساء الأبهر (pSMCs) في 175 سم 2 قوارير ثقافة مليئة 20 مل من مستنبت كاملة تتألف من Dulbecco لتعديل النسر متوسطة تستكمل مع 10٪ (V / V) مصل الخنازير (PS)، 10٪ (ت / ت ) مصل بقري جنيني (FBS)، 1٪ (V / V) البنسلين، الستربتومايسين (القلم بكتيريا).
- في ≈90٪ التقاء، فصل pSMCs (مرور 2-4) عن طريق إزالة مستنبت منقارورة من pSMCs، إضافة 5 مل من محلول التربسين (1X في محلول ملحي الفوسفات مخزنة، PBS)، واحتضان لمدة 10 دقيقة (T = 37 ° C، 5٪ CO 2، 100٪ الرطوبة).
- Resuspend وpSMCs بتركيز 4 × 10 6 خلية / مل في مستنبت الكامل.
- يعد حل الكولاجين كما هو موضح سابقا (10).
- استخراج وجمع حزم الكولاجين من الأوتار ذيل فأر في حل PBS.
- نقل ألياف الكولاجين في وقت لاحق في الأسيتون (5 دقائق)، الأيزوبروبانول 70٪ (ت / ت) (5 دقائق) وحمض الخليك (0.02 N، 48 ساعة، 4 ° C) الحلول.
- مزيج الحل لزج وتجميد في -20 درجة مئوية لمدة 3 أيام.
- يجفد الحل المجمدة للحصول على الإسفنج الكولاجين.
- إذابة الإسفنج الكولاجين في محلول حمض الخليك (0.02 N) بتركيز 4 ز / L وأجهزة الطرد المركزي في 29581 ز القوة لمدة 45 دقيقة.
- تعقيم الحل الكولاجين من خلال عملية غسيل الكلى ضد الصورة اللاحقةolutions من حمض الخليك (0.02 N، 1 ساعة)، والكلوروفورم 1٪ (ت / ت، 1 ساعة) وحمض الخليك (0.02 N، محلول معقم تتغير كل يوم 2 ل 1 أسبوع).
- جمع الحل الكولاجين معقم (4 جم / لتر) في الثقافة العقيمة خلية غطاء محرك السيارة.
- إعداد المواد الهلامية الكولاجين cellularized كما هو مبين في الشكل (3).
- تجهيز 50 مل من محلول منظم المعقم عن طريق خلط 35 مل من DMEM (5X)، 4 مل من HEPES (1 N)، 3 مل من هيدروكسيد الصوديوم (1 N) في 8 مل من الماء منزوع الأيونات معقمة.
- إعداد الخلايا والكولاجين مزيج هلام في وعاء وضعت في الجليد عن طريق خلط 50٪ (ت / ت) من محلول معقم الكولاجين (4 جم / لتر من حامض الخليك 0.02 N) مع 25٪ (V / V) من حل العازلة و 25٪ (ت / ت) لتعليق pSMCs في كامل مستنبت.
- قياس درجة الحموضة في الخليط وضمان أن تكون بين 7.0 و 7.4.
- صب بلطف 9 مل من خليط الخلايا والكولاجين في السكن / مجمع قالب المذكورة أعلاه (الخطوة 1.4.3، الشكل 3A-B ).
- السماح لها هلام في درجة حرارة الغرفة لمدة 1 ساعة تحت غطاء محرك السيارة زراعة الخلايا (الشكل 3B).
- النضج في مفاعل حيوي ثابت
- إزالة القالب (الشكل 3C) ونقل بعناية بناء في الخزان، التي تحتوي على 35 مل من مستنبت (الشكل 3D).
- احتضان بناء (T = 37 ° C، 5٪ CO 2، 100٪ الرطوبة) في وضع رأسي لمدة 1 أو 2 أسابيع من النضج ثابت.
- تثبيت كاميرا الويب (مختومة من أجل ضمان العزل) داخل الحاضنة أمام بناء.
- تغيير ثقافة المتوسط كل يوم 2 بواسطة الشفط المتوسط القديم من ميناء بالتركيبة الحاجز وإعادة ملء الخزان، مع مبلغ مساو من مستنبت الطازجة.
- قياس سماكة والاستقلابية آخر من SMCS الكولاجين التركيبات جل المستندة خلال ساكنة الثقافة
- وضع تداخل المسح بالليزر في cultu الخليةإعادة غطاء محرك السيارة والوجه من العمودي إلى الوضع الأفقي باستخدام مستوى الروح.
- نقل مفاعل حيوي في غطاء محرك السيارة زراعة الخلايا وإزالة بناء من الخزان.
- نقل بناء (لا يزال شنت على مغزل) في مسار شعاع الليزر، ووضعه بشكل صارم متعامد مع الاحترام لمحور الحزمة (كما هو موضح في الشكل رقم 4).
- قراءة القيمة المعروضة على الشاشة لتداخل الليزر المسح الضوئي، المقابلة للالقطر الخارجي للبناء.
- حساب سمك جدار بناء على أساس قطرها الخارجي والداخلي (أي قطر مغزل).
ملاحظة: كرر الخطوات 2.3.1 إلى 2.3.5 كل ساعة لساعة 12 الأولى ثم كل 24 ساعة. - استخدام 1 مل من مستنبت القديم (عينات عند تغيير مستنبت، خطوة 2.2.4) لقياس تركيزات اكتات والجلوكوز مع محلل غازات الدم.
- استخدام 1 مل منمستنبت الطازجة كمستوى خط الأساس للقياسات تركيزات الجلوكوز واللاكتات 14.
ملاحظة: كرر الخطوات 2.3.6 و2.3.7 كل أيام 2 بعد مستنبت تغيير.
- بناء حصاد لمزيد من Ccharacterizations الميكانيكية والبيولوجية
- بعد 1 أو 2 أسابيع من فترة النضج ثابتة، ونقل مفاعل حيوي ثابت في الخلية هود الثقافة.
- نقل بلطف بناء ناضجة من مغزل لها (التكميلي فيديو 1) إلى 100 مم طبق بتري تحتوي على 40 مل من مستنبت الطازجة (الشكل 5) والشكل (7A).
3. الميكانيكية توصيف يبني في طولية والاتجاهات كفافي
- تثبيت انشاء التجريبية التي تتكون من اختبار الميكرو ميكانيكية مجهزة 5 أو 10 N خلية الحمل وحمام تحتوي على برنامج تلفزيوني في 37 ° C للحفاظ على عينات لتي الزائفة الفسيولوجية الشروط (الشكل 6).
- تحقيق التوازن بين الخلايا الحمل والتمدد.
ملاحظة: موازنة هي وظيفة دمجها في اختبار الميكرو ميكانيكية تتمثل في إعادة قيمة تمديد عرض وقيمة الحمولة عرضها أثناء يتم تحميل أي العينة على الجهاز. تتيح هذه الوظيفة تحديد المرجعية لكل القياسات. - تركيب البنى الأنبوبية على جهاز ميكانيكي: الاتجاه الطولي.
ملاحظة: إجراء اختبارات التعب الطولية مباشرة على البنى الأنبوبية بأكملها. استخدام الأجهزة التي تجتاح المدمج منزل في لتوصيل السيطرة الشاش من بنيات إلى الخلية الحمل وقاعدة الحمام PBS.- جبل أنبوبي بناء على الأجهزة التي تجتاح (الشكل 7B)، وبعد إجراء الحصاد (القسم 2.4).
- التفاف الأجهزة التي تجتاح والسيطرة الشاش مع تفلون الشريط لمنع أي انزلاق قبضة الشاش أثناء الاختبار.جبل العينة على اختبار الميكرو ميكانيكية (الشكل 7C).
- تركيب يبني على شكل حلقة على جهاز ميكانيكي: الاتجاه المحيطي.
ملاحظة: إجراء اختبارات التعب كفافي على العينات على شكل حلقة مقطوع من البنى الأنبوبية. استخدام اثنين من قضبان الفولاذ المقاوم للصدأ والسيطرة على عقد العينات.- جبل أنبوبي بناء على أنبوب بلاستيكي كما شهد دعما مع 5 ثغرات مم (الشكل 7B)، وبعد الحصاد (القسم 2.4).
- قطع 10 مم حلقات من بناء أنبوبي.
- قياس طول العينة باستخدام الفرجار رنيه للتحليلات أخرى.
- جبل العينة على شكل حلقة على قضبان الفولاذ المقاوم للصدأ اختبار الميكرو ميكانيكية (الشكل 7C). تأكد من وضع العينة في وسط القضبان.
ملاحظة: الأنابيب البلاستيكية في خطوة 3.4.1 ونظام القطع كما هو مبين في الشكل 7B تستخدم لتجنب أي ضرر للبناء خلال عدة قطاعات.
- اختبار التعب على ثوابت في الاتجاه الطولي أو كفافي.
- تمتد بناء على طوله قياس الأولي.
- الحفاظ على بناء في هذا المنصب لمدة 10 دقيقة في بيئة شبه الفسيولوجية.
- تطبيق 10٪ الضغط الدائري للقياس طول الأولي (30 دورات) لبناء بنسبة 5٪ معدل سلالة / ثانية.
- كرر الخطوة 3.5.3 في خطوات تدريجية من 10٪ سلالة دوري حتى فشل العينة.
ملاحظة: إن استخدام البيئة شبه الفسيولوجية يتطلب الأخذ بعين الاعتبار الطفو والقصور الذاتي للنظام التي تجتاح التي تؤثر على قياس الحمولة التطبيقية. - تسجيل الخلفية على النحو التالي:
- نقل التحميل إطار لقياس طول الأولي.
- كرر الخطوات 3.5.3 و3.5.4 دون شنت أي عينة، والحفاظ على الأجهزة التي تجتاح متصلا تحميل الخلية (دورة 1 فقط هي REQUIأحمر).
4. اللمعية تبطنن من التركيبات
ملاحظة: بعد اتباع بروتوكول حصاد (القسم 2.4)، ويبني الصمود التعامل مع لتركيبها في مفاعل حيوي الدورية الجدار للحصول على مزيد من تبطنن.
- الدورية الجدار مفاعل حيوي التصميم
- حفر حفرة قطرها 4.5 ملم في وسط غطاء التهوية للأنبوب خزان دون الإضرار غشاء مرشح الذي يغطي فتحات تهوية.
- الصحافة تناسب مغزل (القطر = 4.5 ملم، وطول = 40 ملم) في حفرة وإصلاح مغزل كما هو موضح في الخطوة 1.1.2.
- إعداد اثنين دعم سيليكون على شكل حرف C لقطرها الخارجي بناء = 14 مم؛ القطر الداخلي = 8 مم).
- وضع محرك الدورية في واحدة من نهاية مفاعل حيوي الدورية الجدار ولها تأثير على الطرف الآخر (الشكل 8B).
- التجويف تبطنن
- توسيع umbilic الإنسانآل الوريد الخلايا البطانية (HUVECs) في 25 سم 2 قوارير الثقافة مع 5 مل من M199 مستنبت تستكمل مع 10٪ (ت / ت) PS، 10٪ (V / V) FBS، 1٪ (ت / ت) من ركلة جزاء، بكتيريا في طبق بتري داخل حاضنة (T = 37 ° C، 5٪ CO 2، 100٪ الرطوبة) حتى 90٪ التقاء.
- إعداد 1.5 مل من محلول البروتين طلاء في بناء المطلوبة لالأمثل التصاق الخلايا عن طريق تمييع الخليط تركيز بروتين 10.5 نانوغرام / مل في المصل خالية البطانية مستنبت الخلية.
- قياس طول للبناء باستخدام الفرجار رنيه.
- حساب حجم اللمعية V ومنطقة اللمعية ألف من بناء على النحو التالي: V = D في 2 L / 4 و A = D في L على التوالي (حيث D هو في القطر الداخلي المقابلة لقطر مغزل، وL هو طول للبناء).
- موقف بناء في وسط الخزان بعد إجراء الحصاد (القسم 2.4).استخدام الدعم سيليكون على شكل حرف C لإصلاح بناء على طرفي إلى الخزان (الشكل 8A).
- ملء الخزان مع 35 مل من مستنبت.
- ملء 75٪ من حجم اللمعية يحسب للبناء (V) مع الحل البروتين طلاء أعدت في الخطوة 4.2.2. إغلاق كل من الأطراف للبناء لتجنب أي تسرب من الحل البروتين طلاء (الشكل 8A).
- تجميع نظام مفاعل حيوي الدورية الجدار داخل الخلية هود الثقافة.
- وضع مفاعل حيوي في الحاضنة 37 درجة مئوية وبدء دوران مفاعل حيوي في 4.02 × 10 -5 ز القوة لمدة 1 ساعة للسماح للطلاء اللمعية كما هو مبين في الشكل 8B.
- فتح الطرف العلوي للبناء ونضح الحل البروتين طلاء من التجويف.
- فصل HUVECs (مرور 2-3) عن طريق إزالة مستنبت من القارورة من HUVECs وإضافة 3 مل من محلول التربسين (1X في PBS). أناncubate لمدة 5 دقائق (T = 37 ° C، 5٪ CO 2، 100٪ الرطوبة).
- Resuspend وHUVECs بتركيز 4 × 10 6 خلية / مل في استكمال M199 مستنبت.
- داخل غطاء الثقافة الخلية، البذور HUVECs في التجويف للبناء مع كثافة 1000 خلية / سم 2 15. أغلق الأطراف العلوية للبناء لتجنب أي تسرب من الحل HUVECs.
- احتضان بنيات (T = 37 ° C، 5٪ CO 2، 100٪ الرطوبة) استضافت في مفاعل حيوي الدورية الجدار (الشكل 8B) والثقافة لمدة 2 أيام في دوران مستمر من 4.02 × 10 -5 ز القوة.
- حصاد بناء 2 بعد أيام من الثقافة في ظروف معقمة وتهيئته لمزيد من التوصيف البيولوجي كما هو موضح في القسم 2.4.
النتائج
يصف هذا العمل تلفيق المهندسة يبني على أساس الكولاجين أنبوبية تحتوي على خلايا الأوعية الدموية. بالفعل بعد 1 ساعة من دبق في وقت مبكر، تم تجميع خليط الخلايا والكولاجين مباشرة في الهندسة أنبوبي 3D، مع القطر الخارجي يساوي قطرها من العفن المقابلة (حوالي 14 ملم). على طول النضج ثابت، كشفت قياسات التخفيض السريع للالقطر الخارجي للهياكل cellularized أنبوبي، كما هو مبين في الجدول 1. القطر من المواد الهلامية الكولاجين cellularized تقلصت من نحو 60٪ من قيمتها الأصلية بعد 1 يوم ثقافة ثابتة، و ما يقرب من 85٪ في غضون 7 أيام (التكميلي فيديو 2). SMCS داخل بنيات هي المسؤولة عن وحظ تقلص وتعزيز الميكانيكية ذات الصلة، وهذه الظاهرة لا تحدث في السقالات الكولاجين غير cellularized. لاحظ أن أي التدرج من أي نوع (الحرارية، والكيمياء الحيوية، الميكانيكية، أو غيرها) تم تطبيق. الخلايا بالسيارةن أدى الضغط في المواد مع أكبر كثافة الكولاجين التي يمكن التعامل معها، وأخضع لاستدراج العروض الميكانيكية (فيديو خلفية 3 و 4).
لربط إعادة مدفوعة الخلايا إلى الخواص الميكانيكية واللزجة الشاملة، أجريت اختبارات التعب على بنيات (فيديو خلفية 5 و 6). وتألفت هذه الاختبارات في ركوب الدراجات يبني (30 مرة) في سلالات مختلفة ثابتة (10٪، 20٪، و 30٪ من طول المقياس الأولي) وتسجيل التوتر هو رد يبني على العطاء الميكانيكية مع مرور الوقت. وأظهرت نتائج تمثيلية للبناء واحد في الشكل 9. صمدت وبناء الضغوط أعلى في الاتجاه الطولي (75 كيلو باسكال) من في الاتجاه كفافي (16 كيلو باسكال) عندما تتعرض لنفس النطاق سلالة (سلالة 30٪). وفي الوقت نفسه، في كل دورة، وصلت قيمة التوتر ذروته لتاانخفض rgeted أقصى إجهاد مع مرور الوقت. هذا السلوك هو نموذجي من الخصائص اللزجة العالية التي أظهرتها هذه التركيبات المعتمدة على الكولاجين.
تم تقييم النشاط البيولوجي للبنيات cellularized خلال نضوج ثابت. وبالتالي، تم تقييم النشاط الأيضي SMCS عن طريق قياس استهلاك الجلوكوز وإنتاج اللاكتات أثناء ثقافة ثابتة. تم أخذ عينات مستنبت كل أيام 2 و الجلوكوز وتم قياس تركيز اللاكتات باستخدام محلل غازات الدم. الزيادة المستمرة في استهلاك الجلوكوز وإنتاج اللاكتات مجتمعة إلى تقلص هاما من البنى، يشهد النشاط SMCS على طول ثقافة ثابتة (الشكل 10).
زيادة الاستقرار الميكانيكي بسبب إعادة يحركها الخلية يسمح التلاعب في بنيات وعملية تبطنن اللاحقة. أداء ثلاثي الألوان تلطيخ ماسون على بنيات endothelializedأظهر البطانة متجانسة إلى حد كبير. SMCS عرضت مورفولوجيا المغزل تشبه شكل وبدت مشتتة متجانس من خلال الجدار، في حين بدا HUVECs انتشر جيدا في الجانب اللمعية (الشكل 11).
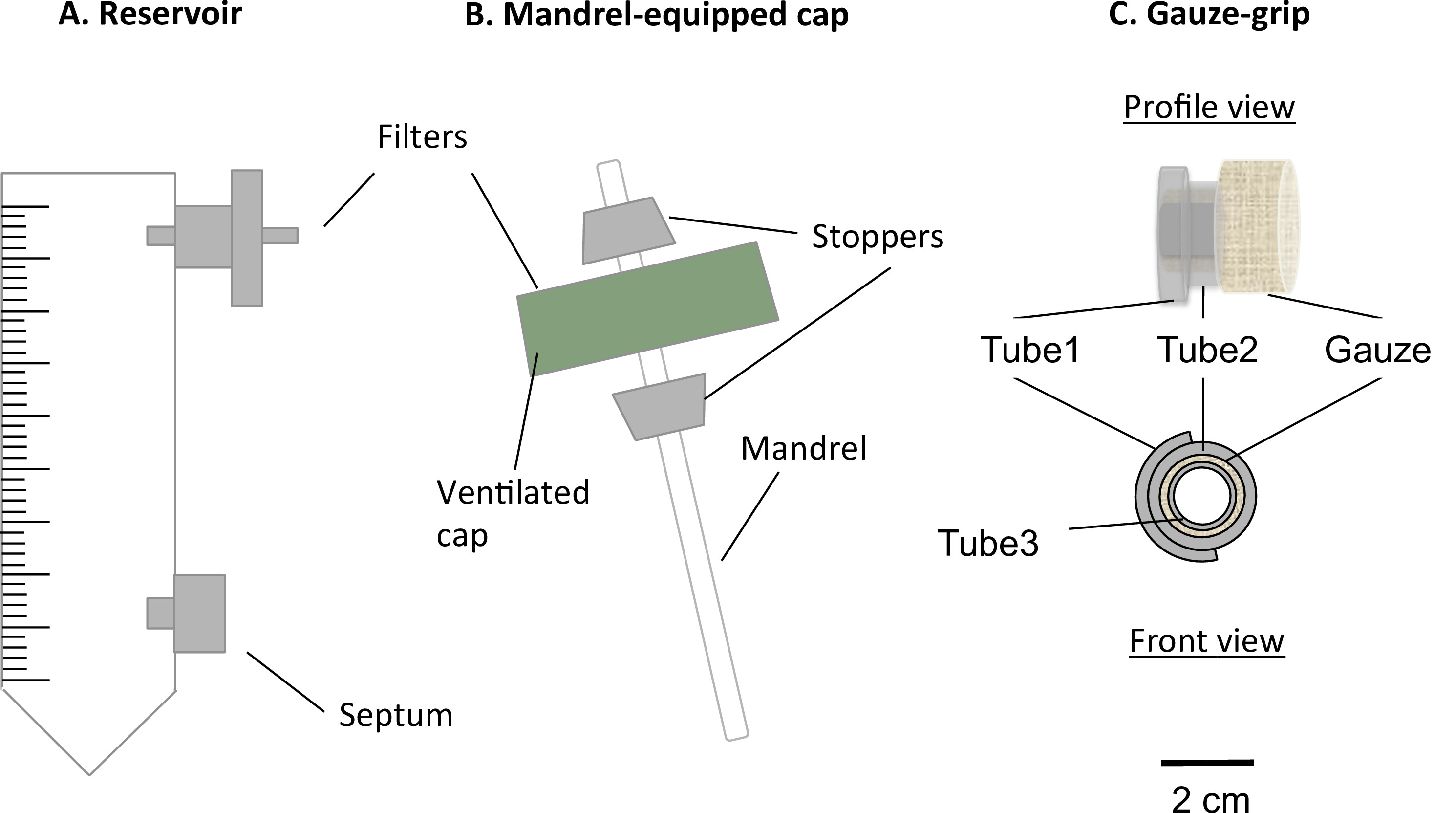
الشكل 1: مكونات مفاعل حيوي ثابت يتكون مفاعل حيوي ثابت لتعديل 50 مل أنبوب الطرد المركزي (A) وقبعة مجهزة مغزل (B). الأنبوب بمثابة خزان المتوسط، وكانت مجهزة مع منفذ للمرشح 0.22 ميكرون، لتبادل الغاز، والحاجز، لأخذ العينات والمتوسطة المتغيرة. A مغزل موجودة في سقف التهوية يسمح تلفيق يبني في شكل أنبوبي. وقد صممت للسيطرة على الشاش (C) وملفقة لدعم دبق من يبني على مغزل. وعلاوة على ذلك، فإن هذهسمحت السيطرة يبني ليتم التعامل معها بعد نضوج ثابت وتكون ثابتة لجهاز ميكانيكي. كان القطر الخارجي للمغزل 4.7 مم.
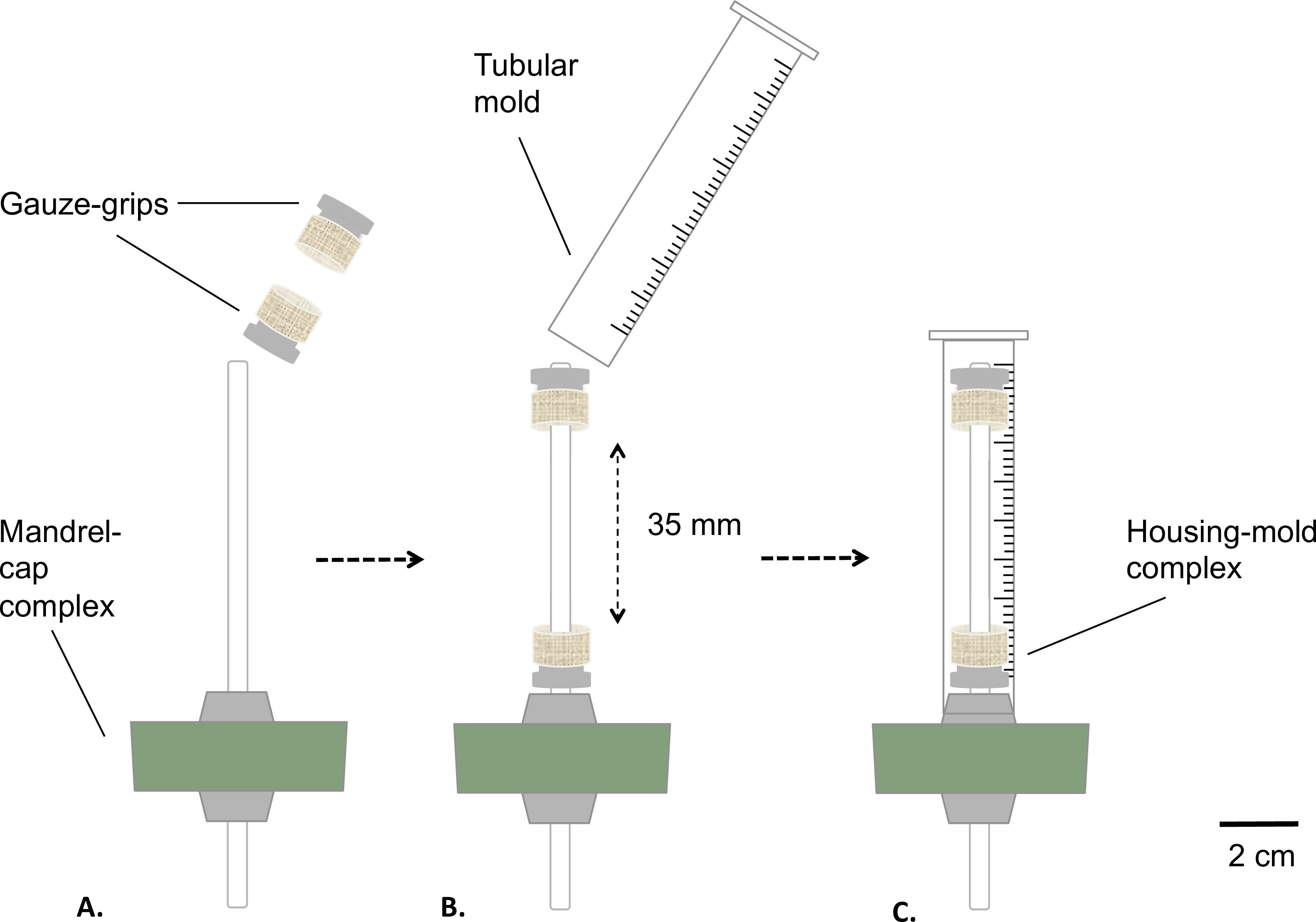
الشكل 2: تجميع مفاعل حيوي ثابت تجميع مراحل مفاعل حيوي قبل التعقيم. وقد شنت للقبض الشاش على مغزل (A) على مسافة ثابتة. تم إدراج A العفن (B) وثابتة بإحكام إلى سدادة سيليكون (C). كان القطر الخارجي للمغزل 4.7 مم.
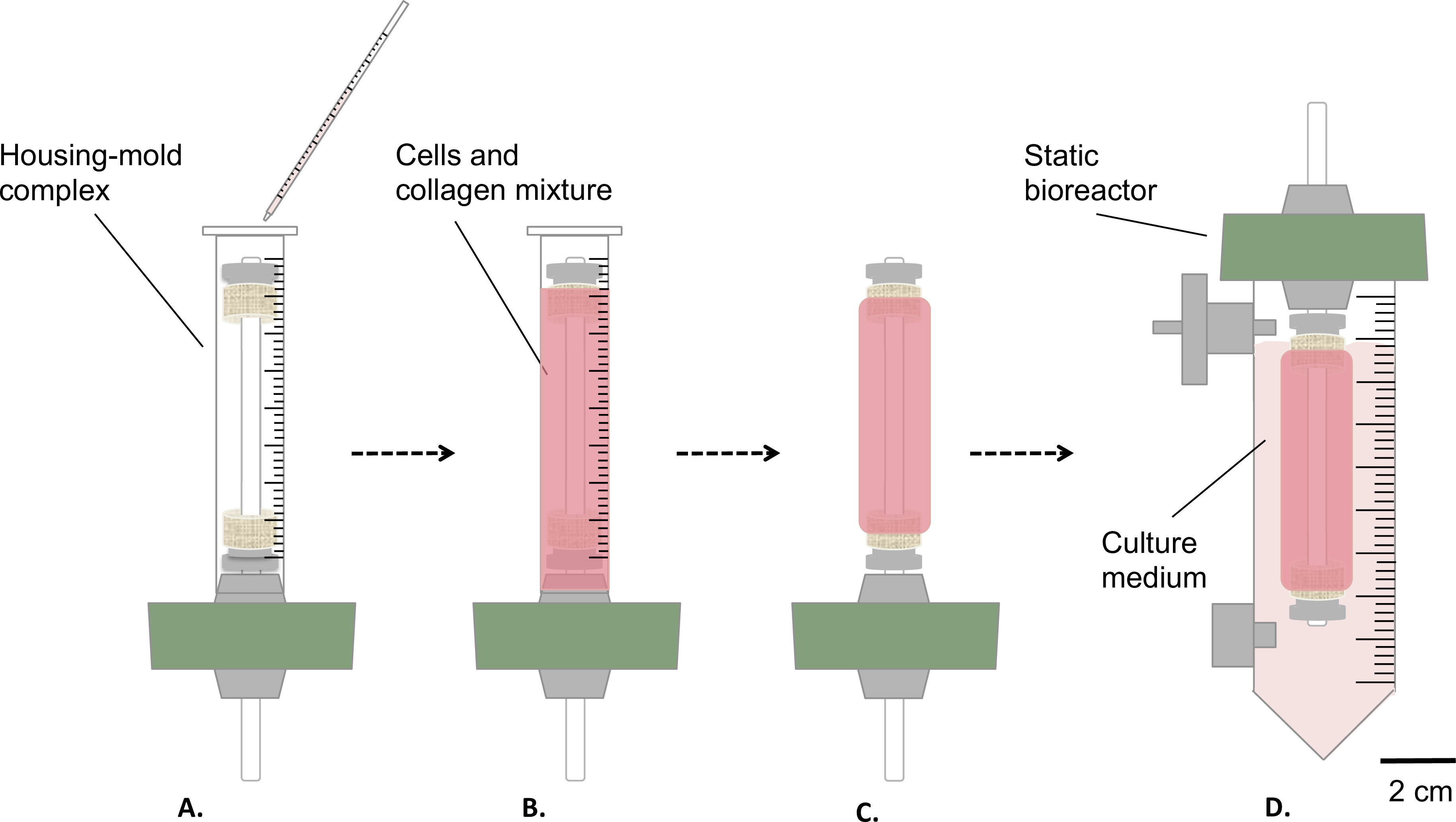
الرقم 3: تصنيع البناءات في ظروف معقمة وسكب الخلايا والكولاجين الخليط في المجمع السكني العفن (A)، والسماح هلام لمدة 1 ساعة في درجة حرارة الغرفة (B). بعد ذلك، تم إزالة العفن (C)، تم تجميع مفاعل حيوي ثابت (D) ونقلها داخل خزان للنضوج ثابت للبناء في حاضنة (T = 37 ° C، 5٪ CO 2، 100٪ الرطوبة). كان القطر الخارجي للمغزل 4.7 مم.

الرقم 4: قياس سمك / القطر الخارجي للبنيات تم استخدام تداخل المسح بالليزر لأداء قياس أقطار الخارجية للثوابت. وقد وضعت بناء في مسار شعاع الليزر ولدت الظل. عرض الظل، المقابلة للالقطر الخارجي للبناء، ثم تم قياس وعرضها على الشاشة.

الرقم 5: ظهور الصرفي للبناء تحصد (A) الحق بعد دبق و (B) بعد دفع الخلايا إعادة عرض خلال نضوج ثابت لمدة 2 أسابيع.

الشكل 6: تجريبي مجموعة المتابعة لتوصيف الميكانيكية وتألفت من اختبار الميكرو ميكانيكية مجهزة 5 أو 10 N خلية الحمل وحمام تحتوي على برنامج تلفزيوني في 37 ° C للحفاظ على عينات في ظروف شبه الفسيولوجية.
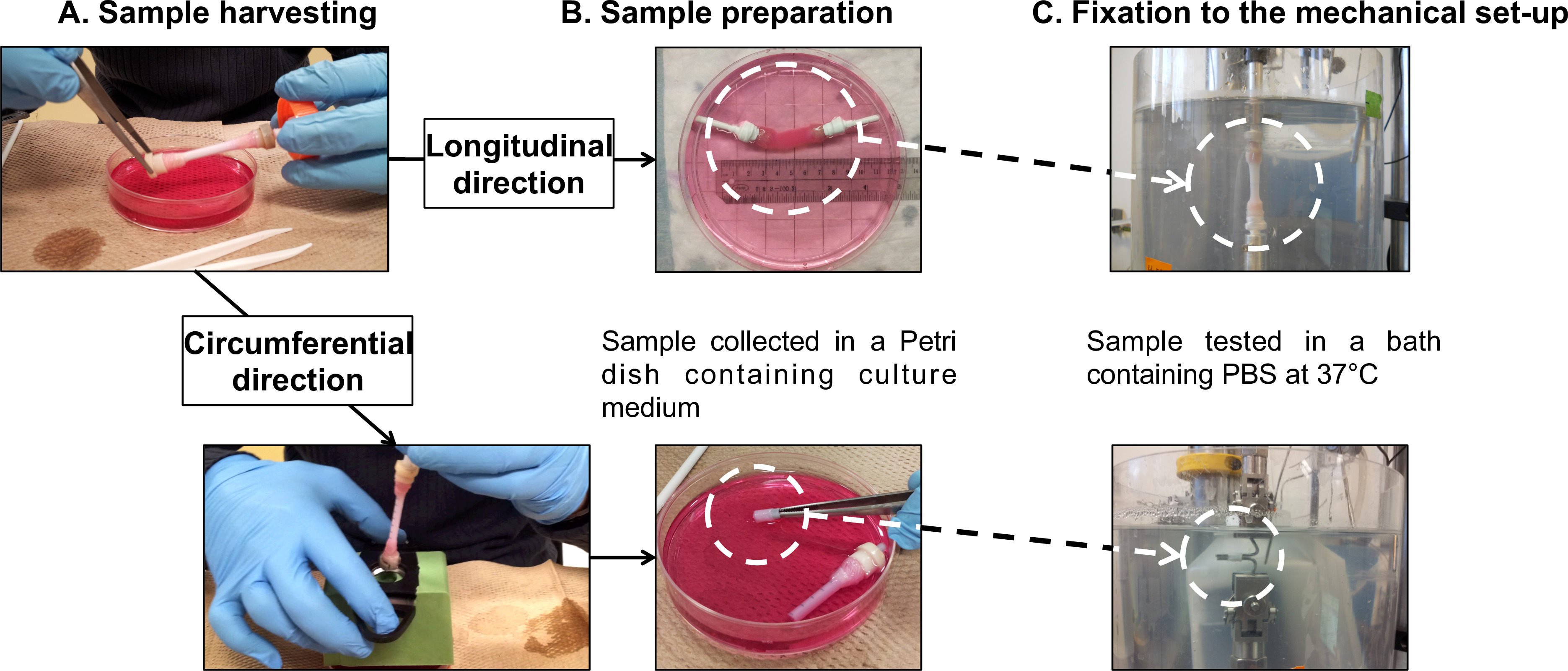
الرقم 7: نموذج تحضير و أو الأوصاف الميكانيكية. حصاد نموذج (A) وإعداد (B) للاختبارات التعب أجريت في طولية والاتجاهات كفافي (C). كان القطر الخارجي للمغزل 4.7 مم.
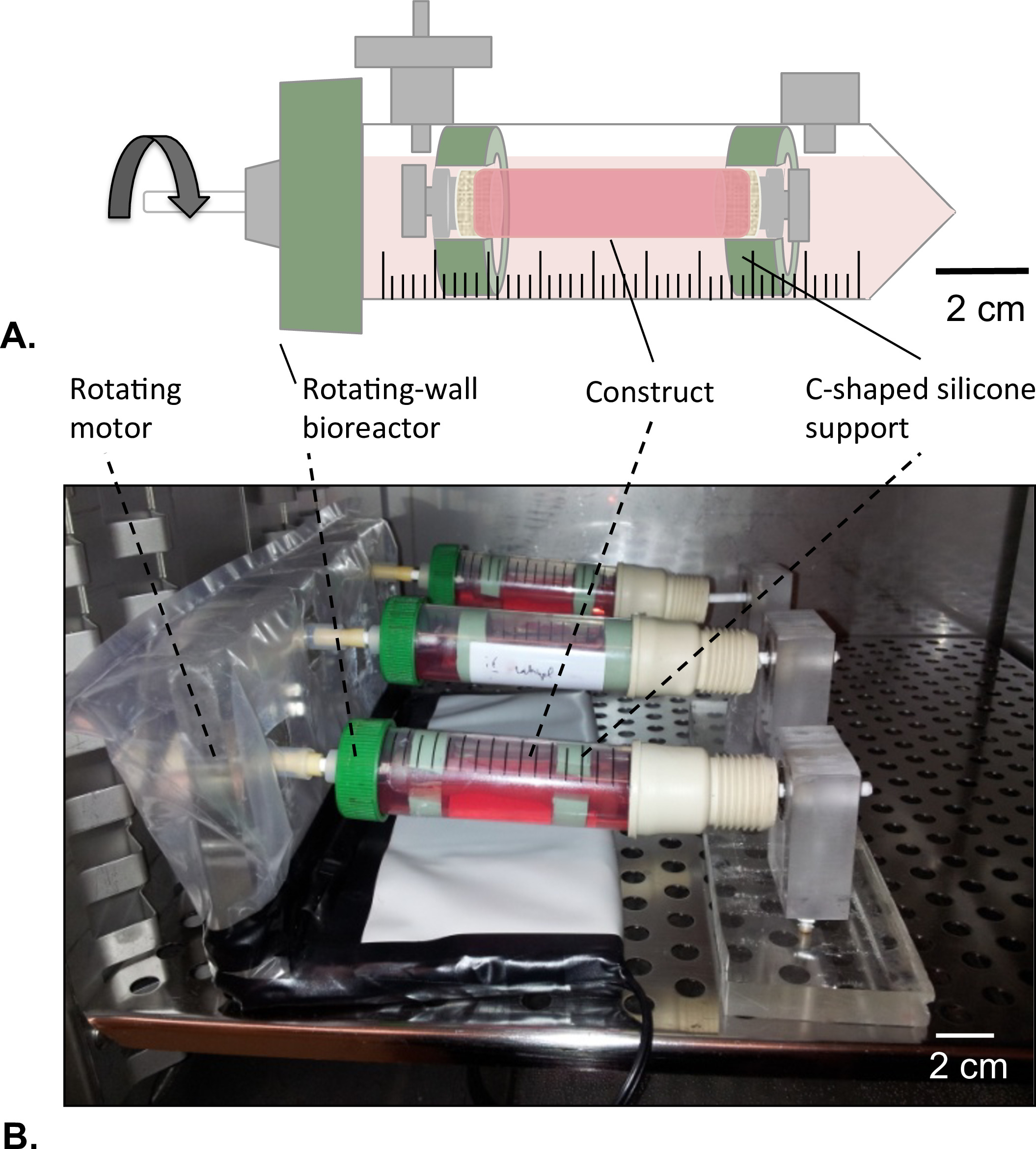
الرقم 8: تدوير الجدار مفاعل حيوي (A) تم تجميعها في البنى الأنبوبية في وسط الخزان بمساعدة على شكل ج سيليكون الدعم. وأغلقت كل من الأطراف للبناء لتجنب أي تسرب من الحل HUVECs. (B) ومثقف ويبني في حاضنة (T = 37 ° C، 5٪ CO 2، 100٪ الرطوبة) في التناوب على 4.02 × 10 -5 ز القوة لمدة 2 أيام.
2 / 52812fig9highres.jpg "العرض =" 700 "/>
الرقم 9:. الأوصاف الميكانيكية نتائج اختبارات الإجهاد التي أجريت على البناءات في الطولي (A) وكفافي (B) الاتجاهات بعد إعادة يحركها الخلية الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
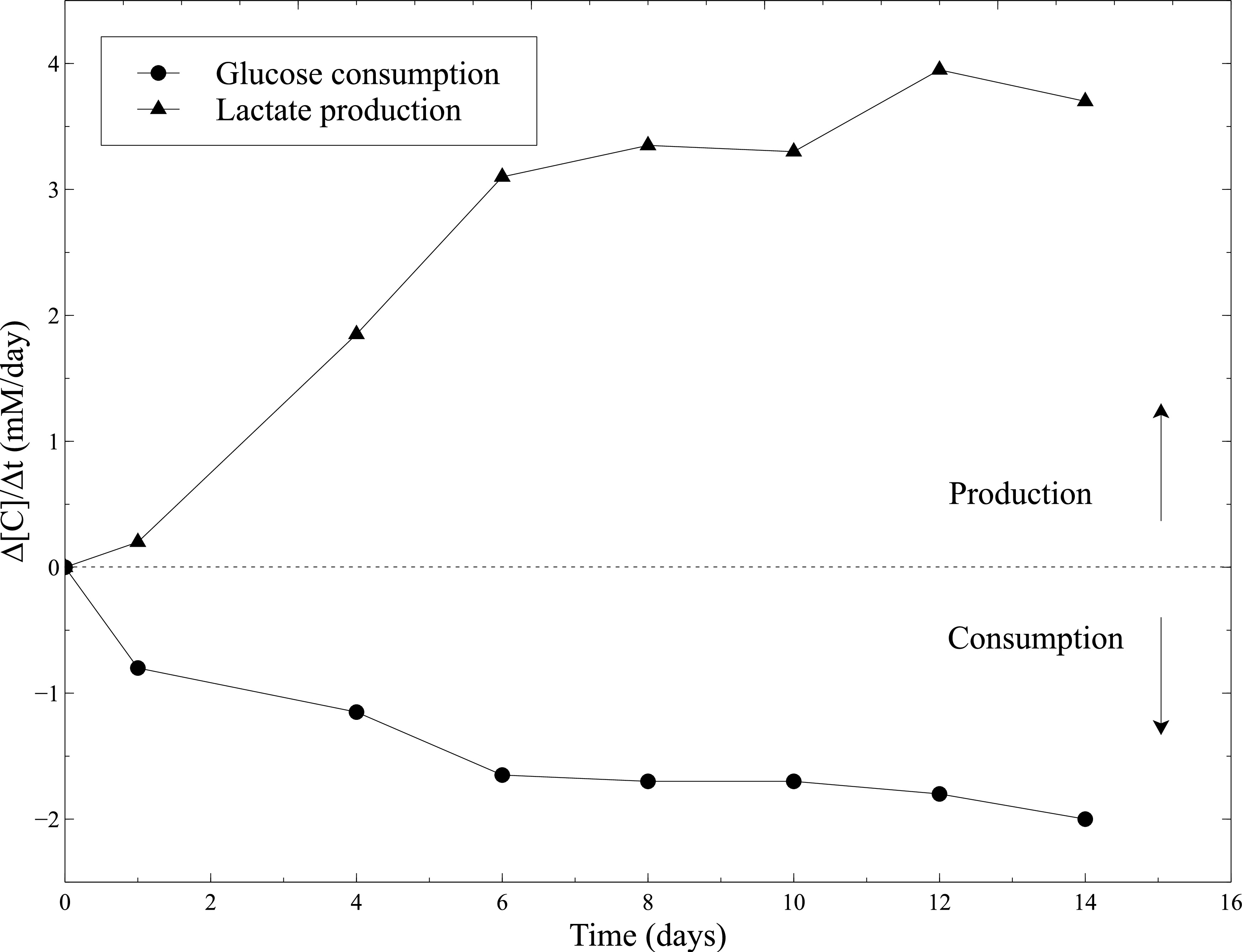
تم تنفيذ النشاط الأيضي SMCS ضمن المواد الهلامية الكولاجين قياسات معدل استهلاك الجلوكوز ومعدل إنتاج اللاكتات مع محلل غازات الدم كل أيام 2، بعد مستنبت تغيير: الرقم 10. واستخدمت الطازجة المتوسطة الثقافة باعتبارها مستوى خط الأساس للقياسات الجلوكوز وتركيزات اللاكتات.
ن صفحة = "دائما"> 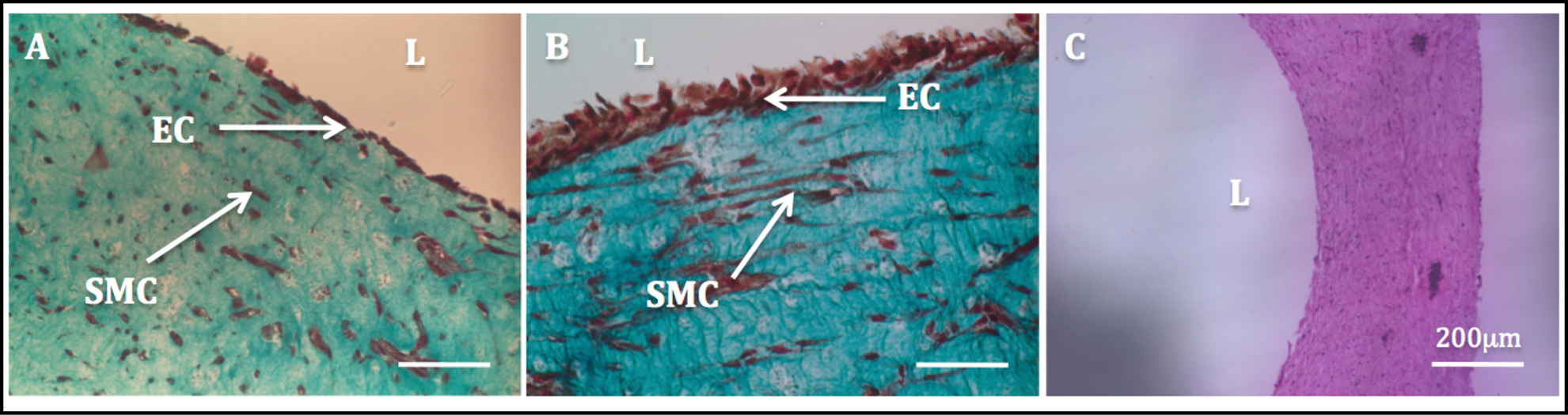
الرقم 11: التجويف تبطنن الصور النسيجية من شعاعي المقاطع العرضية من بنيات أنبوبي. ماسون في شعري الشكل تلطيخ بنيات أنبوبي مثقف بشكل ثابت لمدة 1 أسبوع (A) و 2 أسابيع (B). H & E تلطيخ لبناء أنبوبي (C).
| مرة | سمك (مم) | الضغط (٪) |
| 0 ساعة | 4.83 ± 0.02 | 0 ± 0 |
| 2 ساعة | 4.26 ± 0.02 | 12 ± 0 |
| 4 ساعة | 4.21 ± 0.03 | 13 ± 1 |
| 6 ساعة | 4.06 ± 0.10 | 16 ± 2 |
| 12 ساعةص | 3.16 ± 0.07 | 35 ± 1 |
| 1 يوم | 2.08 ± 0.11 | 57 ± 2 |
| 1 أسبوع | 0.68 ± 0.07 | 86 ± 1 |
| 2 أسابيع | 0.36 ± 0.00 | 93 ± 0 |
الجدول 1: الضغط السريع لقطر بناء خلال نضوج ثابت سمك الجدار من بنيات ومعدل الضغط بوصفها وظيفة من الوقت للثقافة ثابتة. وقد تم قياس الضغط من خلال تحديد القطر الخارجي للبنيات أنبوبي مع تداخل المسح بالليزر (سلسلة 183B، LaserMike 136). بعد 24 ساعة، ضغط بنيات إلى 57٪ ± 2٪ من أبعادها مصبوب. يتم التعبير عن البيانات كما يعني ± SD (ن = 3). ان وجود ونشاط الخلايا الحية العضلات الملساء المسؤولة فقط لمثل هذه التغييرات الكبرى.
سوpplemental فيديو 1: حصاد المواد الهلامية غير تشكيلها أنبوبي الكولاجين الرجاء النقر هنا لمشاهدة هذا الفيديو.
تكميلية فيديو 2: مدفوعا خلايا الضغط من المواد الهلامية الكولاجين أنبوبي الرجاء النقر هنا لمشاهدة هذا الفيديو.
تكميلية فيديو 3: التلاعب في المواد الهلامية غير تشكيلها أنبوبي الكولاجين الرجاء النقر هنا لمشاهدة هذا الفيديو.
تكميلية فيديو 4: التلاعب في الخلايا تشكيلها المواد الهلامية أنبوبي الكولاجين الرجاء انقر هنا لمشاهدة الهو الفيديو.
تكميلية فيديو 5: الطولي اختبار التعب (بنسبة 30٪) على خلايا تشكيلها المواد الهلامية أنبوبي الكولاجين الرجاء انقر هنا لمشاهدة هذا الفيديو.
تكميلية فيديو 6: محيطي اختبار التعب (بنسبة 30٪) على خلايا تشكيلها المواد الهلامية أنبوبي الكولاجين الرجاء انقر هنا لمشاهدة هذا الفيديو.
Discussion
بين مجتمع المهندسين الأنسجة الوعائية، وقد تم القيام به جهودا جبارة لإعادة إنتاج طبقة وسائل الاعلام الغلالة المسؤولة عن الاستقرار الميكانيكي الأوعية الدموية 16. منذ العمل الرائد لواينبرغ وبيل 17، تم الكولاجين تستخدم على نطاق واسع سقالة لهندسة الأنسجة الوعائية لما له من توافق مع الحياة، خصائص غير المناعية ومدى توافرها. ومع ذلك، فإن استخدام الكولاجين يمثل تحديا كبيرا للباحثين، وهذه المواد ليس من السهل التعامل معها، نظرا لعدم وجود لا يتجزأ من صلابة ميكانيكية. التلاعب أثناء إعداد سقالة قد يؤدي إلى تلف السقالات، المساس بها لاستخدامها مرة أخرى.
تقنية الموضحة في هذا العمل يسمح: ط) لهندسة المواد الهلامية الكولاجين cellularized إلى الهندسة على شكل أنبوبي؛ الثاني) لهندسة الأنسجة البيولوجية قوية بما فيه الكفاية ليتم التعامل معها بعد فترة نضوج ثابتة قصيرة (1 أو 2 أسابيع)؛ الثالث) باسمالخواص الميكانيكية واللزجة sess هذه الأنسجة البيولوجية على شكل أنبوبي في 2 الاتجاهات. الخلايا في هلام تلعب دورا رئيسيا في إعادة عرض الكولاجين المصفوفة. خلال فترة النضج، أدت SMCS مقلص للضغط من المواد الهلامية مما أسفر عن بناء مع الاستقرار الميكانيكي العالي التي يمكن تقييمها في الاتجاهات الطولية والدائرية. بعد ذلك، المصنف HUVECs في الجانب اللمعية من بنيات لدت البطانة متجانسة وقابلة للحياة، مما يدل على صلاحية المواد الهلامية الكولاجين لتطبيقات هندسة الأنسجة الوعائية.
مفاعل حيوي المعروضة في هذا العمل وقد صمم خصيصا لتوفير بيئة مثلى لنمو الخلايا أثناء نضوج ثابت. وبالإضافة إلى ذلك، تم تصميم الأجهزة المتقدمة لتوصيف الخواص الميكانيكية واللزجة من بنيات بهدف الحد من أي أضرار محتملة الأصيل في التلاعبهذه المواد الحساسة. وبالتالي، تم تجهيز مفاعل حيوي ثابت من 0.22 ميكرون تصفية وغشاء مرشح على الغطاء (الخطوة 1.1.2، الشكل 1A وB) التي سمحت تبادل الغازات بين مستنبت داخل الخزان والحاضنة، مع الحفاظ على البيئة ثقافة عقيمة. وقد استخدم الحاجز بالتركيبة في الجزء السفلي كميناء لمستنبت أخذ العينات وتتغير خلال ثقافة ثابتة. بعض الخطوات الحاسمة يتعين النظر خلال تلفيق بناء والأوصاف. تم تنفيذ جميع التلاعبات (ينجز في الخطوة 2.1.1 والخطوات اللاحقة) التي قد تغير من عقم النظام في غطاء محرك السيارة البيولوجي العقيمة. تم معالجة الخلايا والكولاجين جل إعداد الخليط على الجليد من أجل تأخير عملية دبق (الخطوات 2.1.4 إلى 2.1.7). في خطوة 2.1.7، أي فقاعات الهواء المحبوسة في الخليط قبل دبق هي مناطق تركيز الضغط المحتملة التي يمكن أن تؤثر سلبا على الصورةtability من بنيات. لذلك، إزالة هذه فقاعات الهواء يتطلب تهز قليلا من التجمع أو باستخدام فراغ الطبية لمدة 3 دقائق لdegasing في ظروف معقمة. وأخيرا، تم تصميم السيطرة على وجه التحديد للحفاظ على محور مغزل المركزي في قالب أنبوبي خلال دبق والسماح التلاعب الدقيق للبنيات أثناء حصاد (إزالة مغزل، القسم 2.4)، لتبطنن، وتسهيل التركيب على النظام الميكانيكي (اختبارات طولية).
ويقترح هذا البروتوكول النهج الأصلي سهلة لعملية بديل من تعزيز المواد الهلامية الكولاجين يبني على أساس إمكانات مقلص الكامنة الطبيعية من SMCS. وتشمل التقنيات الشائعة لمصفوفات الكولاجين تعزيز استخدام وكلاء يشابك الفيزيائية والكيميائية التي يمكن أن يكون لها آثار ضارة على تفاعلات خلايا مصفوفة 18-20. تقنية تصنيع المقدمة فيهذا العمل يتيح توجيه هذه العملية إعادة مدفوعة الخلايا لانتاج بناء الأنسجة المهندسة مع الخواص الميكانيكية المستهدفة دون أي المعالجة الفيزيائية أو الكيميائية.
توصيف الخواص الميكانيكية والمواد الهلامية اللزجة الكولاجين المائية هو التحدي الكبير. في هذا المنظور، يصف هذا البروتوكول وسيلة بسيطة وفعالة الأصلي لتقييم الخواص الميكانيكية للأنسجة الرخوة الأنبوبية. هذا التوصيف يمكن القيام بها ليس فقط في الاتجاه المحيطي، ولكن أيضا في الاتجاه الطولي، مباشرة على هيكل أنبوبي كله. خلال توصيف الميكانيكية، ودرجة الحرارة، والبيئة المائية، ودرجة الحموضة والقوة الأيونية هي بعض العوامل البيئية التي هي معروفة لتؤثر بشكل كبير على السلوك الميكانيكي للالأنسجة البيولوجية 21. وبالتالي، فإن العمل الحالي يدل على وجود الأصلي انشاء وبروتوكول لتوصيف الميكانيكية من الأنسجة البيولوجية في غايةاستنساخه الزائفة الفسيولوجية البيئة (محلول ملحي في 37 ° C ودرجة الحموضة 7.4). إلى حد علمنا، لم يتم الإبلاغ عن هذا النوع من التوصيف في أماكن أخرى.
في الختام، التقنية المقترحة في هذا العمل يدل على قدرة عالية من الاختلاط المباشر للخلايا مع الكولاجين لتطبيقات هندسة الأنسجة الوعائية. هذه الطريقة مع توصيف وتبطنن عملية ميكانيكية تشكل بروتوكولات متعددة التكافؤ عالية. وبالتالي، من خلال تعديلات طفيفة من مجموعة عمليات والبروتوكولات مع الحفاظ على نفس المنطق، المتطلبات الرئيسية لهندسة الأنسجة الوعائية في حكمه ويمكن معالجة مثل معالجة سريعة وغير معقدة، بما في ذلك تبطنن، وإمكانية أن يكون نقلها إلى مجموعة واسعة من لينة الأنسجة مع مختلف الأطوال والأقطار. وعلاوة على ذلك، تختلف أنواع الخلايا الملتصقة، والبروتينات ECM وهندستها مصبوب يمكن التحقيق لعدد من تطبيق والمستهدفةإضافات، مثل الأوتار والهندسة، وترقيع الجلد، والبقع القلب والأعصاب وغيرها. على الرغم من أن الخواص الميكانيكية للبنيات مشجعة، إلا أنها لا تزال أقل من تلك الأنسجة الأصلية. في هذا السياق، ونحن نعتقد بقوة أن فترة النضج ثابتة قصيرة جدا هي خطوة حاسمة نحو تحفيز الحيوية في مفاعل حيوي، مما يؤدي إلى السلامة الهيكلية أعلى والاستقرار الميكانيكي. ومع ذلك، فإن إمكانية لإنتاج بسرعة cellularized يبني على أساس الكولاجين الأنسجة المهندسة مناسبة للأعمال الميكانيكية والنسيجية تحليلات يجعل مفاعل حيوي ثابت ووصفت الوثيقة أداة مفيدة واعدة لتوفير نظرة ثاقبة على التفاعل بين الخلايا وECM أثناء النمو وإعادة عرض، أو حتى ل أن تستخدم كنموذج لالعلاجات ونظم لتقديم الأدوية.
Disclosures
وكان في استقبال أي تمويل من منظمات أو وكالات مع تضارب محتمل في المصالح.
Acknowledgements
وقد تم تمويل هذا البحث من قبل مركز البحوث كيبيك CHU دي العلوم الطبيعية والهندسة مجلس البحوث وكندا، والمعهد الكندي للبحوث الصحية و.
Materials
| Name | Company | Catalog Number | Comments |
| CellTreat 50 ml Bio-Reaction tubes | CELLTREAT Scientific Products | 229-475 | Centrifuge tube |
| Male luer with lock ring x 1/8" hose barb. PP. 25/pk | Cole Parmer | RK-45503-04 | Luer fittings for "gas-exchange port" |
| Female luer x 1/8" hose barb adapter. PP. 25/pk | Cole Parmer | RK-45500-04 | Luer fittings for the "medium sampling port" |
| Masterflex platinum-cured silicone tubing L/S 17. 25 ft. | Cole Parmer | RK-96410-17 | Tube 1 and 2 for the gauze grippers |
| Masterflex platinum-cured silicone tubing L/S 16. 25 ft. | Cole Parmer | RK-96410-16 | Tube 3 for the gauze grippers |
| Silastic Medical adhesive silicone, type A | Dow Corning | - | Silicon glue for the fabrication of the static bioreactor |
| Polyvent 4 Vessel venting filters | Whatman | 6713-0425 | Filter for "gas exchange port" |
| Rod. PP. stirring. 8’’ | Scienceware | 377660008 | Mandrel |
| Stopper silicone rubber 00 PK12 | VWR | 59590-084 | Stopper for the insertion of the mandrel to the vented cap of the centrifuge tube |
| Krytox PFPE/PTFE Greases | Dupont | GPL 202 | Medical grade grease for covering the mandrel |
| Trypsin-EDTA (0.5%) | Gibco | 15400-054 | Cell culture |
| Xiameter RTV-4130-J base and curing agent | Dow Corning | - | C-shaped silicone support for endothelialization |
| Dulbecco’s modified Eagle medium, DMEM, high glucose, pyruvate | Gibco (Life Technology) | 11995-065 | Cell culture |
| Pure acetone (99%) | Laboratoire Mat Inc. | AP0102 | Chemical for collagen extraction |
| Isopropyl alcohol (HPLC grade, 99.9%) | Fisher Scientific | AC610080040 | Chemical for collagen extraction |
| 0.02 N acetic acid (glacial acetic acid, HPLC grade, 99%) | Fisher Scientific | FL070494 | Chemical for collagen extraction |
| Chloroform solution (99%) | Laboratoire Mat Inc. | CR 0179 | Chemical for collagen extraction |
| Hepes | Sigma-Aldrich | 163716 | Chemical for construct preparation |
| NaOH | Laboratoire Mat Inc. | SR-0169 | Chemical for construct preparation |
| LaserMike 136 | LaserMike | Series 183B | Scanning laser interferometer |
| ElectroPulse MicroTester | Instron Corporation | - | Micromechanical Tester |
| HyClone Media M199/EBSS, 500 ml | GE Healthcare Life Sciences | SH30253.01 | Component of cell culture medium |
| Fetal bovine serum HI - 500 ml | Gibco | SH 30396.03 | Component of cell culture medium |
| Porcine serum (PS) | Sigma-Aldrich | P9783 | Component of cell culture medium |
| Penicillin-Streptomicin | Gibco | 15140-122 | Component of cell culture medium |
| Phosphate buffered saline (PBS) | Fisher Scientific | BP661-50 | Saline solution |
| Tissue culture flask T17CN Vent Cap Red | Sarstedt Inc. | 83.1812.002 | Cell culture |
| ColorpHast- pH-indicator strips (pH = 6.5-10.0) | EMD | 9583 | pH measurements |
| Matrigel Basement Membrane Matrix Growth Factor Reduced, 5 ml vial | BD Biosciences - Discovery Labware | 356230 | Concentrate protein mixture for endothelialization process |
| LifeCam VX-3000 | Microsoft | - | Thickness measurement |
| Biochemical analyzer, DxC600 | Beckman Coulter Unicell Synchron | - | Glucose and lactate concentrations measurements |
| Collagen fibers | Rat tails | - | Collagen was extracted in the laboratory |
| Porcine smooth muscle cells (pSMCs) | Porcine aortas | - | pSMCs were isolated in the laboratory |
| Human umbilical vein endothelial cells (HUVECs) | Human umbilical veins | - | HUVECs were isolated in the laboratory |
References
- Kim, B. S., Nikolovski, J., Bonadio, J., Smiley, E., Mooney, D. J. Engineered smooth muscle tissues: regulating cell phenotype with the scaffold. Experimental cell research. 251, 318-328 (1999).
- Heureux, N., McAllister, T. N., de la Fuente, H. L. Tissue-engineered blood vessel for adult arterial revascularization. The New England journal of medicine. 357 (14), 1451-1453 (2007).
- Syedain, Z. H., Meier, L. A., Bjork, J. W., Lee, A., Tranquillo, R. T. Implantable arterial grafts from human fibroblasts and fibrin using a multi-graft pulsed flow-stretch bioreactor with noninvasive strength monitoring. Biomaterials. 32 (3), 714-722 (2011).
- Lee, C., Singla, A., Lee, Y. Biomedical applications of collagen. International journal of pharmaceutics. 221 (1-2), 1-22 (2001).
- Couet, F., Rajan, N., Mantovani, D. Macromolecular biomaterials for scaffold-based vascular tissue engineering. Macromolecular bioscience. 7 (5), 701-718 (2007).
- Christiansen, D. L., Huang, E. K., Silver, F. H. Assembly of type I collagen: fusion of fibril subunits and the influence of fibril diameter on mechanical properties. Matrix Biology. 19 (5), 409-420 (2000).
- Eppell, S. J., Smith, B. N., Kahn, H., Ballarini, R. Nano measurements with micro-devices: mechanical properties of hydrated collagen fibrils. Journal of the Royal Society, Interface / the Royal Society. 3 (6), 117-121 (2006).
- Lai, V. K., Lake, S. P., Frey, C. R., Tranquillo, R. T., Barocas, V. H. Mechanical behavior of collagen-fibrin co-gels reflects transition from series to parallel interactions with increasing collagen content. Journal of biomechanical engineering. 134 (1), 011004 (2012).
- Seliktar, D., Nerem, R. M., Galis, Z. S. The Role of Matrix Metalloproteinase-2 in the Remodeling of Cell-Seeded Vascular Constructs Subjected to Cyclic Strain. Annals of Biomedical Engineering. 29 (11), 923-934 (2001).
- Rajan, N., Habermehl, J., Coté, M. -. F., Doillon, C. J., Mantovani, D. Preparation of ready-to-use, storable and reconstituted type I collagen from rat tail tendon for tissue engineering applications. Nature protocols. 1 (6), 2753-2758 (2006).
- Kumar, V. A., Caves, J. M., et al. Collagen-Based Substrates with Tunable Strength for Soft Tissue Engineering. Biomaterials science. 1 (11), 1193-1202 (2013).
- Li, S., Van Den Diepstraten, C., D’Souza, S. J., Chan, B. M. C., Pickering, J. G. Vascular smooth muscle cells orchestrate the assembly of type I collagen via alpha2beta1 integrin, RhoA, and fibronectin polymerization. The American journal of pathology. 163 (3), 1045-1056 (2003).
- Badylak, S. F., Freytes, D. O., Gilbert, T. W. Extracellular matrix as a biological scaffold material: Structure and function. Acta biomaterialia. 5 (1), 1-13 (2009).
- Engbers-Buijtenhuijs, P., Buttafoco, L., et al. Biological characterisation of vascular grafts cultured in a bioreactor. Biomaterials. 27 (11), 2390-2397 (2006).
- Cheung, A. L. Isolation and culture of human umbilical vein endothelial cells (HUVEC). Current protocols in microbiology. 4, 4B (2007).
- Seifu, D. G., Purnama, A., Mequanint, K., Mantovani, D. Small-diameter vascular tissue engineering. Nature reviews. Cardiology. , (2013).
- Weinberg, C., Bell, E. A blood vessel model constructed from collagen and cultured vascular cells. Science. 231 (4736), 397-400 (1986).
- Meghezi, S., Chevallier, P., Mantovani, D. Why Mechanical Properties of Collagen Scaffolds Should Be Tested in a Pseudo-Physiological Environment. Advanced Materials Research. 409, 158-163 (2011).
- Tirella, A., Liberto, T., Ahluwalia, A. Riboflavin and collagen: New crosslinking methods to tailor the stiffness of hydrogels. Materials Letters. 74, 58-61 (2012).
- Madhavan, K., Belchenko, D., Tan, W. Roles of genipin crosslinking and biomolecule conditioning in collagen-based biopolymer: Potential for vascular media regeneration. Journal of biomedical materials research. Part A. , 16-26 (2011).
- Meghezi, S., Couet, F., Chevallier, P., Mantovani, D. Effects of a pseudophysiological environment on the elastic and viscoelastic properties of collagen gels. International journal of biomaterials. 2012, 319290 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved