A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
ميكروفلويديك Genipin ترسب تقنية للثقافة الموسعة من Micropatterned الأوعية الدموية العضلات الرقيقة
In This Article
Summary
We present a method for microfluidic deposition of patterned genipin and fibronectin on PDMS substrates, allowing extended viability of vascular smooth muscle cell-dense tissues. This tissue fabrication method is combined with previous vascular muscular thin film technology to measure vascular contractility over disease-relevant time courses.
Abstract
The chronic nature of vascular disease progression requires the development of experimental techniques that simulate physiologic and pathologic vascular behaviors on disease-relevant time scales. Previously, microcontact printing has been used to fabricate two-dimensional functional arterial mimics through patterning of extracellular matrix protein as guidance cues for tissue organization. Vascular muscular thin films utilized these mimics to assess functional contractility. However, the microcontact printing fabrication technique used typically incorporates hydrophobic PDMS substrates. As the tissue turns over the underlying extracellular matrix, new proteins must undergo a conformational change or denaturing in order to expose hydrophobic amino acid residues to the hydrophobic PDMS surfaces for attachment, resulting in altered matrix protein bioactivity, delamination, and death of the tissues.
Here, we present a microfluidic deposition technique for patterning of the crosslinker compound genipin. Genipin serves as an intermediary between patterned tissues and PDMS substrates, allowing cells to deposit newly-synthesized extracellular matrix protein onto a more hydrophilic surface and remain attached to the PDMS substrates. We also show that extracellular matrix proteins can be patterned directly onto deposited genipin, allowing dictation of engineered tissue structure. Tissues fabricated with this technique show high fidelity in both structural alignment and contractile function of vascular smooth muscle tissue in a vascular muscular thin film model. This technique can be extended using other cell types and provides the framework for future study of chronic tissue- and organ-level functionality.
Introduction
أمراض الأوعية الدموية، مثل بالتشنج الدماغي 1،2 وارتفاع ضغط الدم 3، وتصلب الشرايين 4، تتطور ببطء، هي المزمنة عادة في الطبيعة، وتنطوي على توليد قوة مختلة من قبل خلايا العضلات الملساء الوعائية (VSMCs). ونحن نهدف إلى دراسة هذه الاختلالات الأوعية الدموية بطيئة التقدم باستخدام أساليب المختبر مع تحكم أكثر دقة من الظروف التجريبية منه في في النماذج الحية. وقد وضعنا سابقا الأوعية الدموية الأغشية الرقيقة العضلات (vMTFs) لقياس انقباض وظيفية في المختبر هندستها الأنسجة القلب والأوعية الدموية 5، ولكن تم هذا الأسلوب تقتصر على الدراسات نسبيا على المدى القصير. هنا، نقدم تقنية تعديل الركيزة التي تقوم بتوسيع أسلوبنا vMTF السابقة لقياس المدى الطويل.
في حين أن البطانة هي حاسمة أيضا في وظيفة الأوعية الدموية الشاملة، المهندسة صفائح الشرايين توفير نظام نموذجا مفيدا لتقييم التغيرات في الأوعية الدمويةانقباض أثناء تطور المرض. لهندسة الأنسجة الوعائية نموذج مرض وظيفي، فإن كلا من هيكل ووظيفة الصفيحة الشرايين، وحدة مقلص الأساسية للسفينة، يجب تلخيصها مع الدقة العالية. الشرياني صفائح متحدة المركز، وصحائف الانحياز محيطي من VSMCs مقلص مفصولة ورقة من الإيلاستين 6. microcontact الطباعة من المصفوفة خارج الخلية (ECM) البروتينات على polydimethylsiloxane (PDMS) ركائز تم استخدامها سابقا لتقديم العظة التوجيه في تنظيم أنسجة لتقليد الانحياز أنسجة القلب والأوعية الدموية 5،7-10. ومع ذلك، أنسجة منقوشة باستخدام microcontact الطباعة يمكن أن تفقد سلامة بعد 3-4 أيام في الثقافة، مما يحد من إمكانية تطبيقها في الدراسات المزمنة. يوفر هذا البروتوكول إلى حل لهذه المشكلة عن طريق استبدال تقنيات microcontact الطباعة السابقة مع تقنية ترسيب ميكروفلويديك جديدة.
Genchi وآخرون. PDMS ركائز تعديل مع genipin وواوند لفترات طويلة جدوى myocytes تصل إلى شهر واحد في الثقافة 11. هنا، فإننا نستخدم نهجا مماثلا لتوسيع ثقافة خلايا العضلات الملساء الوعائية منقوشة على PDMS. Genipin، وهو مشتق حلمهي الطبيعية من الفاكهة الغردينيا، هو المرشح المرغوب فيه تعديل الركيزة نظرا لسمية منخفضة نسبيا بالمقارنة مع وكلاء يشابك مماثلة، والاستخدام المتزايد بوصفها مادة بيولوجية في مجالات إصلاح الأنسجة 12،13 وECM تعديل 14، 15. في هذا البروتوكول، ويستخدم فبرونيكتين باعتباره جديلة توجيه الخلايا، كما هو الحال في وسائل microcontact الطباعة السابقة؛ ومع ذلك، وتودع genipin على PDMS ركائز قبل فبرونيكتين الزخرفة. وهكذا، كما تتحلل خلايا المصفوفة المزخرفة، ECM تصنيعه حديثا من VSMCs المرفقة يمكن ربط المغلفة genipin PDMS الركيزة.
هذا البروتوكول يستخدم جهاز تسليم ميكروفلويديك لمن خطوتين genipin وECM الترسيب. تصميم يحاكي جهاز ميكروفلويديك microcoأنماط الطباعة ntact تستخدم لالمهندسة صفائح الشرايين في الدراسات السابقة 16. وبالتالي، فإننا نتوقع هذا البروتوكول لتسفر يقلد صفائح الدم التي تلخص بنجاح الانحياز للغاية في بنية الجسم الحي وظيفة مقلص من صفائح الشرايين. نحن أيضا تقييم انقباض الأنسجة للتأكد من أن genipin هو مناسب مجمع تعديل الركيزة على المدى الطويل في المختبر نماذج أمراض الأوعية الدموية.
Protocol
ملاحظة: إن الهدف من هذا البروتوكول هو لبناء والاستفادة من فيلم الأوعية الدموية العضلات رقيقة (vMTF) مع هيكل هو مبين في الشكل رقم 1 لتقييم انقباض خلال ثقافة ممتدة من خلايا العضلات الملساء الوعائية (VSMCs) على PDMS ركائز. لإطالة بقاء VSMC، نحن الاستفادة من genipin مجمع crosslinker. صممت ركائز لهذه vMTFs لتحليل انقباض الأنسجة كما وضعتها Grosberg وآخرون. 8 طرق أخرى vMTF 5 مايو أن تستخدم أيضا، مع بعض التغييرات الطفيفة على بروتوكول الركيزة تلفيق المقدمة.
1. الركيزة تلفيق
- تنظيف ساترة
- وضع 25 مم coverslips الزجاج قطر إلى رف ساترة تلطيخ. وضع رف في كوب أو وعاء كبير (على سبيل المثال، وهي فارغة 100 - 1000 ميكرولتر الماصة حاوية طرف).
- إضافة 70٪ من الإيثانول إلى الحاوية أن تزج تماما لل coverslips. يصوتن لمدة 30 دقيقة على الأقل.
- إزالة رف ساترة من الحل الايثانول. السماح لل coverslips الهواء الجاف شنقا رف في غطاء الثقافة العقيمة (لمنع تراكم الجسيمات coverslips على) ل1- 2 ساعة.
ملاحظة: يجب أن يكون لل coverslips يجف تماما قبل الخطوات التالية.
- بولي (N-ISO-propylacrylamide) عزل (PIPAAm) قطاع على ساترة
- باستخدام شريط لاصق، شريط من الجانبين من ساترة تنظيفها، ترك الشريط يتعرض تركز على ساترة (الشكل 1A). تعديل عرض هذا الشريط يتعرض بناء على طلب و / أو تصميم ميكروفلويديك.
- علامة حواف شرائط الشريط على ساترة باستخدام علامة مختبر للرجوع إليها فيما بعد (الشكل 1A).
- قطع حول محيط ساترة لإطلاق سراح من الطبق (الشكل 1A، الخط الأحمر المنقط).
- بولي (N-ISO-propylacrylamide) (PIPAAm) طلاء
- باستخدام ميزان تحليلي، تزن 1 غرام من PIPAAm مسحوق. لا تستخدم unpolymerized N-ISO-propylacrylamide، وهو مادة مسرطنة.
- نقل PIPAAm إلى أنبوب الطرد المركزي 50 مل. إضافة 10 مل من 1-بيوتانول داخل غطاء الكيميائية لانتاج 10٪ ث / ت حل. تنبيه: نقطة وميض من 1-بيوتانول هي 37 درجة مئوية. تخزين الحل مما أدى إلى مجلس الوزراء قابلة للاشتعال، وتجنب التدفئة.
- السماح للPIPAAm بحل لمدة 10 دقيقة. إذا مسحوق لا تزال واضحة، مزيج الحل باستخدام خلاط دوامة حتى يذوب كل مسحوق.
ملاحظة: تتطلب الخطوات التالية استخدام المغطي تدور. لكل ساترة: - وضع ساترة مسجلة على تشوك تدور المغطي بالملقط.
- نقل 150 ميكرولتر من محلول PIPAAm على ساترة عن طريق وضع قطرات على الزجاج يتعرض في وسط ساترة. ضمان تغطية كاملة للمنطقة عرضة للخطر.
- معطف تدور PIPAAm استخدام الوصفة التالية:
- المنحدر 10 ثانية إلى 3000 دورة في الدقيقة. يسكن لمدة 5 ثانية.
- منحدر 10 ثانية إلى 6،000 دورة في الدقيقة. يسكن لمدة 60 ثانية.
- المنحدر 10 ثانية إلى 3000 دورة في الدقيقة. يسكن لمدة 5 ثانية.
- وضع ساترة في طبق بتري مغطاة PIPAAm مواجهة. السماح للهواء الجاف لمدة 15 دقيقة على الأقل.
- إزالة بعناية شريط لاصق من جميع coverslips، وترك ساترة الكاملة يتعرض مع طبقة رقيقة من طلاء PIPAAm في قطاع الوسط.
- PDMS الطلاء
- خلط وديغا 15 غرام من PDMS في 10: 1 قاعدة: نسبة crosslinker. إضافة 7-8 قطرات من sonicated 0.2 ميكرون بلي الفلورسنت قبل الخلط. تغطية كأس PDMS مع رقائق الألومنيوم عندما لا تكون قيد الاستعمال لمنع الغبار والجزيئات الأخرى من تلويث PDMS.
ملاحظة: تتطلب الخطوات التالية استخدام المغطي تدور. لكل ساترة: - وضع ساترة PIPAAm المغلفة على تشوك تدور المغطي بالملقط.
- نقل PDMS على ساترة، التي تغطي ثلث على الأقل من منطقة ساترة.
- معطف تدور باستخدام رجب التاليةه:
- المنحدر 5 ثانية إلى 500 دورة في الدقيقة. يسكن 5 ثانية.
- المنحدر 5 ثانية إلى 1000 دورة في الدقيقة. يسكن 5 ثانية.
- المنحدر 10 ثانية إلى 3000 دورة في الدقيقة. يسكن 10 ثانية.
- المنحدر 10 ثانية إلى 4000 دورة في الدقيقة. يسكن 60 ثانية.
- المنحدر 10 ثانية إلى 2000 دورة في الدقيقة. يسكن 15 ثانية.
- المنحدر 10 ثانية إلى 1000 دورة في الدقيقة. يسكن 10 ثانية.
- المنحدر 5 ثانية إلى 500 دورة في الدقيقة. يسكن 5 ثانية.
- وضع ساترة في طبق بتري مغطاة PDMS مواجهة. تسجيل الوقت عندما كانت ساترة تدور المغلفة. تتبع الوقت المرتبطة بكل ساترة في كافة مراحل التجربة لاستخدامها لاحقا في تحديد سمك الركيزة PDMS.
- وضع طبق بتري تحتوي لل coverslips في C الفرن 90 درجة لمدة لا تقل عن 1.5 ساعة لضمان علاج PDMS السليم. إذا كان الفرن غير متوفر، والسماح لل coverslips علاج للا يقل عن 48 ساعة على RT.
- إزالة لل coverslips من الفرن وتخزينها في درج مظلم حتى جاهزة للاستخدام.
- جانبا كل ساترة و الرابعةأو قياس لاحق من سمك الركيزة، بوصفها وظيفة من الزمن تدور طلاء، مع profilometer.
- خلط وديغا 15 غرام من PDMS في 10: 1 قاعدة: نسبة crosslinker. إضافة 7-8 قطرات من sonicated 0.2 ميكرون بلي الفلورسنت قبل الخلط. تغطية كأس PDMS مع رقائق الألومنيوم عندما لا تكون قيد الاستعمال لمنع الغبار والجزيئات الأخرى من تلويث PDMS.
2. الزخرفة ميكروفلويديك لأنسجة الهندسة
- تصنيع الأجهزة ميكروفلويديك
- تصميم الأنسجة الضوئية الرئيسية ميكروفلويديك
- استخدام أي برنامج مناسب التصميم بمساعدة الكمبيوتر لتصميم أنماط ميكروفلويديك. لصفائح الشرايين تتكون من الشريان الحبل السري خلايا العضلات الملساء الوعائية الإنسان، استخدام نمط بالتناوب من 10 ميكرون القنوات مع 10 ميكرون الجدران.
- استخدام قناة ثنائية التفرع إذا كان ذلك ممكنا 17، ولكن يمكن استخدام تصاميم المتفرعة الأخرى. إنقاص عرض وطول قنوات لكل التكرار المتفرعة حتى تحقيق نمط النسيج المطلوب تباعد (الجدران والقنوات، والشكل 1B).
- تصميم الجهاز ليكون لها مدخل واحد لمعالجة السطوح حل التنسيب ومنفذ واحد لتطبيق فراغ.
- فابricate الضوئية الرئيسية التي تحتوي على تصميم ميكروفلويديك (ق)، كما هو موضح سابقا (18).
- الطباعة التصويرية تصنيع الشرائح
ملاحظة: إجراء ضوئيه في غرف الأبحاث مناسبة أو منشأة مماثلة. لجعل رقائق السليكون مع أنماط لتصنيع معدني ناعم من الأجهزة ميكروفلويديك النسيج (~ 20 - 25 ميكرون ارتفاع قناة) باستخدام ضوئيه:- تنظيف رقاقة السيليكون في الأسيتون، والميثانول، وايزوبروبيل لمدة 1 دقيقة لكل منهما. تجفيف رقاقة بمسدس النيتروجين.
- Prebake الرقاقة على طبق ساخن لمدة 5 دقائق عند 115 درجة مئوية لإزالة الرطوبة الزائدة.
- معطف تدور الرقاقة مع SU-8 3025 مقاومة للضوء باستخدام الوصفة التالية لانتاج يتميز 20-25 ميكرومتر في الطول:
- المنحدر 5 ثانية إلى 500 دورة في الدقيقة. يسكن 5 ثانية.
- المنحدر 15 ثانية إلى 4000 دورة في الدقيقة. يسكن 15 ثانية.
- خبز لينة الرقاقة على طبق ساخن في درجة حرارة 95 درجة مئوية لمدة 15 دقيقة.
- تحميل الضوئية الرئيسية، وفضح ركان يفر لمدة 16 ثانية باستخدام برنامج فراغ الاتصال على اليجنر قناع للإتصال به.
- خبز الصعب الرقاقة على طبق ساخن في درجة حرارة 95 درجة مئوية لمدة 4 دقائق.
- تطوير رقاقة لمدة 6 دقائق في المطور. ثم، وغسل الرقاقة مرتين لمدة 2 ثانية في المطور الطازجة وشطف الرقاقة مع ايزوبروبيل.
- Silanate على نمط رقاقة O / N عن طريق وضع 2-3 قطرات من tridecafluoro-trichlorosilane في طبق فارغ داخل مجفف فراغ. دعم الرقاقة حتى باستخدام أطباق بتري بحيث يتعرض كل من الجزء السفلي والعلوي من الرقاقة.
تنبيه: Tridecafluro-trichlorosilane هو سائل قابل للاشتعال والتآكل. معدات الوقاية الشخصية المناسبة والعادم المحلي ضرورية للاستخدام.
- الأنسجة جهاز ميكروفلويديك تلفيق
- وضع silanated، نمط ويفر من جانب ميزة حتى في طبق بيتري.
- خلط وديغا 100 غرام من PDMS مع 10: 1 قاعدة: نسبة crosslinker. صب PDMS في طبق، تماما وبشكل متساو تغطي الرقاقة.
- وضع الطبق في مجفف فراغ حتى تتم إزالة جميع فقاعات الهواء من PDMS غير مخمر، ما يقرب من 30 دقيقة. علاج PDMS في الطبق عند 90 درجة مئوية لمدة لا تقل عن 1.5 ساعة. الوقت ودرجة الحرارة يمكن تعديلها وفقا لما تمليه المبادئ التوجيهية تصنيع للحصول على الشفاء التام.
- بمجرد الشفاء من PDMS قطع، خارج PDMS حول رقاقة بشفرة حلاقة والافراج بعناية ويفر مغطى PDMS-من الطبق. إزالة PDMS الزائدة تحت رقاقة وقشر ببطء PDMS بعيدا عن الجزء العلوي من الرقاقة.
- ضع القرص PDMS جانب الميزة حتى في صحن نظيف وتخزين ويفر بعيدا عن الضوء بعد الاستعمال.
- خفض بعيدا PDMS الزائدة من جميع أنحاء أنماط باستخدام شفرة حلاقة. أجهزة يقتطع الأشكال المستطيلة (الشكل 1C) لتخفيف تقشير الجهاز من ركائز في خطوات لاحقة. تخفيضات دقيقة ليست ضرورية، ما دام وجود مساحة وافرة للمدخل، مخرج، ومنطقة نمط النسيج (الشكل 1C).
- لكمةمدخل ومخرج الثقوب (الشكل 1C) باستخدام 1 ملم خزعة جراحية لكمة.
- تصميم الأنسجة الضوئية الرئيسية ميكروفلويديك
- ميكروفلويديك ترسب الأجهزة
ملاحظة: في هذا البروتوكول، ويستخدم تسليم ميكروفلويديك لإيداع genipin منقوشة، وكيل يشابك رئيسيا لزراعة الأنسجة على المدى الطويل، وكذلك فبرونيكتين. الخطوات السابقة للتعقيم البنسلين / الستربتومايسين (2.2.3) لا بد من أن يجري في ظروف معقمة، ولكن تشجيع الحد من التلوث والغبار جمع في جميع أنحاء البروتوكول. وينبغي لجميع الخطوات التي تحدث بعد التعقيم ساترة مع البنسلين / الستربتومايسين (2.2.3) تستخدم تقنية معقمة. ملاحظة: يجب تشغيل هذا الجزء من البروتوكول يوم واحد قبل البذر الخلية.- الركيزة وميكروفلويديك جهاز تحضير
- يصوتن الأجهزة ميكروفلويديك في الايثانول 70٪ لمدة 30 دقيقة على الأقل.
- تجفيف الأجهزة ميكروفلويديك sonicated باستخدام الهواء المضغوط أو النيتروجين، ووضعها في طبق بيتري وايقناة ال ملامح الوجه لأعلى لمنع ارتداء لا لزوم له على الميزات.
- وضع ما يصل إلى 10 vMTF coverslips الركيزة في نظافة UVO (إزالة الغطاء على الطبق بحيث يتم functionalized السطح) لمدة 8 دقائق.
- إزالة لل coverslips UVO المعاملة، ووضع أجهزة ميكروفلويديك جانب ميزة أسفل على كل زلة واحدة في وقت واحد (يجب أن يكون التوجه مشابهة للشكل 1C). اضغط لأسفل بشدة على الأجهزة لضمان وجود ختم ضيق إلى المغلفة PDMS-coverslips.
- ترسب Genipin وفيبرونكتين]
- إعداد 5 ملغ / مل حل genipin عن طريق إضافة 1 مل من ده العقيمة 2 O إلى حاوية 5 ملغ من genipin مجفف بالتجميد. مزيج الحل باستخدام خلاط دوامة. جانبا في RT لمدة 30 دقيقة على الأقل.
ملاحظة: مسحوق من الصعب إذابة في RT، خلط تكرار ذلك لدقيقة على الأقل هو غالبا ما يكون ضروريا. - بسرعة، ضع قطرة من الايثانول 70٪ عند مدخل كل جهاز لفتيلة الجهاز. ملاحظة: ETHأنول يجب الفتيل من خلال الأجهزة.
- بعد 5-10 دقائق، ونضح بعناية الايثانول الزائد عند مدخل، والاستعاضة عنها فورا مع الفوسفات 1X مخزنة المالحة (PBS) في مدخل. من هذه النقطة إلى الأمام، ومن المؤكد أن لا تسمح مدخل لتصبح جافة تماما لتجنب إدخال الهواء إلى الجهاز.
- وضع تلميح فراغ الشافطة عند مخرج كل جهاز. رسم 1X PBS من خلال أجهزة لشطف الإيثانول بعيدا. ترك كمية صغيرة من 1X PBS عند مدخل. ملاحظة: إذا ظهر مدخل الجاف تقريبا، إضافة المزيد من 1X PBS.
- نضح الزائد 1X PBS بحيث لا يبقى سوى كمية صغيرة عند مدخل قبل تطبيق حل genipin.
- وضع 60 ميكرولتر من 5 ملغ / مل حل genipin في كل مدخل (1D الشكل). رسم الحل genipin من خلال الأجهزة عن طريق وضع الشافطة طرف فراغ عند مخرج (1D الشكل). تأكد من عدم رسم كل من الحل من خلال ترك كمية صغيرة من محلول عند مدخل.
- قطرات مكان (ما يقرب من عشرة سنتات الحجم) من 1X PBS في كل من مدخل ومخرج للحفاظ على ترطيب أثناء الحضانة. نقل صحن يحتوي على أجهزة للفرن مرطب أو الحاضنة (بيئة معقمة ليست ضرورية) لتعيين 37 ° C، واحتضان لمدة 4 ساعات. لا يحتاج الطبق المراد تغطيتها.
- خلال فترة الحضانة، و resuspend فبرونيكتين إلى تركيز 50 ميكروغرام / مل في العقيمة ده 2 O على الجليد لمدة 30 دقيقة على الأقل قبل تطبيق لجهاز ميكروفلويديك.
- بعد حضانة genipin، ونضح كل ما تبقى من 1X PBS في منافذ الجهاز. الاستمرار في تطبيق الشافطة فراغ في كل منفذ الجهاز، وسحب من خلال 1X PBS المتبقية في مدخل.
- وضع 100 ميكرولتر من 50 ميكروغرام / مل حل فبرونيكتين في كل مدخل، إضافة إلى الحد الأدنى المتبقي من 1X PBS في مدخل (1D الشكل).
- رسم الحل فبرونيكتين من خلال الأجهزة التي تستخدم تلميح فراغ الشافطة عند مخرج ( الشكل 1D). ومن المؤكد أن لا يوجه كل من الحل من خلال. ملاحظة: سوف انخفاض فبرونيكتين تبدو مختلفة من 1X PBS وgenipin بسبب الاختلافات في التوتر السطحي.
- نقل طبق كشف تحتوي على أجهزة لفرن أو مجموعة حاضنة إلى 37 درجة مئوية، واحتضان لمدة 24 ساعة. ملاحظة: لا يتطلب خطوة فبرونيكتين ترطيب مدخل ومخرج مع 1X PBS. سوف تجمع ما تبقى من فبرونيكتين في مدخل تجف. ومن المتوقع هذا.
- إعداد 5 ملغ / مل حل genipin عن طريق إضافة 1 مل من ده العقيمة 2 O إلى حاوية 5 ملغ من genipin مجفف بالتجميد. مزيج الحل باستخدام خلاط دوامة. جانبا في RT لمدة 30 دقيقة على الأقل.
- التعقيم والتحضير للالبذر الخلية
- إعداد محلول البنسلين / الستربتومايسين لتعقيم coverslips vMTF منقوشة. إضافة 5 مل من البنسلين / الستربتومايسين (10000 وحدة / مل؛ 10000 ميكروغرام / مل) إلى 500 مل من العقيمة 1X PBS.
- ضع صحن يحتوي على الأجهزة في غطاء العقيمة السلامة الأحيائية.
- إزالة بعناية الأجهزة من لل coverslips عن طريق تقشير ببطء الجهاز في الزاوية، في حين استيعاب برفق ساترة في الجانب المعاكس.ملاحظة: تتطلب هذه الخطوة عمليا للحد من الأضرار ساترة في عملية الإزالة. بديل يستخدم حقنة لحقن 1X PBS عند مدخل و / أو منفذ للمساعدة في الافراج عن الجهاز.
- ضع لل coverslips في أطباق ستة جيدا العقيمة. إضافة لا يقل عن 5 مل من محلول البنسلين / الستربتومايسين إلى كل بئر. ضع الأطباق في الحاضنة معقمة عند 37 درجة مئوية لمدة 30 دقيقة على الأقل.
- بعد التعقيم، ونضح الحل البنسلين / الستربتومايسين، والبذور لل coverslips مع مثقف الشريان السري الأوعية الدموية cells19 العضلات الملساء البشرية (1D الشكل). تركيز البذر لVSMCs هو ~ 80000 خلية لكل سم 2. للحد من عدد من الخلايا اللازمة لكل عينة، استخدم المخفض للتقليل من منطقة البذر. مثال واحد من المخفض هو أعلى قطع من أنبوب مخروطي 15 مل تعلق على ساترة العقيمة مع الشحوم فراغ قبل البذر.
- لاحتضان coverslips المصنفة في حاضنة معقمة عند 37 درجة مئوية و 5٪ CO 2 وتسمح للخلايا المصنفة إرفاق وتشكل الانحياز الشرايين يقلد صفاحات O / N (الشكل 2A-B).
- على المدى الطويل vMTF زراعة الأنسجة
- بعد يوم واحد من البذر، وإزالة الخلايا المتوسطة ومخفضات. شطف الأنسجة مع 1X PBS. إضافة 4 مل من مصل خالية المتوسطة خلية للحث على النمط الظاهري مقلص في VSMCs 20.
- تكرار شطف 1X PBS وإضافة جديدة المتوسطة مجانا المصل كل يوم كما هو مطلوب للثقافة على المدى الطويل.
- الركيزة وميكروفلويديك جهاز تحضير
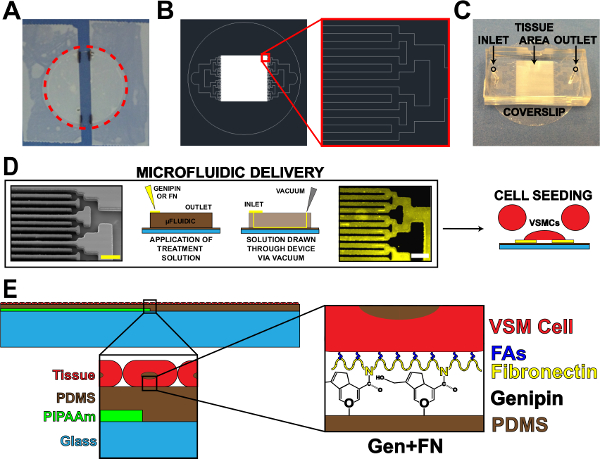
الشكل 1. ميكروفلويديك البروتين تسليم الأجهزة. (A) مسجلة خارج ساترة لPIPAAm الطلاء. الحمراء المنقطة الدائرة: قطع الطريق للافراج عن ساترة (B) الممثل رسم أوتوكاد من نسيج نمط قناع ميكروفلويديك. أقحم: التفاصيل من التفرع الثنائي لalternأثناء التشغيل 10 ميكرون × 10 ميكرون نمط النسيج. (C) تنسيب الجهاز ميكروفلويديك على ركيزة ساترة مع مدخل ومخرج المشار إليها. (D) رسم تخطيطي للميكروفلويديك الزخرفة البروتين والتسليم. من اليسار إلى اليمين: صورة مجهر المسح الإلكتروني للقنوات ميكروفلويديك (شريط النطاق: 50 ميكرون). التخطيطي مفصل لطريقة لترسب البروتين. المناعية الملون فبرونيكتين (شريط النطاق: 50 ميكرون). البذر الخلية مع خلايا العضلات الملساء في الأوعية الدموية. (E) تخطيطي من الأنسجة ملفقة. 1 ش أقحم: التفاصيل من بناء الطبقات. 2 الثانية أقحم: تفاصيل التعديل genipin من PDMS الركيزة بعد الترسيب ميكروفلويديك. © IOP النشر. مستنسخة و / أو تعديل بإذن. جميع الحقوق محفوظة. 19 اضغط هنا لمشاهدة نسخة أكبر من هذا الرقم.
تحليل وظيفة 3. الأنسجة مع vMTF انقباض الفحص
ملاحظة: على غرار الفحص MTF انقباض المقدمة هنا بعد هذه التقنية المتقدمة في Grosberg آخرون 8.
- vMTF انقباض التجربة
- وضع عينة الأنسجة في طبق 100 ملم. إضافة solution8 العقيمة 1X تايرود في درجة الحموضة 7.4 درجة حرارة 37 ° C لتغطية العينة.
- استخدام شفرة حلاقة لإجراء عدة تخفيضات موازية عمودي على حافة PIPAAm. جعل التخفيضات بطريقة يمكن أن ينتج أقسام الأنسجة أوسع من شأنها أن تكون vMTFs (مع عرض ~ 2 مم) بالتناوب مع شرائح رقيقة (الشكل 3A، تخفيضات الجانب). لإجراء تخفيضات نظيفة، ضع شفرة حلاقة في اتصال مع عينة واسحب بقوة إلى الجانب.
- وتناوب على طبق 90 ° وجعل اثنين من التخفيضات على التوالي، موازية في منتصف الأنسجة، بالتوازي مع شريط من PIPAAm (الشكل 3A، تخفيضات النهاية). إزالة والتخلص من الشريط فضفاض من النسيج بين هذه القطعالصورة وشرائح رقيقة بين vMTFs (قطع في الخطوة السابقة) لمنع الأفلام المجاورة من إجراء اتصالات.
- السماح للعينة للراحة في RT لمدة 10 دقيقة، أو حتى كل ما حل PIPAAm. ملاحظة: إذا كان لا يزال PIPAAm في الخطوات المقبلة، قد يتم إرجاع عينة على طبق القطع بحل PIPAAm المتبقية. A كشط لطيف من الجانب السفلي من vMTF يمكن أن تساعد في إزالة PIPAAm، حسب الحاجة.
- وضع نقطة صغيرة من الشحوم فراغ في نظيفة طبق بيتري 35 ملم. إضافة 5 مل من محلول جديد، معقم 1X تايرود عند 37 درجة مئوية. نقل ساترة مع قطع فيلما من 100 مم طبق إلى 35 مم طبق، ثم اضغط على الشحوم فراغ لمنع حركة ساترة.
- وضع الطبق في منصة التحكم في درجة حرارته على المسرح stereomicroscope.
- القبض على مرور الزمن المنقولة والصور ضوء الفلورسنت على فترات المطلوب (على سبيل المثال، 30 ثانية) في جميع أنحاء فحص العلاج.
- متسلسل علاج vMTFs مع 50 نانومتر endothelin-1 لمدة 20 دقيقة (الانكماش الناجم) و 100 ميكرومتر HA-1077 لمدة 30 دقيقة (استرخاء الأنسجة). إضافة حلول مركزة من كل معاملة على طبق تجريبية تحتوي على 5 مل من محلول معقم 1X تايرود في نقطة زمنية معينة، مما أسفر عن تركيز العلاج المطلوب في حجم 5 مل. جعل الإضافات العلاج خلال الفترة الفاصلة بين عمليات الاستحواذ صورة مرور الزمن لتجنب التقاط ماصة في الصور.
- vMTF تحليل انقباض
- باستخدام coverslips جانبا في 1.4.8، وقياس سمك PDMS الركيزة مع profilometer21. إنشاء سمك مقابل منحنى الوقت تدور لكل مجموعة من coverslips. استخدام هذا المنحنى لتقدير سمك vMTF لكل ساترة المستخدمة في التجربة انقباض.
- قياس أطوال إسقاط vMTF عن كل نقطة زمنية خلال التجربة، وحساب نصف قطر المصاحبة للانحناء (الشكل 3B) باستخدام أساليب ذكرت سابقا 8.
- حساب vMTF الإجهاد في كل ص الوقتكثافة العمليات باستخدام أساليب vMTF السابقة 5.
ملاحظة: استخدام سمك vMTF المحسوب من 3.2.1. قياس سمك VSMC باستخدام الصور مبائر، كما ذكرت سابقا 9. الحصول على معامل PDMS يونغ من صحائف بيانات الشركة.
النتائج
كان الهدف الأساسي من هذا العمل لتمديد بقاء VSMCs micropatterned على PDMS ركائز مسعور. وقد تحقق ذلك من خلال دمج نظام تسليم ميكروفلويديك لإيداع genipin نمط وفبرونيكتين على PDMS (الشكل 1). ترسب البروتينات ECM باستخدام تسليم ميكروفلويديك أسفرت عن نقل عالية الدقة من نمط قناة مع PDMS ا?...
Discussion
هنا، نقدم البروتوكول الذي يبني على التكنولوجيا vMTF التي سبق وضعها، مما يسمح مرات التجربة الممتدة أكثر نموذجية من مسارات مرض الأوعية الدموية المزمنة 1،23،24. لتحقيق ذلك، ونحن micropattern genipin، التي سبق أن ثبت أن توفير functionalization على المدى الطويل من ركائز PDMS 11، وذلك ...
Disclosures
The authors have nothing to disclose.
Acknowledgements
We acknowledge financial support from the American Heart Association Scientist Development Grant, 13SDG14670062 (PWA) and the University of Minnesota Doctoral Dissertation Fellowship (ESH). We also acknowledge the microfabrication resources of the Minnesota Nano Center (MNC) and the image processing resources of the University Imaging Centers (UIC), both at the University of Minnesota. Parts of this work were carried out in the Characterization Facility, University of Minnesota, which receives partial support from NSF through the MRS program.
Materials
| Name | Company | Catalog Number | Comments |
| Coverslip staining rack | Electron Microscopy Sciences | www.emsdiasum.com/ | 72239-04 |
| Microscope cover glass - 25 mm | Fisher Scientific, Inc. | www.fishersci.com | 12-545-102 |
| Poly(N-iso-propylacrylamide) (PIPAAm) | Polysciences, Inc. | www.polysciences.com/ | #21458 |
| 1-butanol | Sigma-Aldrich | www.sigmaaldrich.com | 360465 |
| Spincoater | Specialty Coating Systems, Inc. | www.scscoatings.com | |
| Polydimethylsiloxane (PDMS) | Ellsworth Adhesives (Dow Corning) | www.ellsworth.com | 184 SIL ELAST KIT 0.5KG |
| Fluorescent microbeads | Polysciences, Inc. | www.polysciences.com/ | 17151 |
| Silicon wafers | Wafer World, Inc. | www.waferworld.com | 2398 |
| Photoresist | MicroChem Corp. | www.microchem.com | |
| Contact mask aligner | Suss MicroTec | www.suss.com | |
| Developer | MicroChem Corp. | www.microchem.com | |
| Tridecafluro-trichlorosilane | UCT Specialties, Inc. | www.unitedchem.com | T2492 |
| Surgical biopsy punch | Integra LifeSciences Corp. | www.miltex.com | 33-31AA-P/25 |
| Genipin | Cayman Chemical | www.caymanchem.com | 10010622 |
| 1X phosphate buffered saline | Mediatech, Inc. | www.cellgro.com | 21-031-CV |
| Fibronectin | Corning, Inc. | www.corning.com | 356008 |
| Penicillin/streptomycin | Life Technologies, Inc. | www.lifetechnologies.com | 15140-122 |
| Umbillical artery smooth muscle cells | Lonza | www.lonza.com | CC-2579 |
| Tyrode's solution components | Sigma-Aldrich | www.sigmaaldrich.com | various |
| Stereomicroscope | Zeiss | www.zeiss.com | 4350020000000000 |
| Temperature-controlled platform | Warner Instruments | www.warneronline.com | 641659; 640352; 641922 |
| Endothelin-1 | Sigma-Aldrich | www.sigmaaldrich.com | E7764-50UG |
| HA-1077 | Sigma-Aldrich | www.sigmaaldrich.com | H139-10MG |
References
- Humphrey, J. D., Baek, S., Niklason, L. E. Biochemomechanics of cerebral vasospasm and its resolution: I. A new hypothesis and theoretical framework. Ann. Biomed. Eng. 35, 1485-1497 (2007).
- Hald, E. S., Alford, P. W. Smooth muscle phenotype switching in blast traumatic brain injury-induced cerebral vasospasm. Transl. Stroke Res. 5, 385-393 (2014).
- Olivetti, G., Anversa, P., Melissari, M., Loud, A. V. Morphometry of medial hypertrophy in the rat thoracic aorta. Lab. Invest. 42, 559-565 (1980).
- , Atherosclerosis. Nature. 407, 233-241 (2000).
- Alford, P. W., Feinberg, A. W., Sheehy, S. P., Parker, K. K. Biohybrid thin films for measuring contractility in engineered cardiovascular muscle. Biomaterials. 31, 3613-3621 (2010).
- Rhodin, J. A. G., ed, B. e. r. n. e. ,. R. .. ,. Architecture of the vessel wall. Physiol. Rev. , (1979).
- Balachandran, K., et al. Cyclic strain induces dual-mode endothelial-mesenchymal transformation of the cardiac valve. Proc. Natl. Acad. Sci. U. S. A. 108, 19943-19948 (2011).
- Grosberg, A., Alford, P. W., McCain, M. L., Parker, K. K. Ensembles of engineered cardiac tissues for physiological and pharmacological study: heart on a chip. 11, 4165-4173 (2011).
- Alford, P. W., Nesmith, A. P., Seywerd, J. N., Grosberg, A., Parker, K. K. Vascular smooth muscle contractility depends on cell shape. Integr. Biol. (Camb). 3, 1063-1070 (2011).
- Win, Z., et al. Smooth muscle architecture within cell-dense vascular tissues influences functional contractility). Integr. Biol. (Camb). , (2014).
- Genchi, G. G., et al. Bio/non-bio interfaces: a straightforward method for obtaining long term PDMS/muscle cell biohybrid constructs). Colloid Surface B. 105, 144-151 (2013).
- Fessel, G., Cadby, J., Wunderli, S., van Weeren, R., Snedeker, J. G. Dose- and time-dependent effects of genipin crosslinking on cell viability and tissue mechanics - Toward clinical application for tendon repair. Acta Biomater. , (2013).
- Lima, E. G., et al. Genipin enhances the mechanical properties of tissue-engineered cartilage and protects against inflammatory degradation when used as a medium supplement. J. Biomed. Mater. Res. A. 91, 692-700 (2009).
- Madhavan, K., Belchenko, D., Tan, W. Roles of genipin crosslinking and biomolecule conditioning in collagen-based biopolymer: Potential for vascular media regeneration. J. Biomed. Mater. Res. A. , (2011).
- Satyam, A., Subramanian, G. S., Raghunath, M., Pandit, A., Zeugolis, D. I. In vitro evaluation of Ficoll-enriched and genipin-stabilised collagen scaffolds. J. Tissue Eng. Regen. Med. , (2012).
- Alford, P. W., et al. Blast-induced phenotypic switching in cerebral vasospasm. Proc. Natl. Acad. Sci. U. S. A. 108, 12705-12710 (2011).
- Song, H., Tice, J. D., Ismagilov, R. F. A microfluidic system for controlling reaction networks in time. Angew. Chem. Int. Ed. Engl. 42, 768-772 (2003).
- Whitesides, G. M., Ostuni, E., Takayama, S., Jiang, X., Ingber, D. E. Soft lithography in biology and biochemistry. Annu. Rev. Biomed. Eng. 3, 335-373 (2001).
- Hald, E. S., Steucke, K. E., Reeves, J. A., Win, Z., Alford, P. W. Long-term vascular contractility assay using genipin-modified muscular thin films. Biofabrication. 6, 045005 (2014).
- Han, M., Wen, J. K., Zheng, B., Cheng, Y., Zhang, C. Serum deprivation results in redifferentiation of human umbilical vascular smooth muscle cells. Am. J. Physiol. Cell Physiol. 291, C50-C58 (2006).
- Feinberg, A. W., et al. Muscular thin films for building actuators and powering devices. Science. 317, 1366-1370 (2007).
- Volfson, D., Cookson, S., Hasty, J., Tsimring, L. S. Biomechanical ordering of dense cell populations. Proc. Natl. Acad. Sci. U. S. A. 105, 15346-15351 (2008).
- Intengan, H. D., Schiffrin, E. L. Vascular remodeling in hypertension: roles of apoptosis, inflammation, and fibrosis. Hypertension. 38, 581-587 (2001).
- Kayembe, K. N., Sasahara, M., Hazama, F. Cerebral aneurysms and variations in the circle of Willis. Stroke. 15, 846-850 (1984).
- McCain, M. L., Agarwal, A., Nesmith, H. W., Nesmith, A. P., Parker, K. K. Micromolded gelatin hydrogels for extended culture of engineered cardiac tissues. Biomaterials. 35, 5462-5471 (2014).
- Weir, B., Grace, M., Hansen, J., Rothberg, C. Time course of vasospasm in man. 48, 173-178 (1978).
- McCain, M. L., Sheehy, S. P., Grosberg, A., Goss, J. A., Parker, K. K. Recapitulating maladaptive, multiscale remodeling of failing myocardium on a chip. Proc. Natl. Acad. Sci. U. S. A. 110, 9770-9775 (2013).
- Agarwal, A., Goss, J. A., Cho, A., McCain, M. L., Parker, K. K. Microfluidic heart on a chip for higher throughput pharmacological studies. Lab. Chip. 13, 3599-3608 (2013).
- Huh, D., Torisawa, Y. S., Hamilton, G. A., Kim, H. J., Ingber, D. E. Microengineered physiological biomimicry: organs-on-chips. Lab. Chip. 12, 2156-2164 (2012).
- Meer, A. D., van den Berg, A. Organs-on-chips: breaking the in vitro impasse. Integr. Biol. (Camb). 4, 461-470 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved