A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
جدوى Bioprinted الخلوية التركيبات باستخدام طابعة ثلاثة الديكارتية موزع
In This Article
Summary
A Cartesian bioprinter was designed and fabricated to allow multi-material deposition in precise, reproducible geometries, while also allowing control of environmental factors. Utilizing the three-dimensional bioprinter, complex and viable constructs may be printed and easily reproduced.
Abstract
Tissue engineering has centralized its focus on the construction of replacements for non-functional or damaged tissue. The utilization of three-dimensional bioprinting in tissue engineering has generated new methods for the printing of cells and matrix to fabricate biomimetic tissue constructs. The solid freeform fabrication (SFF) method developed for three-dimensional bioprinting uses an additive manufacturing approach by depositing droplets of cells and hydrogels in a layer-by-layer fashion. Bioprinting fabrication is dependent on the specific placement of biological materials into three-dimensional architectures, and the printed constructs should closely mimic the complex organization of cells and extracellular matrices in native tissue. This paper highlights the use of the Palmetto Printer, a Cartesian bioprinter, as well as the process of producing spatially organized, viable constructs while simultaneously allowing control of environmental factors. This methodology utilizes computer-aided design and computer-aided manufacturing to produce these specific and complex geometries. Finally, this approach allows for the reproducible production of fabricated constructs optimized by controllable printing parameters.
Introduction
يستخدم هندسة الأنسجة مبادئ علم الأحياء والهندسة في تطوير بدائل وظيفية للحفاظ على، استعادة أو تعزيز النسيج الأم و. القدرة على توليد بنيات المحاكاة البيولوجية ثلاثية الأبعاد عند الطلب من شأنه أن ييسر التقدم العلمي والتكنولوجي في هندسة الأنسجة وكذلك في أجهزة الاستشعار المعتمدة على الخلايا المخدرات / فحص السمية، والأنسجة أو الورم النماذج، وغيرها. المنظمة ثلاثية الأبعاد للبنيات الأنسجة المهندسة هو عنصر أساسي من أسلوب تلفيق لأنه يجب أن تحاكي بشكل وثيق التفاعل المنظم للغاية من الخلايا والمصفوفة خارج الخلية في الأنسجة الأصلية.
السقالات ثلاثية الأبعاد القابلة للتحلل والتي تشكل شكل من العوامل الحاسمة في توليد بنيات الأنسجة الجديدة لأن الخلايا تهاجر لتشكيل طبقة ثنائية الأبعاد من الخلايا، ولكنها تفتقر إلى القدرة على النمو في فضل ثلاثي الأبعاد. تخدم سقالة كأساس مؤقت للخليةالمرفقات والانتشار، لذلك يجب أن تبنى من مواد ذات المسامية السيطرة عليها والتحلل البيولوجي، والنزاهه الميكانيكية الكافية. المواد سقالة لا ينبغي أن يكون السامة للخلايا أو إنشاء استجابة سلبية من المضيف. تم الهلاميات المائية التي يشيع استخدامها في تقنيات هندسة الأنسجة، ونظرا لhydrophilicity، وتسمح الهلاميات المائية الصرف السائل والغاز في جميع أنحاء متطوره. من خلال الجمع بين الهلاميات المائية المختلفة، خصائص هيدروجيل تصنيعه هي للتعديل لتلبية متطلبات تطبيق متميز.
نهج هندسة الأنسجة التقليدية ينطوي على إنشاء السقالات الأضاحي التي يسهل اختراقها ديكي التي المصنف مع الخلايا آخر fabricatio. وقد استخدمت العديد من التقنيات، مثل الألياف الرابطة، صب المذيبات، وتذوب الصب، ولكن ثبت أن تكون ناجحة الحد الأدنى للتطبيقات هندسة الأنسجة. طرق الألياف الرابطة تسمح الألياف إلى الانحياز في أشكال محددة، ولكنها ليست سوى قادرة على المواليةducing سقالة رقيقة جدا. طرق الصب المذيبات أنتجت بنيات المسامية العالية، ولكن كان الغشاء أكبر تنتج سوى 3 ملم thic. لذلك، وخلق بنيات ثلاثية الأبعاد من غير الممكن استخدام هذه التقنيات. أثبتت تقنيات صب تذوب الناجحة في إنتاج السقالات ثلاثية الأبعاد، ولكنها تتطلب درجات حرارة عالية أن المواد البيولوجية لا يمكن إدراجها خلال بروسس الإنتاج. المصنفة السقالات بعد تلفيق-محدودة في قدرتها على تلبية متطلبات هندسة الأنسجة لإنتاج السقالات ثلاثية الأبعاد مع المجهرية ومحددة مسبقا أو السيطرة عليها. آخر قضية رئيسية مع التقنيات سقالة البذر الصلبة هي نقص الأوعية الدموية والفقراء الميكانيكية.
ومنذ ذلك الحين تم تمديد Bioprinting إلى ثلاثة أبعاد من خلال استخدام غير سامة، قابلة للتحلل، والمواد الهلامية الحرارية عكسها للتغلب على عيوب التقليدية. وهناك عدد قليل من صلب حر تلفيق رechniques التي يجري استخدامها حاليا هي بمساعدة الليزر bioprinting والنافثة للحبر الطباعة. تقنيات bioprinting بمساعدة الليزر تستخدم مصدر نابض الليزر، لوحة الهدف، وركيزة المتلقي لتوليد ثلاثي الأبعاد. ومع ذلك، هذه التقنية محدودة بسبب الإنتاجية، وانخفاض بقاء الخلية، ويمكن أن تنتج فقط ترتيبات محدودة من الهياكل ملفقة فقط لأن prepolymers photocrosslinkable يمكن استخدامها لتشكيل هيدروجيل crosslinked. وقد وضعت الطباعة النافثة للحبر كمنهجية عدم الاتصال أن يستنسخ بيانات الصور الرقمية على الركيزة عن طريق إيداع الحبر بيكو لتر. ومع ذلك، الطباعة النافثة للحبر لا تنتج عالية الدقة بناء، يبني تجربة السريع تمسخ البروتين، والعديد من الخلايا هي lysed خلال الترسيب.
حاليا، وقد تم تطوير طرق التصنيع المضافة bioprinting جديدة. في هذه الأنظمة يتم دمج الخلايا والبروتينات وعوامل النمو، والهلاميات المائية الجزيئية الحيوية عادة في مصفوفة الأمأمية أثناء عملية التصنيع وأودعت في نفس الوقت باستخدام المحركات الكمبيوتر التي تسيطر عليها لتوليد خلايا محملة يبني على أساس سقالة ثلاثية الأبعاد التي تحاكي عن كثب المعمارية المصغرة من الأم. الهلاميات المائية خلايا محملة تشكل bioink، التي يمكن أن تكون غير متجانسة، تتكون من أنواع خلايا متعددة، أو متجانسة. المضافات نظم التصنيع إيداع bioink قطرة تلو قطرة أو طبقة تلو طبقة عن طريق المحاقن ونصائح على مرحلة الكمبيوتر التي تسيطر عليها قادرة على التحرك في الاتجاهات X، Y، Z و. من خلال برامج الكمبيوتر، والهندسة المعمارية السقالات المطبوعة يمكن التلاعب بها بسهولة اعتمادا على متطلبات التطبيق. وخلافا للتقنيات التقليدية، ويمكن دمج التكنولوجيات الطبية ثلاثية الأبعاد (التصوير بالرنين المغناطيسي، والتصوير المقطعي الكمبيوتر) في التصاميم، وتوليد بناء المريض محددة. هذه الأساليب تسمح أيضا إمكانية إنتاج بدائل أوعية دموية لأن يتم إنتاج بنيات مع ارتفاع لكثافة الخلية OCAL، مما يسمح التفاعلات خلية خلية وتحسين احتمالات ما بعد الزرع بقاؤه.
الطابعة بالميتو هي ثلاثية الأبعاد نظام تعدد موزع خصيصا بنيت يستخدم أساليب التصنيع الروبوتية قابلة للبرمجة لتوليد ثلاثية الأبعاد بنيات الأنسجة غير المتجانسة (الشكل 1). لأنها تتيح استخدام عدد وافر من المواد في مجموعات فريدة من نوعها لإنتاج هياكل غير المتجانسة. التهيئة للbioprinter هي واحدة من أهم الخطوات في bioprinting لأنه يسمح لك لتعيين مجموعة متنوعة من المعلمات لتحسين القابلية للبنيات bioprinted.
تضم bioprinter عملية من النوع المتقطع مع تسلسل بدء التشغيل، التشغيل والاغلاق التي تسيطر عليها وحدة تحكم منطق برمجة (PLC)، التي تعمل على المستخدم من خلال لوحة تحكم تعمل باللمس التفاعلية (الشكل 1، A). لمنع التلوث الحيويالمواد منطقية ومرفق طيه وbioprinter في بولي إيجابيا لضغوط (ميتاكريليت الميثيل) (PMMA) غرفة مع الجسيمات arrestance عالية الكفاءة (HEPA) -filtered نظام دوران الهواء (الشكل 1، B، C). داخل الطابعة يمكن تعقيمها باستخدام مصادر الأشعة فوق البنفسجية المدمج في (الشكل 1، D). المكون الرئيسي للbioprinter هو الروبوت تحديد المواقع للبرمجة بشكل كامل يمكن أن تضع بتكاثر طرف موزع مع دقة 10 ميكرومتر (الشكل 1، E). هناك ثلاثة موزعات، والتي هي قادرة على أن تودع أحجام صغيرة مثل 230 NL باستخدام الدوارة (الشكل 1، F). هم برمجة بشكل مستقل باستخدام أجهزة كمبيوتر منفصلة التي تحكم المعلمات الطباعة لكل موزع (الشكل 1، G). دوار المسمار الاستغناء يستخدم دوران المسمار بالمحركات لنقل bioink أسفل حقنة ويخرجون من طرف الحقنة. هي التي شنت هذه موزعات على لpneumaticalأداة عش تسيطر لاي (الشكل 2A، B)، والسماح للروبوت للتبديل موزع شنت على الذراع الروبوتية Z المحور تحت السيطرة المبرمجة (الشكل 1، H).
يتلقى روبوت XYZ تعليمات الطباعة من جهاز كمبيوتر يقوم بتشغيل برامج التصميم (الشكل 1، I). يحتوي كل برنامج مواقع صرفها، وإجراءات المعايرة، والبروتوكولات المتغيرة موزع. تصميم بنيات ولدت تتكون أساسا من XYZ ينسق حيث كل موزع ستودع المواد. تضم bioprinter اثنين من أجهزة الاستشعار البصرية ضوء (الشكل 2C) التي تحدد إحداثيات XYZ من نهاية حقنة طرف. هذه المجسات ترسل تنسيق المعلومات لالروبوت، والذي يستخدم هذه لحساب مواقف طرفي موزع طرف. هناك ليزر النزوح إضافية (الشكل 2D) التي تتوقع 633 نانومتر الصمام الثنائي الأحمر شعاع ليزر من حجم البقعة 30 × 100 ميكرومتر لقياس المسافة مع ACCURAقبرصي من 0.1 ميكرومتر. عندما تركز بشدة شعاع الروبوت يحدد المسافة Z من سطح الطباعة. هذا القياس، وقياس البصرية وأجهزة الاستشعار ضوء في نهاية طرف في Z، يسمح حساب Z دقة الإحداثيات المستخدمة لوضع طرف موزع فيما يتعلق سطح الطباعة. نصائح موزع تتحرك أفقيا وعموديا من خلال X-محور الموجهة ضوء استشعار بصري للعثور على مراكز Y و Z، وأفقيا من خلال جهاز استشعار العمودي للعثور على مركز للمحور X. تم تعيين سطح الطباعة باستخدام صيغة لمنبسط في الفضاء XYZ: الفأس + من قبل + تشيكوسلوفاكيا = د لتحديد مكان السطح هو نسبي لموقف نهاية الاستغناء طرف. المرحلة الطابعة (الشكل 1، J) يحمل طبق بتري عينة تصل إلى 80 مم في القطر، ويستخدم حمام مائي إعادة تدوير للحفاظ على درجة الحرارة المحددة (الشكل 1، K). يمكن ضبط درجة الحرارة المرحلة ضمن مجموعة من -20 و لا تزال مستقرة في الداخل. هناك كاميرا USB محمولةعلى الروبوت Z-الذراع لتقديم وجهة نظر تضخيم من طرف الاستغناء أثناء عملية الطباعة (الشكل 1، L). هناك كاميرا ثانية شنت نحو الجزء العلوي من الداخل غرفة التي توفر رؤية متكاملة للbioprinter أثناء عملية الطباعة (الشكل 1، L).
وهناك برامج التصميم الرسم بمساعدة الكمبيوتر يحدد نمط ترسب ويسمح للمستخدم لتوليد قطرات متباعدة تدريجيا والهياكل المعقدة (الشكل 3). مسارات ثلاثي الأبعاد يمكن تلوينها يدويا في تصميم البرمجيات طابعة متوافقة أو استيرادها من برنامج منفصل التصميم بمساعدة الكمبيوتر الرسم (الشكل 4، الجدول 1). يسمح البرنامج للطابعة متوافقة الاختلافات المعلمات الطباعة مثل طريقة الترسيب (ترسب قطرة واحدة أو ترسب مسار مستمر)، والهندسة ثلاثية الأبعاد من المسارات، ومعدل الترسيب، والمسافة بين نهاية حقنة طرف وSUBSTيتم رفع معدل سطح الطباعة، وكمية من الوقت لإيداع انخفاضا الفردي، وارتفاع وسرعة الحقنة بين ترسب قطرات. يحتوي كل برنامج XYZ مواقع صرفها، والروتين طرف المعايرة، والبروتوكولات المتغيرة موزع لتوفير بيئة معقمة، دون تدخل المشغل، أثناء الطباعة. وحدة تحكم منطق برمجة (PLC) للروبوت يتلقى تعليمات من جهاز كمبيوتر يستخدم في تصميم البرمجيات ويتحكم في توقيت الأحداث من وحدات تحكم خارجية (على سبيل المثال، موزعات). للقيام بذلك، يستخدم PLC آلية تنفيذ الحلقات للسيطرة على موزعات ، جهاز تحديد المواقع الروبوتية، والعوامل البيئية.
ثلاثي الأبعاد الكتابة المباشر bioprinting الاستفادة من دوار المسمار، نظام صرف السائل يسمح للعملية إيداع الخلايا لتكون أكثر كفاءة ودقة، وأسهل من الطرق السابقة. وتظهر هذه الدراسة bioprinter عرف بني قادر على توليد مبنيات هيدروجيل ليرة لبنانية محملة بقاء الخلية عالية.
Protocol
1. إعداد الجيلاتين تحتوي على الركيزة لBioprinting ثلاثي الأبعاد من الجينات الهلاميات المائية
- إعداد الركيزة الكالسيوم / الجيلاتين وفقا للطريقة الركيزة الكالسيوم / الجيلاتين التي وصفها Pataky وآخرون 11 لتجنب انخفاض الجدوى المرتبطة نسبة عالية. يتم سرد طريقة الركيزة الكالسيوم / الجيلاتين أدناه.
- الجمع بين يذوى كلوريد الكالسيوم (1.5٪ بالوزن)، كلوريد الصوديوم (0.9٪ بالوزن)، والجيلاتين الخنزيري (2٪ بالوزن) في الماء المقطر، ويغلي لمدة 2 دقيقة لإيجاد حل الجيلاتين 100 ملم.
- صب 5 مل من محلول الجيلاتين / الكالسيوم إلى 100 ملم أطباق بتري القياسية، دوامة الحل في جميع أنحاء لجعل حتى الطلاء على السطح، ومكان على سطح مستو في الثلاجة لهلام O / N (السماح لهلام لا يقل عن 8 ساعة قبل الاستخدام).
- لزيادة التعتيم على سطح الركيزة، إضافة ثاني أكسيد التيتانيوم (0.3٪ بالوزن) لالجيلاتين / CaCl 2 الحل. يحرك المزيج لمدة 10 دقيقة. AUToclave الحل الجيلاتين / تيو 2 على دورة السوائل لمدة 30 دقيقة لتعقيمها.
- إضافة 3 مل من الجيلاتين / تيو 2 حل للسطح لوحات الجيلاتين أعدت مسبقا. دوامة الخليط لضمان ينتشر بالتساوي على السطح. السماح لهلام في 4 ° C الثلاجة O / N (السماح لهلام لا يقل عن 8 ساعة قبل الاستخدام). يجب استخدام ركائز خلال 3 أيام.
2. الجيني الأكسدة
- أكسدة bioink الجينات الصوديوم وفقا للطريقة لالجينات تتأكسد جزئيا Bouhadir وآخرون 30 هو موضح أدناه.
- لجعل 5٪ حل الجينات أكسدة، ويحل 1 غرام من الجينات الصوديوم في 100 مل من الماء المقطر. إضافة محلول مائي من بريودات الصوديوم (0.25 M، 0.25 ملمول)، عامل مؤكسد، لإنتاج حل الأكسدة 5٪. يحرك المزيج لمدة 19 ساعة على RT. إضافة 40 مل جلايكول الإثيلين إلى حل بعد 24 ساعة لإنهاء الجرميةction.
- حل 2.5 غرام من كلوريد الصوديوم في الحل. إضافة كميات زائدة من الكحول الإيثيلي (2: 1 نسبة) لترسيب أملاح الجينيه أكسدة. أجهزة الطرد المركزي الحل في 1000 x ج لجمع الرواسب وإعادة بحل-في الماء المقطر. تكرار غسل الايثانول.
- تجميد تجفيف الكريات الجينات أكسدة وتخزينها في -20 درجة مئوية لتصبح جاهزة للاستخدام.
- تحديد درجة أكسدة عن طريق قياس نسبة الصوديوم بريودات المستهلكة قبل أن يتم إنهاؤها من قبل جلايكول الإثيلين.
- إعداد محلول يوديد البوتاسيوم (20٪ ث / ت، ودرجة الحموضة عازلة فوسفات الصوديوم 7.0) وحل thyodene (10٪ ث / ت، ودرجة الحموضة 7.0 الصوديوم العازلة الفوسفات). مزيج من الحلين مع الجينات أكسدة في RT.
- إسقاط تدريجيا رد فعل الجينات والصوديوم حل بريودات في مزيج من يوديد البوتاسيوم وtheodyne الحلول. قياس الامتصاصية من خليط طيفيا في 426 نانومتر. عندما وصلت عليهالحد الأقصى، تسجيل الصوت المستخدمة من الجينات الصوديوم وحل بريودات كما V 1.
- رد فعل
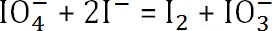 . كمية غير المتفاعل بريودات الصوديوم
. كمية غير المتفاعل بريودات الصوديوم 
- طرح كمية غير المتفاعل بريودات الصوديوم من التركيز الأصلي لتحديد كمية الصوديوم المستهلكة بريودات. باستخدام الصيغة السابقة، وتحديد درجة أكسدة الأخيرة من الجينات.
3. الجيني الببتيد الإقتران
- بروابط المترافقة مع يتعرض تسلسل أرجينين-الجلايسين اسبارتاتي (الببتيد) في الجينات أكسدة معدة مسبقا وذلك باتباع طريقة الاقتران RGD-ملح الجيني بواسطة رولي وآخرون 31 المبينة أدناه إلى تعزيز مرفق الخلية والانتشار.
- استخدام carbod مائيالكيمياء iimide مع G 4 RGDSPto المترافقة 31.
- حل 1 غرام من 5٪ الجينات أكسدة في 0.1 M 2- (N-morpholino) حمض ethanesulfonic (MES) العازلة، ودرجة الحموضة = 4. إضافة 1-ethyl- (dimethylaminopropyl) carbodiimide (EDC، 0.54 ملمول) وN-Hydroxysuccinimide ( NHS، 0.27 ملمول) في 2: 1 نسبة إلى تشكيل أميد المتوسط.
- إضافة 0،28 مليمول الببتيد، اقتران العمود الفقري للبوليمر الجينات عبر أمين المحطة. إثارة في RT O / N.
- وقف رد فعل اقتران عن طريق إضافة 2.5 غرام كلوريد الصوديوم إلى الحل. إضافة كميات زائدة من الكحول الإيثيلي (2: 1 نسبة) لترسيب أملاح الجينيه أكسدة. أجهزة الطرد المركزي الخليط في 4000 x ج لمدة 5 دقائق لجمع الرواسب. نضح في وسائل الإعلام في الخلية هود الثقافة وإعادة بحل-يترسب في الماء المقطر. تكرار غسل الايثانول.
- تجميد تجفيف الرواسب حتى يصبح جفت تماما (سوف تظهر مسحوقا أبيض) وتخزينها في -20 درجة مئوية الثلاجة لوقت لاحقاستخدام.
4. الدهنية لجسم الإنسان خلايا الأنسجة اللحمية خلية الثقافة (hADSC ل)
- ثقافة الدهنية لجسم الإنسان خلايا انسجة الأنسجة (hADSC ل) في 75 سم تعامل قوارير ثقافة خلية (قوارير T75)، مع تغطية 15 مل منخفض DMEM الجلوكوز مع 10٪ مصل الجنين البقري و 1٪ البنسلين، الستربتومايسين، 1٪ الجلوتامين، و 1٪ antimycin. تغيير وسائل الإعلام، في الخلية هود الثقافة، كل يومين حتى وصلت confluency (80-90٪).
- مرة واحدة متموجة، ونقل قوارير T75 إلى الخلية هود الثقافة وتعليق لhADSC باستخدام طريقة التربسين انزيم الهضم.
- في غطاء محرك السيارة، ونضح كل وسائل الإعلام خلية ثقافة الخروج من الخلايا. شطف مع 5 مل من Dulbecco والفوسفات مخزنة المالحة مع الكالسيوم والمغنيسيوم (DPBS ++). نضح DPBS ++ الخروج من الخلايا.
- بينما في غطاء محرك السيارة، وجعل حل التربسين وDPBS ++ عن طريق خلط 1 مل التربسين و 4 مل DPBS ++. كل قارورة تتطلب 5 مل من solutأيون، لذلك جعل حجم مناسب لعدد من قوارير متموجة. إضافة 5 مل من التربسين / DPBS ++ إلى كل قارورة ووضعها في الحاضنة لمدة 2 دقيقة.
- بعد 2 دقيقة، وإزالة قوارير وبخفة الجانبين منهم لتخفيف الخلايا من القيعان. ننظر في كل قارورة تحت المجهر لضمان وقف التنفيذ الخلايا. وضع قوارير مرة أخرى في الخلية هود الثقافة وإضافة 3 مل من المناسب سائل الإعلام والثقافة الخلية إلى كل قارورة. ينتهي هذا رد فعل التربسين.
- نقل وسائل الإعلام الخلايا المحملة من كل قارورة وضعت في مخروطي 50 مل. أجهزة الطرد المركزي في 1000 x ج منهم لمدة 5 دقائق. يجب أن تظهر الخلايا كما هو بيليه الأبيض الصغير في أسفل المخروطية. نقل مرة أخرى إلى الخلية هود الثقافة ونضح وسائل الإعلام. resuspend الخلايا في 2 مل من وسائل الإعلام ثقافة الخلية.
- عد الخلايا باستخدام عدادة الكريات تحت المجهر. مرة واحدة وقد تم عد الخلايا، في غطاء محرك السيارة والثقافة، وقسامة كمية من وسائل الإعلام التي تحتوي على ~ 1.3 millioن الخلايا ونقل إلى المخروطية 15 مل. الطرد المركزي المخروطية 15 مل تحتوي على خلايا مرة أخرى لمدة 5 دقائق في 1000 ز س.
- في الثقافة هود، RESEED الخلايا المتبقية في عدة T-75 قوارير، إضافة تركيز ~ 350000 خلايا لكل قارورة. إضافة 15 مل من وسائل الاعلام DMEM والعودة إلى الحاضنة حتى متموجة مرة أخرى.
- مرة واحدة في دورة الطرد المركزي هي كاملة، وعودة المخروطية 15 مل للثقافة الخلية. نضح وسائل الإعلام من بيليه الخلية، وresuspend الخلايا في محلول مائي الجينات عند تركيز 1.3 مليون خلية لكل مليلتر من bioink، terteriating الحل في كثير من الأحيان حتى لا يكون هناك توزيع متجانس من الخلايا في جميع أنحاء bioink. تحميل حل الخلية محملة إلى طابعة متوافقة معقمة 3 مل حقنة والمسمار على العقيمة 22 G غيض من البلاستيك.
5. إعداد Bioprinter
- بدوره على bioprinter، كل من أجهزة الكمبيوتر موزع، وrecirculatجي حمام الماء.
- يدويا تعيين إعادة تدوير درجة حرارة حمام الماء للآلية دبق.
- تعيين معلمات يدويا الطباعة لكل موزع على الكمبيوتر ربط موزع. تعيين حجم الاستغناء إلى 230 NL، عدد من تراجعات إلى 0، ومعدل الاستغناء عن ل10μl -sec.
- فتح تصميم البرمجيات وبرنامج لمشاهدة عرض الكاميرا USB على جهاز الكمبيوتر.
- باستخدام البرنامج، يدويا إدخال إحداثيات نقطة مجموعة 5 × 5 مع 2.4 ملم تباعد بين قطرات.
- تعيين المعلمات الطباعة لتكون: المسافة بين نهاية طرف وسطح الركيزة = 0.1 مم؛ ورفعت ارتفاع حقنة بين ترسبات = 20 مم؛ مقدار الوقت في ترسب = 1 ثانية.
- حفظ البرنامج وإرسالها إلى الروبوت.
- وضع طبق بتري الجيلاتين / تيو 2 التي تحتوي على 4 ° C مرحلة الطابعة. إغلاق وقفل باب الغرفة.
- استخدام PLC لINItialize مصادر الأشعة فوق البنفسجية، وتعقيم الغرفة لمدة 90 ثانية.
- مرة واحدة التعقيم كاملة، فتح الغرفة وتحميل حقنة تحتوي hADSC وعلقت في الجينات إلى بندقية 1. إغلاق وقفل باب الغرفة.
- استخدام PLC لتشغيل نظام المروحة، انتظر 30 ثانية لتوازن الضغط الداخلي.
- على الكمبيوتر، قم بتشغيل البرنامج الذي يحتوي على مسار الهندسية والطباعة المعلمات.
- في جميع مراحل عملية الطباعة، ومشاهدة عرض الكاميرا USB على جهاز الكمبيوتر لتأكيد الطباعة دقيقة وموحدة.
- بمجرد الانتهاء من الطباعة، والسماح للبنيات إلى هلام لمدة 40 دقيقة.
تقييم الجدوى 6. خلية
- تغطية التركيبات التي لا تسير على أن تصويرها على الفور ما بعد الطباعة في DMEM وتخزينها في الحاضنة حتى وقت التصوير.
- لتحديد الجدوى من يبني، وصمة عار لهم باستخدام استنادا فلوري الجدوى / السمسة مقايسة، وهوالثانية الصورة باستخدام متحد البؤر المجهري.
- اتباع الإرشادات عدة، يعد حل تلطيخ تحتوي على calcein AM وإيثيديوم homodimer-1. لجعل 10 مل من محلول التلوين، إضافة 20 ميكرولتر من إيثيديوم homodimer-1 و 5 ميكرولتر من calcein صباحا إلى 10 مل من عقيم، زراعة الأنسجة الصف Dulbecco والفوسفات مخزنة المالحة (+ المغنيسيوم، + الكالسيوم، DPBS ++).
- تزج بنيات bioprinted في الحل وصمة عار لمدة 15 دقيقة في الظلام.
- صورة بنيات الملون باستخدام نظام المجهر متحد البؤر في أيام 0 و8. يمكنك التقاط صور متعددة من كل بناء bioprinted، وذلك باستخدام المعلمات Z-كومة من 30 شرائح الضوئية على عمق 300 ميكرون، ويدويا عد الخلايا. في حالة ظهور خلايا صفراء أو خضراء نعدهم كما على قيد الحياة، وإذا أحمر، نعدهم الموتى كما.
- حساب النسبة المئوية بقاء الخلية حيث وصل عدد الخلايا الحية مقسوما على العدد الكلي للخلايا في بناء؛ بقاء الخلية = عددالخلايا الحية (أخضر + أصفر) / العدد الإجمالي للخلايا (أخضر + أصفر + أحمر) × 100٪.
- حساب كمية من تكاثر الخلايا لكل عينة حيث وصل عدد الخلايا من يوم 8 مقسوما على عدد الخلايا في يوم 0؛ انتشار الخلايا = عدد الخلايا الحية في يوم 8 / خلية حية تعتمد على اليوم 0 × 100٪.
7. RGD الببتيد الإقتران تحليل
- لتحليل نجاح RGD الببتيد اقتران على الجينات، مقارنة الجينات RGD-مترافق والجينات غير مترافق. للقيام بذلك، صورة بنيات المطبوعة باستخدام (4، 6-Diamidino-2-Phenylindole، هيدروكلوريد) (دابي) وphalloidin البقع.
- جعل phalloidins حل العمل عن طريق تمييع 5 ميكرولتر من محلول المخزون المثيلي مع 200 ميكرولتر من DPBS ++. تخزين في درجة حرارة -20 درجة مئوية حتى الاستخدام.
- جعل 300 ميكرومتر حل الأسهم وصمة عار دابي التالية المعادلة: (0.10509 جم / L) / (350.3 جم / مول) = 3 × 10 -4 M = 0.0003 M = 0.300 ملي = 300 ميكرومتر. جعل عشرالحل ه دابي العمل عن طريق تمييع الحل الأوراق المالية 1: 100 في DPBS ++ للحصول على 3 ميكرومتر الحل. تخزين في درجة حرارة -20 درجة مئوية حتى الاستخدام.
- تماما غمر العينة في 4٪ امتصاص العرق. احتضان لمدة 1 ساعة على RT. يغسل ثلاث مرات مع DPBS ++، مما يتيح الحل على الجلوس لمدة 5 دقائق كل غسل. نقل العينة جل من البئر إلى شريحة زجاجية، التقليب هلام في أكثر من عملية. تزج هلام في 0.1٪ تريتون X-100 (0.1 غرام / 100 مل) في DPBS ++ لمدة 10 دقيقة. يغسل ثلاث مرات مع DPBS ++، مما يسمح لل5 دقائق لكل يغسل.
- وصمة عار على بنيات المطبوعة مع phalloidin عن طريق غمر لهم في حل العاملة. مع تغطية احباط واحتضان لمدة 4 ساعات. إزالة وصمة عار phalloidin ويغسل ثلاث مرات مع DPBS ++. يجب أن تكون أول غسل سريع، ينبغي أن يغسل الأخيرة الجلوس لمدة 5 دقائق لكل منهما.
- وصمة عار على بنيات المطبوعة مع دابي عن طريق غمر لهم في حل العمل دابي. مع تغطية احباط واحتضانها في RT لمدة 30 دقيقة. غسلثلاث مرات مع DPBS ++، مما يسمح كل غسل للجلوس لمدة 5 دقائق. مراقبة وصورة العينات على نظام المجهر متحد البؤر.
النتائج
وتبين النتائج أن bioprinter قادر على إيداع الهلاميات المائية خلية لادن في المواقع الثلاثة الأبعاد محددة بدقة وباستمرار باستخدام البرمجيات بمساعدة الكمبيوتر. هذه البرمجيات تحدد وضع كل قطرة ومراقبة العديد من المعلمات للاستغناء عن (الشكل 3،4). والتكرار من bioprinter أن ...
Discussion
التركيز الرئيسي لهندسة الأنسجة هو سد الفجوة بين نقص الأعضاء واحتياجات زرع من خلال تطوير بدائل بيولوجية قادرة على استعادة والحفاظ على، أو تحسين functio أنسجة الأم. وقد أدى هذا إلى تلفيق المباشر السقالات مع مجمع، هندسة الخارجية الصحيحة تشريحيا، ومراقبة دقيقة على مدى geometr...
Disclosures
The authors have nothing to disclose.
Acknowledgements
وأيد هذا العمل من قبل الدعم الحكومي بموجب منحة رقم EPS-0903795 تمنحها المؤسسة الوطنية للعلوم، NIH NIDCR R01-DE019355 (MJY PI)، ومنح 8P20 GM103444 (YM PI).
Materials
| Name | Company | Catalog Number | Comments |
| Positioning Robot (JR2000 XYZ) | Janome | ||
| Dispensers: SDAV Linear Drive SmartDispensers | Fishman Corporation | ||
| Optical Light Sensors: | Keyensce | ||
| Displacement Laser: OD Mini | SICK | ||
| Recirculating Water Bath: Polystat | Cole-Parmer | EW-12122-02 | |
| USB Cameras: Dino-Lite Premier 5MP | AnMo Electrionics/YSC Technologies | AD7013MT | |
| Printer-Compatible Computer Design Software: JR-C Points | Janome | Comes with purchase of Janome Robot | |
| Computer-Aided Design Drawing Software: Visual PathBuilder | RatioServ | Can be downloaded at: www.ratioserv.com/index.php/downloads | |
| Printer 3 cc Syringes: | Fishman Corporation | 122051 | |
| 22 G Dispenser Tips | Fishman Corporation | Z520122 | |
| Calcium Chloride Dihydrate | Sigma-Aldrich | 10035-04-8 | |
| Sodium Chloride | Sigma-Aldrich | 7647-14-5 | |
| Porcine Gelatin | Sigma-Aldrich | 9000-70-8 | |
| Titanium Dioxide | Sigma-Aldrich | 13462-67-7 | |
| Protanal LF 20/40 Alginate (Sodium Alginate) | FMC BioPolymer | 9005-38-3 | |
| Hydrochloric Acid | Sigma-Aldrich | 7647-01-0 | |
| Ethylene Glycol | Mallinckrodt Baker, Inc | 9300-01 | |
| Sodium Periodate | Sigma-Aldrich | 7790-28-5 | |
| hADSC | Lonza | PT-5006 | Store in vials in liquid nitrogen until use. |
| Dulbecco's Modified Eagle's Medium | Gibco Life Technologies | 11965-092 | Warm in 37 °C water before use. |
| Trypsin/EDTA | Lonza | CC-5012 | Warm in 37 °C water before use. |
| Calcein AM | Gibco Life Technologies | C3100MP | Store in the dark at -80 °C until use. |
| Live/Dead Mammalian Viability Assay Kit | Invitrogen Life Technologies | L-3224 | Store in the dark at -80 °C until use. |
| MES Hydrate | Sigma-Aldrich | M2933 | |
| N-Hydroxysuccinimide | Sigma-Aldrich | 130672 | |
| 1-ethyl-(dimethylaminopropyl) carbodiimide (EDC) | Sigma-Aldrich | E1769 | 10 G |
| Dulbecco's Phosphate-Buffered Saline, +Calcium, +Magnesium | Life Technologies | 14040133 | Warm in 37 °C water before use. |
| Dulbecco's Phosphate-Buffered Saline, -Calcium, -Magnesium | Life Technologies | 14190144 | Warm in 37 °C water before use. |
| RGD Peptides | International Peptides | ||
| Alexa Fluor 546 Phalloidin Stain | Invitrogen Life Technologies | A22283 | Store at -20 °C until use |
| (4’, 6-Diamidino-2-Phenylindole, Dihydrochloride) (DAPI) Stain | Life Technologies | R37606 | Store at -20 °C until use |
References
- Langer, R., Vacanti, J. P. . Tissue Engineering. Science. 260 (5110), 920-926 (1993).
- Derby, B. Review: Printing and Prototyping of Tissues and Scaffolds. Science. 338 (6109), 921-926 (2012).
- Kachurin, A. M., et al. Direct-Write Construction of Tissue-Engineered Scaffolds. Mat. Res. Soc. Symp. Proc. 698, 10-1557 (2002).
- Sachlos, E., Czernuszka, J. T. Making Tissue Engineering Scaffolds Work. Review on the Application of Solid Freeform Fabrication Technology to the Production of Tissue Engineering Scaffolds. European Cells and Materials. 5, 29-40 (2003).
- Yeong, W. Y., Chua, C. K., Leong, K. F. Rapid Prototyping in Tissue Engineering. Challenges and Potential. Trends Biotechnol. 22 (12), 643-652 (2004).
- Landers, R., Pfister, A., Hubner, U., John, H., Schmelzeisen, R., Mulhaupt, R. Fabrication of Soft Tissue Engineering Scaffolds by means of Rapid Prototyping Techniques. Journal of Materials Science. 37 (15), 3107-3116 (2002).
- Murphy, S. V., Skardal, A., Atala, A. Evaluation of Hydrogels for Bio–Printing Applications. Journal of Biomedical Materials Research Part A. 101A (1), 272-284 (2013).
- Burg, K. J. L., Boland, T. Minimally Invasive Tissue Engineering Composites and Cell Printing. IEEE Eng Med Biol Mag. 22 (5), 84-91 (2003).
- Billiet, T., Vandenhaute, M., Schelfhout, J., Van Vlierberghe, S., Dubruel, P. A Review of Trends and Limitations in Hydrogel-Rapid Prototyping for Tissue Engineering. Biomaterials. 33 (26), 6020-6041 (2012).
- Khalil, S., Nam, J., Sun, W. Multi–Nozzle Deposition for Construction of 3D. Biopolymer Tissue Scaffolds. Rapid Prototyping Journal. 11 (1), 9-17 (2005).
- Pataky, K., Braschler, T., Negro, A., Renaud, P., Lutolf, M. P., Brugger, J. Microdrop Printing of Hydrogel Bioinks into Three–Dimensional Tissue–Like Geometries. Adv Mater. 24 (3), 391-396 (2011).
- Pati, F., Shim, J. H., Lee, J. S., Cho, D. W. Three-Dimensional Printing of Cell–Laden Constructs for Heterogeneous Tissue Regeneration. Manufacturing Letters. 1 (1), 49-53 (2013).
- Gruene, M., et al. Laser Printing of Three–Dimensional Multicellular Arrays for Studies of Cell–Cell and Cell–Environment Interactions. Tissue Eng. 17 (10), 973-982 (2011).
- Khalil, S., Sun, W. Bioprinting Endothelial Cells With Alginate for 3D Tissue Constructs. J Biomed Eng. 131 (11), 1-8 (2009).
- Xu, T., et al. Hybrid Printing of Mechanically and Biologically Improved Constructs for Cartilage Tissue Engineering Applications. Biofabrication. 5 (1), 1-10 (2012).
- Zhang, T., Yan, K. C., Ouyang, L., Sun, W. Mechanical Characterization of Bioprinted in vitro Soft Tissue Models. Biofabrication. 5 (4), 1-10 (2013).
- Chung, J. H. Y., et al. Bio–ink Properties and Printability for Extrusion Printing Living Cells. J. Biomater. Sci., Polym. Ed. 1 (7), 763-773 (2013).
- Yang, S., Leong, K. F., Du, Z., Chua, C. K. The Design of Scaffolds for Use in Tissue Engineering. Part II. Rapid Prototyping Techniques. Tissue Engineering. 8 (1), 1-11 (2002).
- Ferris, C. J., Gilmore, K. G., Wallace, G. G., Panhuis, M. Biofabrication: An Overview of the Approaches Used for Printing of Living Cells. Appl. Microbiol. Biotechnol. 97 (10), 4243-4258 (2013).
- Lu, L., Mikos, A. G. The Importance of New Processing Techniques in Tissue Engineering. MRS Bull. 21 (11), 28-32 (1996).
- Wake, M. C., Gupta, P. K., Mikos, A. G. Fabrication of pliable biodegradable polymer foams to engineer soft tissues. Cell Transplant. 5, 465-473 (1996).
- Mironov, V., Visconti, R. P., Kasyanov, V., Forgacs, G., Drake, C. J. Organ Printing: Tissue Spheroids as Building Blocks. Biomaterials. 30 (12), 2164-2174 (2009).
- Norotte, C., Marga, F. S., Niklason, L. E. Scaffold–free Vascular Tissue Engineering Using Bioprinting. Biomaterials. 30 (30), 5910-5917 (2009).
- Devillard, R., et al. Cell Patterning by Laser–Assisted Bioprinting. Methods Cell Biol. 119, 159-174 (2014).
- Binder, K. W., Allen, A. J., Yoo, J. J. Drop–on–Demand Inkjet Bioprinting: a Primer. Gene Ther Reg. 6 (1), 33 (2011).
- Xu, T., et al. Viability and Electrophysiology of Neural Cell Structures Generated by the Inkjet Printing Method. Biomaterials. 27 (19), 3580-3588 (2006).
- Calvert, P. Inkjet Printing for Materials and Devices. Chem Mater. 13 (10), 3299-3305 (2001).
- Chang, C. C., Boland, E. D., Williams, S. K. Direct–Write Bioprinting Three–Dimensional Biohybrid Systems for Future Regenerative Therapies. J Biomed Mater Res B Appl Biomater. 98 (1), 160-170 (2011).
- Li, M. G., Tian, X. Y. A Brief Review of Dispensing–Based Rapid Prototyping Techniques in Tissue Scaffold Fabrication: Role of Modeling on Scaffold Properties Prediction. Biofabrication. 1 (3), 1-10 (2009).
- Bouhadir, K. H., Lee, K. Y., Alsberg, E., Damm, K. L., Anderson, K. W., Mooney, D. J. Degradation of Partially Oxidized Alginate and its Potential Application for Tissue Engineering. Biotechnol Prog. 17 (5), 945-950 (2001).
- Rowley, J. A., Madlambaya, G. Alginate Hydrogels as Synthetic Extracellular Matrix Materials. Biomaterials. 20 (1), 45-53 (1999).
- Smith, C. M., Christian, J. J., Warren, W. L. Characterizing Environmental Factors that Impact Viability of Tissue–Engineered Constructs Fabricated by a Direct–Write Bioassembly Tool. Tissue Engineering. 13 (2), 373-383 (2007).
- Ozbolat, I., Yu, Y. Bioprinting Towards Organ Fabrication: Challenges and Future Trends. IEEE Trans Biomed Eng. 60 (3), 691-699 (2012).
- Peltola, S. M., Melchels, F. P., Grijpma, D. W., Kellomaki, M. A. A Review of Rapid Prototyping Techniques for Tissue Engineering Purposes. Annals of Medicine. 40 (4), 268-280 (2008).
- Malda, J., et al. 25th Anniversary Article: Engineering Hydrogels for Biofabrication. Adv Mat. 25 (36), 5011-5028 (2013).
- Murphy, S. V., Atala, A. 3D Bioprinting of Tissues and Organs. Nat Biotech. 32 (8), 773-785 (2014).
- Jia, J., et al. Engineering Alginate as Bioink for Bioprinting. Acta Biomaterialia. 10 (10), 4323-4331 (2014).
- Forty, R. A., Steinberg, M. S. The Differential Adhesion Hypothesis: a Direct Evaluation. Developmental Biology. 278 (1), 255-263 (2005).
- Wang, L., Shansky, J., Borselli, C., Mooney, D., Vandenburgh, H. Design and Fabrication of a Biodegradable, Covalently Crosslinked Shape–Memory Alginate Scaffold for Cell and Growth Factor Delivery. Tis Eng Part A. 18 (19-20), 2000-2007 (2012).
- El–Sherbiny, I. M., Yacoub, M. H. Hydrogel Scaffolds for Tissue Engineering: Progress and Challenges. Global Cardiology Science, & Practice. 3 (38), 316-342 (2013).
- Smith, C. M., et al. Three–Dimensional BioAssembly Tool for Generating Viable Tissue-Engineered Constructs. Tissue Engineering. 10 (9–10), 1566-1576 (2004).
- Ozbolat, I. T., Chen, H. Development of a ‘Multi-arm Bioprinter’ for Hybrid Fabrication of Tissue Engineering Constructs. Robotics and Computer–Integrated Manufacturing. 30 (3), 295-304 (2014).
- Kolesky, D. B., Truby, R. L., Gladman, A. S., Busbee, T. A., Homan, K. A. Three-Dimensional Bioprinting of Vascularized, Heterogeneous Cell–Laden Tissue Constructs. Adv Mater. X. Adv Mater. X, x-y (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved