Method Article
تحديد أكسيد المعادن النانوية في العينات النسيجية من خلال تعزيز بمجهر ذي ساحة مظلمة المجهري الطيفي ورسم الخرائط
In This Article
Summary
Enhanced darkfield microscopy and hyperspectral imaging with spectral mapping enable screening, localization, and identification of nanoscale materials in histological samples with improved speed and accuracy over traditional methods. The goal of this paper is to provide methods for darkfield imaging and hyperspectral mapping of metal oxide nanoparticles in histological samples.
Abstract
Nanomaterials are increasingly prevalent throughout industry, manufacturing, and biomedical research. The need for tools and techniques that aid in the identification, localization, and characterization of nanoscale materials in biological samples is on the rise. Currently available methods, such as electron microscopy, tend to be resource-intensive, making their use prohibitive for much of the research community. Enhanced darkfield microscopy complemented with a hyperspectral imaging system may provide a solution to this bottleneck by enabling rapid and less expensive characterization of nanoparticles in histological samples. This method allows for high-contrast nanoscale imaging as well as nanomaterial identification. For this technique, histological tissue samples are prepared as they would be for light-based microscopy. First, positive control samples are analyzed to generate the reference spectra that will enable the detection of a material of interest in the sample. Negative controls without the material of interest are also analyzed in order to improve specificity (reduce false positives). Samples can then be imaged and analyzed using methods and software for hyperspectral microscopy or matched against these reference spectra in order to provide maps of the location of materials of interest in a sample. The technique is particularly well-suited for materials with highly unique reflectance spectra, such as noble metals, but is also applicable to other materials, such as semi-metallic oxides. This technique provides information that is difficult to acquire from histological samples without the use of electron microscopy techniques, which may provide higher sensitivity and resolution, but are vastly more resource-intensive and time-consuming than light microscopy.
Introduction
كما تستخدم المواد متناهية الصغر على نحو متزايد في مجموعة متنوعة من الصناعات والتطبيقات، وهناك حاجة للتصوير النانو وتوصيف الطرق التي هي أكثر سرعة، وبأسعار معقولة، ومريحة من الطرائق التقليدية، مثل المجهر الإلكتروني. لتصور جسيمات متناهية الصغر (NP) التفاعل مع الخلايا والأنسجة، والأنظمة الحية، وقد استخدمت العديد من التقنيات البصرية، بما في ذلك على النقيض تدخل الفرق (DIC) المجهري 1 والنهج الميداني زائل، مثل الانعكاس الكلي الداخلي (TIR) أو القريب المجهر المجال البصري (NSOM) 2،3. ومع ذلك، وهذه هي المناهج التحليلية الراقية، بعيدا عن متناول معظم المختبرات غير المتخصصين 4. المجهر الإلكتروني، بما في ذلك انتقال المجهر الإلكتروني (TEM)، كما تم استخدامها لدراسة NP التفاعل مع الخلايا 5،6،7،8. وقد استخدم عالية زاوية الحلقي الساحة المظلمة (HAADF) المجهر الإلكتروني النافذ لدراسة التفاعل مصادر القدرة النوويةمع فيروسات 9. المجهر متحد البؤر هو أسلوب آخر شعبية تستخدم لدراسة التفاعلات NP-10 خلية.
في السنوات الأخيرة، وقد استخدمت التصوير الطيفية (HSI) التقنيات المعتمدة الساحة المظلمة كأداة تحليلية واعدة لدراسة المصادر في المصفوفات البيولوجية 11. نظم HSI تولد تمثيل ثلاثي الأبعاد للبيانات المكانية والطيفية، والمعروفة باسم المكعب الزائدي أو datacube 12. يتم استخدام الخريطة المكانية من التباين الطيفي لتحديد مادية. يمكن أن تتولد لمحات طيفية من المواد المعروفة وتستخدم مكتبات مرجعية للمقارنة عينات مجهولة. واحدة من المزايا الرئيسية مع أنظمة HSI هو قدرته على الجمع بين التصوير مع التحليل الطيفي، وبالتالي تأسيس الموقع وتوزيع تلك المصادر غير معروفة في الجسم الحي أو خارج الجسم فضلا عن ربطها الجسيمات إشارة أخرى من المعروف، تركيبة مشابهة.
هناك العديد من المزايا للاستخدام نظم HSI على تقنيات التصوير التقليدية: مطلوب الحد الأدنى من إعداد العينة. إعداد العينات عادة غير المدمرة في الطبيعة؛ الحصول على الصور والتحليل هو أسرع؛ تقنية تقدر ب 13 فعالية من حيث التكلفة. والتوزيع المكاني وتحليل المركبات من تكوين مختلطة و / أو في مصفوفات معقدة يتم إنجاز أكثر سهولة 14.
للبحث المواد متناهية الصغر التي تنطوي على العينات الثمينة، واحدة من أهم الاعتبارات هو توافر طريقة التصوير غير المدمرة، والذي يسمح للالقدرة على فحص عينات مرارا وتكرارا من قبل وسائل واحد أو أكثر. المتكرر أو قد يكون المطلوب تحليلات متعددة لتطوير قواعد البيانات الشاملة التي لن تكون متاحة من أسلوب واحد. في هذا الصدد، ودراسة خصائصه البصرية هو الطريق الأسلم لتحليل العينة. باستخدام المجهر تعزيز الساحة المظلمة (EDFM) ونظام HSI لدراسة استجابة البصرية من العينة - وهي reflectance، ولكن أيضا الامتصاصية والنفاذية - تحديد وتوصيف ميزة لا يمكن أن يؤديها 15. وتشمل النقاط النهائية توصيف المحتملة تقييما لحجم وشكل الجسيمات النانوية أو تكتلات وتوزيع الجسيمات النانوية داخل عينة النسبي.
في هذه الورقة، ونحن تصف أساليب رسم الخرائط خصيصا لجزيئات أكسيد المعادن في الأنسجة بعد الوفاة باستخدام نظام HSI بناء على خوارزمية مباراة بكسل الطيفي يشار إلى مخطط زاوية الطيفي (SAM). لقد اخترنا هذا تطبيق معين لأنه لديه القدرة على استكمال الحالية والمستقبلية في مجال البحوث nanotoxicology الجسم الحي، حيث يتم استخدام نماذج حيوانية لتقييم الآثار الصحية الناجمة عن التعرض للمواد النانوية المهندسة. يمكن تطبيق هذه الطريقة أيضا بإبلاغ النانو الأبحاث توصيل العقاقير التي تستخدم الأنسجة الحيوانية أو النماذج. ولا سيما، وامتصاص جسيمات متناهية الصغر، والتوزيع، والتمثيل الغذائي، وإفراز طوال سيمكن أن يتم التحقيق rgans والأنسجة مع هذا النظام. ويجري التحقيق مجموعة واسعة من التطبيقات لاستخدامها في البحوث الطبية الحيوية 11.
هذه الطريقة يمكن استخدامها لتقييم العينات البيولوجية المختلفة (مثل الأنسجة المختلفة الأنواع، وعينات غسيل القصبات، ومسحات الدم) التي تعرضت لالنانوية من مجموعة متنوعة من التراكيب عنصري 16-19. وعلاوة على ذلك، وهذه الطريقة مفيدة لدراسة جسيمات متناهية الصغر biodistribution في الجسم الحي في المختبر، والتي هي وثيقة الصلة للدراسات تسليم النانو المخدرات 11. ما وراء العينات البيولوجية، EDFM وHSI يمكن استخدامها لتقييم النانوية في العينات البيئية، مثل مياه الصرف الصحي 20. تقييم التعرض المهني يمكن أن يتيسر من خلال استخدام هذه التقنية أيضا، لأنها يمكن أن تستخدم لتقييم فعالية معدات الوقاية الشخصية في منع اختراق جسيمات متناهية الصغر. وعلاوة على ذلك، والشركة المصرية للاتصالات البحوثصباحا حاليا على وضع EDFM مماثل وبروتوكول HSI لتقييم عينات سائل الاعلام فلتر الجسيمات النانوية التي تم جمعها من عمليات تقييم التعرض المهني. في حين إعداد هذه الأنواع عينة مختلفة عن EDFM وHSI قد تختلف، فمن المهم أن يتم إعداد في مثل هذه الطريقة التي يمكن تصور بسهولة من قبل النظام البصري. عادة، يجب أن تكون على استعداد العينة كما لو أن تصور ذلك عن طريق الفحص المجهري brightfield التقليدية. هناك العديد من أنظمة التصوير الطيفية المتاحة تجاريا 11.
Protocol
تمت الموافقة على البروتوكولات الحيوانية رعاية الحيوان واللجنة المؤسسية استخدم في التعاون مؤسسة المحققين، جامعة ستوني بروك. ويمكن الاطلاع على قائمة المواد والمعدات المستخدمة في هذه الورقة المحددة في الجدول 1.
1. إعداد عينة من الأنسجة
- إعداد الأنسجة الحيوانية تتعرض لجزيئات أكسيد المعادن لتلطيخ النسيجي أو المناعى حسب الأساليب المذكورة سابقا 21-23.
2. التصوير
- تهيئة مجهر
ملاحظة: للحصول على هذه الدراسة، تم استخدام المجهر الصف البحوث وتجهيزه مع مصدر ضوء الساحة المظلمة عالية الأداء، XY بمحركات تحكم المرحلة، 14 بت عمق الكاميرا الفائقة الطيفية، والعدسات موضوعية متعددة (10X الهواء، 40X الهواء، 100X الغمر النفط) . النظام المستخدم هنا لديه القرار المكانية 64 نانومتر في 100X (الغمر النفط) التكبير. المكثف المستخدمة لهذا عشيقذ على حد سواء كوهلر والحرجة ميزات الإضاءة، ويركز الضوء موازى للغاية في الزوايا المائلة على العينة.- سد العجز في وبدوره على مصدر للضوء، XY تحكم المرحلة، وكاميرا بصرية (لتصوير الساحة المظلمة)، وكاميرا الفائقة الطيفية، ونظام الكمبيوتر. تعيين مصدر الضوء إلى طاقة 75٪. رفع المرحلة إلى أقصى ارتفاع. ربط نور الهداية إلى المكثف لتعزيز التصوير الساحة المظلمة أو إلى الموازاة على الجزء الخلفي من مجهر لتصوير brightfield ينعكس.
ملاحظة: من خلال وضع مصدر الضوء إلى طاقة 75٪، وهناك ما يكفي، والإضاءة موحدة من كل بكسل في مجال كامل من الرأي القائل بأن يعزز ممل بكسل في حين لا يزال يسمح لالتناقض بين بكسل مملة ومشرق. - رفع المكثف إلى وضع التشغيل. تطبيق 3-5 قطرات من نوع-A النفط الغمر على عدسة مكثف بعناية، وتجنب تشكيل أي فقاعات. يمسح النفط وتطبيق ذلك، إذا كان ينبغي أن تشكل الفقاعات.
- ضع س الشريحةن المرحلة. رفع ببطء المكثف حتى يجعل النفط الغمر اتصال مع الشريحة. هذا وسوف يكون ملحوظا خلال حلقة اشراق بسرعة من الإضاءة حيث يجعل النفط اتصال مع الشريحة.
- سد العجز في وبدوره على مصدر للضوء، XY تحكم المرحلة، وكاميرا بصرية (لتصوير الساحة المظلمة)، وكاميرا الفائقة الطيفية، ونظام الكمبيوتر. تعيين مصدر الضوء إلى طاقة 75٪. رفع المرحلة إلى أقصى ارتفاع. ربط نور الهداية إلى المكثف لتعزيز التصوير الساحة المظلمة أو إلى الموازاة على الجزء الخلفي من مجهر لتصوير brightfield ينعكس.
- وضع الهدف 10X في المكان. التركيز ومحاذاة المكثف من خلال دراسة من خلال oculars.
- نقل المرحلة صعودا وهبوطا عبر الخشنة موضوعي مقبض التركيز حتى يتم تعظيم السطوع.
- التحرك المكثف تركز صعودا وهبوطا من خلال تعديل مقبض الباب مكثف حتى يتم العثور أقصى سطوع. محاولة لخلق ألمع نقطة مركزية الممكنة في مجال الرؤية.
- ضبط مكثف محاذاة المقابض عند الضرورة لتوسيط نقطة مضيئة، إذا لزم الأمر.
- استخدام غرامة مقبض التركيز موضوعي لجلب نقطة مضيئة في التركيز. عند تغيير الأهداف للحصول على التكبير مختلفة، تعدل الطائرة التركيز. عند استخدام الهدف 100X، وتطبيق قطرة من زيت الغمر على ساترة لتعزيز عشرالصورة الإلكترونية وتجنب الأضرار التي لحقت العدسة الشيئية.
- التقاط الصور
- استخدام جهاز تحكم المرحلة لإيجاد منطقة الفائدة. وسيتم تحديد هذه المنطقة التي كتبها احتياجات التجربة. وهناك مؤشر نموذجي يكون التباين العالي مع المناطق المحيطة بها، على أنها مناطق قاسى مع جزيئات أكسيد المعادن غالبا ما تظهر أكثر إشراقا من المناطق بدونها.
- جلب المنطقة إلى التركيز باستخدام غرامة موضوعي مقبض التركيز، وضبط التركيز المكثف على أنه ضروري لتوازن الإضاءة. تحقيق منطقة عالية التباين، الذي يعرف جيدا داخل مجال الرؤية.
- تحديد ما هي الصور (للكاميرا بصرية) أو datacubes (للكاميرا الفائقة الطيفية) وسوف يتم القبض، وبأي تسلسل. عادة، يتم الحصول على الصور الضوئية مع الهدف 10X الهواء، الهواء الهدف 40X، و100X الهدف غمر النفط والمقابلة HSI datacube مع الهدف الغمر النفط 100X.
- فتح برامج التصوير الضوئي. انقر على "إعدادات &# 8221؛ في شريط القوائم. حدد "التقاط الصور زر لالتقاط الحدث". حدد تنسيق الصورة المخزنة (تم استخدام TIFF لهذه التجربة)؛ تعيين اسم الملف. تصفح وحدد مجلد الصور المخزنة. الحفاظ timelapse الافتراضية. انقر على زر "موافق".
- حدد إعدادات التعرض التي تخلق أعلى النقيض من الصورة في القائمة "التعرض" (لهذه الدراسة، على مستوى 0.0٪، وزيادة من 3.0 ديسيبل، ومصراع من 35 مللي كانت تستخدم).
- التقاط الصورة عن طريق النقر على زر "صورة" في شريط القوائم. التقاط العديد من الصور الساحة المظلمة منخفضة التكبير بالإضافة إلى تلك التي في تضخم عالية عن طريق تغيير أهداف المجهر، من أجل توفير السياق.
ملاحظة: التقاط الصور الضوئية في نفس التكبير إلى أي datacubes التي سيتم التقاطها باستخدام الكاميرا الفائقة الطيفية، وهذه الصور الضوئية تميل إلى أن تكون أكبر مجال الرؤية وأفضل المظهر الجمالي للتفتيش البصرية لاحق. ومن الضروري أن أي datacubes التي سيتم لاحقا تحليل طيفيا استخدام التكبير ثابت، كما أنه من الممكن أن تغيير الهدف سوف يغير الأطياف انتقال البصريات المجهر، وتغيير أطياف القبض عليه، وبالتالي تقليل دقة معين زاوية الطيفي (SAM). إذا تم مقارنة datacube إلى datacube المتحصل عليها مع هدف مختلف، قد لا تعمل وظيفة SAM.
- حدد الطيفية للكشف عن كاميرا التصوير عن طريق إعادة توجيه مقبض مصدر الضوء على المجهر إلى الكاميرا الفائقة الطيفية. إذا تم توجيه الضوء نحو الكاميرا الفائقة الطيفية، سيتم عرض أي صورة في برنامج الكاميرا الضوئية. تقليل لكن لم يتم إغلاق إطار البرنامج التصوير الضوئي، كما يمكن للمرء أن في حاجة إليها على النحو المحدد في الخطوة 2.4.4.
- التقاط Datacubes
- فتح برامج التصوير فائق الأطياف لشراء datacubes HSI. ضمان توجه دليل الضوء إلى الكاميرا الفائقة الطيفية.
- فتح "HYPمجهر erspectral "في شريط القوائم واختيار" الضوابط HSI مجهر ".
- تعيين التكبير موضوعي وحفظ المسار. تأكد من تسمية كل الصور والملفات بشكل مميز حتى لا يحدث الكتابة فوق. تغيير القبض على المنطقة من خلال تعديل إعدادات مجال الرؤية أو عدد من خطوط (استخدم 720 خطوط لهذه الدراسة)، مع قدر كبير من الوقت الإضافي اللازم لالتقاط مناطق أوسع. وأخيرا، تعيين وقت التعرض (0.25 ثانية لهذه الدراسة). ترك كل شيء لالافتراضي، وانقر على زر "معاينة HSI" لعرض الصورة.
ملاحظة: الرسم البياني الذي يظهر كثافة يظهر datacube HSI التي سيتم تسجيلها في المحور الأفقي. المحور الرأسي يمثل الأطوال الموجية للالأطياف التي سيتم التقاطها في datacube HSI. وضع المؤشر في أي موقف على الرسم البياني شدة المقابلة لطول الموجة الطيفي يسبب شدة جميع النقاط عبر الصورة، على أن الطول الموجي، ليتم عرضها. التركيز على أساس هذه المعاينة عن طريق ضبط التركيز الموضوعي على ما يرام لشحذ القمم في هذه الصورة. إذا هذا أمر صعب جدا، البعد البؤري الكاميرا البصرية يشبه إلى حد ما، لذلك تحميل برامج التصوير الضوئي وتحويل شريط الانزلاق إلى الكاميرا البصرية، والتركيز، ومن ثم العودة إلى برامج التصوير فائق الأطياف والعودة شريط الانزلاق إلى الكاميرا الفائقة الطيفية . - ضبط شدة من هذه المعاينة عن طريق ضبط سطوع مصدر، والتركيز المكثف، أو عن طريق إلغاء المعاينة لضبط وقت التعرض. هذه الأخيرة تعطي أفضل النتائج، ولكن زيادة وقت التعرض يمكن أن يستغرق وقتا أطول لصورة. والهدف من ذلك هو لقمة أكثر أهمية أن تكون كبيرة بما فيه الكفاية، ولكن لا يتجاوز الحد الأقصى للكثافة للكشف. هنا، ومجموعة المثالي هو بين 1000 و 16000 وحدة.
- انقر على "القبض". سوف يسأل المجهر لالتقاط صورة الحالية المظلمة. إعادة توجيه شريط الشريحة الأعلى أو فتحة (بعناية، حتى لا تعكر صفو محاذاةومحور أي من البصريات الأخرى)، وانقر على "OK". استعادة شريط الشريحة أو الفتحة إلى الموضع الصحيح وانقر على زر "موافق" مرة أخرى عندما موجه لتظهر الصورة. التصوير يمكن أن يستغرق فترة تصل إلى 30 دقيقة، على الرغم من الأوقات من حوالي 5 دقائق أكثر نموذجية. مرات التعرض أطول تؤدي إلى أوقات التصوير أطول. مؤشر تقدم موجودا. يجب الحرص على عدم تعكير صفو جسديا نطاق قبل اكتمال مؤشر التقدم.
- نلاحظ أربع نوافذ جديدة مع أسماء: "قائمة العصابات المتاحة"، "# 1zoom"، "# 1scroll" و "# 1 RGB الفرقة". تحقيق أقصى قدر من نافذة "# 1RGB فرقة" لأن هذا هو datacube لجميع إشارات المستقبل.
- انقر على الحق في datacube وحفظه باعتباره TIFF وانقر على "OK". إذا انتهى التصوير. وضعت بعيدا كل العينات. تنظيف جميع الأسطح المعرضة للنفط مع 70٪ الأيزوبروبانول في الماء؛ رفع المرحلة إلى أقصى ارتفاع. انخفاض مكثف لارتفاع الحد الأدنى والصحافة في موقف غير التشغيلي؛ إغلاقأسفل أو افصل مصدر للضوء، تحكم المرحلة، والكاميرات.
3. إنشاء مرجع الطيفي المكتبات
- اختيار المرجعية الأطياف
- حدد تحكم إيجابية ما هو معروف لاحتواء المواد التي تهم الواردة في المصفوفة نفسها باعتبارها نماذج تجريبية، منذ HSI ملامح الطيفية هي التي تعتمد على المصفوفة.
- لهذه الدراسة، استخدم الجلد الخنازير حقن بجرعات عالية من جزيئات أكسيد المعادن والضوابط الإيجابية للمقارنة التجريبية أنسجة الجلد الخنازير من دراسة التعرض الموضعي. تم إنشاء التشكيلات الطيفية للجزيئات أكسيد المعادن في التعليق ودرست وجدت لتكون عنصر تحكم إيجابية ملائمة لعينات تجريبية النسيجية نظرا لمصفوفات مختلفة.
- الحصول على datacube من السيطرة الإيجابية كما هو موضح في الخطوة 2.4، استخدام الكاميرا الفائقة الطيفية.
- توخي الحذر بشكل خاص عند حد ذاتهاtting كثافة، وهذا هو المقياس الأساسي الذي فلتر الجسيمات الداخلي وتحديد المواد. فإن أي كثافة أعلى من نقطة التشبع للكشف (هنا، 16000 وحدة) يؤدي إلى بيانات غير صحيحة (راجع الخطوة 2.4.5).
- انقر بزر الماوس الأيمن في إطار الصورة، وغادر انقر على "الطيف Z-الشخصي". سيظهر الطيفي الملف نافذة منبثقة. غادر انقر على بكسل من الفائدة على datacube، ولا سيما ألمع منها أو تلك التي يمكن تحديدها بكل ثقة بأنها تمثل المواد المثيرة للاهتمام. مراقبة الطيفي الملف نافذة تظهر الطيف المرتبطة بها. يحيط علما ولا سيما من أدنى وأعلى قيمة، والذي يتوافق عليه الطول الموجي.
- عندما مسح عينة مراقبة إيجابية، والمسح بالضغط على المناطق ذات الاهتمام التي هي مشرقة جدا نسبة إلى الأنسجة المحيطة بها، ولا سيما مع جزيئات يسهل تحديدها. من المرجح أن تكون الأم هذه الجسيماتأمية المصالح، لا سيما في حالة من المعادن.
- استخدام "الجسيمات تصفية" أداة ضمن القائمة "تحليل الجسيمات" لتحديد الجزيئات الموجودة في datacube. في إطار منبثق جديد، ومراقبة "الطيفي ماكس يجب أن تتجاوز". وسيتم تحديد ذلك من خلال الملاحظات في الخطوة 3.1.3. تعيين هذه القيمة لذلك هو أعلى من الخلفية بكسل، ولكن أقل من المواد المثيرة للاهتمام. و"ماكس بيانات صالح" هو الحد الأقصى للكثافة (هنا، 16000 وحدة).
- ترك غيرها من المعالم التقصير، ولكن استبعاد الأشياء على أساس الحجم عن طريق ضبط مربع "حجم عتبة". حفظ هذه البيانات إما عند هذه النقطة، أو بعد تشغيل التحليل. لهذه التجربة، استخدم المعلمات التالية: الطيفي ماكس يجب أن يتجاوز: 5000؛ صحيح ماكس البيانات: 16000. حجم عتبة (بكسل): 400. مرة واحدة وقد تم تعيين كافة المعلمات، انقر فوق "موافق".
- نلاحظ في الرسم البياني الناتج مع تفاصيلالجسيمات الكشف داخل عتبة شدة اللزوم. يمكن تصدير هذه البيانات. إذا كان من المعروف مميزة الحد الأقصى لطول الموجة انعكاس لمادة الفائدة، حدد تلك الجزيئات التي لها قيمة مماثلة "ماكس WL". خلاف ذلك، انقر فوق "تحديد كافة". ثم انقر فوق "تصدير". "إلى المكتبة الطيفي". اختيار اسم الملف ثم انقر فوق "موافق".
- حدد تحكم إيجابية ما هو معروف لاحتواء المواد التي تهم الواردة في المصفوفة نفسها باعتبارها نماذج تجريبية، منذ HSI ملامح الطيفية هي التي تعتمد على المصفوفة.
- إزالة الأطياف إيجابية كاذبة
- اختيار عينة من شأنها أن تكون بمثابة سيطرة سلبية. كان يجب أن تعد هذه عينة وتعامل بنفس الطريقة التي حفظ جميع العينات التجريبية أن غياب النانوية متشابهة أو متطابقة إلى المواد ذات الاهتمام مضمونة.
ملاحظة: من المهم أن المصفوفة من السيطرة السلبية هي نفس المصفوفة من العينات التجريبية، كما HSI ملامح الطيفية هي التي تعتمد على المصفوفة. لهذه الدراسة، كنا الجلد الخنازير التي لم تتعرض لمواد النانوية أكسيد المعادن سلبياضوابط. - الحصول على العديد datacubes من السيطرة السلبية كما هو موضح في الخطوة 2.4.7، وذلك باستخدام الكاميرا الفائقة الطيفية. واحد على الأقل هو مطلوب، ولكن أكثر يمكن الحصول عليها لزيادة الانتقائية (وهذا مهم بشكل خاص في حال أن بعض الملوثات قد تكون في أطياف المرجعية).
- استخدام برامج التصوير فائق الأطياف لتصفية مكتبة الطيفية التي تم جمعها في الخطوة 3.1 (مراقبة إيجابية) ضد كل datacube المأسورة في خطوة 3.2.2 (ضوابط السلبية) متسلسل، كما هو موضح في الخطوات التالية:
ملاحظة: حفظ الناتجة عن ذلك، تمت تصفيتها مكتبة الطيفية لملف منفصل، واستخدام كمكتبة الطيفية المرجعية للمواد المثيرة للاهتمام.- انقر على "تصفية مكتبة الطيفي" ضمن القائمة التحليل، وتقع على شريط الأدوات البرنامج الرئيسي. انقر فوق "فتح". "ملف جديد" وحدد مكتبة الطيفية بإنشائه في الخطوة 3.1. لمراقبة إيجابية مثل ملف الإدخال. انقر على زر "موافق".
- لهمصدر xternal، حدد "صورة" تحت خانة الطيفي البيانات. الحفاظ على الإعدادات الافتراضية ضمن المربع معالجة معلمات. اختيار اسم الإخراج لمكتبة المصفاة (هذا ينبغي أن يكون مختلفا عن النص الأصلي، أو ستفقد المكتبة الطيفية الخام التي تم جمعها). انقر على زر "موافق".
- انقر فوق "فتح". "ملف جديد" وحدد datacube أولا المأسورة في خطوة 3.2.2 لمراقبة سلبية، عندما يطلب منك تحديد مصدر الصورة.
ملاحظة: سوف يقوم البرنامج بتحليل مكتبة الطيفية وإزالة كل الطيف الذي يطابق أي طيف من سيطرة datacube سلبية. إزالة خلفية من معايير الاختيار مما يقلل من احتمالات-ايجابيات كاذبة. وملخص تكون متاحة عندما يتم ذلك (لاحظ أن هذا الملخص لا يتم حفظ تلقائيا). - إذا كان المطلوب تصفية إضافية، كرر من الخطوة 3.2.3.1، ما عدا: خطوة 3.2.3.2، حدد مشاركة مكتبة الطيفية التي تمت تصفيتها خلق (الناتج بعد خطوة 3.2.3.3 المشترك.mpletes)؛ في خطوة 3.2.3.3، حدد datacube القادم من الخطوة 3.2.2.
ملاحظة: تصحيح وتطبيع لطيف مصباح قد يكون ضروريا إذا كانت العينات تبعثر قدرا كبيرا من الضوء (على سبيل المثال، أنابيب الكربون النانوية) و / أو إذا صفر أطياف تبقى عند تصفية عنصر تحكم مكتبة الطيفية إيجابية ضد سيطرة سلبية. لم تنشأ هذه الظروف لدراستنا وذلك لم يتم تنفيذ هذا التصحيح.
- اختيار عينة من شأنها أن تكون بمثابة سيطرة سلبية. كان يجب أن تعد هذه عينة وتعامل بنفس الطريقة التي حفظ جميع العينات التجريبية أن غياب النانوية متشابهة أو متطابقة إلى المواد ذات الاهتمام مضمونة.
تحليل 4. صورة
- الطيفية زاوية رسم الخرائط
- فتح "الطيفي زاوية مخطط" (SAM) من القائمة الطيفي، طرق رسم الخرائط الفرعية، وذلك باستخدام برامج التصوير فائق الأطياف مرة واحدة تم الحصول عليها كل datacubes التجريبية التالية الخطوة 2.4. زاوية مخطط الطيفي يقارن الأطياف من خلال تحليل هندسي التغيرات في كثافة بوصفها وظيفة من الطول الموجي (أي أنه يقارن بين أطياف عن طريق تطبيع كثافتها ومقارنة الزوايا إعادةفلكل لتتبع الرسم البياني من كل الأطياف) 24.
- مع datacube فتح، حدد اسم datacube التجريبية في إطار منبثق وانقر على "OK". إذا تم سرد لم أسماء الملفات، انقر فوق "فتح". "ملف جديد"، اختر datacube التجريبية، ثم انقر فوق "موافق".
- مراقبة نافذة منبثقة جديد يسمى Endmember مجموعة: SAM. انقر فوق "استيراد" في شريط القوائم، ثم اختر "من الطيفي ملف مكتبة". نافذة منبثقة ستظهر اسمه الطيفي مكتبة ملف الإدخال. فتح مكتبة الطيفي المرجعي الذي تم إنشاؤه في الخطوة 3.2.3. وانقر على "OK". مراقبة نافذة منبثقة جديد يسمى "الإدخال مكتبة الطيفي".
- انقر على "تحديد كل الأصناف". انقر على زر "موافق" انقر بزر الماوس الأيمن على "اللون" وحدد "تطبيق الألوان الافتراضية للجميع." انقر "حدد كافة"، يليه "تطبيق" ثم اختيار اسم ملف الإخراجد انقر فوق "موافق". سوف الطيفي زاوية مخطط اتخاذ بضع ثوان لتحليل وحفظ البيانات.
- فتح datacube في برامج التصوير فائق الأطياف. حدد "تصنيف" في القائمة تراكب من نافذة الصورة، ثم انتقل إلى اسم الملف ثم انقر فوق "موافق". يمكن للمستخدم الآن تراكب أي طيف من المكتبة لنرى أين هم الخريطة لفي الصورة.
- حدد "دمج فئات" خيار من القائمة الخيار في "أداة الطبقة التفاعلية" فتح من خلال القائمة تراكب في إطار الصورة، إذا كان المطلوب مخطط لون موحد، مثل لتسهيل التحليل من قبل البرامج الأخرى (كما هو موضح في الخطوة 4.2 .).
- تسليط الضوء على جميع التصنيفات في الجمع بين (عادة، كل شيء ما عدا "غير مصنف" في "الطبقات لدمج إلى قاعدة" القائمة)، وحدد مجموعة واحدة من القائمة "الفئة الأساسية"، ثم انقر فوق "موافق". هذا اللون سوف repres الآنوالأنف والحنجرة جميع أطياف المحدد.
- انقر على اللون المحدد وسيتم عرض جميع أطياف مطابقة في هذا اللون.
- للحصول على صورة مبصر اللونين التي سوف تظهر أطياف مطابقة على خلفية سوداء، cIick على مربع الألوان "غير المصنفة"، وهو الأسود افتراضيا. نلاحظ صورة مبصر اللونين. هذه الخطوة يمكن عكسها من خلال النقر مرة أخرى على مربع الألوان "غير المصنفة".
- انقر بزر الماوس الأيمن لحفظ الصورة باعتبارها TIFF، بما في ذلك أي تراكب النشطة حاليا.
ملاحظة: للحصول على معالجة التصوير في المستقبل، وسوف تستخدم صورة مبصر اللونين. - حدد "توزيع فئة" من القائمة الخيار في "أداة الدرجة التفاعلية" نافذة للحصول على إحصاءات رسم الخرائط. وتمثل هذه البيانات كيف كان العديد من بكسل تفاصيلها (غير مصنف) وعدد اعتبرت المادة المثيرة للاهتمام. لاحظ أن عدد البكسل لا تتوافق مع عدد الجسيمات معين. هذه المعلومات ليست ص تلقائياecorded.
- تحليل الجسيمات في الطيفي المعينة الصور
- فتح الصور في برنامج NIH يماغيج.
- استخدام القائمة صورة، ضبط القائمة الفرعية "عتبة" وظيفة. حدد المعلمات التي تميز الجزيئات من الاهتمام من جميع المواد الأخرى. استخدام المعلمات عتبة التالية لهذه الدراسة: طريقة العتبة الافتراضية، اللون الأحمر، لون الفضاء HSB، فحص مربع خلفية مظلمة، مربعات تمرير التحقق من هوى، والتشبع والسطوع.
ملاحظة: هذا قد تتفاوت تفاوتا كبيرا من حالة إلى أخرى. عند تحليل datacube معين، وهذا يمكن أن تكون مبسطة من خلال توحيد جميع الطبقات ذات الصلة للون واحد وتتراكب هذا اللون مع جميع الألوان غير المصنفة قبل إنشاء صورة (الخطوات 4.1.4 إلى 4.1.8). - استخدم القائمة تحليل "تحليل الجزيئات" وظيفة، والتي سوف استرجاع المعلومات عن المنطقة، يعني الحدين الأدنى والأقصى. لهذه الدراسة، استخدم المعلمات هنا: حجم 0 اللانهاية، دائرية0-1، وتظهر شيئا، فحص عرض النتائج مربع.
- للتحليل الإحصائي، تصدير هذه البيانات إلى برنامج آخر تمكن المقارنة الإحصائية مع عدد وحجم الجسيمات الموجودة في عينات مراقبة مماثلة. نحن نقترح استخدام جداول البيانات لتحليل البيانات يماغيج. يجب نسخ البيانات المعروضة في الجدول النتائج بعد خطوة 4.2.4 إلى جدول بيانات. وظيفة MAX يمكن استخدامها على أول (بدون عنوان) عمود لتحديد عدد من الجزيئات، في حين أن وظيفة العادي يمكن أن تستخدم على عمود المساحة لتحديد حجم متوسط من الجسيمات. في المستقبل، سيتم متابعة التحقق التجريبي للتحقيق في هذه الوظيفة في تحديد متوسط الحجم ضد معيار أنشئت لتحجيم (على سبيل المثال، TEM).
النتائج
المجهر الطيفي هو مفيد لقدرته على تحديد المواد بطريقة مماثلة لقياس الطيف الضوئي. كما هو مبين في الشكل 1، كل مادة لديها العديد من أطياف مميزة والشكل العام للانعكاس، والتي هي فريدة من نوعها. وعلاوة على ذلك، يوضح الشكل 1 الطبيعة التي تعتمد على مصفوفة لمحات الطيفية: لمحات طيفية لكل من أكاسيد المعادن الثلاثة في عينات الأنسجة النسيجية (اللوحة العلوية) تختلف عن ملامح الطيفية لكل من أكاسيد المعادن الثلاثة في تعليق مائي ( اللوحة السفلية). عن طريق تعيين لمحات طيفية مميزة لعينات مجهولة في نفس المصفوفة، والتقنية هي مفيدة لتحديد وجود أو عدم وجود المواد، ويمكن أيضا مقارنة نصف الكمية كميات النسبية من المواد في العينات.
المكتبات الطيفية المرجعية التي تم إنشاؤها من عينات الجلد مراقبة إيجابية مناسبة لرسم خرائط لالتجريبيةعينات الجلد. كما رأينا في الشكل 2، والمكتبات الطيفية المرجعية خريطة جيدا إلى الضوابط الإيجابية المقابلة و لا خريطة للضوابط السلبية المقابلة.
أهم ميزة لهذه التقنية هي قدرتها على اكتشاف مستويات منخفضة من المواد الاهتمام العينات، وكذلك لتمييزها عن الملوثات. على سبيل المثال، الأنابيب النانوية الفردية يمكن ملاحظة في الرئتين أثناء الشهيق من جرعات منخفضة تصل إلى 40 ميكروغرام في 20-30 ز الفئران 25 الشكل 3 يوضح هذا في عينات الجلد النسيجية: في حين أن بعض الجسيمات واضحة بسهولة في الصورة البصرية الساحة المظلمة (العمود 2)، تم الكشف عن الآخرين باستخدام التصوير الطيفية (العمود 3) يمكن أن تكون قد غاب باستخدام المجهر brightfield (العمود 1) أو وسائل أخرى. يخدم استخدام الساحة المظلمة HSI أيضا إلى تحسين نوعية خلال المجهر brightfield بسيط. ويمكن لهذه الصور أن تكون ثم يخضع لمزيد من النماذج الكمية للتحليل، نتحليل الجزيئات otably عبر يماغيج.
تعزيز المجهر الساحة المظلمة لديها العديد من التطبيقات المختلفة، حتى في غياب التصوير فائق الأطياف. الأول هو قدرتها على توليد عالية الجودة، وصور عالية التباين. هو أفضل يتضح ذلك من الشكل 3، الذي جزيئات الفائدة يمكن تحديدها بسهولة بالمقارنة مع نظرائهم brightfield بهم. ويمكن لهذه الصور أيضا أن تخضع للتحليل الكمي الجسيمات، على الرغم من عدم وجود خرائط الطيفية، والحذر ضروري لتجنب الخلط بين الجسيمات الملوثة من الجسيمات المثيرة للاهتمام.
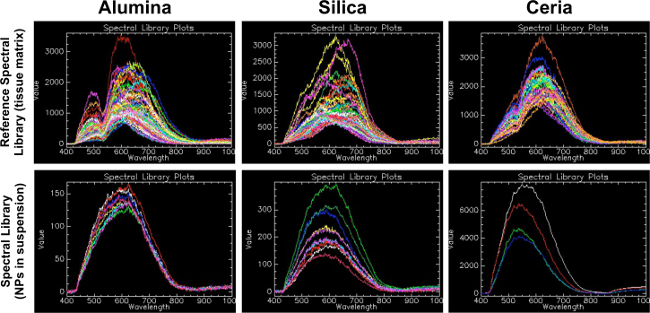
الشكل 1. المرجعي المكتبات الطيفية (مصفوفة الأنسجة) مقارنة المكتبات الطيفية (النانوية في تعليق). يوضح هذا الرقم على أهمية توليد مكتبة طيفية إشارة من نانomaterials من الفائدة في نفس المصفوفة كما العينات التجريبية. ويظهر في الصف الأول في مكتبة الطيفية المرجعية (RSL) لكل مادة في هذه الدراسة (الألومينا والسليكا وceria). الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
تم إنشاء هذا RSL بواسطة الطريقة الموصوفة في هذا البروتوكول، حيث تم تصفيتها عينات الأنسجة مراقبة إيجابية ضد عينات الأنسجة السيطرة السلبية. ويظهر في الصف الثاني المكتبات الطيفية (SL) التي تم إنشاؤها من الجسيمات النانوية من الاهتمام في تعليق السائل على شريحة زجاجية. لالألومينا، تم العثور على ذروة ذات النسقين في موجات من 500 و 650 في RSL، في حين كان ينظر الى الذروة أكثر المنحنية وأقل مميزة في الألومينا NP تعليق SL حوالي 600. لالسليكا، وبلغت ذروتها في الطول الموجي حوالي 650 كان موجودة في RSL، في حين كان ينظر الى الذروة أكثر المنحنية وأقل مميزة في السيليكا NP تعليق SL في أروالثانية 600. لceria، تم العثور على ذروة ذات النسقين في موجات من 520 و 620 في RSL، في حين كان ينظر الى ذروة أقل مميزة في ceria NP تعليق SL بنحو 560. وهذا يشير إلى أن المصفوفة التي هي جزء لا يتجزأ من مصادر القدرة النووية يخلق تحول في الأطياف التي يمكن أن تكون كبيرة عند اختيار الضوابط لإنشاء SL لتجربة محددة.
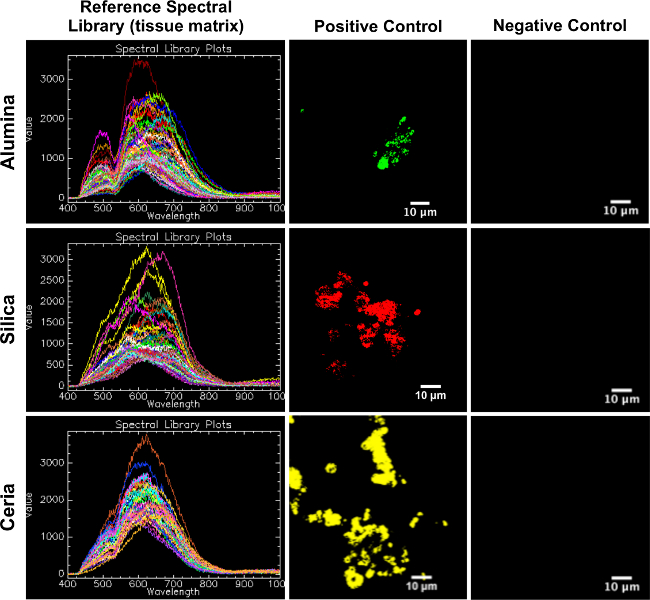
الرقم المرجعي 2. المكتبات الطيفية (مصفوفة الأنسجة) معين على السيطرة الإيجابية والسلبية السيطرة أنسجة الجلد الخنازير. يخدم هذا الرقم تأكيدا للRSLs بما يتناسب مع رسم الخرائط لعينات تجريبية، في أن كل RSL (العمود الأيسر) خرائط جيدا إلى المقابلة السيطرة الايجابية (العمود الأوسط) وليس خريطة لفي المقابلة سيطرة سلبية (العمود الأيمن). الرجاء انقر حيحرث لعرض نسخة أكبر من هذا الرقم.
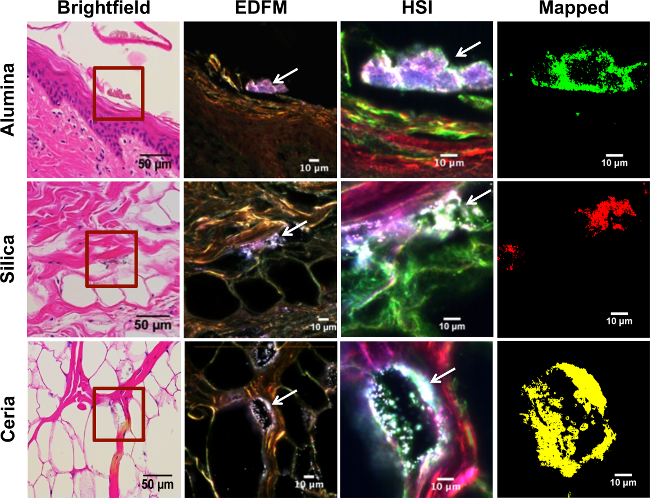
الشكل 3. الطيفي رسم خرائط تجريبية أنسجة الجلد الخنازير تتعرض لجزيئات أكسيد المعادن. الصفوف من أعلى إلى أسفل تتوافق مع الطبقات المختلفة من الجلد، من سطحية إلى أعمق طبقة: البشرة، الأدمة، والأنسجة تحت الجلد، على التوالي. ويظهر في الصف الأول في الطبقة القرنية من البشرة من عينة من الجلد التي تعرضت للمصادر القدرة النووية الألومينا في تعليق. تعرضت الصف الثاني إلى السيليكا المصادر في تعليق. والصف الثالث إلى ceria المصادر في تعليق. كل عمود يصور نفس المنطقة من الجلد تصويرها مع تقنيات مختلفة. العمود الأول يتوافق مع المجهر brightfield (40X ماج على نطاق و؛ بار = 50 ميكرون)، حيث تم تضخيم المنطقة المغلقة في الساحة الحمراء (100X ماج؛ شريط النطاق = 10 ميكرومتر) مع تعزيز المجهر الساحة المظلمة (EDFM) في العمود الثاني، حيث السهام البيضاء تشير إلى التباين العالي مصادر القدرة النووية. تم الحصول على العمود الثالث مع كاميرا الفائقة الطيفية (HSI)، والتي تبين نفس مصادر القدرة النووية التباين العالي (السهام البيضاء). اتخذت EDFM وHSI الصور في التكبير 100X. = شريط نطاق 10 ميكرون. العمود الرابع يظهر صورة HSI معين ضد RSL منها لكل مجموعة التعرض، حيث يتم عرض مصادر القدرة النووية الألومينا في الخضراء، ومصادر القدرة النووية السيليكا باللون الأحمر، وceria المصادر في الأصفر، على التوالي. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
ليمكن تحقيق عينات الأنسجة التي خضعت تلطيخ النسيجية التقليدية، وتحديد وتحليل جزيئات أكسيد المعدن من خلال مزيج من EDFM، ورسم الخرائط HSI، وتقنيات تحليل الصور. في حين أن هناك مرونة في إعداد العينات لالأنسجة أو المناعية (على سبيل المثال، وذلك باستخدام الأنسجة الثابتة أو تجميدها؛ نوع من وصمة عار)، فمن المهم أن العينات مقطوع لسمك 5-10 ميكرون التصور الأمثل. وكانت العينات المستخدمة هنا الثابتة الفورمالين وقبل باجتزاء مع مشراح الدوارة إلى 6 ميكرون سمك جزءا لا يتجزأ من البارافين، التي شنت على شرائح المجهر الزجاجية، ملطخة الهيماتوكسيلين ويوزين وcoverslipped. تم استخدام أنسجة الجلد الخنازير من الجلدي التعاون فيفو السابقين اختراق السموم لهذه الدراسة. تعرضت أنسجة لجزيئات أكسيد المعادن (الألومينا والسليكا وceria) في تعليق مائي. الكشف عن المنطقة (ق) من الفائدة (التباين العالي إيليمياليلة) مع EDFM هو الخطوة الأولى الحاسمة التي تسهل رسم الخرائط HSI لاحق والتحليل. يجب تصوير عينات السيطرة الإيجابية والسلبية وتحليلها أولا من أجل إنشاء مكتبة الطيفية لتكون مرجعا. ويتم تصدير الأطياف التي تم جمعها من السيطرة الإيجابية لمراقبة إيجابية مكتبة الطيفية. ثم، يتم طرح جميع الأطياف من الصور سيطرة سلبية من مكتبة الطيفية مراقبة إيجابية من أجل تحسين نوعية (لحد من ايجابيات كاذبة). ويعتبر الناتج تصفيتها مكتبة الطيفية RSL يخدم لتحليل المواد المثيرة للاهتمام. جميع عينات الأنسجة الخضوع لعملية التصوير نفسها، ويتم تعيين ضد RSL. فإن الصورة الناتجة تحتوي على المناطق الوحيدة مع عناصر من الفوائد على خلفية سوداء. ويمكن بعد ذلك بتحليل هذه الصورة مع يماغيج باستخدام وظائف العتبة وتحليل الجزيئات من أجل الحصول على مجال الجزيئات المعينة في مجال الرؤية. البيانات الرقمية التي تم الحصول عليها من يماغيج يمكن أن يكون التصديرإد إلى جدول بيانات لمزيد من التحليل.
من المهم أن نعتبر أن كعينات البيولوجية تختلف بطبيعتها عن بعضها البعض، وأساليب تلطيخ قد تؤثر على التصور من خلال EDFM وHSI، ينبغي تحديد إعدادات التعرض وفقا لما ينتج أفضل صورة التباين العالي لنوع معين من العينة. على الرغم من أن الحد من ايجابيات كاذبة يمكن أن يتحقق من خلال الترشيح المكتبات الطيفية، فمن الأهمية بمكان الحصول على ضوابط السلبية الموثوق بها التي تجنبت التلوث مع عنصر المصلحة، كما الأطياف المقابلة لهذا التلوث المحتمل أن تتم تصفيته من مكتبة الطيفية السيطرة الإيجابية ل ، وزيادة معدلات سلبية كاذبة. أيضا، ومجموعة كثافة الطيف الذي يمكن كشفها مع برنامج التصوير الطيفية لا يمكن أن يتجاوز الحد الأقصى للبرنامج معين (على هذه الدراسة، وهذا هو 16000 وحدة): المناطق مع عدد كبير من الجزيئات المتراكمة التي تنتج ليرة سوريةيتم ترك شدة ectral فوق الحد كثافة من المكتبة الطيفية، نظرا لخطر زيادة عدد من السلبيات كاذبة.
في حين أن النظام HSI يمنح مزايا عديدة أكثر من الطرق التقليدية، هناك بعض السلبيات وأوجه القصور للنظر فيها. واحد هو أن كمية كبيرة من البيانات البصرية التي تم جمعها قد تتطلب قوة الحوسبة كبيرة. آخر هو أن HSI يمكن أن يكون الوقت كثيفة، وخاصة في المراحل الأولى عندما يتم خلق مرجعية المكتبات الطيفية. أيضا، قد تتطلب وقتا التصوير عدة دقائق في التقاط الصور، مما يجعلها أبطأ من التصوير الساحة المظلمة بسيط. ومع ذلك، فإنه لا يزال أسرع من أداء إعداد العينات والتصور بواسطة المجهر الإلكتروني. بالإضافة إلى ذلك، قد يؤدي الأنظمة المعقدة في أطياف مميزة متعددة، والتي تتطلب وضع ضوابط درجة عالية من التخصص وجعل إنشاء موحدة والمكتبات مرجعية عالمية صعبة (26). وأخيرا، فإن التكنولوجياالنتائج يت ضمن في دقة أقل من التقنيات probe- أو الإلكترون المجهري، مثل مجهر القوة الذرية أو انتقال المجهر الإلكتروني، والتي يمكن حل ذرات الفردية. القرار هذا الأسلوب هو محدود نظرا لطبيعتها الضوئية، والذي يمنع من أن يكون أداة عالية الدقة لقياس أحجام الجسيمات على مستوى النانومتر أو لتحديد بدقة المواد على مستوى ميكرون الفرعية. في حين أن التقنية قد تكون قادرة على تحديد جزيئات معينة داخل المقصورات الأنسجة أو العضيات الخلوية أكبر من 1 ميكرون (مثل نواة الخلية)، العضيات أصغر أو ميزات تشكل تحديا لتصور بدقة مع هذا الأسلوب. ومن الجدير ذكره، نظرا القرار المكانية، ويمكن هذا الأسلوب لا تفرق بين الجسيمات النانوية واحدة وتكتلات 11.
وتشمل الاعتبارات الأخرى: بعض المواد (مثل المعادن النبيلة) لديها أعلى بكثير الانعكاس وملامح طيفية مميزة، والتي يمكن جعلها أسهل للanalyزي وخريطة طيفيا مع هذه الأداة. آخرون، مثل أكاسيد شبه لامع التحقيق في هذه الدراسة والمواد النانوية الكربونية 24، 27، قد يكون أكثر صعوبة بسبب من عناصر تكوينها، والشكل، واعتمادا على المصفوفة. في دراستين استنشاق الفئران التي ميرسر وآخرون، تم استخدام نظام مماثل لتلك التي استخدمت في هذه الدراسة من أجل تحديد موقع أنابيب الكربون النانوية في الرئة وأجهزة الثانوية على أساس التباين العالي بشكل ملحوظ مع الأنسجة المحيطة بها. ومع ذلك، لم يكن أظهر رسم الخرائط الطيفية في أي دراسة، من المحتمل بسبب شكل فريد من ألياف الكربون كان سمة كافية لتحديد الهوية. وهناك اعتبار آخر ويتعلق على وجه التحديد إلى الأنسجة: منذ إيداع النانوية التي تهم أجهزة معينة من خلال عمليات فيزيائية حيوية طبيعية لا يمكن التنبؤ بها (وغالبا في حد ذاته موضوع الدراسة)، ويمكن تحديد عنصر تحكم الإيجابية التي تنطبق يكون صعبا ويتطلب النظر في كيفية توليد سيطرة مآيت تؤثر على حالة المواد المثيرة للاهتمام. على سبيل المثال، إذا تم إنشاء مكتبة الطيفية من الجسيمات النانوية البكر من الفائدة، قد يكون من الصعب رسم خريطة للمكتبة لنفس تلك الجسيمات النانوية في الأنسجة أو الخلايا نتيجة للتغيرات في أطياف الناتجة عن تغيير في الجسيمات (على سبيل المثال، وذلك بسبب تغيير في درجة الحموضة، وانحلال، والتكتل، بروتين ملزمة) والمكروية العامة أو المصفوفة. وأخيرا، فإن تقنية محدودة في طبيعتها شبه الكمية: أنه يمكن أن يكون إلا الكمي مثل تقنيات المجهر ثنائي الأبعاد الأخرى لقرار مماثل، مما يعني أنه لا يمكن استخدامها بسهولة لأداء مهام مثل تميز عبء الجهاز الكلي للمادة.
عموما، EDFM وHSI توفير العديد من المزايا التصوير المواد متناهية الصغر وتوصيف التقنيات التقليدية، مثل TEM، HAADF ومدينة دبي للإنترنت. EDFM / HSI يسمح لسرعة الحصول على الصور وتحليلها، مما يوفر الوقت والتكلفة بالمقارنة مع أكثر conven مكثفةتقنيات tional. بالإضافة إلى ذلك، وإعداد العينات لEDFM / HSI هو عادة كل من الحد الأدنى وغير مدمرة، مما يوفر الوقت ويسمح أيضا لتحليل أكثر مرونة من عينة نظرا لأنه قد ثم استخدامها لتقنيات أخرى. وعلاوة على ذلك، HSI هي متعددة، مما يسمح لتحليل المواد النانومترية الحجم من العديد من المؤلفات ومجموعة متنوعة من المصفوفات. ويعمل فريق البحث لتحسين الطريقة الموصوفة هنا لمواد أخرى وأنواع العينات، بما في ذلك تقييم متعمق لخصوصية هذه التكنولوجيا. والخطوة القادمة حاسمة قيد التحقيق من قبل فريق البحث هو التحقق من صحة هذه التقنيات ضد معايير الذهب التقليدية (على سبيل المثال، رامان، TEM، SEM) للمواد وأنواع الأنسجة من الاهتمام.
Disclosures
The authors have nothing to disclose.
Acknowledgements
The authors thank Günter Oberdörster, DVM, PhD and Alison Elder, PhD (University of Rochester) and Mary Frame, PhD (Stony Brook University) for animal research collaborations resulting in tissue samples for analysis. Additionally, the authors thank: Christina Rotondi (Albany Medical College Histology Core); Rani Sellers, DVM, PhD and Barbara Cannella, PhD (Albert Einstein College of Medicine Histology and Comparative Pathology Facility); Leonardo Bezerra and Ahlam Abuawad (Brenner research team members); and Leslie Krauss, Byron Cheatham and Elyse Johnson (CytoViva). This work was supported in part by CDC-NIOSH grant OH-009990-01A1 and the NanoHealth and Safety Center, New York State, awarded to S.B.
Materials
| Name | Company | Catalog Number | Comments |
| CytoViva 150 Unit (condenser) | CytoViva (Auburn, AL) | mounted to Olympus BX43 microscope | |
| Olympus BX43 Microscope - Analyzer Slot - HSI with 10x and 40x air objectives and 100X oil immersion objective | obtained through CytoViva (Auburn, AL) | for use with CytoViva 150 Unit condenser | |
| Dagexcel-M Digital Firewire Camera - Cooled; includes Exponent 7 software | obtained through CytoViva (Auburn, AL) | enhanced darkfield camera and software | |
| CytoViva Hyperspectral Imaging System 1.4; includes Pixelfly hyperspectral camera, XY stage controller, ENVI hyperspectral imaging software | obtained through CytoViva (Auburn, AL) | hyperspectral camera and software | |
| cleanroom cleaned glass microscope slides (glass B slides) | Schott NEXTERION | 1025087 | reduced debris and artifacts compared to conventional glass microscope slides for optimal imaging |
| cleanroom cleaned glass microscope coverslips (#1.0; 22 mm x 22 mm x 1.45 mm) | Schott NEXTERION | custom | reduced debris and artifacts compared to conventional glass coverslips for optimal imaging |
| type A microscopy immersion oil | Fisher Scientific | 12368B | multiple suppliers |
| 70% isopropanol in water | multiple suppliers | ||
| ImageJ software | National Institutes of Health (NIH) | free open-source software online download | |
| metal oxide nanoparticles | supplied to the research team by industrial partners | alumina, silica, and ceria nanoparticles in aqueous suspensions. Due to a Non-Disclosure Agreement between the authors and industry partners, further product information cannot be disclosed. |
References
- Sun, W., et al. Endocytosis of a single mesoporous silica nanoparticle into a human lung cancer cell observed by differential interference contrast microscopy. Anal Bioanal Che. 391 (6), 2119-2125 (2008).
- Anselme, K., et al. The interaction of cells and bacteria with surfaces structured at the nanometre scale. Acta Biomate. 6 (10), 3824-3846 (2010).
- Anshup, A., et al. Growth of gold nanoparticles in human cells. Langmui. 21 (25), 11562-11567 (2005).
- Weinkauf, H., et al. Enhanced dark field microscopy for rapid artifact free detection of nanoparticle binding to Candida albicans cells and hyphae. Biotechnol. 4 (6), 871-879 (2009).
- Sondi, I., et al. Silver nanoparticles as antimicrobial agent: a case study on E coli as a model for Gram negative bacteria. J Colloid Interface Sc. 275 (1), 177-182 (2004).
- Berry, C. C. Possible exploitation of magnetic nanoparticle cell interaction for biomedical applications. J Mater Chem. 15 (5), 543-547 (2005).
- Chithrani, B. D., et al. Elucidating the mechanism of cellular uptake and removal of protein coated gold nanoparticles of different sizes and shapes. Nano Lett. 7 (6), 1542-1550 (2007).
- Chithrani, B. D., et al. Determining the size and shape dependence of gold nanoparticle uptake into mammalian cells. Nano Lett. 6 (4), 662-668 (2006).
- Elechiguerra, J. L., et al. Interaction of silver nanoparticles with HIV 1. J Nanobiotechnol. 3 (6), 1-10 (2005).
- Carlson, C., et al. Unique cellular interaction of silver nanoparticles size dependent generation of reactive oxygen species. J Phys Chem. 112 (43), 13608-13619 (2008).
- Roth, G. A., et al. Hyperspectral microscopy as an analytical tool for nanomaterials. WIREs Nanomed Nanobiotechnol In Press. , (2015).
- Williams, P., et al. Maize kernel hardness classification by near infrared (NIR) hyperspectral imaging and multivariate data analysis. Anal Chim Act. 653 (2), 121-130 (2009).
- Ziph Schatzberg, L. Hyperspectral imaging enables industrial applications. Industrial Photonic. , (2014).
- Sun, D. W. . Hyperspectral imaging for food quality analysis and contro. , (2010).
- ElMasry, G., et al. Hyperspectral imaging for nondestructive determination of some quality attributes for strawberry. J Food En. 81 (1), 98-107 (2007).
- Mortimer, M., et al. Potential of hyperspectral imaging microscopy for semi quantitative analysis of nanoparticle uptake by protozoa. Environ Sci Techno. 48, 8760-8767 (2014).
- Sarlo, K., et al. Tissue distribution of 20 nm 100 nm and 1000 nm fluorescent polystyrene latex nanospheres following acute systemic or acute and repeat airway exposure in the rat. Toxico. 263, 117-126 (2009).
- Husain, M., et al. Pulmonary instillation of low doses of titanium dioxide nanoparticles in mice leads to particle retention and gene expression changes in the absence of inflammation. Toxicol Appl Pharmacol. 269, 250-262 (2013).
- Meyer, J. N., et al. Intracellular uptake and associated toxicity of silver nanoparticles in Caenorhabditis elegan. Aquatic Toxicol. 100, 140-150 (2010).
- Badireddy, A. R., et al. characterization and abundance of engineered nanoparticles in complex waters by hyperspectral imagery with enhanced darkfield microscopy. Environ Sci Technol. 46 (18), 10081-10088 (2012).
- Dettmeyer, R. F. . Staining techniques and microscopy Forensic histopathology fundamentals and perspectives. , 370 (2011).
- Titford, M. Progress in the development of microscopical techniques for diagnostic pathology. J Histotechnol. 32 (1), 9-19 (2009).
- Kumar, G. L. . Special stains and H&E. , (2014).
- Manolakis, D., et al. Hyperspectral image processing for automatic target detection applications. Lincoln Laboratory Journal. 14 (1), 79-116 (2003).
- Mercer, R. R., et al. Pulmonary fibrotic response to aspiration of multi walled carbon nanotubes. Part Fibre Toxicol. 8 (1), 21 (2011).
- Kim, M. S., et al. Hyperspectral reflectance and fluorescence imaging system for food quality and safety. T Am Soc Ag En. 44 (3), 721-730 (2001).
- Mercer, R. R., et al. Extrapulmonary transport of MWCNT following inhalation exposure. Part Fibre Toxico. 10 (1), 38 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved