Method Article
المفاعلات الحيوية الألياف المجوفة ل
In This Article
Summary
يمكن تحسين السلوك الوظيفي للخلايا في الثقافة عن طريق زراعة في أكثر في الجسم الحي تشبه البيئات الثقافة 3-الأبعاد 16-21. توضح هذه المخطوطة انشاء وتشغيل نظام الألياف مفاعل حيوي جوفاء في الجسم الحي تشبه الثدييات زراعة الأنسجة.
Abstract
Tissue culture has been used for over 100 years to study cells and responses ex vivo. The convention of this technique is the growth of anchorage dependent cells on the 2-dimensional surface of tissue culture plastic. More recently, there is a growing body of data demonstrating more in vivo-like behaviors of cells grown in 3-dimensional culture systems. This manuscript describes in detail the set-up and operation of a hollow fiber bioreactor system for the in vivo-like culture of mammalian cells. The hollow fiber bioreactor system delivers media to the cells in a manner akin to the delivery of blood through the capillary networks in vivo. The system is designed to fit onto the shelf of a standard CO2 incubator and is simple enough to be set-up by any competent cell biologist with a good understanding of aseptic technique. The systems utility is demonstrated by culturing the hepatocarcinoma cell line HepG2/C3A for 7 days. Further to this and in line with other published reports on the functionality of cells grown in 3-dimensional culture systems the cells are shown to possess increased albumin production (an important hepatic function) when compared to standard 2-dimensional tissue culture.
Introduction
زراعة الأنسجة هي تقنية أنشئت لنمو و / أو صيانة الخلايا التي تم استخدامها لأكثر من 100 سنة 1،2. راحة دراسة الخلايا والاستجابات خارج الحي وبعيدة المدى مزايا السماح التجارب التي من شأنها أن يكون الأمر خلاف ذلك صعبة للغاية إن لم يكن مستحيلا، على سبيل المثال جيل من خطوط الخلايا المعدلة وراثيا واستخدام الخلايا مراسل في عالية الإنتاجية المقايسات فحص 3. وفي الآونة الأخيرة أعطت زراعة الأنسجة يؤدي إلى مجال هندسة الأنسجة، لتوليد نماذج في المختبر والطب التجديدي. مع هذه التطبيقات، وتنامى الاهتمام في نظم ثقافة ديناميكية 3 الأبعاد (3D) إلى حد كبير.
أساليب الثقافة 3D (المعرفة هنا باعتبارها الركيزة ثقافة 3D و / أو إدخال تدفق الحيوية الاتجاه) أفضل تلخيص بنية في الجسم الحي البيئة الخلوية، مهمة لتحقيقالمزيد الفسيولوجية مثل وظيفة. القدرة على استخراج، وتنمو، تمييز وخلايا الزرع بهدف إصلاح الأنسجة المريضة والتالفة هي مجال الدراسة أن لديها امكانات ضخمة لصالح المرضى والفرص التجارية. على سبيل المثال استخدام الخلايا الكيراتينية ذاتي لعلاج الحروق (انظر 4) واستخدام العلاجات القائمة على الخلايا لعلاج السكتة الدماغية (انظر 5). وبالمثل، فإن السوق لنماذج في المختبر يمتد اكتشاف المخدرات إلى تطبيقات الطب الطبقية. الاتفاقية في زراعة الأنسجة هو نمو أنواع الخلايا تعتمد ملتصقة أو مرسى على (2D) سطح 2-الأبعاد من قارورة زراعة الأنسجة. بينما المقبولة حاليا كمعيار الذهب في إعداد البحوث، وقد أبرزت الاهتمام الأخيرة في تطبيقات هندسة الأنسجة حقيقة أن بيئة زراعة الأنسجة 2D الحالية غير كافية لحاجة النطاق حتى في إنتاج خلايا 6.
لأنواع الخلايا الملتصقة على scaffolمطلوب د، والتي سوف تختلف اعتمادا على الاستخدام النهائي، سواء من حيث التركيب الكيميائي والخواص الميكانيكية. بعض النظم تستخدم السقالات وكذلك لوحة إدراج تتكون من مصفوفة المسامية العالية شكلت من ارتفاع النموذجيه المرحلة مستحلب الداخلي (انظر 7) أو الألياف electrospun (انظر 8) تتطلب الحد الأدنى من التكيف من تقنيات ثقافة 2D التقليدية. الخلايا يمكن المصنف على ناقل دقيق من المؤلفات متفاوتة ونمت في خزانات أثارت التي تقدم المواد الغذائية والجزيئات يشير، ونقل النفايات بعيدا (النقل الجماعي) من خلال بيئة مختلطة جيدا ديناميكية 9. ومع ذلك، فإن هذه الأنظمة محدودة في الجسم الحي تشبه البيئة ويمكن إجراء المزيد من التحسينات فيما يتعلق حجم المتابعة التكاليف. المفاعلات الحيوية الألياف المجوفة (HFBs) هي نظام الثقافة 3D التي تتكون من ألياف الثابتة في وحدة نمطية مع الخلايا عادة المصنف في الخارج من الألياف التي يسهل اختراقها وسائل الإعلام التي تنفذ من خلال تجويف الألياف (إعادة النظر في 10) (الشكل 1). HFBs نقدم في الجسم الحي تشبه البيئة مع الألياف محاكاة الشعيرات الدموية ويحمي الخلايا من اجهادات القص المرتبطة تسليم وسائل الإعلام الديناميكي، في حين يسمح القص محددة ليتم تطبيقها على خلايا عبر تدفق السوائل من خلال المنافذ الجانبية إذا رغبت في ذلك. وهذا يخلق نظاما ثقافة تنوعا مع النقل الجماعي متفوقة فيها كثافات عالية الخلية يمكن الوصول 11. النظام HFB هي مناسبة تماما للحفاظ على أنواع الخلايا تعتمد مرسى واستخدمت لثقافة مجموعة متنوعة من الخلايا بما في ذلك الفئران الجزر البنكرياسية لانجرهانز 12، β-TC-3 الماوس جزيري خط الخلية 12، خلايا الكبد البشرية الابتدائية 13، عظام بشرية خلايا نخاع وحيدات النوى 14، مادين داربي خلايا الكلى الكلبي (MDCK) 15 وكاتشو-2 خلايا 16 على سبيل المثال لا الحصر.
بالإضافة إلى مزايا نظام نقل الجماعي وزيادتها والخلايا المزروعة في 3D تيسنظم الاستزراع مقاضاة تميل إلى أن تكون أكثر في الجسم الحي تشبه في الشكل وأكثر استجابة لمنبهات التجريبية. على سبيل المثال الفئران خلايا الكبد الأولية تظهر التشكل أكثر مكعبة، وزيادة قدرتها على البقاء، أكبر تحريض نشاط انزيم السيتوكروم-P450 وزيادة الحساسية للسمية الباراسيتامول عندما نمت في سقالة البوليسترين المتاحة تجاريا مقارنة مع الخلايا المزروعة في 2D الثقافة 17. باستخدام نفس سقالة وقد تبين أيضا خط الخلية سرطانة الكبد HepG2 لزيادة إنتاج الألبومين 18 و تظهر أكثر في الجسم الحي تشبه استجابة للميثوتريكسات مقارنة 2D الخلايا المستزرعة 19. أظهرت خلايا الكبد البشرية الأساسية المتأخر فقد التمايز، وارتفاع النشاط السيتوكروم P450-وزادت إزالة ل4/5 مركبات اخضعت للاختبار في نظام الثقافة نضح 20. الخلايا الجذعية العصبية البشرية الخلايا العصبية المشتقة والدبقية مثقف في سقالة البوليسترين المتاحة تجاريا عرضت على حد سواء عالية (إمكانات العمل)، وانخفاض freque-تم الكشف عن NCY (إمكانات الميدانية المحلية) النشاط العفوي في حين لا نشاط الخلايا العصبية في خلايا 2D مثقف 21. أظهرت خلايا كاتشو-2 تعزيز التمايز في HFB مقارنة ثقافة 2D تقاس زيادة الفوسفاتيز القلوية، γ-glutamyltransferase والنشاط ف بروتين سكري وارتفاع تعبير عن F-الأكتين وزونا النطيقة-1 بروتين 16. على الرغم من المزايا، لا يزال غير تمارس زراعة الروتينية من الخلايا في الأنظمة الأخرى من سطح نسيج الثقافة قارورة 2D في العديد من المختبرات، على الرغم من أن عدد من المنشورات نقلا عن زراعة الخلايا 3D ينمو (زيادة بنسبة 8 أضعاف في السنوات ال 10 الماضية. المصدر : مجلات "النتائج حسب السنة" أداة بحث مع "ثقافة 3D ').
توضح هذه المخطوطة انشاء وظروف التشغيل من نظام HFB للثقافة خلايا الثدييات وتوضح فائدتها في زراعة خط الخلية سرطانة الكبد HepG2 / C3A. والهدف من هذه الطريقة هو ثقافة الخلايا فيوفي الجسم الحي تشبه نظام أكثر ثقافة أن يحتفظ بما فيه الكفاية البساطة لجعلها قابلة لأولئك الذين هم جديدة لأنظمة الثقافة 3D. الأساس المنطقي وراء استخدام HFBs في تطبيق يصف هنا، وهو لتحسين القدرة على التنبؤ نماذج الكبد هو أنه من الممكن نظريا لتقليد السيني الكبدي ضمن بيئة HFB 22. هذا ليس ممكنا في الوقت الراهن مع أنظمة ثقافة أخرى.
Protocol
1. ألياف
- تصنيع الألياف عن طريق مرحلة انعكاس تدور الصب (الغزل). تفاصيل هذه الطريقة يمكن العثور عليها في 23،24.
ملاحظة: للحصول على هذا العمل يتم تصنيع الألياف في المنزل باستخدام البوليمر الملكية غير القابلة للتحلل، NMP مثل المذيبات وH 2 O باعتبارها غير مذيب. تفاصيل البوليمرات مناسبة أخرى يمكن العثور عليها في المناقشة. الألياف المستخدمة في النظام المذكور هنا 1.05mm قطرها الخارجي مع قطر التجويف 600-700 ميكرون. الألياف هي التي يسهل اختراقها مع أقطار مسام قياس 2.28 ميكرون ± 1.5 ميكرون (يعني ± الانحراف المعياري). تم تصميم هذا لفصل الخلايا من تغذية وسائل الإعلام في لمعة الألياف، تكرار جيب كبدي أو الأوعية الدموية من الأنسجة الأخرى. ويمكن أيضا الألياف يمكن شراؤها من الموردين غشاء مثل بول.
2. تصنيع وحدة
ملاحظة: الوحدات المستخدمة في هذه الدراسة تتم من 1 ملم الزجاج البورسليكات سميكة مع 2 الموانئ الجانب(الشكل 2A). الألياف في وحدة صفها هنا لها مساحة السطح الخارجي 4.95 سم 2 وهو ما يعادل تقريبا نصف بئر لوحة 6 جيدا.
- وحدات Siliconize قبل الاستخدام لأول مرة عن طريق طلاء السطح الداخلي مع Sigmacote (الجدول 1) والسماح ليجف في غطاء الدخان. الأوتوكلاف (121 درجة مئوية، 1 أجهزة الصراف الآلي، و 20 دقيقة) لزيادة عمر من العلاج.
- باستخدام مشرط لقص 75 ألياف طويلة مم وإدراج ثلاثة الألياف في كل وحدة وترك ~ 7 ملم الزائد طول في كل نهاية (الشكل 3A).
- مكان ~ 0.5 مل من السيليكون الغراء (الجدول 1) في قارب وزنها. استخدام تلميح ماصة P200 لالتقاط كمية صغيرة من السيليكون والعمل الغراء في طرفي وحدة في جميع أنحاء الألياف لتشكيل المكونات 3-5 مم (الشكل 3B). السماح ليجف ل> 3 ساعة.
- باستخدام مشرط قطع تدفق سيليكون مع نهايات حدة الزجاج (الشكل 3C).
- التفافكمية صغيرة (~ 4 طبقات) من تترافلوروإيثيلين (PTFE) الشريط حول ميناء جانب واحد.
3. إعداد النظام والتعقيم
ملاحظة: لا يتم تعقيمها الأنابيب مضخة وحدات مع الألياف ويتم تعقيم باستخدام الايثانول 70٪. يوصي الكتاب معايرة أنابيب مضخة مع مضخة لاستخدامها. يتم تنفيذ الإجراء أدناه في غطاء تدفق الصفحي.
- الأوتوكلاف (كقسم 2.1) جميع مكونات autoclavable قبل انشاء.
- اقامة
- وضع 10 مل 70٪ من الإيثانول في زجاجة خزان وانشاء زجاجة خزان، وكأب Q-سلسلة، أنبوب تغذية، مضخة ومضخة وأنابيب (الجدول 1) كما في الشكل (4).
- وضع فضفاضة وغطاء نهاية عبر منفذ الجانبية المسجلة PTFE. حرك نهايات الموصلات L / وحدة S16 على طرفي وحدة وميناء الجانب الحرة. توصيل المادة 40 ملم من L / S13 أنابيب إلى موصل وحدة أقرب ميناء الجانب توج (الجدول 1) كما في الشكل 2B .
- ربط وحدة لأنابيب مضخة، وضمان لتوجيه وحدة حتى ميناء الجانب توج هو الأقرب إلى المضخة.
- ربط خط تتخلل وخط retentate إلى الموصلات وحدة وL / S14 من Y-موصل على زجاجة خزان (الجدول 1). تأكد من أن مجموعة المتابعة يشبه الخطط في الشكل (4).
- تعقيم
- ضخ الإيثانول من خلال وحدة في 800 ميكرولتر / ساعة (267 ميكرولتر / ساعة في الألياف) لما يكفي من الوقت لعلاج مكونات unautoclaved ل> 30 دقيقة (ضبط مرات إذا تم استخدام أساليب تعقيم أخرى، انظر 25).
- غسل
- لغسل الايثانول من النظام، أولا إيقاف المضخة واستنزاف الأنابيب. أولا، فصل أنابيب المضخة من أنابيب وحدة محول. عقد وحدة عاليا لاستنزاف الإيثانول من الألياف وretentate خط، والعودة الى القمقم الخزان. إزالة الغطاء نهاية ميناء جانب من وحدة لاستنزاف عشرالبريد الإيثانول من الوحدة نفسها، والخط تتخلل. أعد الغطاء نهاية ميناء الجانب. عكس تدفق وسائل الاعلام على مضخة لتصريف أنابيب المضخة وخط تغذية من الإيثانول. إيقاف المضخة، وأعد أنابيب المضخة إلى محول وحدة.
- فك زجاجة الإيثانول من الغطاء واستبدال زجاجة تحتوي على 10 مل من المتوسط نمو الخلايا (مثل EMEM، GMEM، DMEM أو RPMI) دون المصل. ضخ المتوسطة من خلال النظام في 800 ميكرولتر / ساعة حتى خط retentate هو الكامل من الوسائل الإعلامية. المشبك خط retentate لفرض تخلل وسائل الإعلام من خلال الألياف لغسل وحدة. غسل ل~ 2 ساعة.
4. البذر
ملاحظة: وسائل الإعلام والمكملات الغذائية المستخدمة في هذا البروتوكول يجب أن تكون تلك التي أنشئت لنوع من الخلايا المطلوبة. يرجى الرجوع إلى الأدب، وجمع الأوروبي الثقافات الخليوي (ECACC) ومجموعة الثقافة نوع الأمريكية (آي تي سي سي) لمزيد من المعلومات. قبل وينبغي أن تكون هذه الخلايا طريقة maintaINED وفقا لبروتوكولات أنشئت لنوع من الخلايا المطلوبة. لهذا العمل والحفاظ على خط الخلية سرطانة الكبد HepG2 / C3A subclone وفقا لتوصيات الموزعين (آي تي سي سي).
ملاحظة: بروتوكول البذر عرض الدنيا تخدم في مرحلة ما قبل ثقافة الوحدة مع خلية ثقافة المتوسط قبل نمو الخلايا. يجب أن تكون هناك حاجة إلى أكثر اتساعا قبل الثقافة ثم وهذا يجب أن يتم من قبل البذر وحدة عن طريق تصفية وسائل الاعلام غسل من النظام، لتحل محل مع وسائل الاعلام النمو وتتخلل هذا من خلال وحدة لبضع ساعات. انظر القسم 7.5.2.1 للحصول على تفاصيل حول استبدال وسائل الاعلام في النظام.
- إعداد تعليق خلية واحدة بواسطة trypsinization وفقا لبروتوكولات أنشئت لنوع من الخلايا المطلوبة. بروتوكول عام لثقافة T75 على النحو التالي:
ملاحظة: عدد من الخلايا لاستخدامها في خطوة البذر يجب أن يكون تصميما تجريبيا لنوع من الخلايا المطلوبة. هي المصنفة في المفاعلات الحيوية الموصوفة هنا في سل أعلى 35 أضعافكثافة ليرة سورية (خلية / سم 2) من المستخدمة في 2D البلاستيك زراعة الأنسجة للثقافة 7 أيام.- غسل الخلايا بإضافة 10 مل الفوسفات مخزنة المالحة (PBS)، نضح، ثم يضاف 3 مل 0.05٪ التربسين ثنائي أمين الإيثيلين رباعي حمض الخل (EDTA) (ما يكفي لتغطية الخلايا)، واحتضان عند 37 درجة مئوية، و 5٪ CO 2 لمدة 5 دقائق.
- حصاد الخلايا في 7 مل وسائط النمو تستكمل مع 10٪ مصل بقري جنيني (FBS) لتحييد التربسين. تخلط جيدا، إضافة 10 ميكرولتر إلى غرفة عدادة الكريات وعدد الخلايا.
- أجهزة الطرد المركزي في 200 x ج لمدة 5 دقائق لخلايا بيليه.
- نضح الخلايا طاف و resuspend في 4x10 6 / مل في وسائل الإعلام نمو تستكمل على النحو المطلوب لنوع من الخلايا المطلوبة.
- إيقاف المضخة واستنزاف أنبوب تغذية وحدة كما هو الحال في 3.4.1.
- فصل وحدة من الموصلات وحدة ونعلق قبعات وحدة نهاية (الجدول 1) قبل تعقيمها في 70٪ من الإيثانول، وترك ميناء جانب واحد مجانا.
- نقل ~ 500 ميكرولتر من تعليق الخلية (الخلايا 2x10 6) (4.1.4) إلى وحدة باستخدام 18 إبرة G و 1 مل حقنة، مع الحرص على تجنب تشكيل فقاعة وعدم الاضرار الألياف.
- تتويج ميناء الجانب باستخدام نهاية الحد الأقصى. احتضان الخلايا عند 37 درجة مئوية، و 5٪ CO 2 لمدة 2-4 ساعة مع تحول اليدوي وحدة من 180 درجة كل 5 دقائق. بدلا من الوحدات يمكن تركيبها على محور دوار أنبوب مع بيئة خلط متقطع (الجدول 1).
- بعد غرس البذور، ونعلق على نهاية سقف على منفذ الحقن (الجدول 1) قبل تعقيمها في 70٪ من الإيثانول، وإرفاق ذلك إلى ميناء الجانبية المسجلة PTFE. إزالة الغطاء نهاية ميناء الجانب الآخر، واستنزاف ببطء الخلايا عن طريق حقن الهواء إلى ميناء حقن المرفقة باستخدام 27 إبرة G و 1 مل حقنة.
- استبدال ميناء حقن مع نهاية الحد الأقصى. ببطء ملء وحدة مع وسائل الإعلام باستخدام منفذ الجانب المجانية وإبرة G 18 مع حقنة 1 مل. ريمولقد القبعات نهاية وحدة وإرفاق وحدة لأنابيب باستخدام موصلات وحدة.
- استبدال زجاجة سائل الإعلام غسل مع واحدة تحتوي على 50 مل وسائط النمو والمكملات الغذائية التالية الإجراء الموضح في 7.5.2.1. ضخ وسائط النمو من خلال النظام في 800 ميكرولتر / ساعة.
5. انتشار
ملاحظة: الألياف المستخدمة في نظام البحوث الموصوفة هنا يتم تعيين لتتخلل في ~ 80 ميكرولتر / ساعة، مع معدل التغذية 800 ميكرولتر / ساعة.
- استخدام الألياف تنمو الخلايا لفترات تصل إلى 7 أيام في حاضنة ترطيب وضعت في 37 درجة مئوية، و 5٪ CO 2.
ملاحظة: رصد المواد الغذائية ونواتج الأيض أثناء مرحلة النمو يمكن أن توفر معلومات مفيدة عن انتشار، امتصاص التمثيل الغذائي وإنتاج الخلايا ومستويات المغذيات والأيض في وسائل الإعلام. على سبيل المثال الجلوكوز استخدام وإنتاج اللاكتات. هي مجموعات المتاحة من مختلف الموردين التي يمكن quantitate هذه العوامل من وسائل الإعلام (انظر الجدول رقم 1 لتلك المستخدمة في هذه الدراسة). الموانئ حقن يمكن أن تضاف إلى تتخلل وretentate أنابيب وسائل الإعلام عينات عن طريق 27 G الإبر والمحاقن، وسائل الإعلام يمكن أخذ عينات من الزجاجة وسائل الإعلام الخزان. وهذا يعطي المعلومات الغذائية والتمثيل الغذائي للمدخلات وكلا النوعين من الانتاج. وينبغي أن يتم أخذ العينات في غطاء تدفق الصفحي. تعقيم الموانئ حقن قبل أخذ العينات بعقد الإيثانول غارقة لفة الزرقاء ضد الميناء ل> 30 ثانية.
6. الختان
ملاحظة: الالياف يمكن رفعه من وحدة في نهاية التجربة لتحليلها.
- افصل واستنزاف HFB.
- اضافة الى وجود مشرط سكين / الدقيقة (الجدول 1) شفرة بين الزجاج والسيليكون. تحويل وحدة وذلك لقطع السيليكون من الزجاج. كرر هذا الإجراء على طرفي الوحدة النمطية.
- باستخدام شفرة ربط خارج المكونات سيليكون واحدة من نهاية وسحب بلطف. تأكد من أن الألياف تأتي معها.
- أرقام الهواتف المحمولة
ملاحظة: للحصول على الخلايا C3A المستخدمة في هذه الدراسة أي نقطة زمنية في فترة النمو 7 أيام هي مناسبة للاستخدام في الحسابات لأن معدلات النمو لا تتغير بدرجة كبيرة على مدى كثافة الخلية التي تحققت في هذا الإطار الزمني.- بعد الختان (القسم 6) تراجع الألياف في برنامج تلفزيوني لغسل وقطع منها في أنبوب 1.5 مل تحتوي على 0.5 مل تريس EDTA (TE) العازلة. تخضع هذه لدورتين تجميد أذاب في الفريزر -80 درجة مئوية. قياس محتوى الحمض النووي باستخدام PicoGreen وتحديد أعداد الخلايا بمقارنة هذه القيمة إلى منحنى المعد مع نوع من الخلايا المطلوبة 26.
- معدلات تكاثر الخلايا
- باستخدام أرقام خلية محسوبة على نقطتين زمنية مختلفة حساب معدل النمو محدد μ (المعادلة 1) حيث سطر (X1) هو سجل الطبيعية من عدد الخلايا عند نقطة لأول مرة وسطر (X2) هو سجل الطبيعية للخلية عدد عند نقطة زمنية ثانية.
μ = (سطر (X2) -Ln (X1)) / الوقت (ساعة) (1)
من هذا حساب الأوقات السكان مضاعفة (DT) (المعادلة 2) حيث μ هو معدل نمو معين.
DT = LN2 / μ (2)
- باستخدام أرقام خلية محسوبة على نقطتين زمنية مختلفة حساب معدل النمو محدد μ (المعادلة 1) حيث سطر (X1) هو سجل الطبيعية من عدد الخلايا عند نقطة لأول مرة وسطر (X2) هو سجل الطبيعية للخلية عدد عند نقطة زمنية ثانية.
- بقاء الخلية
- بعد الختان (القسم 6) تراجع الألياف في برنامج تلفزيوني لغسل وقطع منها في أنبوب 1.5 مل تحتوي على 500 ميكرولتر التربسين 0.05٪ ثنائي أمين الإيثيلين رباعي حمض الخل (EDTA). احتضان عند 37 درجة مئوية لمدة 10 دقيقة.
- خلط وإضافة 10 ميكرولتر من التعليق الخلية إلى 10 ميكرولتر التريبان الأزرق. تحميل 10 ميكرولتر الصعود إلى عداد خلايا الدم وإحصاء عدد القتلى (الأزرق) والخلايا على قيد الحياة.
- التصوير
- بعد الختان تراجع الألياف في برنامج تلفزيوني لغسل واستخدام المقص لقطع منها إلى أطوال صغيرة في لوحة 24-جيدا. إضافة 400 ميكرولتر بارافورمالدهيد 4٪ (في برنامج تلفزيوني)، واحتضان في RT لمدة 20 دقيقة.
- يغسل مع برنامج تلفزيوني قبل pipetting 400 ميكرولتر وخارجها. كرر ثيالصورة الخطوة مع برنامج تلفزيوني جديد.
- إضافة 400 ميكرولتر 4 "، 6 diamidino-2-phenylindole (دابي) المخفف في برنامج تلفزيوني إلى تقريبا. 100 نانوغرام / مل واحتضان في RT لمدة 20 دقيقة. احم من الضوء.
- يغسل مع برنامج تلفزيوني مرتين (كما 7.3.2) ومرة واحدة مع H 2 O. إضافة المتوسطة المتزايدة مضان لتغطية الألياف وصورة على الفور لجمع البيانات قبل العينات الجافة (دابي السابق / م، 359/461 نانومتر).
- التقاط صور في طائرات التنسيق المختلفة، واستخدام 'التركيز التراص "برنامج (على سبيل المثال، كومة المصور المساعد ليماغيج أدناه) لجعل صورة مركبة تظهر عمق توسع كبير في المجال. هذا هو المطلوب والألياف ليست مسطحة.
- تحميل يماغيج (http://imageJ.nih.gov/ij/) و "كومة المصور 'البرنامج المساعد (http://rsb.info.nih.gov/ij/plugins/stack-focuser.html).
- في ImageJ فتح الصور لتكون مكدسة. ثم في القائمة "صورة" الذهاب إلى "أكوام" - "الصور إلى كومة". في القائمة 'الإضافات' الذهاب إلى "كومة المصور". تحديد ن لنواة nxn. قد تكون هناك حاجة التجربة والخطأ مع 'ن' من أجل توليد صورة مع قليل "الضوضاء". القيم بين 11 و 77 تميل للعمل بشكل جيد.
- إفراز الألبومين
ملاحظة: هذا هو اختبار وظيفة الخلية الكبدية وليس اختبار العام للوظيفة الخلية.- خلايا البذور (HepG2 / C3A) على 2D نسيج البلاستيك الثقافة في 10667 / سم 2 ونمت لمدة 6 أيام. HFBs البذور كما هو موضح في القسم 4 وتنمو لمدة 6 أيام.
- وبعد هذه الفترة انتشار تغيير ثقافة وسائل الإعلام (EMEM + 10٪ FBS، 1X الجلوتامين و1X البنسلين / الستربتومايسين) للالبلاستيك زراعة الأنسجة وHFB إلى المصل الحرة وسائل الإعلام وليامز E تستكمل مع الجلوتامين 1X و1X البنسلين / الستربتومايسين لمدة 24 ساعة:
- استنزاف وحدة الأنابيب وHFB باتباع الخطوات الواردة في 3.4.1. فك زجاجة الخزان واستبدال هذا مع زجاجة تحتوي على وسائل الإعلام ويليامز E. ضخ هذا من خلال HFB في 800 ميكرولتر / ساعة.
- وبعد 24 ساعة، أخذ عينات سائل الإعلام. قياس الزلال التي يفرزها ELISA وفقا لتعليمات الشركة الصانعة (الجدول 1). تمييع عينات سائل الإعلام 1 في 10-1 في 40 قبل الاستخدام من أجل تحقيق تركيزات الزلال ضمن مجموعة من المنحنى القياسي.
تحليل 7. خلية
النتائج
البذر الخلية هو خطوة حاسمة. قدرة الخلايا على الانضمام إلى الألياف في 3D انشاء هي أقل بكثير مما كان عليه ل2D البلاستيك زراعة الأنسجة. هذا هو الأرجح بسبب وقت الاتصال انخفاض بين الخلية والركيزة. في HFB الخلايا تقع من خلال وحدة خلال مراحل ثابتة من البذر. هذه هي أقصر بكثير في الوقت بالمقارنة مع مرحلة ثابتة واحدة مستمرة المستخدمة في 2D. لديها خلايا لإجراء اتصالات إلى الركيزة في هذا الوقت. بالإضافة إلى ذلك، نظرا لطبيعة منحنية من الألياف لا يوجد أي سطح مستو للخلايا للراحة وإجراء اتصالات مثل هناك في الثقافة 2D. ومع أن هذا يمكن أن يضاعف من الكيمياء من الألياف المستخدمة نعرف هذا لا يكون الحال بالنسبة لالبوليمر المستخدمة في هذه الدراسة (لا تظهر البيانات). زيادة وقت البذر وكثافة الخلايا البذر يؤدي إلى تشكيل المجاميع الخلية التي تقع من خلال وحدة خلال مراحل ثابتة في ص أسرعأكلت من الخلايا واحد وكذلك يقلل من وقت الاتصال بين الخلايا والركيزة. زيادة الوقت يؤدي أيضا إلى اصفرار وسائل الإعلام كما أن هناك كثافة عالية من الخلايا وأي تبادل وسائل الإعلام خلال هذه الخطوة. باستخدام الشروط الموضحة في معدلات القسم 4 خلية البذر من ~ 15٪ تتحقق باستمرار مع الخلايا HepG2 / C3A (الشكل 5A). ومع أن هذا قد يعتبر جزء منخفض هناك ما يكفي من الخلايا لتوليد الألياف جيدا بالسكان في غضون أيام (الأرقام 5B و 6)؛ بعد فترة انتشار لمدة سبعة أيام وكثافة الخلايا التي تم التوصل إليها في HFB يقترب 3x10 5 / سم 2. هذا هو الكثافة المناسبة للعديد من فحوصات باستخدام خلايا الكبد ويمكن النظر إلى أن الوصول إلى نقطة التقاء.
معدلات انتشار تحققت في HFB تكون أبطأ بالمقارنة مع تلك التي تحققت في خلية ثقافة 2D (الشكل 5C). هذا مخالفمن المحتمل أن تكون بسبب فقدان الخلايا في تدفق الديناميكي للنظام كما عدد الخلايا في وسائل الإعلام منخفضة (متوسط ± SEM: 20343 خلايا ± 3674 خلية لكل 24 ساعة على التقاء، الذي هو 4٪ من مجموع الخلايا) وهذا لا زيادة عند تشغيل معدل تخلل تصل إلى 400 ميكرولتر / ساعة (لا تظهر البيانات). ومن المرجح أيضا أن ذلك يعود إلى انخفاض في قابلية والخسارة اللاحقة من الخلايا (انظر الشكل 5D وأدناه). ويمكن تفسير ذلك، على الأقل في جزء من حقيقة وقد اشتق هذا الخط خلية متطابق بسلالة من HepG2 واختيارهم على قدرتها على إظهار تثبيط اتصال من تكاثر الخلايا. هي المصنفة الخلايا في HFB في 6X كثافة الخلايا 2D التي قد تؤدي إلى معدلات انتشار أبطأ.
تبقى جدوى عالية في جميع أنحاء HFB مع الخلايا العارضة> 90٪. في حين أن هناك انخفاضا طفيفا في جدوى في نهاية منفذ مقارنة مدخل هذا لم يتم العثور على أن يكون كبيرا اختبار (ت ع = 0.22).
وقد استخدم رصد استهلاك الجلوكوز وإنتاج حمض اللاكتيك لضبط حجم معدل التغذية وسائل الاعلام وسائل الاعلام في النظام. باستخدام 800 ميكرولتر / ساعة وحجم وسائل الاعلام ما مجموعه 50 مل والحفاظ على مستويات السكر وحمض اللاكتيك أعلاه وأدناه (على التوالي) تلك التي ظهرت في الثقافة البلاستيك زراعة الأنسجة القياسية.
إفراز الألبومين هي وظيفة الكبد الرئيسية التي تقوم بها خلايا الكبد. ويفرز عليه في مصل الدم حيث يلعب عدة أدوار في النقل والتوازن. إفراز الألبومين عن طريق الخلايا المزروعة في HFB هو 15 أضعاف أعلى من ذلك في الخلايا المزروعة في 2D (الشكل 7). وهذا يدل على خلايا وظيفية في HFB وعلى الأقل في حالة إفراز الألبومين، هو ارتفاع هذه الوظيفة في HFB.
JPG "/>
هي المصنفة رقم 1. في الجسم الحي تشبه البيئة من HFB. الخلايا على السطح الخارجي للألياف التي يسهل اختراقها. يتم تسليم وسائل الاعلام من خلال التجويف الألياف، ومحاكاة الشعرية الدم. (A) المقطع الطولي من الألياف (وليس لتوسيع نطاق). (ب) عبر مقطع من مفاعل 3 من الألياف. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2. وحدة HFB. (A) أبعاد وحدة المستخدمة في هذه الدراسة. وقد تم اختيار الأبعاد لتناسب 3 الألياف وتلبية احتياجات المشروع البحثي الحالي. أحجام مختلفة يمكن تصنيعها ومصممة خصيصا لأنظمة الفردية والألياف. (ب) صورة لمodule مع إرفاق نهاية سقف وحدة الروابط. اضغط هنا لمشاهدة نسخة أكبر من هذا الرقم.
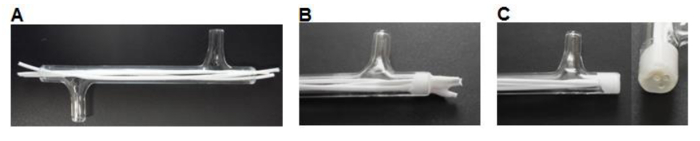
الرقم 3. وحدة التصنيع. يتم قطع (أ) ألياف لحجم وإدراجها في وحدة. يتم لصقها (ب) ألياف داخل الوحدة النمطية، سمح لتجف. (ج) يتم قطع نهايات مطاردة مع الزجاج. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
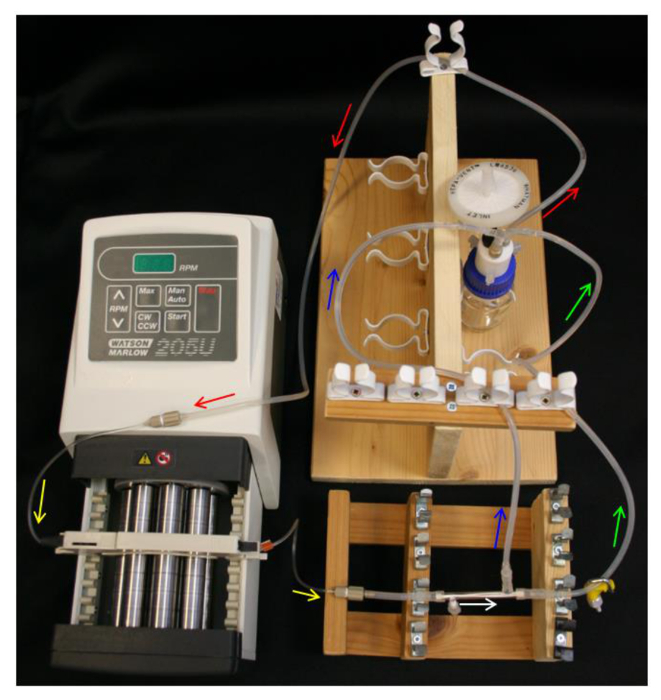
الرقم 4. نظام HFB انشاء. السهام تشير إلى اتجاه تدفق وسائل الاعلام. أحمر = تغذية الأنبوب. أصفر = مضخة تويكون. البيضاء = HFB حدة. الأخضر = أنبوب retentate مع المشبك. = الزرقاء تتخلل أنبوب. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
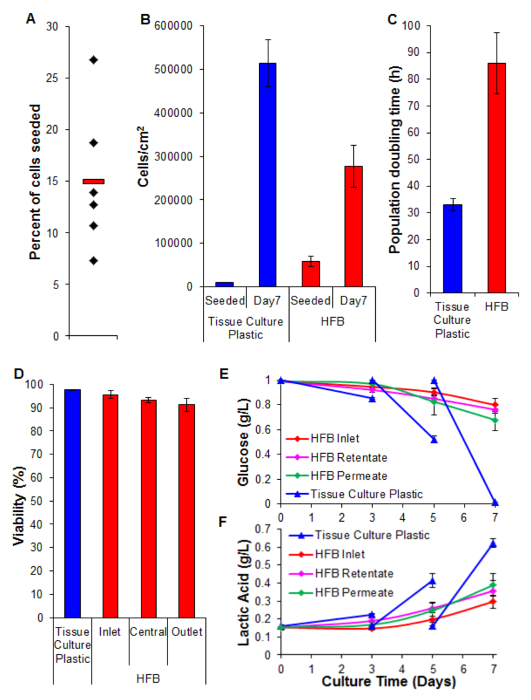
الرقم 5. البذر، والانتشار، والسلامة وتحليل الكيمياء الحيوية. (A) في المئة من خلايا المصنف. تمثل الألماس الأسود HFBs فرد. شريط أحمر هو متوسط. (ب) خلايا كثافة في البذر وبعد فترة الانتشار 7 أيام. تم تحديد أعداد الخلايا 2D بواسطة trypsinization والعد باستخدام عداد خلايا الدم. تم تحديد أعداد الخلايا HFB باستخدام مقايسة PicoGreen ومنحنى القياسية التي تنتج من خلايا C3A 26. ن = 5-6. الحانات = SEM. (ج) عدد السكان تضاعف مرات. ن = 5-7. الحانات = SEM. (D) الجدوى التي تحددها TRYPاستثناء الأزرق في نهاية تكاثر 7 أيام. مدخل ووسط ومنفذ تمثل المناطق داخل HFB. ن = 3-5. الحانات = SEM. (E & F) استهلاك الجلوكوز وإنتاج حمض اللبنيك. تم رصد مستويات في زجاجة خزان (مدخل) وكذلك retentate وتتخلل وسائل وcompered للثقافة الروتينية على البلاستيك زراعة الأنسجة (وسائل الإعلام تتغير في يوم 3 و 5). ن = 3-5. الحانات = SEM. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
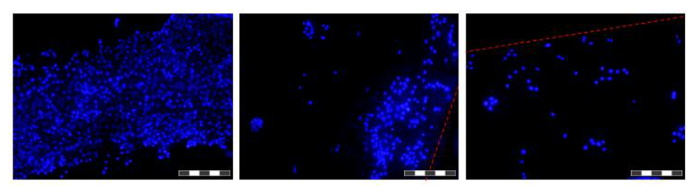
كانت الشكل 6. صور من الخلايا المزروعة على الألياف في HFB. خلايا المصنف ونمت لمدة 48 ساعة قبل رفعه الألياف، وغسلها في برنامج تلفزيوني، ثابتة في 4٪ امتصاص العرق، وغسلها في برنامج تلفزيوني ونوى ملطخة دابي. كل صورة هي مزيج مركب من 12 "التركيز مكدسة" معهد العالم العربيغيس من أجل زيادة عمق الميدان من الصورة الناتجة. تم العثور على مناطق أعلى وأقل كثافة الخلية على طول الألياف في هذه المرحلة الزمنية، وهي واردة. حيث يتم الرمز حدود الألياف الحالية مع خط متقطع أحمر. واتخذت صورة على مجهر مضان مقلوب. صورة الهدف = 10X. بار = 200 ميكرون. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
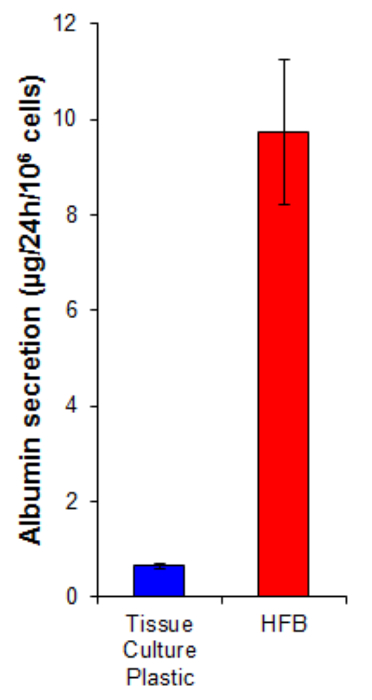
الرقم 7. الزلال إفراز. والمصنف الخلايا على البلاستيك زراعة الأنسجة في 10667 / سم 2 وفي HFB كما هو موضح في القسم وانتشرت 4. الخلايا لمدة 6 أيام. وبعد هذه الفترة انتشار تم تغيير البلاستيك زراعة الأنسجة والثقافة HFB وسائل الاعلام لمصل الحرة وسائل الإعلام وليامز E تستكمل مع الجلوتامين والبنسلين / streptomyciن لمدة 24 ساعة. وتم أخذ عينات سائل الإعلام والزلال كميا بواسطة ELISA وفقا لتعليمات بتصنيع (الجدول 1). ن = 5-6. الحانات = SEM. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
| قسم | اسم معدات | شركة | قط. لا. | الملاحظات | صور |
| 2 | الزجاج HFB الوحدة | سوهام العلمي | --- | البند مخصص. | |
| 2.1 | Sigmacote® | سيغما الدريتش | SL2 | ||
| 2.3 | Silicoset 151 | Intertronics | ACCSS151 | Silicالغراء واحدة. | |
| 2.5 | الشريط PTFE | سيغما الدريتش | Z104388 | ||
| 3.2.1 | زجاجة الخزان | الصياد | 11972619 | ||
| غطاء Q-سلسلة | كينسيس | 00932Q-3V | PTFE على المواضيع المسمار من محولات والجوز المناسب. نعلق على الغطاء Q-سلسلة. إرفاق القسم 8.5 سم من أنابيب PTFE تم توفيرها في إطار محول 1 مم والباب 4 سم تحت محول 3 مم. |  | |
| محول، ذكر، 1.0 ملم معرف | كينسيس | 008NB10-KD5L | |||
| محول، ذكر، 3.0 ملم معرف | كينسيس | 008NB30-KD5L | |||
| البندق المناسب | كينسيس | U-350 | |||
| أنابيب النيوبرين | الصياد | 10366344 | نعلق مرشح هيبا إلى 6 سم من أنابيب النيوبرين وإرفاق ذلك إلى "الجوز المناسب". إرفاق 2X 30 أقسام ملم من L / S14 الأنابيب إلى اثنين من كبار انتقادات لاذعة من Y-موصل وقسم 3 سم من L / S16 الأنابيب إلى أسفل. نعلق هذه لاذع لمحول الرقم 3 مم. (القسم 3.2.1) |  | |
| HEPA تنفيس | الصياد | 11374634 | |||
| Y-موصل شائكة | كول Parmer | OU-06295-10 | |||
| L / S16 سيليكون أنابيب | كول Parmer | OU-96410-16 | |||
| L / S14 سيليكون أنابيب | كول Parmer | WZ-96410-14 | |||
| L / S13 سيليكون أنابيب | كول Parmer | OU-96410-13 | 80 سم لربط محول الشائكة 1.0 ملم على الغطاء س سلسلة لالحوض مضخة جي = أنبوب تغذية. | ||
| WM 205U / CA مضخة | الصياد | 1248-6300 | |||
| WM ضخ أنابيب، بولي كلوريد الفينيل والأزرق والبرتقالي، 0.25 مم تتحمل | الصياد | 12416310 | السليكوون الخيط المسمار محول الذكور وتوصيل محول الإناث. العمل أنابيب ضخ أكثر من واحد من انتقادات لاذعة. كرر هذا انشاء في الطرف الآخر من الأنبوب. (القسم 3.2.1) |  | |
| محول، ذكر، 1.0 ملم معرف | كينسيس | 008NB10-KD5L | |||
| محول، أنثى، 1.0 ملم معرف | كينسيس | 008NB10-KD2L | |||
| 3.2.2 | غطاء لور الإناث | كول Parmer | WZ-45508-64 | جانبية قبعات نهاية الميناء. | blefig4.jpg "/>  |
| L / S13 سيليكون أنابيب | كول Parmer | OU-96410-13 | 40 قسم مم لتوصيل أنابيب ضخ لموصل وحدة. | ||
| L / S16 سيليكون أنابيب | كول Parmer | OU-96410-16 | 3X 30 ملم من L / S16 تركيبها إلى 3x مخفضات = الموصلات وحدة. (القسم 3.2.2) | ||
| المخفض الشائكة 1/8 "س 1/16" | كول Parmer | 30616-43 | |||
| 3.2.4 | L / S13 سيليكون أنابيب | كول Parmer | OU-96410-13 | 55 قسم سم لربط retentate إلى L / S14 من Y-موصل على الغطاء Q-سلسلة. |  |
| L / S13 سيليكون أنابيب | كول Parmer | OU-96410-13 | 45 قسم سم لربط تتخلل إلى L / S14 من Y-موصل على الغطاء Q-سلسلة. | ||
| الاتحاد شائكة على التوالي | كول Parmer | WZ-30612-43 | نعلق على نهاية L / S13 الذي سيربط مع L / S14 من Y-موصل. | ||
| 3.4.2 | المشبك | VWR | 229-0609 | ||
| 4.3 | 4 مم سيليكون أنابيب | الصياد | FB68858 | أضعاف خلال قسم 40 ملم من أنابيب وآمنة مع الكابل التعادل نهاية الحد الأقصى = وحدة نمطية. (القسم 4.3) |  |
| الكابل التعادل | الصياد | 12326377 | |||
| 4.4 | MACSmix أنبوب المدورة | Miltenyi في مجال التكنولوجيا الحيوية | 130-090-753 | قد تكون هناك حاجة إلى التكيف مع اتاكح الوحدات. | |
| 4.5 | ميناء حقن لور | الشوك العلمي | IB-10820 | نعلق نهاية الحد الأقصى إلى ميناء حقن. (القسم 4.5) | |
| غطاء لور الإناث | كول Parmer | WZ-45508-64 | |||
| 5 | مجموعة حمض اللبنيك L | Megazyme | K-متأخرا | ||
| 5 | مجموعة D-الجلوكوز | Megazyme | K-GLUC | ||
| 6.2 | مشرط / سكين الصغير | InterFocus | 10315-12 | ||
| 7.4.3 | الزلال ELISA | Bethyl مختبرات | E80-129 |
الجدول 1. مكونات HFB انشاء. ويعطى قسم النصوص ذات الصلة إلى كل عنصر في العمود 1.
Discussion
توضح هذه المخطوطة انشاء وتشغيل نظام الألياف المجوفة مفاعل حيوي (HFB) للثقافة خلايا الثدييات وأثبتت فائدتها في المتكاثرة خط الخلية الكبدية HepG2 / C3A. تم تصميم هذا النظام لتناسب على الرف من حاضنة القياسية ولها مجموعة المتابعة بسيطة بما فيه الكفاية لأن تقوم بها أي بيولوجيا الخلايا المختصة على دراية تقنية العقيم.
يتم تصنيع الألياف المستخدمة في نظام البحوث وصفها هنا في المنزل عن طريق مرحلة انعكاس تدور الصب (الغزل) باستخدام البوليمر الملكية غير القابلة للتحلل. فمن الممكن لجعل الألياف عن طريق الغزل من مجموعة متنوعة من المواد المناسبة لزراعة الخلايا، سواء القابلة للتحلل وغير القابلة للتحلل، على سبيل المثال، polycaprolactone (PCL) 27، وحمض بولي-L-lactide (PLLA) 28، وبولي (حامض اللبنيك في-ك-الجليكوليك) (PLGA) 29، متعدد السلفون (PSU) 12 وpolyetheretherketone (نظرة خاطفة) 13. كل له خصائص مختلفةالثانية ينبغي اختيار على أساس احتياجات النظام. تأكد من توافق من الألياف يعمل مع الإيثانول المستخدم في الخطوة التعقيم. ومن المعروف PLGA للين مع الإيثانول يستلزم العلاج البديل مثل المضادات الحيوية / مضاد فطري حل 25.
وقد تم اختيار أبعاد وحدات الزجاج المستخدم هنا على أساس احتياجات البحوث الحالية. أحجام مختلفة يمكن أن تقدمها أي نفخ الزجاج شركة محترمة. وهناك اعتبار في حجم الوحدة هو عدد الخلايا، الذي يرتبط عدد من الألياف في وحدة ومعدلات التدفق المحتمل. لمزيد من الخلايا وهناك في وحدة وارتفاع معدلات التدفق سوف تحتاج إلى أن تكون من أجل الحفاظ على ظروف مواتية الثقافة في نهاية تدفق مفاعل حيوي. هذا وسوف تصل إلى حد كنقطة بعض وبعض التجربة والخطأ قد يكون مطلوبا مع رصد أوضاع الإعلام في تتخلل حدة. قد توفر النماذج الرياضية بعض الأفكار في dimen الوحدة المطلوبةاالنبعاثات ومعدلات تدفق 22.
تم تصميم أبعاد جهاز يستخدم هنا لتناسب على رف الحاضنة. وأملت طول أنابيب بطول اللازمة لتصل إلى ما بين الموصلات في حين يسمح أيضا حركة ما يكفي من العناصر للسماح لانشاء وتشغيل. إذا كنت بحاجة لأخذ العينات الوقت بطبيعة الحال، على سبيل المثال في رصد أوضاع الإعلام في وحدة تتخلل ثم الموانئ حقن يمكن أن تضاف إلى retentate وتتخلل خطوط لتسهيل ذلك.
ومن الشروط الأساسية لأي نظام زراعة الخلايا هو للحفاظ على الخلايا على قيد الحياة وفي زراعة معظم الحالات. في ضوء الدراسات يدل على أكثر في الجسم الحي تشبه النمط الظاهري في الخلايا المزروعة في نظم الاستزراع 3D يبدو من المهم أيضا لتوفير بيئة الذي يحاكي عن كثب البيئة في الجسم الحي من قبل خلايا واجهتها. غالبا ما تهمل هذه النقطة الأخيرة في خلية ثقافة 2D لصالح الراحة ويوفر هذا النظام الثقافة. تانه HFB يقلد في الشبكات الشعرية الجسم الحي من خلال توفير المواد الغذائية إلى الخلايا عبر التجويف من الألياف. تتم إزالة الفضلات أيضا من النظام عن طريق تدفق الحيوية. وهذا يخلق في الجسم الحي تشبه نظام للثقافة الخلية واحد الذي يحاكي عن كثب البيئة في الجسم الحي ينظر إليها من قبل خلايا الكبد، مما يجعل هذا النظام خيارا أفضل مقارنة 2D نسيج البلاستيك الثقافة لزراعة هذه الخلايا. وهذا ما تؤكده حقيقة الخلايا تفرز 15 أضعاف كمية الزلال، وظيفة الكبد الهامة، في نظام الثقافة HFB مقارنة بتلك المزروعة في 2D البلاستيك زراعة الأنسجة.
بينما يناسب النظام HFB لمعظم إن لم يكن جميع أنواع الخلايا تعتمد مرسى، والمثال هنا هو لخلايا الكبد بسبب وجود حاجة حقيقية لتكون قادرة على ثقافة وظيفية، وأكثر في الجسم الحي تشبه خلايا الكبد لاستخدامها في تطوير الأدوية من قبل صناعة الأدوية وفي الأجهزة الكبد bioartificial للدعم خارج الجسممن الكبد مرضى الفشل. الحاجة إلى المزيد من الخلايا الوظيفية تتجاوز هذه الأمثلة، لا سيما في مجال الطب التجديدي يدخل مرحلة العمل متعدية. لا ينبغي إغفال مزايا في الجسم الحي تشبه بيئة أكثر ثقافة.
Disclosures
MJE is a founder and director of Cellesce Ltd which aims to provide bioprocessing solutions for tissue engineering-based research and industry.
Acknowledgements
This work was funded by the National Centre for the Replacement, Refinement and Reduction of Animals in Research (NC3Rs) CRACK IT funding.
Materials
| Name | Company | Catalog Number | Comments |
| Glass HFB Module | Soham Scientific | --- | Custom Item. (Section 2) |
| Sigmacote | Sigma-Aldrich | SL2 | (Section 2.1) |
| Silicoset 151 | Intertronics | ACCSS151 | Silicone Glue. (Section 2.3) |
| PTFE tape | Sigma-Aldrich | Z104388 | (Section 2.5) |
| Reservoir bottle | Fisher | 11972619 | PTFE the screw threads of the adapters and fitting nut. Attach to the Q-series cap. Attach an 8.5 cm section of the supplied PTFE tubing under the 1 mm adapter and a 4 cm section under the 3 mm adapter. (Section 3.2.1) |
| Q-series cap | Kinesis | 00932Q-3V | PTFE the screw threads of the adapters and fitting nut. Attach to the Q-series cap. Attach an 8.5 cm section of the supplied PTFE tubing under the 1 mm adapter and a 4 cm section under the 3 mm adapter. (Section 3.2.1) |
| Adapter, Male, 1.0 mm ID | Kinesis | 008NB10-KD5L | PTFE the screw threads of the adapters and fitting nut. Attach to the Q-series cap. Attach an 8.5 cm section of the supplied PTFE tubing under the 1 mm adapter and a 4 cm section under the 3 mm adapter. (Section 3.2.1) |
| Adapter, Male, 3.0 mm ID | Kinesis | 008NB30-KD5L | PTFE the screw threads of the adapters and fitting nut. Attach to the Q-series cap. Attach an 8.5 cm section of the supplied PTFE tubing under the 1 mm adapter and a 4 cm section under the 3 mm adapter. (Section 3.2.1) |
| Fitting Nut | Kinesis | U-350 | PTFE the screw threads of the adapters and fitting nut. Attach to the Q-series cap. Attach an 8.5 cm section of the supplied PTFE tubing under the 1 mm adapter and a 4 cm section under the 3 mm adapter. (Section 3.2.1) |
| Neoprene tubing | Fisher | 10366344 | Attach the Hepa filter to 6cm of neoprene tubing and attach this to the 'fitting nut'. Attach a 2x 30 mm sections of L/S14 tubing to the top two barbs of the Y-connector and a 3 cm section of L/S16 tubing to the bottom. Attach this to the barb of the 3 mm ID adapter. (Section 3.2.1) |
| HEPA-vent | Fisher | 11374634 | Attach the Hepa filter to 6cm of neoprene tubing and attach this to the 'fitting nut'. Attach a 2x 30 mm sections of L/S14 tubing to the top two barbs of the Y-connector and a 3 cm section of L/S16 tubing to the bottom. Attach this to the barb of the 3 mm ID adapter. (Section 3.2.1) |
| Y-connector, barbed | Cole Parmer | OU-06295-10 | Attach the Hepa filter to 6 cm of neoprene tubing and attach this to the 'fitting nut'. Attach a 2x 30 mm sections of L/S14 tubing to the top two barbs of the Y-connector and a 3 cm section of L/S16 tubing to the bottom. Attach this to the barb of the 3 mm ID adapter. (Section 3.2.1) |
| L/S16 Silicone tubing | Cole Parmer | OU-96410-16 | Attach the Hepa filter to 6cm of neoprene tubing and attach this to the 'fitting nut'. Attach a 2x 30 mm sections of L/S14 tubing to the top two barbs of the Y-connector and a 3 cm section of L/S16 tubing to the bottom. Attach this to the barb of the 3 mm ID adapter. (Section 3.2.1) |
| L/S14 Silicone tubing | Cole Parmer | WZ-96410-14 | Attach the Hepa filter to 6cm of neoprene tubing and attach this to the 'fitting nut'. Attach a 2x 30 mm sections of L/S14 tubing to the top two barbs of the Y-connector and a 3 cm section of L/S16 tubing to the bottom. Attach this to the barb of the 3 mm ID adapter. (Section 3.2.1) |
| L/S13 Silicone tubing | Cole Parmer | OU-96410-13 | 80 cm to connect the 1.0 mm barbed adapter on the Q-series cap to the pump tubing = Feed tube. (Section 3.2.1) |
| WM 205U/CA pump | Fisher | 1248-6300 | (Section 3.2.1) |
| WM pump tubing, PVC, blue-orange, 0.25 mm bore | Fisher | 12416310 | PTFE the screw thred of the male adapter and connect the female adapter. Work the pump tubing over one of the barbs. Repeat this set-up at the other end of the tubing. (Section 3.2.1) |
| Adapter, Male, 1.0 mm ID | Kinesis | 008NB10-KD5L | PTFE the screw thread of the male adapter and connect the female adapter. Work the pump tubing over one of the barbs. Repeat this set-up at the other end of the tubing. (Section 3.2.1) |
| Adapter, Female, 1.0 mm ID | Kinesis | 008NB10-KD2L | PTFE the screw thred of the male adapter and connect the female adapter. Work the pump tubing over one of the barbs. Repeat this set-up at the other end of the tubing. (Section 3.2.1) |
| Female Luer cap | Cole Parmer | WZ-45508-64 | Side port end caps. (Section 3.2.2) |
| L/S13 Silicone tubing | Cole Parmer | OU-96410-13 | 40 mm section to connect the pump tubing to a module connector. (Section 3.2.2) |
| L/S16 Silicone tubing | Cole Parmer | OU-96410-16 | 3x 30 mm of L/S16 fitted to 3x reducers = module connectors. (Section 3.2.2) |
| Barbed reducer 1/8"x1/16" | Cole Parmer | 30616-43 | 3x 30 mm of L/S16 fitted to 3x reducers = module connectors. (Section 3.2.2) |
| L/S13 Silicone tubing | Cole Parmer | OU-96410-13 | 55 cm section to connect the retentate to the L/S14 of the Y-connector on the Q-series cap. (Section 3.2.4) |
| L/S13 Silicone tubing | Cole Parmer | OU-96410-13 | 45 cm section to connect the permeate to the L/S14 of the Y-connector on the Q-series cap. (Section 3.2.4) |
| Straight barbed union | Cole Parmer | WZ-30612-43 | Attach to the end of the L/S13 that will connect with the L/S14 of the Y-connector. (Section 3.2.4) |
| Clamp | VWR | 229-0609 | (Section 3.4.2) |
| 4 mm Silicone tubing | Fisher | FB68858 | Fold over a 40 mm section of tubing and secure with a cable tie = Module end cap. (Section 4.3) |
| Cable tie | Fisher | 12326377 | Fold over a 40 mm section of tubing and secure with a cable tie = Module end cap. (Section 4.3) |
| MACSmix tube rotator | Miltenyi Biotech | 130-090-753 | An adaptation may be required to attach the modules. (Section 4.4) |
| Leur Injection port | Thistle Scientific | IB-10820 | Attach the end cap to the injection port. (Section 4.5) |
| Female Luer cap | Cole Parmer | WZ-45508-64 | Attach the end cap to the injection port. (Section 4.5) |
| L-lactic acid kit | Megazyme | K-LATE | (Section 5) |
| D-glucose kit | Megazyme | K-GLUC | (Section 5) |
| Scalpel / micro knife | InterFocus | 10315-12 | (Section 6.2) |
| Albumin ELISA | Bethyl Labs | E80-129 | (Section 7.4.3) |
References
- Lewis, W. H. Experimental evidence in support of the theory of outgrowth of the axis cylinder. American J Anat. 6 (1), 461-471 (1906).
- Harrison, R. G. The development of peripheral nerve fibers in altered surroundings. Wilhelm Roux Arch Entwickl Mech Org. 30 (2), 15-33 (1910).
- Ding, L., et al. A genome-scale RNAi screen for Oct4 modulators defines a role of the Paf1 complex for Embryonic Stem Cell identity. Cell Stem Cell. 4 (5), 403-415 (2009).
- Groeber, F., Holeiter, M., Hampel, M., Hinderer, S., Schenke-Layland, K. Skin tissue engineering -In vivo and in vitro applications. Adv Drug Deliv Rev. 63 (4), 352-366 (2011).
- Sinden, J. D., Vishnubhatla, I., Muir, K. W. Prospects for stem cell-derived therapy in stroke. Prog Brain Res. 201, 119-167 (2012).
- Ouyang, A., Yang, S. -. T. A two-stage perfusion fibrous bed bioreactor system for mass production of embryonic stem cells. Expert Opin Biol Ther. 8 (7), 895-909 (2008).
- Carnachan, R. J., Bokhari, M., Przyborski, S. A., Cameron, N. R. Taloring the morphology of emulsion-templated porous polymers. Soft Matter. 2 (7), 608-616 (2006).
- Deshpande, P., et al. Simplifying corneal surface regeneration using a biodegradable synthetic membrane and limbal tissue explants. Biomaterials. 34 (21), 5088-5106 (2013).
- Storm, M. P., Orchard, C. B., Bone, H. K., Chaudhuri, J. B., Welham, M. J. Three-dimensional culture systems for the expansion of pluripotent embryonic stem cells. Biotechnol Bioeng. 107 (4), 683-695 (2010).
- Wung, N., Acott, S. M., Tosh, D., Ellis, M. J. Hollow fibre membrane bioreactors for tissue engineering applications. Biotechnol Lett. 36 (12), 2357-2366 (2014).
- Ellis, M., Jarman-Smith, M., Chaudhuri, J. B., Chaudhuri, J., Al-Rubeai, Bioreactor systems for tissue engineering: A four-dimensional challenge. Bioreactors for tissue engineering; principles, design and operation. , 1-18 (2005).
- Silva, A. I., Mateus, M. Development of a polysulfone hollow fibre vascular bio-artificial pancreas device for in vitro studies. J Biotechnol. 139 (3), 236-249 (2009).
- De Bartolo, L., et al. Human hepatocyte functions in a crossed hollow fiber membrane bioreactor. Biomaterials. 30 (13), 2531-2543 (2009).
- Schmelzer, E., Finoli, A., Nettleship, I., Gerlach, J. C. Long-term three-dimensional perfusion culture of human adult bone marrow mononuclear cells in bioreactors. Biotechnol Bioeng. 112 (4), 801-810 (2015).
- Tapia, F., et al. Production of high-titer human influenza A virus with adherent and suspension MDKC cells cultured in a single-use hollow fiber bioreactor. Vaccine. 32 (8), 1003-1011 (2014).
- Deng, X., Zhang, G., Shen, C., Yin, J., Meng, Q. Hollow fiber culture accelerates differentiation of Caco-2 cells. Appl Microbiol Biotechnol. 97 (15), 6943-6955 (2013).
- Schutte, M., et al. Rat primary hepatocytes show enhanced performance and sensitivity to acetaminophen during three-dimensional culture on a polystyrene scaffold designed for routine use. Assay Drug Dev Technol. 9 (5), 475-486 (2011).
- Bokhari, M., Carnachan, R. J., Cameron, N. R., Przyborski, S. A. Novel cell culture device enabling three-dimensional cell growth and improved cell function. Biochem Biophys Res Commun. 354 (4), 1095-1100 (2007).
- Bokhari, M., Carnachan, R. J., Cameron, N. R., Przyborski, S. A. Culture of HepG2 liver cells on three dimensional polystyrene scaffolds enhances cell structure and function during toxicological challenge. J Anat. 211 (4), 567-576 (2007).
- Vivares, A., et al. Morphological behaviour and metabolic capacity of cryopreserved human primary hepatocytes cultivated in a perfused multiwell device. Xenobiotica. 45 (1), 29-44 (2015).
- Smith, I., et al. Human neural stem cell-derived cultures in three-dimensional substrates form spontaneously functional neuronal networks. J Tissue Eng Regen Med. , (2015).
- Davidson, A. J., Ellis, M. J., Chaudhuri, J. B. A theoretical approach to Zonation in a bioartificial liver. Biotechnol Bioeng. 109 (1), 234-243 (2012).
- Mulder, M. . The basic principles of membrane technology. 2nd ed. , (1996).
- Ellis, M. J., Chaudhuri, J. B. Poly(lactic-co-glycolic acid) hollow fibre membranes for use as a tissue engineering scaffold. Biotechnol Bioeng. 96 (1), 177-187 (2007).
- Shearer, H., Ellis, M. J., Perera, S. P., Chaudhuri, J. B. Effects of common sterilization methods on the structure and properties of poly(D,L lactic-co-glycolic acid) scaffolds. Tissue Eng. 12 (10), 2717-2727 (2006).
- Forsey, R. W., Chaudhuri, J. B. Validity of DNA analysis to determine cell numbers in tissue engineering scaffolds. Biotechnol Lett. 31 (6), 819-823 (2009).
- Williamson, M. R., Coombes, A. G. A. Gravity spinning of polycaprolactone fibres for applications in tissue engineering. Biomaterials. 25 (3), 459-465 (2004).
- El-Salmawy, A., et al. Preparation and properties of pronectin F-coated biodegradable hollow fibres. J Artif Organs. 8 (4), 245-251 (2005).
- Meneghello, G., et al. Fabrication and characterization of poly(lactic-co-glycolic acid)/polyvinyl alcohol blended hollow fibre membranes for tissue engineering applications. J Memb Sci. 344 (1-2), 55-61 (2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved