A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
إليسا القائم وتجليد وأسلوب المنافسة لتحديد بسرعة التفاعلات يجند مستقبلات
In This Article
Summary
The presented protocols describe two enzyme-linked immunosorbent assay (ELISA) based techniques for the rapid investigation of ligand-receptor interactions: The first assay allows the determination of dissociation constant between ligand and receptor. The second assay enables a rapid screening of blocking peptides for ligand-receptor interactions.
Abstract
A comprehensive understanding of signaling pathways requires detailed knowledge regarding ligand-receptor interaction. This article describes two fast and reliable point-by-point protocols of enzyme-linked immunosorbent assays (ELISAs) for the investigation of ligand-receptor interactions: the direct ligand-receptor interaction assay (LRA) and the competition LRA. As a case study, the ELISA based analysis of the interaction between different lambda interferons (IFNLs) and the alpha subunit of their receptor (IL28RA) is presented: the direct LRA is used for the determination of dissociation constants (KD values) between receptor and IFN ligands, and the competition LRA for the determination of the inhibitory capacity of an oligopeptide, which was designed to compete with the IFNLs at their receptor binding site. Analytical steps to estimate KD and half maximal inhibitory concentration (IC50) values are described. Finally, the discussion highlights advantages and disadvantages of the presented method and how the results enable a better molecular understanding of ligand-receptor interactions.
Introduction
فهم شامل للمسارات إشارات يتطلب معرفة تفصيلية عن التفاعل يجند مستقبلات. معظم وسائل لتقييم تفاعل يجند خاص مع مستقبلات معينة لها مكلفة ومستهلكة للوقت والعمل مكثفة وتتطلب معدات وخبرات 1 محددة.
توضح هذه المقالة بروتوكولين سريعة وموثوق بها نقطة بنقطة للتحقيق التفاعل يجند مستقبلات بناء على انزيم مرتبط المناعي فحص (ELISA): ومباشر يجند مستقبلات التفاعل فحص (جيش الرب للمقاومة) وجيش الرب للمقاومة المنافسة. إليسا هي تقنية حساسة للغاية ومحددة ومتاحة بسهولة، وتستخدم بشكل روتيني في مختبر تقريبا. إليسا لا يمكن أن يؤديها وتكييفها في الموضات المختلفة. يتم تحسين البروتوكولات المعروضة للتحقيق التفاعل بين إنترفيرون مختلفة امدا (INFLs) ومستقبلات بهم.
جيش الرب للمقاومة المباشر يسمح لquantificatiعلى من يجند مستقبلات ملزمة فيما يتعلق تركيز يجند وبالتالي ينتج منحنى ملزم. باستخدام نموذج مناسب للتفاعل يجند مستقبلات، البيانات يمكن تحليلها لتقدير ثابت التفكك (K D).
في بروتوكول المعروضة، يتم تطبيق هيل المعادلة التي يشيع استخدامها في تصميم نموذج ليجند مستقبلات ملزمة. رغم أن هناك طرقا أخرى مثل تكنولوجيا الرنين مأكل سطح 2،3 تسمح تحديد الانتماءات الملزمة بين اثنين من البروتينات، وهذه التكنولوجيا هي في كثير من الأحيان كثيفة العمالة، ومكلفة، وتتطلب معدات المختبرات الخاصة.
جيش الرب للمقاومة المنافسة يمكن فحص الببتيد المثبطة: كميا ويجند مستقبلات ملزم فيما يتعلق تركيز الببتيد. هذا ينتج منحنى الاستجابة للجرعة واصفا تأثير كابح من الببتيد. البيانات يمكن تحليلها لتقدير نصف تركيز مثبط القصوى (IC 50 ) من الببتيد حظر.
كلا البروتوكولين إليسا هي سهلة الاستخدام، ويمكن أن تتكيف مع مجموعة واسعة من الأسئلة البحثية. البروتينات المؤتلف من أي نوع يمكن استخدامها لتحديد موثوق وسريع الأجزاء التفاعل. وبالإضافة إلى ذلك، جيش الرب للمقاومة المنافسة يمكن استخدامها لتحديد مواقع التفاعل تنتقد بروابط ومستقبلات باستخدام منع الببتيدات، والتي صممت لتحاكي إما يجند أو مستقبلات. إذا أظهر الببتيد عرقلة وتثبيط فعالية ومحددة، الببتيد يحتل موقعا حاسما تفاعل يجند (إذا كان يقلد الببتيد مستقبلات) أو من يجند (إذا كان يقلد الببتيد يجند).
يصف البروتوكول الأول تحديد K D قيمة INFLs مختلفة والوحيدات ألفا من المستقبلات الخاصة بهم، أي مستقبلات انترلوكين 28 (IL28RA) باستخدام جيش الرب للمقاومة المباشر. بعد ذلك، يوضح البروتوكول الثاني كيفية تحديد قدرة الببتيد 20 الأحماض الأمينية طويلا لتمنع التفاعلات INFL-IL28RA. تم تصميم الببتيد للتنافس مع IFNLs في موقع مستقبلات تجليدها وبالتالي يمكن فهم الجزيئي للتفاعل. وعلاوة على ذلك، وهذا الببتيد يمكن استخدامها لمنع IL28RA في تجارب في المختبر لتحديد تأثير ذلك على آثار يشير المصب 4.
Protocol
1. إعداد الكاشف
- لإعداد عازلة طلاء كربونات، ويحل 0.36 ز نا 2 CO 3 و 0.84 غرام NaHCO 3 في 100 مل من الماء المقطر. تصفية العقيمة المخزن المؤقت باستخدام فراغ مدفوعة 0.22 ميكرون polyethersulfone (PES) غشاء تصفية وتخزينها في RT حتى الاستخدام.
- إعداد الحل غسل بإضافة 0.05٪ ت / ت توين 20 في الفوسفات مخزنة المالحة (PBS).
- إعداد 5٪ الأبقار مصل الزلال (BSA) (حل حجب) في حل برنامج تلفزيوني عن طريق إذابة 5 ز BSA (≥98٪) في 100 مل برنامج تلفزيوني وتخزينها في 4 درجات مئوية.
- المؤتلف مستقبلات، الليجندات والببتيدات حجب
- Reconstitutethe المؤتلف الإنسان فرعية انترلوكين مستقبلات ألفا (IL28RA) والمؤتلف بروابط صاحب الموسومة من الإنترفيرون البشري (IFNL1-3) وفقا لتعليمات الشركة الصانعة ومخزن في -80 درجة مئوية. Synthetize منع الببتيدات واستخدامها كما هو موضح سابقا (4). استخدام برنامج تلفزيوني لإعداد تركيزات مختلفة من يجندالصورة والببتيدات لاستخدامها في المقايسات.
- لإعداد الأجسام المضادة الأولية، وتمييع 6X صاحب ماوس الأجسام المضادة وحيدة النسيلة في برنامج تلفزيوني مع 0.1٪ BSA في 1: 1000 تخفيف. لإعداد الأجسام المضادة الثانوية، وتمييع الفجل البيروكسيديز (HRP) مترافق الماعز المضادة للماوس مفتش (H + L) في برنامج تلفزيوني مع 0.1٪ BSA في 1: 10000 التخفيف.
- يعد حل جهاز الرصد عن طريق خلط الكواشف ألف وباء وفقا لتعليمات الشركة الصانعة.
- إعداد توقف الحل بإضافة 5 N حامض الكبريتيك (H 2 SO 4) في الماء المقطر وتخزينها في RT.
2. انزيم مرتبط المناعي فحوصات (ELISAs)
ملاحظة: مباشر التفاعل يجند مستقبلات ELISA (جيش الرب للمقاومة المباشر، الشكل 1) يمكن استخدامها لقياس التفكك مستقبلات يجند ثابت (K D)، كمقياس للتقارب مستقبلات يجند ملزمة. التفاعل المنافسة يجند مستقبلات ELISA (جيش الرب للمقاومة المنافسة، الشكل 2) كلالدودة الحلزونية فحص من الببتيدات (وغيرها من المركبات تسد)، والتي تعمل على التدخل في التفاعل بين يجند والمستقبلة. البروتوكول الأساسي الذي تم نشره سابقا 5 تم تحسين أبعد من ذلك.
ملاحظة: في كلا ELISA استخدام أساليب متعددة ماصة لإضافة حلول للآبار لوحة 96-جيدا في كل خطوة. في حل صب أو غسل الخطوات، التخلص من الحلول مباشرة في الحوض.
- مباشر يجند مستقبلات-التفاعل الفحص (مباشر جيش الرب للمقاومة)
ملاحظة: للحصول على توضيح سير العمل (انظر الشكل 1).- لوحة طلاء مع مستقبلات المؤتلف
- تمييع مستقبلات المؤتلف في المخزن كربونات إلى تركيز النهائي من 100 نانوغرام / ميكرولتر. آبار معطف من 96-جيدا لوحة التلازن مع تركيز مستقبلات ثابت (100 نانوغرام / ميكرولتر) من قبل pipetting 100 ميكرولتر من كل بئر باستخدام ماصة الأقنية. استبعاد الجدران الخارجية للوحة لتجنب جيدا قطعة أثرية الحافة. تغطية لوحة مع غطاء واحتضانلوحة في 4 درجات CO / N.
- الحجب وإضافة الليجندات
- في اليوم التالي، وإزالة حل طلاء عن طريق إمالة لوحة ضد الحوض وغسل لوحة 3 مرات مع حل غسل (PBS + 0.05٪ ت / ت توين 20).
- منع المواقع ملزم مستقبلات الحرة في لوحة المغلفة باستخدام 200 ميكرولتر من 5٪ حل جيش صرب البوسنة إلى كل بئر باستخدام ماصة الأقنية واحتضان لوحة لمدة 2 ساعة على RT.
- تجاهل عرقلة الحل (راجع الخطوة 2.1.2.1.) وغسل لوحة 3 مرات مع حل الغسيل.
- إعداد صاحب الموسومة بروابط المؤتلف بتركيزات مختلفة (على سبيل المثال، 8 ميكروغرام / مل، 4 ميكروغرام / مل، 2 ميكروغرام / مل، 1 ميكروغرام / مل، و 0.5 ميكروغرام / مل، 0.25 ميكروغرام / مل، 0.125 ميكروغرام / مل، 0.063 ميكروغرام / مل، 0.031 ميكروغرام / مل، 0.0 ميكروغرام / مل) في برنامج تلفزيوني. إضافة الوحيد في برنامج تلفزيوني في الآبار فارغة.
- إضافة 100 ميكرولتر من كل تركيز يجند إلى الآبار في مكررة واحتضان لوحة لمدة 2 ساعة على RT السماح مستقبلات يجندالتفاعل.
- الحضانة مع الأجسام المضادة
- وبعد الحضانة مع بروابط، وغسل لوحة 3 مرات مع حل الغسيل.
- ماصة 100 ميكرولتر المضادة له، والحل الأساسي الماوس وحيدة النسيلة الأجسام المضادة (1: 1000) إلى كل بئر.
- احتضان لوحة في RT لمدة 2 ساعة. بعد الحضانة، وتجاهل الحل الأجسام المضادة (راجع الخطوة 2.1.2.1.) وغسل لوحة 3 مرات مع حل الغسيل.
- إضافة 100 ميكرولتر من برنامج الصحة الإنجابية يقترن الماعز المضادة للماوس مفتش حل الضد الثانوية (1: 10000) إلى كل بئر. احتضان لوحة لمدة 45 دقيقة في RT.
- تجاهل حل الأجسام المضادة (راجع الخطوة 2.1.2.1.) وغسل لوحة 3 مرات مع حل الغسيل.
- إضافة الركيزة والتنمية
- تقديم حلول الركيزة TMB إلى RT، وإعداد تمب الركيزة حل A و B في نسبة 1: 1. إضافة 100 ميكرولتر الطازجة الركيزة على كل جانب والحفاظ على لوحة على RT لمدة 15-30 دقيقة. بعد العقيد كافية أو التطوير إضافة 50 ميكرولتر توقف الحل.
- قراءة اللوحة وتحليل البيانات
ملاحظة: يقوم بروتوكول الموصوفة على افتراض أن إشارة قياس ترتفع من ملزمة محددة. قد يكون من الضروري تقدير مساهمة غير محددة ملزمة للإشارة لكن هذا هو خارج نطاق هذا البروتوكول.- قراءة الامتصاصية (الكثافة الضوئية، OD) مباشرة في 450 نانومتر.
- طرح إشارة الخلفية من القيم OD قياس وتطبيع هذه العلاقات. تحويل جميع قيم تركيز يجند إلى مقياس لوغاريتمي (القاعدة 10، تسجيل 10).
- مؤامرة تطبيع والخلفية تصحيح القيم OD (العمودي، يتوافق مع جزء من مواقع مستقبلات ملزمة المحتلة) ضد لوغاريتم تركيز يجند (المحور السيني، وتسجيل 10 الحجم).
- لتقدير قيمة K D، وتناسب البيانات إلى النموذج التالي من المعادلة هيل:
tp_upload / 53575 / 53575eq1.jpg "/>
ملاحظة: هنا Y يدل على جزء من مواقع الربط مستقبلات المحتلة وY ماكس على الحد الأقصى ملزمة. [L] يدل على تركيز يجند مجانا ومعامل هيل. إذا كان هناك موقع واحد فقط ملزم ليجند، ومعامل هيل ن = 1. للحصول على أنظمة مع موقع يجند أكثر من واحد ملزم، المعارض ملزمة cooperativity إيجابية إذا كان n> 1، cooperativity السلبية إذا كان n <1 و لا cooperativity إذا كان n = 1. يسمى ثابت التفكك المجهري ويتوافق مع نصف التركيز الفعال الأقصى EC 50 6. التفكك ثابت واضح هو ك د = (K D) ن. في أبسط الحالات حيث n = 1، والتفكك يتوافق مستمرة للتركيز يجند التي تشغل نصف مستقبلات مواقع الربط وك د = ك د. يفترض هذا النموذج العمل الجماعي ملزما بموجب شروط التوازن، فضلا عن أنه ليس هناك سوى جزء صغير منلا بد من يجند إضافة إلى مستقبلات، أي [L] >> [RL].
- لوحة طلاء مع مستقبلات المؤتلف
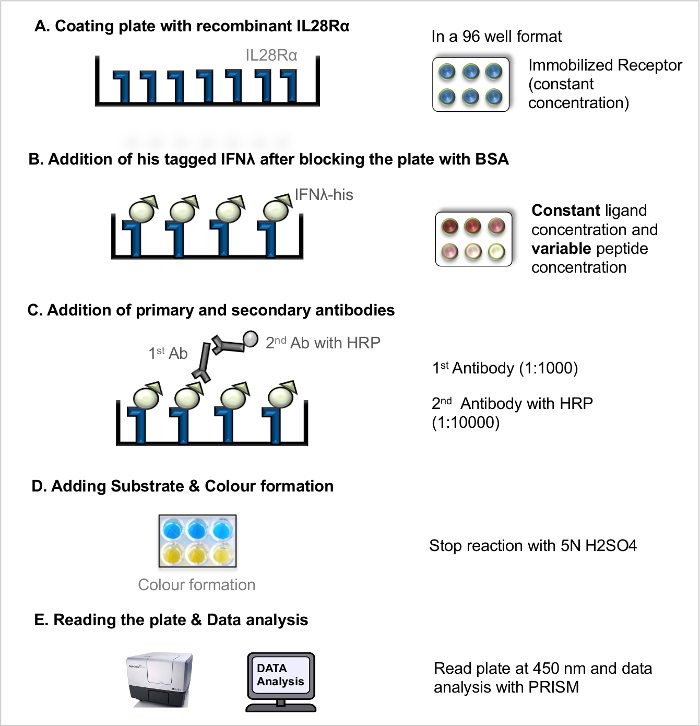
الشكل 1. المباشر يجند مستقبلات التفاعل فحص (جيش الرب للمقاومة المباشر). بروتوكول خطوة بخطوة لجيش الرب للمقاومة المباشر. الرجاء النقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
- المنافسة يجند مستقبلات-التفاعل الفحص (المنافسة جيش الرب للمقاومة)
ملاحظة: للحصول على توضيح سير العمل انظر الشكل 2 ويأتي هذا الإجراء جيش الرب للمقاومة المنافسة نفس الخطوات جيش الرب للمقاومة المباشر (طلاء لوحة، والأجسام المضادة الحضانة، وتطوير لوحة) باستثناء تغييرات هامة في يجند والببتيدات خطوة بالإضافة. ضوابط السلبية السليمة ضرورية لهذا الاختبار. في دراسة فحص السابقة <سوب> 4، الببتيد منع سارعت لم تظهر آثار معادية.- الحظر - إضافة الليجندات والببتيدات حجب
- في اليوم التالي، وإزالة حل طلاء وغسل لوحة (انظر 2.1.2.1).
- منع المغلفة لوحة بإضافة 200 ميكرولتر من 5٪ حل جيش صرب البوسنة إلى كل بئر واحتضان لوحة لمدة 2 ساعة على RT.
- إعداد المؤتلف بروابط صاحب الموسومة (IFNL1-3) بتركيز ثابت (2X 20 نانوغرام / مل) في برنامج تلفزيوني.
- إعداد الببتيد الحجب (راجع الجدول رقم 3) مع تركيزات مختلفة تتراوح ما بين 10 نانومتر إلى 100 ميكرومتر في برنامج تلفزيوني لضمان منحنى الاستجابة للجرعة.
ملاحظة: وهذا يتيح قرار لاحق من قيمة IC 50 لالببتيد حظر. في آبار المراقبة، إضافة تركيز يجند فقط ثابت دون الببتيد لاستخلاص أقصى (100٪) ملزمة. في الفراغ، إضافة الوحيد PBS دون يجند أو الببتيد. - إضافة 50 ميكرولتر من بروابط (IFNL1-3) و 50 ميكرولتر من كل البولي ايثيلينتركيز ptide إلى الآبار في مكررة.
- احتضان لوحة لمدة 2 ساعة على RT.
- قراءة اللوحة وتحليل البيانات
ملاحظة: يقوم بروتوكول الموصوفة على افتراض أن إشارة قياس ترتفع من ملزمة محددة. قد يكون من الضروري تقدير مساهمة غير محددة ملزمة للإشارة لكن هذا هو خارج نطاق هذا البروتوكول.- قراءة الامتصاصية (الكثافة الضوئية، OD) مباشرة في 450 نانومتر.
- طرح إشارة الخلفية من القيم OD قياس وتطبيع هذه العلاقات. تحويل جميع قيم تركيز الببتيد إلى مقياس لوغاريتمي (القاعدة 10، تسجيل 10).
- مؤامرة تطبيع والخلفية تصحيح القيم OD (العمودي، يتوافق مع جزء من مواقع مستقبلات ملزمة المحتلة) ضد لوغاريتم تركيز يجند (المحور السيني، وتسجيل 10 الحجم).
- لتقدير قيمة IC 50، احتواء البيانات للمعادلة التالية:
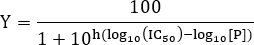
ملاحظة: هنا [ف] هو تركيز الببتيد والمنحدر هيل. يصف المنحدر هيل شدة الانحدار في منحنى الاستجابة للجرعة. وIC 50 يتوافق مع تركيز مثبط الذي لوحظ 50٪ من تثبيط ملزمة بين يجند والمستقبلة.
- الحظر - إضافة الليجندات والببتيدات حجب

الشكل 2. المنافسة يجند مستقبلات التفاعل فحص (جيش الرب للمقاومة المنافسة). بروتوكول خطوة بخطوة لجيش الرب للمقاومة المنافسة. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
النتائج
تم تحديد ثوابت التفكك بين INFL1-3 وعلى مستقبلات ألفا فرعية IL28RA باستخدام جيش الرب للمقاومة المباشر. وتظهر النتائج في الشكل (3): يتم رسم جزء من مواقع الربط المحتلة ضد لوغاريتم تركيز الإنترفيرون منها. ويظهر المؤامرة سكاتشارد البيانات في أسفل الزا?...
Discussion
إليسا هو المعيار وطريقة راسخة للعديد من المختبرات. لقد مزيد من التعديل وتحسين طريقة 5،7 المنشورة سابقا. ويبين أثبتت بروتوكول خطوة بخطوة كيف يمكن استخدامها في طريقة بسيطة لتحديد القيم K D التفاعلات يجند مستقبلات. بالإضافة إلى ذلك، IC50 من الببتيد الحجب الذي ي?...
Disclosures
A.E. was supported by a research grants from the "SNSF Ambizione Score" program (PZ00P3_154709), "Forschungsfond, Förderung strategischer Projekte" University of Basel, Stiftungsinfektionskrankheiten Basel, and Bangeter Rhyner Stiftung. J.L. acknowledges support by an iPhD fellowship of the SystemsX.ch initiative in systems biology program (9th call).
Acknowledgements
We thank Prof. J. Stelling (Department of Biosystems Science and Engineering, ETH Zurich and Swiss Institute for Bioinformatics, Basel, Switzerland) for his critical review of the manuscript.
Materials
| Name | Company | Catalog Number | Comments |
| Nunc-Immunoplate (F96 Maxi sorp) | Thermo Scientific | 442404 | ELISA plate |
| Sodium carbonate (Na2CO3) | Merck | 497-19-8 | For ELISA plate coating buffer |
| Sodium hydrogen carbomnate(NaHCO3) | Merck | 144-55-8 | For ELISA plate coating buffer |
| Bovine Serum Albumin (BSA) | Sigma | A7030-100G | 5% BSA in PBS for Blocking |
| rhIL-28Rα/IFNλR1 | R&D systems | 5260-MR | Recombinant human interlukin-28 Receptor alpha |
| rhIL-29/IFNλ1 | R&D systems | 1598-IL/CF | Recombinant human interlukin-29/Carrier free/C-terminal 10-His tag |
| rhIL-28A/IFNλ2 | R&D systems | 1587-IL/CF | Recombinant human interlukin-28A/Carrier free/C-terminal 6-His tag |
| rhIL-28B/IFNλ3 | R&D systems | 5259-IL/CF | Recombinant human interlukin-28B/Carrier free/C-terminal 6-His tag |
| 6x His Monoclonal antibody (Mouse) | Clontech | 631212 | Primary antiboy to capture His tagged Ligands |
| Goat anti-Mouse igG (H+L) | Jackson Immuno Research | 115-035-166 | Horseradish Peroxidase conjucated secondary antibody |
| BDoptEIA TMB reagent set | BD Biosciences | 555214 | ELISA - TMB substrate solution |
| Sulfuric acid (H2SO4) | Fulka | 84720 | 5 N H2SO4 (Enzyme reaction stop solution) |
| Synergy/H1 - Microplate reader | BioTeK | ELISA plate reader |
References
- Schneider, P., Willen, L., Smulski, C. R. Tools and techniques to study ligand-receptor interactions and receptor activation by TNF superfamily members. Methods in enzymology. 545, 103-125 (2014).
- Rossi, G., et al. Biosensor analysis of anti-citrullinated protein/peptide antibody affinity. Analytical biochemistry. 465, 96-101 (2014).
- van der Merwe, P. A., Barclay, A. N. Analysis of cell-adhesion molecule interactions using surface plasmon resonance. Curr Opin Immunol. 8, 257-261 (1996).
- Egli, A., et al. IL-28B is a key regulator of B- and T-cell vaccine responses against influenza. PLoS Pathog. 10, e1004556 (2014).
- Rosenbluh, J., et al. Positively charged peptides can interact with each other, as revealed by solid phase binding assays. Analytical biochemistry. 352, 157-168 (2006).
- Goutelle, S., et al. The Hill equation: a review of its capabilities in pharmacological modelling. Fundamental & clinical pharmacology. 22, 633-648 (2008).
- Levin, A., et al. Peptides derived from HIV-1 integrase that bind Rev stimulate viral genome integration. PLoS One. 4, e4155 (2009).
- Egli, A., Santer, M. D., O'Shea, D., Tyrrell, D. L., Houghton, M. The impact of the interferon-lambda family on the innate and adaptive immune response to viral infections. Emerging infectious diseases. , e51 (2014).
- Gad, H. H., Hamming, O. J., Hartmann, R. The structure of human interferon lambda and what it has taught us. J Interferon Cytokine Res. 30, 565-571 (2010).
- Folch, B., Rooman, M., Dehouck, Y. Thermostability of salt bridges versus hydrophobic interactions in proteins probed by statistical potentials. Journal of chemical information and modeling. 48, 119-127 (2008).
- Yuzlenko, O., Lazaridis, T. Interactions between ionizable amino acid side chains at a lipid bilayer-water interface. The journal of physical chemistry. B. 115, 13674-13684 (2011).
- Tissot, A. C., Vuilleumier, S., Fersht, A. R. Importance of two buried salt bridges in the stability and folding pathway of barnase. Biochemistry. 35, 6786-6794 (1996).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved