Method Article
التنمية والتحقق من طريقة PCR الكمي لEquid الفيروسة-2 التشخيص في الجهاز التنفسي السوائل
In This Article
Summary
Here, we present a protocol for the development and validation of a quantitative PCR method used for the detection and quantification of EHV-2 DNA in equine respiratory fluids. The EHV-2 qRT-PCR validation protocol involves a three-part procedure: development, characterization of qRT-PCR assay alone, and characterization of the whole analytical method.
Abstract
The protocol describes a quantitative RT-PCR method for the detection and quantification of EHV-2 in equine respiratory fluids according to the NF U47-600 norm. After the development and first validation step, two distinct characterization steps were performed according to the AFNOR norm: (a) characterization of the qRT-PCR assay alone and (b) characterization of the whole analytical method. The validation of the whole analytical method included the portrayal of all steps between the extraction of nucleic acids and the final PCR analysis.
Validation of the whole method is very important for virus detection by qRT-PCR in order to get an accurate determination of the viral genome load. Since the extraction step is the primary source of loss of biological material, it may be considered the main source of error of quantification between one protocol and another. For this reason, the AFNOR norm NF-U-47-600 recommends including the range of plasmid dilution before the extraction step. In addition, the limits of quantification depend on the source from which the virus is extracted. Viral genome load results, which are expressed in international units (IU), are easier to use in order to compare results between different laboratories.
This new method of characterization of qRT-PCR should facilitate the harmonization of data presentation and interpretation between laboratories.
Introduction
وتشارك هربس-2 Equid (EHV-2) في متلازمة الجهاز التنفسي، مع المظاهر السريرية المحتملة مثل الإفرازات الأنفية، والتهاب البلعوم وتضخم الغدد الليمفاوية 1-3. ويشتبه في هذا الفيروس أيضا أن تترافق مع ضعف الأداء من الخيول، والتي قد تؤدي إلى تأثير اقتصادي كبير وسلبي على صناعة الخيل 2.
حتى الآن، كان معيار الذهب أشعة غاما ذات الجهد العالي (γ-EHV) الكشف عن طريقة زراعة الخلايا. كان إزعاج الأول من هذا الإجراء عدم وجود تمييز بين EHV-2 وغيرها من γ-EHV (على سبيل المثال، EHV-5). كان إزعاج الثاني على التطور البطيء لعملية الاعتلال الخلوي، والتي تأخذ 12-28 أيام إلى إظهار 4،5.
تطوير الكمي في الوقت الحقيقي تفاعل البلمرة المتسلسل التحقق من صحة وتطبيع (QRT-PCR) طريقة سيساعد على الكشف بسرعة الفيروس، للتمييز بين EHV-2 وEHV-5 ودراسة العلاقة بين الحمل الجينوم الفيروسي وذلك بفضل المرض إلى الجانب الكمي.
وقد وصفت تفاعل البلمرة المتسلسل (PCR) لأول مرة في عام 1986 من قبل موليس 6 و هو على وشك أن تصبح المعيار الذهبي الجديد في معظم مجالات التشخيص البيولوجي (الإنسان والبيئة والطب البيطري). هذا الأسلوب الذي يعتمد على التضخيم من جزء من الجينوم من مسببات الأمراض، ويقدم العديد من المزايا: خصوصية وحساسية وسرعة. وعلاوة على ذلك، من مخاطر التلوث amplicon تراجع منذ ظهور QRT-PCR وضمان الجودة 7. ومع ذلك، فإن الاعتراف PCR كوسيلة من وسائل المعيار الذهبي الجديد استلزم أكثر من مجرد تحسين بيانات الأداء ولكن أيضا مظاهرة من السيطرة على خطوات التطوير والمصادقة على طريقة كله دون تدهور الأداء مع مرور الوقت.
الأدوات الجزيئية الأولى التي استخدمت للكشف عن EHV-2 كانت المرة جالتضخيم onsuming وتشارك غير محددة مع متداخل PCR تليها التسلسل 8. كانت الجينات المستهدفة للفيروسات الهربس حمض النووي الريبي منقوص الأكسجين (DNA) الحمض النووي بوليميريز والتعبئة والتغليف 9. ومع ذلك، متداخل PCR يعرض لمخاطر عالية من التلوث amplicons. ومنذ ذلك الحين، وقد تم تصميم الاختبارات PCR التقليدية لتضخيم انترلوكين مثل 10 الجين أو بروتين سكري الجين B، استعرض في عام 2009 (2). وفي الآونة الأخيرة، وقد وصفت خصائص PCR في الوقت الحقيقي لتقدير حجم EHV-2 10 لكن لم تتوفر بيانات بشأن المصادقة على طريقة كله بما في ذلك عملية الاستخراج.
في هذا البروتوكول، ووصف إجراءات التطوير والتحقق من صحة طريقة PCR الكمي للكشف وتقدير من EHV-2 الحمض النووي في سوائل الجهاز التنفسي الخيول وفقا للجمعية الفرنسية للتطبيع (AFNOR) المعيار NF U47-600 3،11،12، وهو الممثل الفرنسي فيلجنة تطبيع الدولية. تفاصيل هذه القاعدة "متطلبات وتوصيات لتنفيذ وتطوير والتحقق من صحة PCR البيطري في الحيوان أسلوب التحليل الصحة" 11،12، وفقا لNF EN ISO / CEI 17025، 2005 13 وOIE (المنظمة العالمية لصحة الحيوان) توصيات، ينطوي 2010 14 بروتوكول التحقق من صحة QRT-PCR EHV-2 إجراء ثلاثة أجزاء: (أ) تطوير فحص QRT-PCR، (ب) توصيف QRT-PCR فحص وحدها و (ج) توصيف للمجلس بكامل هيئته المنهج التحليلي (من استخراج الأحماض النووية من العينة البيولوجية لتحليل PCR).
توصيف فحص QRT-PCR والمنهج التحليلي كله يشمل تعريف حدود اثنين: الحد من الكشف (اللد) والحد من الكمي (LOQ). يمثل اللد 95٪ PCR أقل عدد من نسخ الحمض النووي لكل وحدة حجم التي يمكن الكشف عنها في 95٪ من جميع الاكاديميةوفاق. وLOQ 95٪ PCR يمثل أقل كمية النسخ الحمض النووي التي يمكن تحديدها مع الأخذ بعين الاعتبار عدم اليقين.
هذه الطريقة QRT-PCR يسمح للكشف الدقيق وتقدير السريع لEHV-2 في سوائل الجهاز التنفسي. وعلاوة على ذلك، يمكن تطبيق هذه الطريقة في غيرها من المختبرات لضمان إجراءات موحدة والقالب العام لتطوير أخرى المقايسات QRT-PCR جديدة.
Protocol
ملاحظة: يرجى الرجوع إلى جميع الخطوات المختلفة التي يتم هو موضح في الشكل 1.
1. استخراج الأحماض النووية
ملاحظة: إجراء استخراج تحت غطاء الدخان للحد من التلوث الهوائي مع الأحماض النووية. تشمل مراقبة سلبية استخراج مع المياه المعالجة DEPC لضمان أن أيا من الكواشف ملوثة الحمض النووي غير المرغوب فيها.
- استخراج الأحماض النووية من العينة البيولوجية وفقا لسبق وصفها بروتوكول بروتوكول 15 والشركة الصانعة.
- إضافة 140 ميكرولتر من عينة بيولوجية إلى 560 ميكرولتر من حل تحلل (عازلة AVL)، واحتضان لمدة 10 دقيقة في درجة حرارة الغرفة. إضافة 560 ميكرولتر من الايثانول. تطبيق 630 ميكرولتر الأولى من هذا الحل (عينة + تحلل حل + الإيثانول) إلى عمود السيليكا وأجهزة الطرد المركزي.
- تطبيق 630 ميكرولتر المتبقية من هذا الحل إلى العمود السيليكا نفسه وأجهزة الطرد المركزي. ثم يغسل العمود مع 500 ميكرولترمن 2 مختلفة مخازن غسل (AW1 وAW2).
- أزل الحمض النووي مع 50 ميكرولتر من شطف العازلة (عازلة AVE) وتتوازن إلى درجة حرارة الغرفة. إغلاق الغطاء واحتضان في درجة حرارة الغرفة لمدة 1 دقيقة. أجهزة الطرد المركزي في 6000 ز لمدة 1 دقيقة.
2. إجراء التضخيم
- إعداد 22.5 ميكرولتر من مزيج رد فعل لكل فعل. إضافة 12.5 ميكرولتر من PCR مزيج الرئيسي، س ميكرولتر من 20 ميكرومتر التمهيدي إلى الأمام، والعاشر ميكرولتر من 20 ميكرومتر التمهيدي العكسي، ميكرولتر ذ من تحقيق 10 ميكرومتر و z ميكرولتر الماء عالى النقاء كما هو مطلوب للوصول إلى 22.5 ميكرولتر (س، ويتم الحصول على كميات ذ و z بعد المعايرة، انظر الأقسام 3.2.3 و 3.2.6).
- قسامة 22.5 ميكرولتر من مزيج رد الفعل المناسب على كل رد فعل جيد في لوحة 96-جيدا.
ملاحظة: تضمين ضوابط السلبية لاستخراج ولPCR لضمان الملوثة أن أيا من الكواشف مع الحمض النووي غير المرغوب فيها. - إضافة 2.5 ميكرولتر من العينة، و 2.5 ميكرولتر من استخراج negativمراقبة الإلكترونية، 2.5 ميكرولتر من سيطرة سلبية PCR و 2.5 ميكرولتر من عينة إيجابية (سلالة إشارة أو البلازميد) إلى رد فعل مماثل أيضا. بعد توزيع، تغطية لوحة مع ختم لوحة لاصقة. أجهزة الطرد المركزي لوحة لمدة 10 ثانية في 6000 ز.
- وضع لوحة في نظام PCR في الوقت الحقيقي. حدد القالب لتخطيط فحص وبدء التشغيل. استخدام الإعداد برنامج PCR: 10 دقيقة في درجة حرارة 95 درجة مئوية تليها 45 دورات من 15 ثانية في 95 درجة مئوية و 1 دقيقة في 60 درجة مئوية (الجدول 1).
- نقل البيانات الخام من نظام PCR في الوقت الحقيقي إلى جدول بيانات. تعيين العتبة في المؤامرات التضخيم فوق خط الأساس وفي المنطقة النمو الهائل للحصول على دورة عتبة لكل عينة. رسم لكل معيار نقطة النحو منحنى القياسية للحصول الخطي. حساب عدد النسخ للعينات المختلفة استنادا إلى منحنى القياسية.
3. تطوير الكمي RT-PCR
ملاحظة: تطوير اختبار QRT-PCR تتطلب السلالات المرجعية، البلازميد معاير محددة، وضوابط مختلفة وتستلزم المعايرة من الاشعال والتحقيق.
- اختبار أولي
- الاشعال تصميم وتحقيقات مع برامج معينة وفقا للتوصيات السابقة 16.
- استخراج سلالات إشارة كما هو موضح في القسم 1.
- تضخيم كما هو موضح في القسم 2 مع 900 نيوتن متر لتركيز النهائي من الاشعال و 250 نانومتر للتركيز النهائي من التحقيق. تحليل إشارة كما هو موضح في القسم 2.5.
- في الوقت نفسه، نفذ التضخيم من سلالات إشارة الحمض النووي (كما هو موضح في القسم 3.1.3) دون تحقيقات. تسلسل amplicons التي حصل عليها طريقة سانجر 17،18. تحليل تسلسل عن طريق تشغيل انفجار النوكليوتيدات 19.
- المعايرة من الترب و التحقيق
- إعداد 3 خلطات مختلفة مع 250 نيوتن متر من التركيز النهائي التحقيق ومع concentr النهائي مختلفةبالجمع من الأمام وعكس الاشعال (50 نانومتر / 50 نانومتر، 300 نانومتر / 300 نانومتر و 900 نانومتر / 900 نانومتر) لمدة 3 مكررات من العينة إيجابية ومراقبة سلبية. لكل المزيج، إضافة حجم مناسب نفسه من 20 ميكرومتر التمهيدي إلى الأمام و 20 ميكرومتر التمهيدي العكسي (0.25 ميكرولتر للحصول على التركيز النهائي 50 نانومتر، و 1.5 ميكرولتر للحصول على 300 نانومتر تركيز النهائي أو 4.5 ميكرولتر للحصول على التركيز النهائي 900 نانومتر) ، 50 ميكرولتر من مزيج الرئيسي PCR، 2.5 ميكرولتر من تحقيق 10 ميكرومتر والماء عالى النقاء كما هو مطلوب للوصول إلى 90 ميكرولتر.
- تنفيذ الإجراء التضخيم كما هو موضح في القسم 2.
- اختيار أفضل حالة للحصول على أعلى مستوى من التضخيم، أقرب عتبة دورة (CT) وأفضل التكرار بين الظروف 3. تحديد أفضل تركيز وحجم س المقابل ميكرولتر من الأمام وعكس الاشعال.
- إعداد 5 خلطات مختلفة لعينات 4 (3 مكررات من العينة إيجابية والمراقبة السلبية)مع 5 تركيزات النهائية مختلفة من التحقيق (50 نانومتر، 100 نانومتر و 150 نانومتر، 200 نانومتر، 250 نانومتر). لكل المزيج، إضافة العاشر ميكرولتر من 20 ميكرومتر التمهيدي إلى الأمام و x ميكرولتر من 20 ميكرومتر التمهيدي العكسي (التي سبق تحديدها، في القسم 3.2.3)، 50 ميكرولتر من مزيج الرئيسي PCR، حجم مناسب من 10 ميكرومتر التحقيق (0.5 ميكرولتر للحصول على 50 نانومتر تركيز، 1 ميكرولتر للحصول على التركيز نانومتر 100، 1.5 ميكرولتر للحصول على التركيز نانومتر 150، 2 ميكرولتر للحصول على التركيز نانومتر 200 أو 2.5 ميكرولتر للحصول على التركيز نانومتر 250) والماء عالى النقاء كما هو مطلوب لتصل إلى 90 ميكرولتر.
- تنفيذ الإجراء التضخيم كما هو موضح في القسم 2.
- اختيار أفضل حالة للحصول على أعلى مستوى من التضخيم، أقرب عتبة دورة (CT) وأفضل التكرار بين 5 الأحوال. تحديد أفضل تركيز والمناظر حجم ذ ميكرولتر للتحقيق.
4. توصيف الكمي ريال-PCR الوقت (QRT-PCR)
ملاحظة: بعد الخطوة التنمية وتحديد أفضل الظروف للاستخدام، الخطوة توصيف PCR تتضمن خصوصية، والحد من الكشف، ومجموعة الخطي والحد من تقدير حجم QRT-PCR.
- إعداد والمعايرة البلازميد
- طلب البلازميد تجاري يحتوي على جزء ذات الصلة من الجين المستهدف الحمض النووي الذي تم اختياره للPCR (في هذا البروتوكول، النيوكليوتيدات 2081-2381 من EHV-2 بروتين سكري الجين B، انظر الجدول 1).
ملاحظة: للحد من مخاطر التلوث الهوائي مع الحمض النووي الاصطناعي، نفذ التخفيفات المسلسل من البلازميدات تحت غطاء الدخان في غرفة منفصلة، والعمل مع الحمض النووي المخفف خلال جميع الخطوات للتنمية وإجراء التحقق من الصحة. - اعادة تعليق البلازميد مع الماء عالى النقاء لإعداد محلول المخزون في 50 نانوغرام / مل. دوامة وأجهزة الطرد المركزي لفترة وجيزة على حل الأسهم البلازميد.
ملاحظة: تحديد تركيز حقيقي من ستو البلازميدحل المسيخ بعد إعادة تعليق من أجل حساب عدد نسخة من البلازميد. - إضافة 1 ميكرولتر من البلازميد إلى معمل. قراءة الكثافة الضوئية (OD) في 230 نانومتر و 260 نانومتر و 280 نانومتر. قراءة قبالة تركيز الحمض النووي على البرنامج معمل (OD، 260 نانومتر).
- حساب عدد نسخة من البلازميد باستخدام عدد أفوجادرو (N A) والصيغة:
عدد نسخ / ميكرولتر = (N A [البلازميد في نانوغرام / ميكرولتر]) / (الطول البلازميد × 10 9 × متوسط وزن زوج قاعدة) = (6022 × 10 23 × [البلازميد]) / (الطول البلازميد × 10 9 × 660)
- طلب البلازميد تجاري يحتوي على جزء ذات الصلة من الجين المستهدف الحمض النووي الذي تم اختياره للPCR (في هذا البروتوكول، النيوكليوتيدات 2081-2381 من EHV-2 بروتين سكري الجين B، انظر الجدول 1).
- اختبار خصوصية (الشمولية والتفرد) من QRT-PCR
- اختبار الشمولية للنظام PCR. حدد EHV-2 عينات من الحمض النووي إيجابية، وتتميز من قبل التسلسل (التي أنشئت وضع إيجابي).
- تنفيذ الإجراء التضخيم كما هو موضح في القسم 2.
- تحليلPCR البيانات لكل عينة النحو الموضح في القسم 2.5. تحقق من وجود منحنى أسي لجميع العينات المختارة في القسم 4.2.1 وتأكيد الشمولية من PCR.
- اختبار التفرد من نظام PCR باستخدام مقتطفات من الحمض النووي من مسببات الأمراض مع التشابه الوراثية إلى الهدف (في هذه الحالة، فيروس الهربس equid أخرى مثل EHV-1، EHV-4، EHV-3، EHV-5 وهربس 5 أبله كما هو موضح في الجدول رقم 2) وغيرها من مسببات الأمراض تشارك في أمراض الجهاز التنفسي للمضيف (في هذه الحالة، فرسي فيروس التهاب الشرايين، فيروس إنفلونزا الخيول، الكوكسيلا البورنيتية، Rhodococcus متساو، العقدية الخيلية متساو، العقدية الخيلية السوافية، الكلاميدوفيلا المجهضة والكلبسيلة الرئوية، انظر الجدول 2).
- تنفيذ الإجراء التضخيم كما هو موضح في القسم 2.
- تحليل البيانات PCR لكل عينة كما هو موضح في القسم 2.5. تحقق من عدم وجود منحنى الأسي لجميع العينات المختارة فيالقسم 4.2.4 لتأكيد التفرد من PCR.
- الحد من الكشف عن QRT-PCR
- الاستغناء عن 90 ميكرولتر من الماء عالى النقاء إلى 6 الأنابيب.
- أداء 6 التخفيفات المسلسل عشرة أضعاف من البلازميد لاستهداف منطقة الحد (فقدان كشف ط م). نقل 10 ميكرولتر من البلازميد تخفيف عمل إلى أنبوب مع 90 ميكرولتر من الماء عالى النقاء. دوامة لفترة وجيزة أجهزة الطرد المركزي في أنبوب. تلقت كرر الخطوة 4.3.2 حتى أنبوب الماضي في التخفيف المتسلسل البلازميد.
- أداء التضخيم من 6 التخفيفات المسلسل عشرة أضعاف من البلازميد كما هو موضح في القسم 2.
- تحديد منطقة الحد: منطقة بين تخفيف الماضي البلازميد تقديم إشارة إيجابية والتخفيف الأول دون الكشف (انظر الشكل 2).
- لبدء 6 التخفيفات المسلسل شقين، اختر تخفيف الماضي البلازميد الذي يعطي إشارة إيجابية (انظر القسم 4.3.4).
ملاحظة: تنفيذ 3 ثلاثي مستقلةالمرض لتحديد الحد من الكشف عن QRT-PCR (اللد 95٪ PCR) - الاستغناء عن 25 ميكرولتر من الماء عالى النقاء إلى 6 الأنابيب.
- أداء 6 التخفيفات المسلسل شقين من البلازميد. نقل 25 ميكرولتر من تخفيف العمل البلازميد، كما هو محدد في القسم 4.3.5، للأنبوب مع 25 ميكرولتر من الماء عالى النقاء. دوامة لفترة وجيزة أجهزة الطرد المركزي في أنبوب. تلقت كرر الخطوة 4.3.7 حتى أنبوب الماضي في التخفيف المتسلسل البلازميد.
- أداء التضخيم من 6 التخفيفات المسلسل شقين من البلازميد كما هو موضح في القسم 2. كرر الخطوات من 4.3.7 إلى 4.3.8 مرتين، للحصول على 3 تجارب مع 8 مكررات (24 مكررات) من كل واحد من 6 عشرة أضعاف التخفيفات المسلسل من البلازميد.
ملاحظة: يتم تعريف الحد من الكشف عن QRT-PCR (اللد 95٪ PCR)، وأقل عدد نسخ الحمض النووي من قبل وحدة التخزين التي تم الكشف عنها في 95٪ من الحالات. - احسب عدد مكررات إيجابية من أصل 24 مكررات لكل مستوى من concentra البلازميدنشوئها.
- تحديد اللد 95٪ PCR. في اللد 95٪ PCR هو المستوى الذي ينتج في الكشف عن 23 مكررات إيجابية من أصل 24 مكررات.
- المدى الخطي والحد من الكمي لQRT-PCR
ملاحظة: إجراء 4 تجارب مستقلة مع 6 التخفيفات المسلسل عشرة أضعاف من البلازميد للتأكد من أن أقل تركيز المستخدمة في نطاق يناظر٪ اللد 95 PCR التي سبق تحديدها في 4.3.10.- الاستغناء عن 45 ميكرولتر من الماء عالى النقاء في 6 الأنابيب.
- بدء تشغيل 6 التخفيفات المسلسل عشرة أضعاف مع تركيز البلازميد تخفيف العمل الموافق 10 7 اللد 95٪ PCR.
- أداء 6 التخفيفات المسلسل عشرة أضعاف من البلازميد. نقل 5 ميكرولتر من تمييع العمل البلازميد (تحدد في القسم 4.4.2) إلى أنبوب مع 45 ميكرولتر من الماء عالى النقاء. دوامة لفترة وجيزة أجهزة الطرد المركزي في أنبوب. تلقت كرر الخطوة 4.4.3 حتى أنبوب الماضي في التخفيف المتسلسل صlasmid.
- تضخيم 6 التخفيفات المسلسل عشرة أضعاف من البلازميد كما هو موضح في القسم 2.
- تتبع الانحدار الخطي ص = الفأس + ب مع لمنحدر وب لاعتراض (الشكل 3).
- حساب الكفاءة التضخيم (E) من منحدر من المنحنى القياسي (انظر 4.4.5) باستخدام المعادلة:
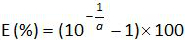 .
.
كرر الخطوات من 4.4.1 إلى 4.4.6 ثلاث مرات.
ملاحظة: تمثل الكفاءة التضخيم كمية من نمو الناتج PCR بعد كل دورة. رد فعل مثالية تصل كفاءة قريبة من 100٪. في الممارسة العملية، E (٪) وبين 75٪ و 125٪. أعلى E يمكن أن تشير إلى التضخيم من المنتجات غير محددة أو خطأ pipetting لفي التخفيف المتسلسل. E أقل ويمكن أيضا أن تشير إلى وجود خطأ pipetting لفي التخفيف المتسلسل، وسوء التصميم التمهيدي أو ظروف التفاعل غير المثلى. - حساب التحيز (الجدول3). تحقق لكل مستوى البلازميد أن قيمة الانحياز المطلق أقل من قيمة التحيز الحرجة (0.25 سجل 10). تحديد الشكوك الخطي (يو ليني) لكل مستوى البلازميد (الجدول رقم 3) لتقييم أداء الانحدار الخطي لEHV-2 QPCR (الشكل 4) يعني التحيز و. يو ليني هو عدم اليقين الخطي تحديدها لكل ط البلازميد المستوى المحسوب من الانحراف المعياري (SD'i) ويعني التحيز. تحديد الخطي عدم اليقين جنبا إلى جنب (يو لين) من EHV-2 QPCR التي قدمها الصيغة:

ملاحظة: يتم تحديد قبول التحيز من قبل المختبر (في التحيز المطلق العام 0.25 سجل 10) وتتوافق مع الفرق بين أقل قيمة وأعلى قيمة من 0.5 السجل 10 (كمية تقاس سجل 10 عدد نسخة). يو لين قيمة يمكن أن تساعد على المقارنة بين أداء QPCR من مختبرات مختلفة. - تحديد الحد من القياس الكمي لQRT-PCR (LOQ PCR): LOQ PCR هو أدنى تركيز مع وجود تحيز 0.25 سجل 10 المستخدمة في مجموعة الخطي (الجدول 3).
5. توصيف المنهج التحليلي الجامع (من استخراج الحمض النووي إلى نتيجة QRT-PCR)
ملاحظة: توصيف طريقة كله هو التحقق من صحة جميع الخطوات اللازمة للحصول على بيانات QRT-PCR (أي من استخراج الحمض النووي من العينة في الجهاز التنفسي (انظر القسم 1) إلى التضخيم وتقدير من الهدف (انظر القسم 2 )).
- إنشاء المراسلات بين عدد النسخ في رد فعل PCR وعدد نسخ موجودة في عينة بيولوجية مع الصيغة:
 .
.
ال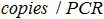 هو عدد نسخ البلازميد في رد فعل PCR،
هو عدد نسخ البلازميد في رد فعل PCR، 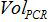 هو حجم العينة إضافة إلى PCR مزيج لتضخيم،
هو حجم العينة إضافة إلى PCR مزيج لتضخيم، 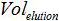 هو حجم العازلة AVE تستخدم لأزل الأحماض النووية و
هو حجم العازلة AVE تستخدم لأزل الأحماض النووية و 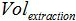 هو حجم العينة المستخرجة.
هو حجم العينة المستخرجة. - اختبار حساسية وخصوصية الأسلوب التحليلي الجامع
ملاحظة: يتم استخدام معروف فقط EHV-2 الإيجابية (أو السلبية) عينات في هذا القسم.- اختبار "حساسية" طريقة QRT-PCR من خلال تحليل عينات إيجابية للهدف (EHV-2).
- حدد EHV-2 عينات من الحمض النووي إيجابية، تتميز سابقا (الوضع الإيجابي).
- استخراج الحمض النووي كما هو موضح في القسم 1. تنفيذ إجراء التضخيم كما هو موضح في القسم 2.
- تحديد عدد من ايجابيات الحقيقية (عينات إيجابيةالتي هي ايجابية مع هذا RT-PCR) وعدد من السلبيات كاذبة (المعروف العينات الإيجابية التي هي سلبية مع هذا RT-PCR).
- اختبار "خصوصية" للطريقة QRT-PCR من خلال تحليل عينات سلبية
- حدد EHV-2 عينات من الحمض النووي السلبية (الوضع السلبي).
- استخراج الحمض النووي كما هو موضح في القسم 1. تنفيذ إجراء التضخيم كما هو موضح في القسم 2.
- تحديد عدد من السلبيات الحقيقية (العينات السلبية التي هي معروفة لتكون سلبية مع هذا RT-PCR) وعدد من ايجابيات كاذبة (العينات السلبية المعروفة التي هي ايجابية مع هذا RT-PCR).
- حساب "الحساسية التشخيصية" (سي) و "خصوصية التشخيص" (SP) من الأسلوب كله (الجدول 4) على النحو التالي: سي = عدد من ايجابيات الحقيقية / (عدد من ايجابيات حقيقية + السلبيات كاذبة) و SP = عدد حقيقي السلبيات / (عدد سلبي حقيقيالصورة + ايجابيات كاذبة) (انظر الجدول 4).
- حساب فاصل الثقة 95٪ للحساسية وخصوصية الأسلوب كله مع صيغة غرينر وغاردنر علاقة 12،20:
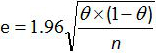
حيث e هو الخطأ التقديري، θ هي سي (أو يرة سورية) و n عدد العينات التي تم تحليلها.
ملاحظة: للحصول على عدد قليل من العينات، استخدم الجدول شوارتز حسب AFNOR القاعدة 12 لحساب فاصل الثقة 95٪ للحساسية وخصوصية الأسلوب كله.
- اختبار "حساسية" طريقة QRT-PCR من خلال تحليل عينات إيجابية للهدف (EHV-2).
- إعداد السلبية المواد الموارد لتوصيف المنهج التحليلي الجامع
تنبيه: لتحديد حدود الكشف النوعي والكمي لطريقة كله (اللد الطريقة والأسلوب LOQ)، إضافة تركيزات معروفة من البلازميد العينات البيولوجية التي هي معروفة لتكون مجاناالهدف (EHV-2 في هذه الحالة). هذه العينات، جنبا إلى جنب مع البلازميد كميا، تشكل المعايير الإيجابية التي لتحديد الطريقة اللد والطريقة LOQ.- تأكيد غياب الهدف (EHV-2) في العينات البيولوجية المستخدمة في بناء معايير إيجابية.
- اختيار مختلف العينات البيولوجية السلبية المعروفة.
- استخراج العينات البيولوجية كما هو موضح في القسم 1. تنفيذ الإجراء التضخيم كما هو موضح في القسم 2.
- تأكيد غياب الهدف عن طريق عدم وجود إشارة PCR في هذه العينات.
ملاحظة: استخدم نفس المواد المرجعية سلبية على جميع الخطوات بين 5.4 و 5.5.
- تجميع العينات سلبية مختلفة للحصول على 15 مل من المواد المرجعية السلبية (حجم اللازمة للمصادقة كاملة). الاستغناء عن 135 ميكرولتر من هذه المواد الموارد السلبية إلى 100 الأنابيب. إبقاء الأنابيب في +4 درجة مئوية أو في -80 درجة مئوية لمدة التخزين الطويل.
- تأكيد غياب الهدف (EHV-2) في العينات البيولوجية المستخدمة في بناء معايير إيجابية.
- دييزطن من الكشف عن الطريقة التحليلية الجامع
- تحديد المنطقة الحد من الأسلوب كله.
- الاستغناء عن 45 ميكرولتر من الماء عالى النقاء في 6 الأنابيب.
- أداء 6 التخفيفات المسلسل عشرة أضعاف من البلازميد. نقل 5 ميكرولتر من تمييع العمل البلازميد الموافق 10 7 اللد 95٪ PCR (كما هو محدد في القسم 4.3.10) إلى أنبوب مع 45 ميكرولتر من الماء عالى النقاء. دوامة لفترة وجيزة أجهزة الطرد المركزي في أنبوب. تلقت كرر الخطوة 5.4.1.2 حتى أنبوب الماضي في التخفيف المتسلسل البلازميد.
- نقل 5 ميكرولتر من كل تخفيف البلازميد إلى 2 الأنابيب مع 135 ميكرولتر من المواد المرجعية السلبية للحصول على 2 نسخ متماثلة للمعايير إيجابية 6. دوامة وأجهزة الطرد المركزي لفترة وجيزة.
- أداء استخراج مكررات 2 للمعايير إيجابية 6 كما هو موضح في القسم 1. تنفيذ الإجراء التضخيم كما هو موضح في القسم 2.
- تحديد منطقة الحد: منطقة بين اضرب الماضيentration البلازميد إعطاء إشارة إيجابية وتركيز الأولى التي يظهر أي إشارة.
- الحد من الكشف عن أسلوب (اللد الطريقة) التي يحددها 2 المحاكمات المستقلة
ملاحظة: إجراء محاكمات 2 مستقلة لتحديد الحد من الكشف عن طريقة كله (اللد الطريقة).- بدء تشغيل 6 التخفيفات المسلسل شقين مع تخفيف العمل البلازميد التي هي 4 مرات أكثر تركيزا أن تركيز الأخير من البلازميد الذي أعطى إشارة إيجابية (انظر القسم 5.4.1.5).
- الاستغناء عن 25 ميكرولتر من الماء عالى النقاء في 6 الأنابيب.
- أداء 5 التخفيفات المسلسل شقين من البلازميد. نقل 25 ميكرولتر من البلازميد العمل التخفيف (كما هو محدد في القسم 5.4.2.1) لأنبوب مع 25 ميكرولتر من الماء عالى النقاء. دوامة لفترة وجيزة أجهزة الطرد المركزي في أنبوب. تلقت كرر الخطوة 5.4.2.3 حتى أنبوب الماضي في التخفيف المتسلسل البلازميد.
- نقل 5 ميكرولتر من كل تخفيف من plasmiد إلى 4 أنابيب مع 135 ميكرولتر من المواد المرجعية السلبية للحصول على 4 مكررات من 5 معايير إيجابية. دوامة لفترة وجيزة أنابيب الطرد المركزي.
- أداء استخراج 4 مكررات ل5 معايير إيجابية كما هو موضح في القسم 1. تنفيذ الإجراء التضخيم كما هو موضح في القسم 2.
- كرر الخطوات من 5.4.2.1 إلى 5.4.2.5 مرة للحصول على 8 مكررات لكل مستوى من مستويات تركيز البلازميد.
- حساب عدد مكررات إيجابية من 8 مكررات لكل مستوى من مستويات تركيز البلازميد.
- تحديد طريقة اللد. طريقة اللد هو المستوى الأخير الذي يعيد 8 من أصل 8 مكررات إيجابية (كما هو موضح في القسم 5.4.2.7).
- تحديد المنطقة الحد من الأسلوب كله.
- المدى الخطي والحد من الكمي من الطريقة التحليلية الجامع
ملاحظة: لتحديد الحد من القياس الكمي لطريقة كله (LOQ الطريقة)، إضافة تركيزات معروفة من البلازميد لالبيولوجيةالعينات التي هي معروفة لتكون خالية من الهدف (EHV-2 في هذه الحالة). وتشكل هذه العينات معايير إيجابية لتحديد الطريقة LOQ.- الاستغناء عن 45 ميكرولتر من الماء عالى النقاء في 6 الأنابيب.
- أداء 6 التخفيفات المسلسل عشرة أضعاف من البلازميد. نقل 5 ميكرولتر من تمييع العمل البلازميد الموافق 10 7 اللد الطريقة (كما هو محدد في القسم 5.4.2.8) لأنبوب مع 45 ميكرولتر من الماء عالى النقاء. دوامة لفترة وجيزة أجهزة الطرد المركزي في أنبوب. تلقت كرر الخطوة 5.5.2 حتى أنبوب الماضي في التخفيف المتسلسل البلازميد.
- نقل 5 ميكرولتر من كل تخفيف من البلازميد إلى 2 الأنابيب مع 135 ميكرولتر من المواد السلبية الموارد البيولوجية للحصول على 2 مكررات المعايير الإيجابية 6. دوامة وأجهزة الطرد المركزي لفترة وجيزة.
- أداء استخراج مكررات 2 للمعايير إيجابية 6 كما هو موضح في القسم 1. تنفيذ الإجراء التضخيم كما هو موضح في القسم 2. كرر الخطوات من 5.5.1إلى 5.5.4 ثلاث مرات.
- تعريف الملف دقة من أجل تقييم والتحقق من صحة الأداء الكمي للطريقة.
- تعريف حدود قبول طريقة كاملة للمختبر. في هذا البروتوكول، ويتم تحديد حدود القبول كما ± 0.75 سجل 10 من LABéO فرانك دونكومبو.
- لتجربة واحدة، وتتبع أول الانحدار الخطي ص = الفأس + ب (أ هو المنحدر وb هو التقاطع) مع تكرار واحد من القيم ط مناظر لكل القيمة المقدرة للمنحنى القياسية. مع هذا أول الانحدار الخطي، وحساب القيمة التجريبية من عدد نسخ لمكررات من القيم ط استخدامها لهذا أول منحنى القياسية. كرر الخطوة 5.5.5.2 مع مكررات الثانية من القيم ط م إلى الحصول على الانحدار الخطي الثاني وحساب القيمة التجريبية من عدد نسخ لمكررات الثانية من القيم ط المستخدمة في منحنى مستوى الثاني.
- كرر الخطوة 5.5.5.2 مع التجارب الثانية والثالثة.
- حساب الدقة، صدق ودقة حدود لكل مستوى البلازميد وفقا لNF U47-600-2 12.
- إنشاء جدول بيانات لتجميع المعلومات عن كل نقطة القياسية (5.5.5.4) وإنشاء ملف شخصي دقة مع حدود القبول المحددة سابقا في 5.5.5.1 وصدق البيانات جنبا إلى جنب مع انخفاض وحدود دقة العليا وفقا لحسابات في 5.5 .5.4 (الشكل 5).
- تحديد طريقة LOQ: هذا يتوافق مع أقل تركيز من منحنى القياسية مع صدق 0.75 سجل 10 كما يستخدمه لمجموعة الخطي المحسوبة في 5.5.5.5.
- تقييم التكرار واستنساخ
ملاحظة: التحقق من التكرار واستنساخ باستخدام النسبة بين الانحراف المعياري والمتوسط من قياسات تكرار (معامل الاختلاف، أو السيرة الذاتية = الانحراف المعياري /تعني).- تقييم التكرار من الطريقة كاملة من 1 محلل:
- اختيار 3 عينات بيولوجية مع 3 الأحمال الجينوم الفيروسي مميزة (سبق اختبارها في PCR على سبيل المثال).
- استخراج 8 مكررات من العينات 3 كما هو موضح في القسم 1. تنفيذ الإجراء التضخيم كما هو موضح في القسم 2.
- حساب المتوسط والانحراف المعياري للقيمة ط م جمعها لكل عينة.
- حساب السيرة الذاتية داخل الفحص باستخدام الصيغة CV = الانحراف المعياري / يعني.
- تقييم القدرة على التكاثر من أسلوب الجامع بنسبة 3 محللون:
- اختيار 3 عينات بيولوجية مع 3 الأحمال الجينوم الفيروسي مميزة (سبق اختبارها في PCR على سبيل المثال)
- استخراج 2 مكررات من العينات 3 المختار في 5.6.2.1 (كما هو موضح في المادة 1). تنفيذ الإجراء التضخيم كما هو موضح في القسم 2. كرر الخطوات 5.6.2.2 بنسبة 2 محللين مستقلين.
- حساب المتوسط والانحراف المعياريمن قيمة ط م جمعها لكل عينة.
- حساب CV بين الفحص باستخدام الصيغة CV = الانحراف المعياري / يعني.
- تقييم التكرار من الطريقة كاملة من 1 محلل:
النتائج
طريقة RT-PCR الكمي، كما هو موضح أعلاه، تم تنفيذها لكشف وتحديد equid هربس-2 في سوائل الجهاز التنفسي الشكل 1 يوضح الرسم البياني سير العمل التخطيطي لتطوير والتحقق من صحة طريقة RT-PCR الكمي وفقا لمعيار AFNOR NF U47-600. ولم يتم التحقق من خصوصية الاشعال وتحقيقات أثناء وضع خطوة بخطوة من PCR. فقط EHV-2 وتضخمت سلالات في هذا النظام. وفي وقت لاحق، وكان أداء QRT-PCR تتسم.
أولا، لتقدير اللد PCR، تم إجراء التخفيف المتسلسل 6 عشرة أضعاف لإنشاء منطقة الحد (الشكل 2). في هذا المثال، تم إجراء 6 التخفيفات المسلسل عشرة أضعاف بين 10 -5 و 10 -10 (بين 26000 و 0.26 نسخ / 2.5 ميكرولتر عينة) لتقدير اللد PCR. منطقة الحد لالمنشأ بين التخفيفات من 10 -9 و 10 -10 (بين 2.6 و 0.26 نسخة / 2.5 ميكرولتر عينة). لتحديد قيمة اللد PCR في هذه الحالة، وقدمت 6 التخفيفات المسلسل شقين من البلازميد في هذه المنطقة الحد بين 5.2 و 0.16 نسخة / 2.5 ميكرولتر عينة. وبلغت قيمة اللد PCR 2.6 نسخ / 2.5 ميكرولتر عينة.
لتحديد نطاق الخطي وLOQ PCR، تم استخدام القيمة اللد PCR لبدء مجموعة من 6 التخفيفات المسلسل عشرة أضعاف، بين 2.6 (اللد PCR) و260،000 نسخة / 2.5 ميكرولتر عينة الشكل 3 يوضح الانحدار الخطي للEHV2 QRT-PCR من تجربة واحدة. يتم التحقق من صحة العروض من الانحدار الخطي (الشكل 4) في quadruplicate باستخدام العمليات الحسابية هو موضح في الجدول 3. يتم تنفيذ العمليات الحسابية لتحديد نطاق الخطي وفقا للمعايير التحيز المطلق ط فالرق ≤0.25 تسجيل 10، بغض النظر عن المستوى الأول من الحمل البلازميد. في هذه الحالة، الخطي مجموعة يكمن بين 2.6 و 260،000 نسخة / 2.5 ميكرولتر عينة. وLOQ PCR هو أدنى تركيز في مجموعة الخطي (أي 2.6 نسخ / 2.5 ميكرولتر عينة في هذه الحالة). تقرر يو لين أن تكون 0.12 سجل 10 في مجموعة 2.6-260،000 نسخ / 2.5 ميكرولتر من الحمض النووي.
بعد التطوير (الشكل 1، الأزرق) وتوصيف QRT-PCR (الشكل 1 والأصفر)، توصي AFNOR NF U47-600 القاعدة توصيف المنهج التحليلي كله من استخراج الحمض النووي لQRT-PCR (الشكل 1 والبرتقالي). حسبت الحساسية التشخيصية والخصوصية كما هو موضح في الجدول رقم (4). والعروض الكمية من المنهج التحليلي كله QRT-PCR تم تقييم والتحقق من صحتها مع ملف تعريف دقة ( الشكل 5).
يسمح هذا البروتوكول، والذي يستخدم للدولة من بين الفن والتكنولوجيا الجزيئية، لنا لكشف وقياس الفيروسية تحميل الجينوم EHV-2 في 172 عينة مسحة أنفية تم الحصول عليها من الخيول الذين يعانون من اضطرابات في الجهاز التنفسي و / أو الاشتباه السريري للعدوى. كانت نسبة EHV-2 من العينات الميدانية (البيولوجية) 50٪ (86/172) في هذه الفئة من السكان. وأظهرت التحليلات الكمية التي الأحمال الجينوم الفيروسي من EHV-2 كانت أعلى بكثير في الخيول الصغيرة و انخفض الرقم إعادة تقسيم الأحمال الجينوم الفيروسي مع التقدم في السن (الشكل 6). في هذه الدراسة، تم الكشف عن أعلى EHV-2 تحميل الجينوم الفيروسي (1.9 × 10 11 نسخة / مل) في المهرات (الشكل 6).
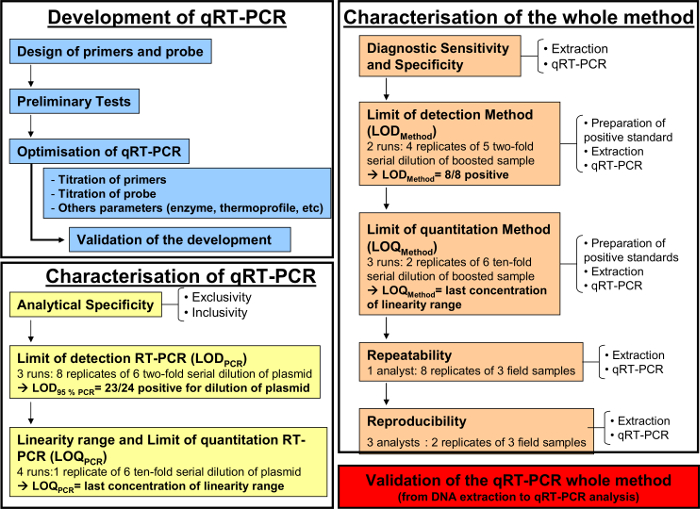
الشكل 1: مخطط سير العمل لتطوير (الأزرق)، وتوصيف الكمي RT-PCR(الأصفر) وتوصيف المنهج التحليلي كله من استخراج الحمض النووي لQRT-PCR (برتقالي) وفقا لمعيار AFNOR NF U47-600-2 يظهر على الرسم البياني سير العمل استئناف الخطوات المختلفة لتطوير وتوصيف RT الكمي -PCR وتوصيف المنهج التحليلي كله من استخراج الحمض النووي لQRT-PCR. لكل خطوة، والرسم البياني سير العمل يشير إلى عدد من يدير المطلوبة، التخفيفات أن تؤدي وعدد من المحللين المطلوبة. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
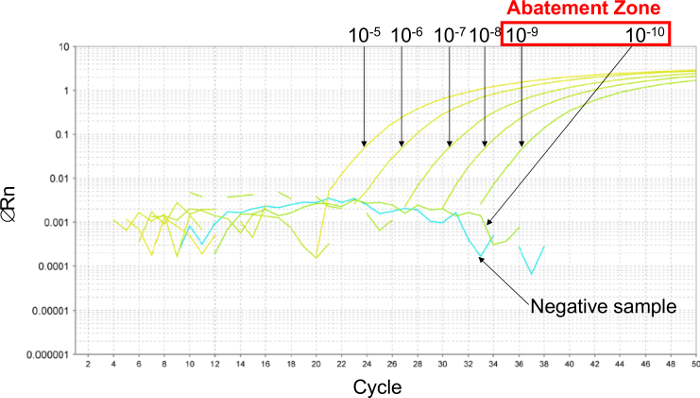
الشكل 2: تحديد منطقة الحد مع نتائج ممثلة من الوقت الحقيقي منحنيات PCR تم الحصول عليها مع 6 التخفيفات المسلسل عشرة أضعاف البلازميد. لتقدير منطقة الحد، المسلسل 6 عشرة أضعافيتم إجراء التخفيفات بين 10 -5 (26،000 نسخة / 2.5 ميكرولتر عينة) و 10 -10 (0.26 نسخة / 2.5 ميكرولتر عينة). منطقة الحد تقع بين التخفيفات من 10 -9 (2.6 نسخ / 2.5 ميكرولتر عينة) و 10 -10 (0.26 نسخة / 2.5 ميكرولتر عينة). في هذه الحالة، وقدمت 6 التخفيفات المسلسل شقين البلازميد في هذه المنطقة الحد لتحديد اللد 95٪ PCR، بين 5.2 و 0.16 نسخة / 2.5 ميكرولتر عينة. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
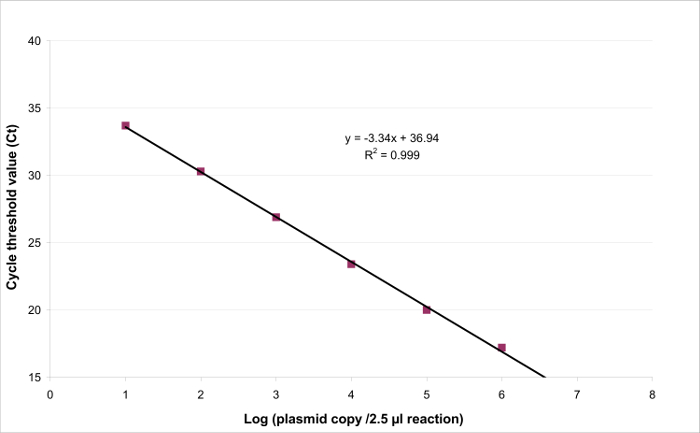
الرقم 3: الانحدار الخطي لEHV2 QRT-PCR والخطي من الاختبار الكمي هي القدرة على توليد النتائج التي تتناسب مع تركيز على الهدف الحالي في نطاق معين. وهذا يمكن أن تكون على غرار بواسطةالانحدار الخطي (ص = الفأس + ب) بين الاستجابة مفيدة (عتبة دورة أو ط م) ولوغاريتم كمية من الهدف (عدد النسخ الهدف / 2.5 ميكرولتر عينة). الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم .
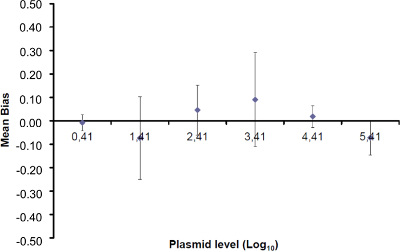
الرقم 4: أداء الانحدار الخطي للEHV-2 QPCR يعني التحيز تمثل الفرق بين متوسط كمية البلازميد المقاس ( 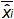 ) وكمية البلازميد النظرية (س 'ط) لكل مستوى البلازميد. تمثل القضبان العمودية عدم اليقين الخطي (يو ليني) تعطى بالمعادلة
) وكمية البلازميد النظرية (س 'ط) لكل مستوى البلازميد. تمثل القضبان العمودية عدم اليقين الخطي (يو ليني) تعطى بالمعادلة 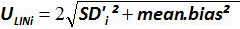
حيث SD'i هو الانحراف المعياري س و كمية البلازميد قياسها. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
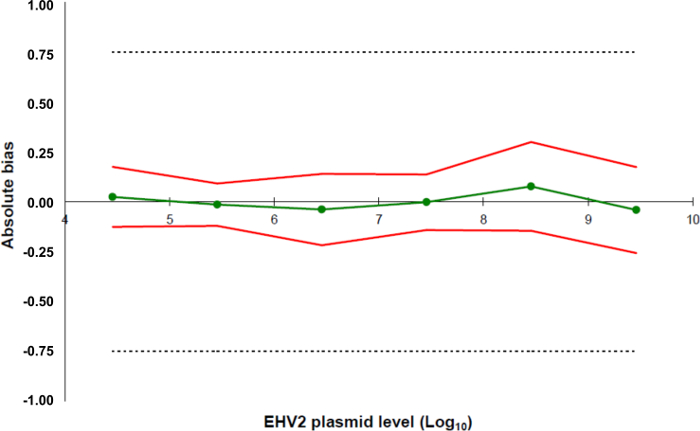
لمحات دقة استنادا إلى نتائج التحقق من EHV-2 طريقة QRT-PCR الخط الأخضر (الدوائر) يمثل صدق البيانات (خطأ منهجي، أو التحيز): الشكل 5. يتم تعريف حدود القبول في ± 0.75 سجل 10 من قبل المختبر (الخطوط المتقطعة). تم تحديد الحدود الدنيا والعليا دقة لكل مستوى تحميل البلازميد من التحيز يعني ± ضعف الانحراف المعياري للبيانات الموثوقية (الخطوط الحمراء). اضغط هنا لمشاهدة نسخة أكبر من هذا الرقم.
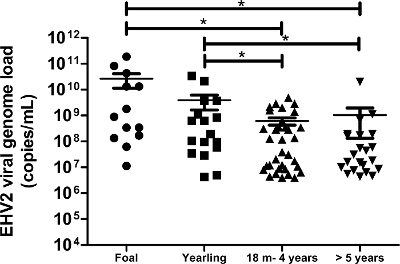
ويمثل الكمي الأحمال الجينوم الفيروسي من EHV-2 وفقا للسن الجينوم توزيع الحمل الفيروسي من EHV-2 الكشف في عينات المسحة الأنفية للفئات العمرية المختلفة: الشكل (6). تمثل الخطوط الأفقية والقيم الوسيطة داخل الانحراف المعياري (م = شهرا). * تختلف اختلافا كبيرا من قبل ANOVA مع نيومان Keuls اختبار خاص بعد (P <0.05). الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
| الجين المستهدف | الاشعال التحقيق وplasmide تسلسل (5'-3 ') | موقف النوكليوتيدات | حجم المنتج (النيوكليوتيدات) | الظروف الدراجات الحرارية | المراجع | |||
| EHV2 GB (HQ247755.1) | إلى الأمام: GTGGCCAGCGGGGTGTTC | 2113-2130 | 78 | 95 ° C 5 دقائق | 11 | |||
| عكس: CCCCCAAAGGGATTYTTGAA | 2189-2170 | 95 ° C 15 ثانية | 45 دورات | |||||
| التحقيق: FAM-CCCTCTTTGGGAGCATAGTCTCGGGG-MGB | 2132-2157 | 60 ° C 1 دقيقة | ||||||
| البلازميد: ACCTGGGCACCATAGGCAAGGTGGTGGTCA ATGTGGCCAGCGGGGTGTTCTCCCTCTTTG GGAGCATAGTCTCGGGGGTGATAAGCTTTTT CAAAAATCCCTTTGGGGGCATGCTGCTCATA GTCCTCATCATAGCCGGGGTAGTGGTGGTG TACCTGTTTATGACCAGGTCCAGGAGCATAT ACTCTGCCCCCATTAGAATGCTCTACCCCGG GGTGGAGAGGGCGGCCCAGGAGCCGGGCG CGCACCCGGTGTCAGAAGACCAAATCAGGA ACATCCTGATGGGAATGCACCAATTTCAG | 2081-2381 | |||||||
يتوافق متواليات الاشعال، تحقيقات والضوابط الإيجابية الحمض النووي الاصطناعية المستخدمة في هذا البروتوكول التسلسل البلازميد (الحمض النووي الاصطناعي إيجابي) إلى النوكليوتيدات مواقف 2081-2381 من تسلسل EHV2gB (HQ247755.1): الجدول 1. تم الحصول على تصميم الاشعال وتحقيقات المستخدمة في هذا البروتوكول باستخدام برامج معينة.
| الكائنات الممرضة | المرجعية (المنشأ) | عدد من السلالات | النتائج |
| EHV-2 | |||
| EHV-2 | VR701 (آي تي سي سي) | 20 | إيجابي |
| 20 عينة (جمع إف دي إل) | |||
| EHV-5 | KD05 (GERC) | 20 | سلبي |
| 20 عينة (جمع إف دي إل) | |||
| EHV-3 | VR352 (آي تي سي سي) | 2 | سلبي |
| T934 WSV (GERC) | |||
| EHV-1 | كنتاكي سلالة كنتاكي ألف (آي تي سي سي) | 3 | سلبي |
| 2 عينات (جمع إف دي إل) | |||
| EHV-4 | VR2230 (آي تي سي سي) | 1 | سلبي |
| أبله هربس AHV5 | إف دي إل مجموعة | 1 | سلبي |
| فرسيفيروسات الأنفلونزا | A / الفروسية / Jouars / 4/2006 (H3N8) | 1 | سلبي |
| (الانضمام عدد JX091752) | |||
| فرسي فيروس التهاب الشرايين | VR796 (آي تي سي سي) | 2 | سلبي |
| Rhodococcus متساو | إف دي إل مجموعة | 1 | سلبي |
| العقدية الخيلية subsp. السوافية | إف دي إل مجموعة | 1 | سلبي |
| العقدية الخيلية subsp. متساو | إف دي إل مجموعة | 1 | سلبي |
| الكوكسيلا البورنيتية | ADI-142-100 (Adiagene) | 1 | سلبي |
| الكلاميدوفيلا المجهضة | ADI-211-50 (Adiagene) | 1 | سلبي |
| كليبسيلا الهوmoniae | إف دي إل مجموعة | 1 | سلبي |
الجدول 2: خصوصية تحليلية لQRT-PCR لEHV-2.
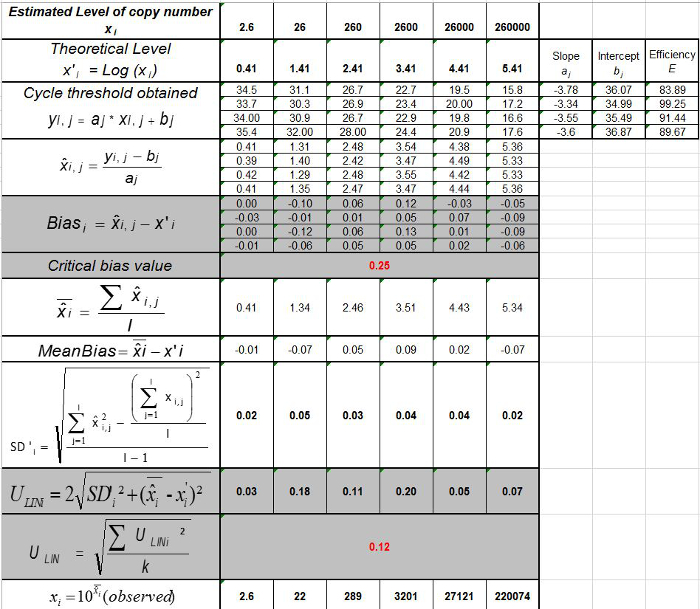
الجدول 3: حساب التحيز وعدم اليقين الخطي (مقتبس من NF U47-600-2 12). لكل المحاكمة، وأداء الانحدار الخطي (ص = الفأس + ب) يتم التحقق من صحة باستخدام الجدول حيث ص هو عتبة دورة المتوصل إليها؛ لهو منحدر الحصول؛ x هو مستوى البلازميد وب هو اعتراض i غير البلازميد مستوى (ط يختلف من 1 إلى مستويات ك)؛ ك هو عدد مستويات البلازميد المستخدمة (على سبيل المثال، ك = 6 في تيطاولته)؛ ي هو محاكمة (ي يختلف من 1 إلى محاكمات الأول)؛ الأول هو عبارة عن عدد من التجارب، تضم ما بين 3 و 6 تجارب (على سبيل المثال أنا = 4 في هذا الجدول) خ ط هو كمية البلازميد المقدرة لكل. ط البلازميد مستوى. س 'i هو كمية النظرية البلازميد تم الحصول عليها مع المعادلة س' ط = تسجيل 10 (خ ط) لكل ط البلازميد مستوى. خلال كل محاكمة ي، حصلت على عتبة دورة لكل ط يتم احتساب مستوى البلازميد مع الانحدار الخطي ذ ط، ي = أ ي س ط، ي + ب ي.  هي كمية البلازميد قياسها خلال ي محاكمة. التحيز ط فرعية> هو الفرق الذي لوحظ بين كمية البلازميد قياس وكمية البلازميد النظرية لكل محاكمة وكل مستوى البلازميد.
هي كمية البلازميد قياسها خلال ي محاكمة. التحيز ط فرعية> هو الفرق الذي لوحظ بين كمية البلازميد قياس وكمية البلازميد النظرية لكل محاكمة وكل مستوى البلازميد. 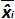 هي القيمة المتوسطة لل
هي القيمة المتوسطة لل 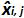 كل ط البلازميد مستوى، SD "أنا هو الانحراف المعياري لقياس كمية
كل ط البلازميد مستوى، SD "أنا هو الانحراف المعياري لقياس كمية 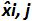 لكل ط مستوى البلازميد، يعني التحيز هو يعني التحيز الأول؛ يو ليني هو عدم اليقين الخطي تحديدها لكل ط البلازميد المستوى المحسوب من SD'i ويعني التحيز. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
لكل ط مستوى البلازميد، يعني التحيز هو يعني التحيز الأول؛ يو ليني هو عدم اليقين الخطي تحديدها لكل ط البلازميد المستوى المحسوب من SD'i ويعني التحيز. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
وقد استخدم جدول شوارتز حساب الحساسية التشخيصية (جنوب شرق) والخصوصية (SP) من الأسلوب كله لحساب confid: الجدول 4فترة سينعقد في 95٪ من حساسية وخصوصية الأسلوب كله كما هو موضح في NF U47-600-2.
Discussion
منذ 2000s في، تم في الوقت الحقيقي PCR لتحل محل تقنيات الذهب القياسية (زراعة الخلايا وأساليب ثقافة البكتيريا) في عدد متزايد من المختبرات. تنفيذ أسلوب سهل نسبيا. ومع ذلك التحقق من صحة أساليب المختبر ضروري للكشف الجزيئي وتقدير من مسببات الأمراض لضمان بيانات دقيقة وقابلة للتكرار وموثوق بها.
منذ الخطوة استخراج هي المصدر الرئيسي لفقدان المواد البيولوجية، فإنه يمكن اعتبار المصدر الرئيسي للخطأ الكمي بين بروتوكول واحد وآخر. على هذا النحو، وإنشاء منحنى مستوى DNA البلازميد خلال QRT-PCR، ذكرت أساسا في الأدب، ويشير إلى تحميل الجينوم الفيروسي ولكن لا يأخذ بعين الاعتبار خطوة الاستخراج.
وصف لدي نوفو استراتيجية لعملية التحقق من صحة الطريقة كاملة في القاعدة AFNOR NF U47-600-2 يمثل تقدما كبيرا في هذا المجال. كما هو موضح فيهذه الورقة لEHV-2 في الخيول، أو من قبل الآخرين في النحل 21، وهذا يتطلب تمايز واضح بين الخطوة التنمية وخطوة التحقق مع توصيف PCR وتوصيف طريقة كله. الحد واحد في هذا النهج المثير للاهتمام هو أن أي تغيير في البروتوكول سوف يؤدي إلى التزام إعادة تأكيد العملية الكاملة التي يمكن أن تكون مكلفة للغاية. وأبرز هذا القيد أيضا من حقيقة أن حدود الكمي تعتمد على المصدر الذي يستخرج فيروس (على سبيل المثال سوائل الجهاز التنفسي، وأجهزة، والدم أو البول). في الواقع، تقدم كل مصفوفة خصوصيات مختلفة في خصائصها الفيزيائية والكيمياء، وأنه من المهم أن تحدد بشكل مستقل كل مصفوفة المختلفة المستخدمة للكشف عن الفيروس وتقدير من قبل QRT-PCR. وهكذا، وتحميل الجينوم الفيروسي من كل عينة بيولوجية يمكن قياس أكثر دقة من استخراج. يأخذ التوصيف في الاعتبار أيضا وزارة الدفاع thermocyclerايل وعندما استخدام الأسلوب سابقا تتميز جيدا (على سبيل المثال، EHV-2 طريقة QPCR وصفها في هذه الورقة) يتطلب نوعا جديدا من جهاز في المختبر الوالدين أو مختبر آخر، لا بد من تأكيد أداء هذا الصك. تأكيد لأداء فحص QPCR هو شرط أساسي لجميع الاختبارات تجلب إلى المختبر. ويتحقق ذلك عادة عن طريق تحليل عينة مرجعية مع الخصائص المعروفة. مثل هذا الاختيار هو شرط أساسي ويعتبر إلزاميا على النحو المطلوب من قبل القاعدة NF 47-600-1 AFNOR من أجل التحقق من صحة أداء (كفاءة اللد، LOQ) QPCR ومتانة الأسلوب كله (اللد، LOQ). ليس فقط خلال خطوات التطوير وتوصيف ولكن أيضا عندما تستخدم في البحوث أو لأغراض التشخيص، عوامل الخطر يمكن تحديد وتسيطر عليها بشكل جيد لضمان توحيد البروتوكول. ومما يثير القلق بشكل خاص هو تدريب عدد كاف من الموظفين، الموظفين المؤهلين تأهيلا عاليا، ومراقبة جودة المواد الاستهلاكيةوتستخدم وتخزينها، والسيطرة على الظروف البيئية المباشرة والوعي الظروف المترولوجية التي قد تؤثر على أداء الأجهزة العلمية المعنية في الفحص. استخدام العينات المرجعية لإجراء المقارنات بين المختبرات يمكن أن يساعد أيضا في السيطرة على الشكوك. بهذه الطريقة، يمكن تسهيل مقارنة البيانات بين المختبرات. في الواقع، بين المختبرات اختبارات الكفاءة ضرورية لتقييم وتأكيد استنساخ الأسلوب.
الفيروسية نتائج الحمل الجينوم التي يتم التعبير عنها في وحدة دولية (IU) من مصفوفة البيولوجية تحليلها (وحدة دولية: نسخة / مل للسوائل أو نسخ / ز لأنسجة) هي أسهل للاستخدام من أجل مقارنة النتائج بين المختبرات المختلفة. يتم التعبير عن نتائج فوق LOQ عن نسخ / مل ونتيجة لذلك بين اللد وLOQ يؤخذ نتيجة إيجابية وغير قابلة للقياس الكمي. عرض البيانات quantificational من الجينوم بهذه الطريقة يتفق أكثر دقة لبروسسالصورة من التحليلات (التضخيم من الجينوم). في الواقع، في تجارب زراعة الخلايا، والتعبير عن الحمل الفيروسي بواسطة TCID 50 (الأنسجة متوسط ثقافة معدية جرعة) يعتمد على طبيعة الخلايا وسلالات الفيروس. كل سطر سلالة تمتلك فيها حركية عدوى فريدة من نوعها وبعض الفيروسات مثل EHV-2 يمكن أن يستغرق عدة أيام قبل أول تأثير ممرض للخلايا هو واضح.
في الختام، يجب أن هذا الأسلوب الجديد من توصيف QRT-PCR تسهيل المواءمة بين العرض وتفسير البيانات بين المختبرات. وسيكون هذا مفيدا جدا لتطبيقات جديدة محتملة من QRT-PCR في المستقبل مثل إنشاء قيمة قطع للإعلان على الحالة المرضية بدلا من مجرد وجود أو عدم وجود العوامل المسببة للأمراض.
Disclosures
الكتاب تعلن أنه ليس لديهم مصالح مالية المتنافسة.
Acknowledgements
The authors would like to thank Sophie Castagnet and Nadia Doubli-Bounoua for their technical support. This work received financial support from the General Council of Calvados and the agreement of Region Basse-Normandie and French Government (CPER 2007-2013; project R25 p3). The authors would like to thank the experts of the AFNOR group and particularly Jean-Philippe Buffereau and Eric Dubois.
Materials
| Name | Company | Catalog Number | Comments |
| AB-1900 natural color ABgene 96 well plate | Dutsher | 16924 | |
| Adhesive film qPCR Absolute | Dutsher | 16629 | Adhesive film used for sealing the plate prior to the qRT-PCR run |
| 0.5 ml microtubes, skirted, caps | Dutsher | 039258 | |
| Ethanol 98% | Sodipro | SAF322941000 | |
| Primers | Eurofins | Custom order | |
| Probe | Life Technologies | Custom order | |
| Plasmid | Eurofins | Custom order | |
| QIAamp RNA viral Mini Kit (containing: QIAamp Mini column, AVL buffer, AW1 buffer, AW2 buffer, AVE buffer, collection tubes) | Qiagen | 52906 | AVL buffer: pre-warm 5 min at 72 °C |
| Sequencing by Sanger method | Eurofins | Custom order | |
| Taqman Universal PCR Master Mix | Life Technologies | 4364340 | |
| Tris-EDTA buffer solution | Santa Cruz | sc-296653A | |
| NanoDrop 2000c Spectrophotometer | Thermoscientific | ND-2000C | |
| StepOnePlus Real-Time PCR systems | Life Technologies | 4376600 | pre-warm 15 min |
References
- Brault, S. A., et al. The immune response of foals to natural infection with equid herpesvirus-2 and its association with febrile illness. Vet.Immunol.Immunopathol. 137 (1-2), 136-141 (2010).
- Fortier, G., Van Erck, E., Pronost, S., Lekeux, P., Thiry, E. Equine gammaherpesviruses: pathogenesis, epidemiology and diagnosis. Vet.J. 186 (2), 148-156 (2010).
- Hue, E. S., et al. Detection and quantitation of equid gammaherpesviruses (EHV-2, EHV-5) in nasal swabs using an accredited standardised quantitative PCR method. J Virol.Methods. 198 (1), 18-25 (2014).
- Diallo, I. S., et al. Multiplex real-time PCR for the detection and differentiation of equid herpesvirus 1 (EHV-1) and equid herpesvirus 4 (EHV-4). Vet.Microbiol. 4 (1-3), 93-103 (2007).
- Williams, K. J., et al. Equine multinodular pulmonary fibrosis: a newly recognized herpesvirus-associated fibrotic lung disease. Vet.Pathol. 44 (6), 849-862 (2007).
- Mullis, K., et al. Specific enzymatic amplification of DNA in vitro: the polymerase chain reaction. Cold Spring Harb.Symp.Quant.Biol. 51 (1), 263-273 (1986).
- EPA Office of Water (4607). EPA-815-B-04-001. Quality Assurance/Quality Control Guidance for Laboratories Performing PCR Analyses on Environmental Samples. , (2004).
- Telford, E. A., et al. Equine herpesviruses 2 and 5 are gamma-herpesviruses. Virology. 195 (2), 492-499 (1993).
- Fortier, G., et al. Identification of equid herpesvirus-5 in respiratory liquids: A retrospective study of 785 samples taken in 2006-2007. Vet.J. 182 (2), 346-348 (2009).
- Brault, S. A., Bird, B. H., Balasuriya, U. B., MacLachlan, N. J. Genetic heterogeneity and variation in viral load during equid herpesvirus-2 infection of foals. Vet.Microbiol. 147 (3-4), 253-261 (2011).
- Association Francaise de Normalisation. NFU 47-600-1. Animal health analysis methods-PCR-Part 1: Requirements and recommandations for the implementation of veterinary PCR. , (2015).
- Association Francaise de Normalisation. NFU 47-600-2. Animal health analysis methods-PCR-Part 2: Requirements and recommendations for the development and the validation of veterinary PCR. , (2015).
- ISO. EN ISO-CEI 17025. General requirements for the competence of testing and calibration laboratories. , (2005).
- Manual of Diagnostic Tests and Vaccines for Terrestrial Animals 2010. Chapter1.1.1.4/ 5. Principles and Methods of Validation of Diagnostic Assay for Infectious Diseases. , This thoroughly revised chapter replaces Chapter 1.1.4 Principles of validation of diagnostic assays for infectious diseases and Chapter 1.1.5 Validation and quality control of polymerase chain reaction methods used for the diagnosis of infectious diseases from the sixth edition of the OIE Terrestrial Manual (2009).
- Apaza, S., et al. Detection and genogrouping of noroviruses from children's stools by Taqman One-step RT-PCR. J Vis.Exp. (65), e3232(2012).
- Lorenz, T. C. Polymerase chain reaction: basic protocol plus troubleshooting and optimization strategies. J Vis.Exp. (63), e3998(2012).
- Sanger, F., Coulson, A. R. A rapid method for determining sequences in DNA by primed synthesis with DNA polymerase. J Mol.Biol. 94 (3), 441-448 (1975).
- Sanger, F., Nicklen, S., Coulson, A. R. DNA sequencing with chain-terminating inhibitors. Proc.Natl.Acad.Sci.U.S.A. 74 (12), 5463-5467 (1977).
- NCBI. BLAST Homepage and Selected Search Pages. Introducing the BLAST homepage and form elements/functions of selected search pages. , (2015).
- Greiner, M., Gardner, I. A. Application of diagnostic tests in veterinary epidemiologic studies. Prev.Vet Med. 45 (1-2), 43-59 (2000).
- Blanchard, P., Regnault, J., Schurr, F., Dubois, E., Ribiere, M. Intra-laboratory validation of chronic bee paralysis virus quantitation using an accredited standardised real-time quantitative RT-PCR method. J Virol.Methods. 180 (1-2), 26-31 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved