Method Article
لماذا الكمي المسائل: توصيف الظواهر في
In This Article
Summary
Morphology, size and location of intracellular organelles are evolutionarily conserved and appear to directly affect their function. Understanding the molecular mechanisms underlying these processes has become an important goal of modern biology. Here we show how these studies can be facilitated by the application of quantitative techniques.
Abstract
معظم الدراسات على التشكل تعتمد على الوصف النوعية كيفية الصفات التشريحية تتأثر تعطيل جينات معينة ومسارات الوراثية. نادرا ما يتم تنفيذ الوصف الكمي، على الرغم من التلاعب الجيني تنتج مجموعة من الآثار المظهرية ولاحظت اختلافات حتى بين الأفراد داخل المجموعة الضابطة. شواهد يدل على التشكل وحجم وموقع من العضيات تلعب، دورا أساسيا بعد بالتقدير سابقا في وظائف الخلايا والبقاء على قيد الحياة. هنا نقدم إرشادات خطوة بخطوة لإجراء تحليلات كمية من الظواهر في ذبابة الفاكهة اليرقات الوصل العصبي العضلي (NMJ). نحن نستخدم العديد من علامات المناعية النسيجية موثوقة جنبا إلى جنب مع تقنيات التصوير الحيوي والمورفولوجية تحليل لدراسة آثار الطفرات الوراثية في العمليات الخلوية محددة. على وجه الخصوص، ونحن نركز على التحليل الكمي من الظواهر التي تؤثر على التشكل، حجم وموضع نuclei داخل العضلات المخططة من يرقات ذبابة الفاكهة. ذبابة الفاكهة اليرقات NMJ هو النموذج التجريبي قيما للتحقيق في الآليات الجزيئية الكامنة وراء بنية ووظيفة الجهاز العصبي العضلي، سواء في الصحة والمرض. ومع ذلك، فإن منهجيات وصفنا هنا يمكن أن تمتد إلى الأنظمة الأخرى كذلك.
Introduction
Qualitative analysis restricts the focus of most experimental studies to the examination of genetic manipulations leading to large phenotypic effects or to phenotypes that are not amenable to quantification, e.g., absence/presence. Quantification of phenotypes is not usually performed and variations present within members of a phenotypic group are not taken into consideration. Additionally, without mathematical descriptions of morphologies, it may be difficult to determine whether fine scale phenotypic changes are the result of genetically induced alterations or whether observed changes are simply due to random fluctuations.
We propose that for an accurate and unbiased analysis of phenotypic defects due to gene disruption, quantitative methodologies should accompany more traditional qualitative approaches. Quantitative evaluation of phenotypes is particularly beneficial for structures such as synapses that present a high degree of variability due to their intrinsic morphological and functional plasticity. We have selected examples of quantitative analyses applied to areas of investigation with which we are most familiar, namely the Drosophila larval neuromuscular junctions (NMJs). However, concepts and principles apply equally well to other experimental systems.
The larval NMJ is an excellent model system to study synaptic development and function because of the highly stereotyped nature of its structure. Each hemi-segment of the larval neuromuscular system contains 32 identifiable motor neurons forming synaptic contacts with their postsynaptic target muscle. Every hemi-segment also contains a fixed number of muscles visible as multinucleated fibers attached to the internal surface of the cuticle1. Another advantage of using the larval neuromuscular system is the power and versatility of Drosophila genetics that easily allows the generation of a number of mutant alleles and the possibility to modify gene expression in a time- and tissue-restricted manner. Finally, 75% of the human genes causing a disease have an evolutionarily conserved orthologue in Drosophila2. Indeed, entire genetic pathways are conserved between flies and humans. Because of this, the Drosophila larval neuromuscular system is a very popular experimental model to elucidate the molecular mechanisms underlying a number of human diseases including amyotrophic lateral sclerosis (ALS)1.
Here we show that the availability of several reliable immuno-histochemical markers, combined with bio-imaging techniques and accurate morphometric analyses can describe anatomical traits that are likely to play an important functional role3,4,5. Among the cellular processes that are amenable to quantitative analyses, we focus on changes in shape, size and position of intracellular structures such as the nuclei. All these are processes that we know very little about.
The challenge for molecular geneticists in the coming decades will be to extend our current knowledge by analyzing the effect of genetic mutations that produce very subtle phenotypic defects. Quantitative methodologies that allow researchers to meticulously explore the effects of genetic mutations can provide a more comprehensive understanding of how genotypes relate to phenotypes, especially for poorly understood cellular processes.
Protocol
1. إعداد التجريبية
يتم إجراء تشريح والإجراءات المناعية الكيمياء النسيجية في الفقرتين 2 و 3 وفقا لمراجع 3-6، ولكن مع بعض التعديلات: مذكرة.
- إعداد مخزنة الفوسفات 1X المالحة (PBS) وبرنامج تلفزيوني تحتوي على 0.1٪ تريتون X-100 (PBT). الاحتفاظ بها على الجليد.
- إعداد تثبيتي بوان (15 البكريك حمض: 10 فورمالديهايد: 1 الجليدية حمض الخليك). جعل هذا كاشف الطازجة.
- حدد دبابيس minutien الفولاذ المقاوم للصدأ نظيفة وملقط غرامة.
- إعداد لوحات تشريح تحتوي على قرص Sylgard في 5 سم طبق بتري.
2. تشريح الثالث الطور اليرقات لل NMJs
- اختيار تجول الطور الثالث اليرقات من قارورة أو زجاجة مع فرشاة دقيقة ووضعها في طبق 2 سم بتري تحتوي على 4 درجات مئوية في برنامج تلفزيوني لغسل المواد الغذائية المتبقية بعيدا.
- وضع يرقة واحدة على رأس السطح sylgard من لوحة التشريح وتأكد من أنه هو positioned مع الجانب الظهري حتى أن اثنين من أنابيب القصبة الهوائية الطولية واضحة على القمة.
- باستخدام ملقط لعقد دبوس، دبوس اليرقة إلى أسفل في نهايتها الأمامية، والحق تحت هوك الفم. تمتد اليرقة خارج قدر الإمكان ويعلقون الخلفي ليغلق منخفضا.
- إضافة ما يكفي من المياه المالحة في برنامج تلفزيوني لتصل إلى جدران اللوحة وتزج تماما اليرقة.
- كرر الإجراء من الخطوات 2،1-2،3 ليرقات أخرى من نفس النمط الجيني. وحيد 5 سم بيتري لوحة طبق تشريح يمكن أن تستوعب بسهولة ما يصل إلى 8 اليرقات.
- باستخدام مقص تشريح الصغيرة، ورفع قليلا بشرة الظهرية وجعل شق أفقي صغير في نهاية الخلفي بالقرب من دبوس.
- إدراج مقص في شق، وقطع اليرقة على طول الطريق حتى النهاية الأمامية على طول خط الوسط بين اثنين من مساحات طولية من القصبة الهوائية. تأكد من أن التخفيضات خط الوسط سطحية بما فيه الكفاية لتمرير فقط من خلال بشرة وتجنب قطع طريق العضلات علىالجانب البطني.
- في كل نهاية، وقطع درجتين على كل من اليسار واليمين الجانبين.
- فتح شرائح من خلال وضع اثنين من المسامير على جانبي الشق الأمامي. كرر الشيء نفسه مع نهاية الخلفية. عند وضع دبابيس، للتأكد من نشر جدار الجسم عن بعضها البعض.
- تنظيف الأعضاء الداخلية باستخدام ملقط وبرنامج تلفزيوني المالحة. ترك الجهاز العصبي المركزي سليمة. تمتد برفق اليرقة مع دبابيس الزاوية حتى تمددت فيه تماما ولكن تأكد من أن العضلات لا تتمزق أثناء هذه العملية.
- كرر إجراء تشريح نفسه ليرقات أخرى على نفس لوحة تشريح.
- يغسل مع برنامج تلفزيوني المالحة ثلاث مرات لإزالة جميع الأعضاء الداخلية.
- استبدال برنامج تلفزيوني مع تثبيتي بوان وترك في درجة حرارة الغرفة لمدة 10 دقيقة.
- يغسل عدة مرات مع PBT.
- إزالة المسامير بعناية ونقل جميع الاستعدادات، والتي هي الآن صارم إلى حد ما، في أنبوب 1.5 مل الطرد المركزي الصغيرة لالمناعية تلطيخ.
تلطيخ 3. المناعية النسيجية من ذبابة الفاكهة لل NMJs مع الأجسام المضادة المحددة للعضلات وMyonuclei
- شطف بسرعة شرائح اليرقات في PBT.
- منع التحضيرات التي يحتضنها مع 10٪ مصل الماعز العادي (خ ع) في PBT لمدة 2 ساعة في إطار التحريض المستمر.
- احتضان مجموعة من لل NMJs تشريح في PBT تحتوي على 5٪ من NGS والأجسام المضادة أرنب المضادة للامين (بتركيز 1: 500) ومع خنزير غينيا مكافحة DVAP الأجسام المضادة (بتركيز 1: 500) لمدة 2 ساعة في درجة حرارة الغرفة أو في 4 درجات مئوية خلال الليل. و-DVAP مكافحة الأجسام المضادة بقع العضلات المخططة في حين أن تلطيخ مكافحة امين بالكشف عن كفاف من myonuclei.
- يغسل مرة واحدة بسرعة في PBT لإزالة الأجسام المضادة في الزائدة. يغسل في PBT لمدة 2 ساعة عن طريق تغيير PBT العازلة كل 15 دقيقة.
- احتضان هذه العينات في PBT تحتوي على 5٪ NGS والأجسام المضادة الثانوية الفلورية المسمى في 1: 500 التخفيف لمدة 2 ساعة في درجة حرارة الغرفة. نفس العينات جويخضع لتلطيخ مع الأجسام المضادة متعددة في نفس الوقت في حالة استخدام الأجسام المضادة الثانوية مترافق مع حاملات مختلفة.
- إزالة الأجسام المضادة الثانوية، ويغسل في PBT لمدة 2 ساعة عن طريق تغيير PBT العازلة كل 15 دقيقة.
- وصمة عار على المناطق الداخلية من myonuclei غسل العينات ثلاث مرات مع برنامج تلفزيوني والمضي قدما على النحو التالي:
- إضافة علامة النووية-PRO TO-3 في التخفيف من 1: 1000 في برنامج تلفزيوني واحتضان لمدة 20 دقيقة في إطار التحريض المستمر. وتستخدم هذه العلامة في هذه الدراسة، ولكن أي علامة النووية الأخرى المتاحة تجاريا يمكن أن تستخدم أيضا.
- يغسل بسرعة ثلاث مرات في برنامج تلفزيوني قبل التركيب.
4. عينات تصاعد على الشرائح
- اختيار العينات مع ملقط من أنبوب 1.5 مل الطرد المركزي الصغيرة وأضعهما على شريحة معالجة.
- باستخدام مقص تشريح الصغيرة، وقطع الرأس والذيل من شرائح والحفاظ على سطح يصل الداخلي.
- إعداد عشرالبريد تصاعد الشرائح عن طريق الالتفاف حول ثلاث شرائح من الشريط السليلوز على كل جانب من شريحة نظيفة على مسافة حوالي 1 سم عن بعضها البعض. مرة واحدة يتم وضع ساترة على أعلى من شرائح اثنين، سيتم إنشاء فجوة من شأنها أن تجنب تسطيح من العينات. هذا أمر بالغ الأهمية إذا ثلاثية الأبعاد الاداءات حجم الهياكل في هذا الشأن.
- وضع قطرة صغيرة من حوالي 20 ميكرولتر من المتوسطة المتزايدة في منتصف الشريحة المتزايدة بين الشرائط الشريط السليلوز الثلاثة.
- بعد نشر المتوسطة المتزايدة مع ملقط نظيفة، سحب اليرقات تشريح إلى الشريحة المتزايدة في المتوسطة المتزايدة، والحفاظ على سطح يصل الداخلي. محاولة تحميل لهم في الصفوف من أربعة أو خمسة.
- إسقاط بلطف زلة غطاء على رأس الشريحة المتزايدة وتأكد من أن يتم إنشاء أي فقاعات الهواء. ختم الشريحة مع طلاء الأظافر الشفاف. السماح للعينات تجف لمدة 10 دقيقة على الأقل قبل التصوير.
5. اعدادات متحد البؤر التصوير
ملاحظة: يتم التقاط الصور المعروضة في هذه الدراسة باستخدام وحدة متحد البؤر نيكون A1R متكاملة على منظمة الشفافية الدولية: المجهر الإلكتروني المقلوب. ومع ذلك، أي المجهر متحد البؤر مع ما لا يقل عن 3 وحدات الليزر المتاحة في المناطق الطول الموجي من 488 نانومتر، 561 نانومتر و 642 نانومتر، ونظام الكشف عن القناة 3 هو مناسب لهذا الغرض.
- بدوره على الليزر، وحدة للكشف، لمبة الزئبق، تحكم المرحلة المجهر والكمبيوتر. بدء برنامج حاسوبي لمراقبة وتأمين الشريحة على حامل المرحلة.
- لجعل التصوير بشكل أسرع، حدد ووضع علامة كافة المناطق ذات الاهتمام (ROI) على عينة باستخدام الهدف 20X.
- تأرجح بعناية الأنفية إلى 60X أعلى التكبير العدسة الشيئية (60X خطة آبو VC / NA 1.4 النفط).
- وضع قطرة من زيت الغمر على العدسة الشيئية واختيار واحد من العائد على الاستثمار ملحوظ من نافذة نظرة عامة XYZ على الكمبيوتر.
- بدء التصوير باستخدام الإعدادات البصرية التالية: حدد أول مزدوج اللون مرآة: 405/488/561/640. تحديد 488 نانومتر ليزر مع مرشح الانبعاثات 525/50 نانومتر في القناة 1، 561 نانومتر ليزر مع مرشح الانبعاثات 595/50 في القناة 2 والليزر 642 نانومتر مع تمريرة طويلة تصفية 650 نانومتر في قناة 3.
- استخدام إعدادات المسح الضوئي التالية قبل البدء في الحصول على الصور: اختر غالفانو الماسح الضوئي. الاتجاه مسح: طريقة واحدة. سرعة المسح الضوئي: 0.5 لقطة في الثانية.
- حدد سلسلة قناة لتجنب قناة تنزف من خلال.
- ضبط حجم دبوس حفرة ل1 وحدة مهواة. مسح وضبط قوة الليزر، وزيادة الكشف وتعويض بشكل مناسب لكل قناة لتجنب التشبع بكسل ومستوى الخلفية.
- الحصول على مداخن ض باستخدام حجم فوكسل 0.2 X 0.2 X 0.5 ميكرون 3 لكافة رويس والاستعدادات شريحة. إذا كان سيتم إخضاع الصور لdeconvolution ثم تعيين حجم فوكسل إلى 0.06 س 0.06 س 0.15 ميكرون 3.
- حفظ الصور في شكل ملف أو .ics شكل .nd2.
6. حساب المسافة بين النوى داخل مخططة60؛ العضلات عن طريق أسلوب من أقرب تحليل الجار
- لهذا التحليل، استخدم الصور متحد البؤر التي تظهر اليرقات عضلات الجسم الجدار الملون مع الأجسام المضادة DVAP لتصور العضلات ومع الأجسام المضادة امين وعلامة النووية لتسليط الضوء على نوى.
- لتقدير أقرب مسافة بين النوى، واستخدام نقاط القياس ضمن وحدة MeasurementPro من برمجيات تحليل الصور (على سبيل المثال، Imaris). غيرها من التطبيقات البرمجية مماثلة لتحليل الصور يمكن أن تستخدم لنفس الأغراض.
- فتح الصور مبائر. لبدء، انقر مرتين على أيقونة البرنامج. سحب وإسقاط مبائر الصور ض المكدس في الساحة.
- انقر مرتين على الصور لفتح لهم تلقائيا في فق عرض، تحت رمز شريط الأدوات القائمة
 . وتفوق عرض ديه ثلاث لوحات مساحة عمل رئيسية هي: عرض المساحة، كائن قائمة وجوه منطقة خصائص.
. وتفوق عرض ديه ثلاث لوحات مساحة عمل رئيسية هي: عرض المساحة، كائن قائمة وجوه منطقة خصائص. - إنشاء وحدة تخزين المقدمة رصورة قناة hree من خلال النقر على رمز القائمة 3D مشاهدة
 .
. - انقر على نقاط رمز إضافة جديد القياس
 من كائنات شريط الأدوات وتابع معالج إنشاء الذي يظهر في وجوه منطقة خصائص.
من كائنات شريط الأدوات وتابع معالج إنشاء الذي يظهر في وجوه منطقة خصائص. - من معالج إنشاء حدد علامة التبويب تحرير أولا والقناة ثم محددة. حدد إما علامة النووية أو القناة امين لتسليط الضوء على نوى.
- تعيين المؤشر إلى وضع الاختيار عن طريق الضغط على علامة التبويب خروج على لوحة المفاتيح.
- ضبط حجم مربع المؤشر 3D مع عجلة الماوس لاحتواء نواة معين في الصورة. إضافة نقطة قياس طريق الضغط على مفتاح Shift والأيسر للفأرة على نفس النواة.
- إضافة النقطة الثانية على نواة المجاورة على نفس العضلات بتكرار الخطوات السابقة. يتم رسم خط تلقائيا بين النقطتين والمسافة تقاس بين يتم عرض نوى اثنين. يتم تسجيل المسافة بين النوى اثنين من الآن كمتغير الإحصائي في كائن خصائص منطقة تحت علامة التبويب الاحصائيات> بيانات تفصيلية> بعد.
- كرر الإجراء من الخطوات 6،6-6،10 لكل نواة المحيطة نواة معينة.
- من الاحصائيات> بيانات تفصيلية> بعد عرض جميع نقاط القياس التي تم جمعها، حدد أقصر مسافة.
- بالضغط على الاحصائيات التصدير على تبويب العرض لملف
 المتاحة في إطار منطقة خصائص كائن، سيتم حفظ البيانات في جدول بيانات.
المتاحة في إطار منطقة خصائص كائن، سيتم حفظ البيانات في جدول بيانات. - كرر نفس الإجراء نوى المحيطة بها ولعدد مختار من الألياف العضلية في التركيب الوراثي.
- باستخدام البيانات التي تم تصديرها إلى ملف جدول بيانات، وحساب متوسط المسافة أقصر (D افي) لكل رقم م العضلات باستخدام المعادلة التالية:
OAD / 53821 / 53821eq1.jpg "/>
دي هو أقصر مسافة إلى النواة المجاورة للنواة أعطيت لي حيث كنت يختلف من 0 إلى N و N هو عدد النوى تحليلها في العضلات. محصلة القيم من ي = 0 إلى j = يشير م عدد M العضلات تحليلها. - بدلا من ذلك، استخدم البقع المعالج إنشاء والبقع إلى بقع أقرب مسافة إلى ويقدر متوسط المسافة إلى أقرب نواة المجاورة. لهذا، هناك حاجة إلى وحدة تمديد ماتلاب.
- سيتم عرض انقر مرتين على الصورة واحدة محددة على الساحة وصورة 3D الحجم في عرض المنطقة. انقر على أيقونة إنشاء كائن واضافة البقع جديدة
 من شريط الأدوات كائنات.
من شريط الأدوات كائنات. - من معالج إنشاء في كائن خصائص المنطقة، انقر على خيار تخطي الخلق التلقائي، تحرير يدويا.
- حدد إما امين أو قناة علامة النووية لعرض نوى.
- تحويل وانقر LEFر زر الماوس على كل نواة في عضلة معينة في الصورة. سوف تظهر بقعة على كل نواة.
- تحديد البقع إلى بقع أقرب مسافة المدرجة تحت علامة التبويب أدوات في كائن خصائص المنطقة. يبدو تحديد البقع الاحصائيات ظل وضع النتيجة ونافذة ماتلاب.
- تحت التبويب إحصائيات تحديد القيم مفصلة ثم محددة. انقر على Distmin وسوف تظهر قيم المسافات الدنيا لكل نواة.
- تصدير البيانات إلى ملف البيانات وحساب متوسط هذه المسافات في العضلات. كرر الإجراء لجميع عضلات راثى معين.
- سيتم عرض انقر مرتين على الصورة واحدة محددة على الساحة وصورة 3D الحجم في عرض المنطقة. انقر على أيقونة إنشاء كائن واضافة البقع جديدة
7. تحديد شكل النواة داخل عضلات الجسم الجدار من يرقات ذبابة الفاكهة
- لهذا التحليل، استخدم الصور مبائر من عضلات الجسم الجدار ملطخة امين وعلامة النووية لتصور النوى.
- لتقييم شكل myonuclei، كروية مقياس (الذي يعرف بأنه نسبة من سورمنطقة الوجه للكرة مع نفس الحجم باعتبارها نواة معينة، إلى منطقة سطح النواة) أو الإهليليجية (تميز بين القطع الناقص والكروية استرخاء مفلطح /).
- فتح الصورة كما هو موضح سابقا. انقر على أيقونة كائنات شريط الأدوات إضافة جديد السطوح
 .
. - في معالج إنشاء الذي يظهر في كائن خصائص منطقة، حدد تلطيخ علامة النووي قناة المصدر لعرض نوى.
- تعيين الخيار كثافة المطلقة كما العتبة. تأكد من أن معظم النوى تظهر التقديم على نحو سلس وليس فوق طاقتها عن طريق تغيير قيمة على منحنى العتبة. في نفس الوقت، وتجنب وجود ثقوب أو قناع غير مكتمل إلى أي نواة باستخدام نفس المنحنى.
- استخدم ال أداة تصفية لاستبعاد أي ضجيج في تقديم السطح. تحت علامة التبويب تحرير الطبقة السطحية التي تم إنشاؤها حديثا، وسبليت أو دمج الأسطح نوى التي هي بشكل غير صحيح إعادةndered.
- تصدير إلى جدول بيانات ملف القيم الإهليليجية وكروية نوى المقدمة سطح المتوفرة تحت علامة التبويب الإحصائيات.
- بدلا من ذلك، استخدم يماغيج أو فيجي برنامج لقياس دائرية من نواة حيث يتم تعريف الاستدارة (C) كما C
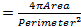 . وتمثل قيمة واحد في دائرة الكمال في حين أن قيمة تقترب من الصفر يدل على وجود شكل ممدود على نحو متزايد.
. وتمثل قيمة واحد في دائرة الكمال في حين أن قيمة تقترب من الصفر يدل على وجود شكل ممدود على نحو متزايد. - خلق توقعات كثافة القصوى من مداخن ض من القائمة صور> الأكوام> Z المشروع. تعيين نوع الإسقاط إلى أقصى كثافة.
- تقسيم القنوات وحدد القناة علامة النووية.
- من القائمة الرئيسية، اختر صورة> ضبط> العتبة.
- قطاع نوى عن طريق ضبط عتبة كثافة. إذا كانت مجزأة نوى القريبة كوحدة واحدة، انقر على عملية> ثنائي> أداة مستجمعات المياه لفصل النوى.
- من القائمة الرئيسية، اختر تحرير> Sالانتخابات> إنشاء الاختيار.
- إضافة كافة رويس المحددة إلى مدير العائد على الاستثمار من خلال النقر على القائمة تحليل> أدوات> ROI مدير. في إطار إدارة العائد على الاستثمار انقر على إضافة. في نفس النافذة، حدد المزيد> سبليت.
- اختر اصفات الشكل في تحليل> تعيين القياسات. في إطار إدارة العائد على الاستثمار انقر فوق علامة التبويب قياس. وهذا عرض قائمة من القيم دائرية من كل نواة المحدد.
- وبالإضافة إلى ذلك، لقياس حجم النووي، اتبع سطح خلق المعالج باستخدام قناة تلطيخ علامة النووية كما هو موضح في الأقسام الفرعية 7،3-7،7.
8. الأداءات حجم 3D من نوى مختارة داخل ذبابة الفاكهة اليرقات عضلات الجسم الجدار لتقييم داخل النواة توطين بروتين معين
- استخدام الصور مبائر الإبلاغ عن عضلات جدار الجسم الملون مع علامة النووية ومع الاجسام المضادة المحددة لامين وDVAP.
- فتح الصور عن طريق الشروع في برنامج وقانون حالة الطوارئإلخ نواة محددة ليتم تحليلها. ويمكن أن يتم ذلك عن طريق اختيار البند الرئيسي القائمة تحرير> 3D المحاصيل.
- اتبع سطح خلق المعالج باستخدام قناة امين كما هو موضح في القسم الفرعي 7،3-7،7.
- مرة واحدة يتم إنشاء السطح، انقر على تحرير في كائنات مساحة خصائص ثم حدد قناع جميع لعزل إشارة داخل النواة. وهذا يخلق نافذة جديدة.
- اختر إشارة DVAP من القائمة المنسدلة اختر القناة. حدد DVAP إشارة المناعية التفاعل داخل النواة عن طريق النقر على خيار تعيين Voxels خارج السطح إلى الصفر. يتم إنشاء قناة ملثمين الجديدة ومتاح في إطار تعديل عرض للاختيار.
- لتصور وجود إشارة داخل نواة إنشاء طائرة كفاف عن طريق النقر على أيقونة إضافة جديد لقطة الطائرة
 من شريط الأدوات كائنات.
من شريط الأدوات كائنات. - تفاعلي ضبط زاوية لقطةطائرة وموقعها لتصور توزيع إشارة داخل النواة.
النتائج
ALS هو مرض التنكسية التي تؤثر على وجه التحديد الخلايا العصبية الحركية مما يؤدي إلى الشلل التدريجي وقاتلة للعضلات المخططة 7. الطفرات مغلطة في المصاحب VAMP البشري البروتين ب (hVAPB) تسبب مجموعة من الأمراض العصبية الحركية بما في ذلك نوع المرض 08-12 أغسطس. تم التعرف على الطفرات مغلطة (V234I) في الجين hVAPB مؤخرا في حالة واحدة من المرض نموذجية في البشر 13. لتقييم إمكاناتها المسببة للأمراض، ولدت لنا الذباب المعدلة وراثيا معربا عن hVAPB ذبابة الفاكهة orthologue DVAP تحمل الطفرة المسببة للمرض (DVAP-V260I). وقد استهدفت التعبير عن هذا التحوير إلى العضلات باستخدام نظام UAS / GAL4 والعضلات محددة سائق BG57-GAL4 14،15. وتمت مقارنة تأثير DVAP-V260I التعبير المعدلة وراثيا ويتناقض إلى أن اثنين من الجينات المحورة أخرى (DVAP-WT1 وDVAP-WT2)، التي تعبر عن مستويات مختلفة من البرية من نوع البروتين DVAP 16. موره على وجه التحديد، فإن الزيادة في DVAP مناعية 2.2 أضعاف عما كانت عليه في الضوابط لخط DVAP WT2 بينما مستويات DVAP-V260I وDVAP-WT1 المعرض للمقارنة وأقل من نفس إشارة 16.
وقد ارتبطت التغيرات النووية مع الشيخوخة والعديد من الأمراض العصبية بما في ذلك 17،18 مرض باركنسون. لتقييم ما إذا كان نموذج الطيران لدينا ALS8 المعارض تغييرات في الهيكل النووي، وموقف والحجم، ونحن ملطخة نوى داخل العضلات المخططة من المورثات المناسبة مع علامة النووية والأجسام المضادة لمكافحة امين 19-22، والذي يتصور المغلف النووي. لتسليط الضوء على العضلات، تمت إضافة الأجسام المضادة DVAP محددة أيضا لنفس العينات (الشكل 1). وقد تم جمع الصور مبائر وأجريت التحليلات المورفومترية مفصلة باستخدام برمجيات تحليل الصور. في عضلات السيطرة، تم العثور على نواة ليتم توزيعها بالتساوي على طول العضلاتالألياف في حين DVAP-V260I وDVAP-WT معربا عن العضلات، نوى تبدي ميلا إلى إعادة توزيع في مجموعات مرتبطة ارتباطا وثيقا (الشكل 1).
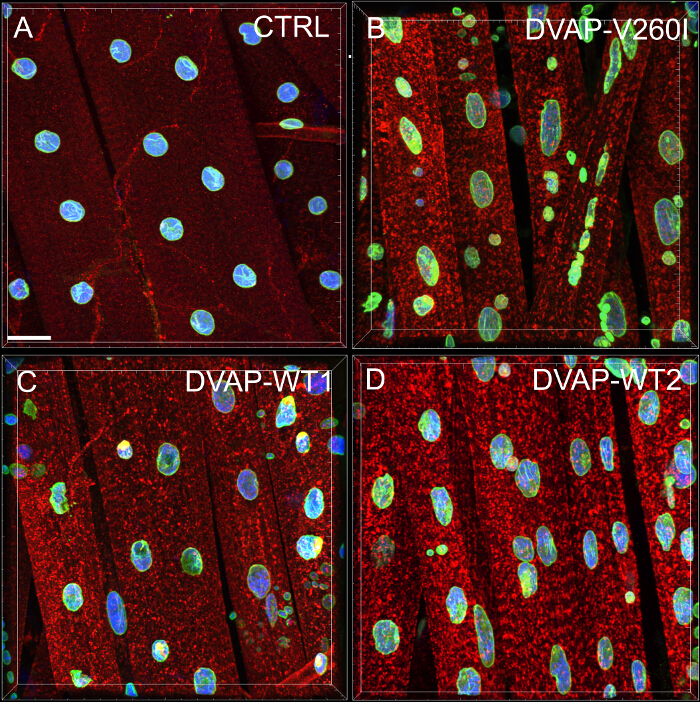
أجرينا أقرب تحليل جار لإجراء تقييم كمي لتوزيع نوى على طول الألياف العضلية من كل راثى. تحليل أقرب جار أولا بتحديد أقرب جار لكل نواة عن طريق قياس المسافة بين مركز نواة معينة ووسط كل نواة المحيطة الأخرى. ثم يتكرر هذا الإجراء كل النوى الأخرى على طول الألياف العضلية. وأخيرا، فإن أقصر مسافة بين النوى ضمن محددة من العضلات، ويحسب عن طريق حساب متوسط أقصر المسافات من كل نواة وأقرب جيرانها. (الشكل 2A - C). مقارنة مع الضوابط، عضلات التعبير إما التحوير DVAP-V260I أو أي من الجينات المحورة overexpressing البروتين من النوع البري، تقديم انخفاض كبير في متوسط المسافة أقصر بين النوى، ونتيجة لذلك، تظهر نواة لتكون مرتبطة بشكل وثيق في مجموعات. تأثير المرض تسبب أليل DVAP-V260I هو أشد من العقوبة المرتبطة overexpression من البروتين من النوع البري، حتى إذا تم استخدام أقوى التحوير-DVAP WT2 (الشكل 1 والشكل 2D).
overexpression من أي DVAP-V260I أو DVAP-WT الجينات المحورة أيضا يسلك تدهور حاد في الهندسة المعمارية النووية مما أدى إلى نوى المشوهة مع بنية ممدود (الشكل 1). وكان كميا هذا الانحراف الهيكلي باستخدام برنامج ImageJ الذي يتم فيه تحديد دائرية بواسطة الصيغة C  والذي يقيس معدل العرض إلى نسبة طول كل نواة مع C = 1 يمثل دائرة الكمال وC = 0 مضلع ممدود بلا حدود. في مقاولاتنوى را اظهار شكل دائري واضح، C يساوي 1 بينما في المسوخ المعدلة وراثيا تغيير في الشكل مع ما يترتب فقدان دائرية، يؤدي إلى انحراف كبير من هذه القيمة (الشكل 1) والشكل (3).
والذي يقيس معدل العرض إلى نسبة طول كل نواة مع C = 1 يمثل دائرة الكمال وC = 0 مضلع ممدود بلا حدود. في مقاولاتنوى را اظهار شكل دائري واضح، C يساوي 1 بينما في المسوخ المعدلة وراثيا تغيير في الشكل مع ما يترتب فقدان دائرية، يؤدي إلى انحراف كبير من هذه القيمة (الشكل 1) والشكل (3).
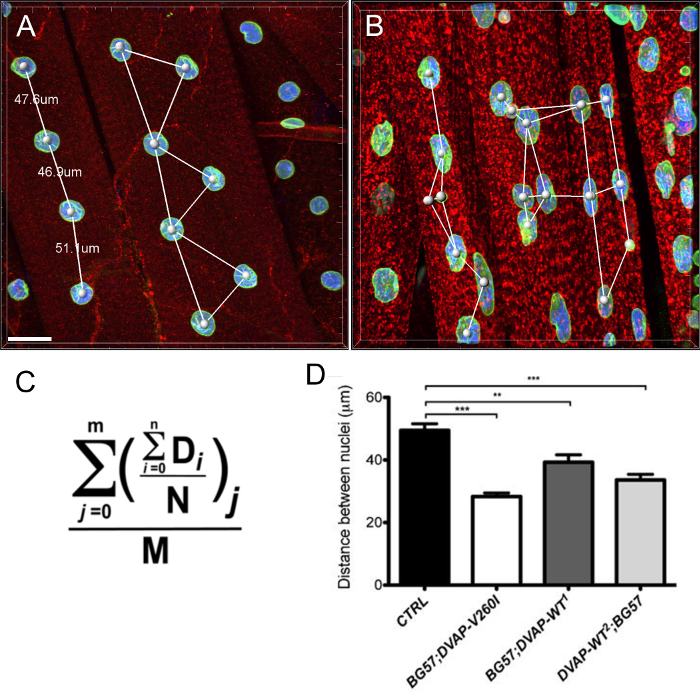
كما وجدنا أن في عضلات التعبير عن نفس الجينات المحورة، نوى عرض حجم النووي الموسع ملحوظ مقارنة مع الضوابط، على الرغم من أن تسبب أليل ALS يبدو لتكون أكثر كفاءة في حمل هذا النمط الظاهري مقارنة الجينات المحورة DVAP-WT (الشكل 4).
تتميز ما يقرب من جميع الأمراض العصبية من تراكم الخلايا من المجاميع التي تحتوي على البروتين المسببة للأمراض. التي قطعناها على أنفسنا اعادة البناء 3D والاداءات حجم النواة وجدنا أن في عضلات التعبير عن التحوير متحولة أو overexpressing البروتين من النوع البري، DVAP المناعية التفاعل تشكيل مجموعات لالثانية أن بعضهم تم ترجمة أيضا في نوى (الشكل 5). على العكس من ذلك، في لل NMJs السيطرة، تتوزع DVAP المناعية التفاعل ضعيف في جميع أنحاء الألياف العضلية ويتم استبعاد من النواة 16.
. الشكل 1: صور متحد البؤر myonuclei داخل العضلات المخططة التعبير إما DVAP-WT أو الجينات المحورة DVAP-260I (A) BG57-GAL4 / + السيطرة، (ب) BG57، DVAP-V260I، (C) BG57، DVAP-WT1 و (D) BG57، ملطخة العضلات DVAP-WT2 التعبير عن الجينات المحورة المشار إليها مع الاجسام المضادة المحددة لDVAP (إشارة حمراء)، امين (إشارة خضراء) مع وجود علامة معينة النووية لتصور النوى (إشارة الزرقاء). شريط مقياس = 30 ميكرومتر الرجاء انقر هنا لعرضنسخة أكبر من هذا الرقم.
الشكل 2: أقرب تحليل جار لتحديد متوسط المسافة بين نواة وأقرب جيرانه واحد (ب) النتائج الممثل تظهر المواقع النووية تغير في عضلات overexpressing التحوير-DVAP WT2 بالمقارنة مع الضوابط في الفقرة (أ). وقدرت المسافة النووية متوسط في عضلات المورثات المشار إليها باستخدام الصيغة في (C) ويتم الإبلاغ عن البيانات في (D). هي ملطخة لل NMJs اليرقات مع الاجسام المضادة المحددة لDVAP (إشارة حمراء)، امين (الأخضر) مع وجود علامة النووية (إشارة الزرقاء). النجمة تدل دلالة إحصائية. *** P <0.001 ** P <0.01. للتحليل الإحصائي لهذه التجربة وجميع التجارب المذكورة أدناه في اتجاه واحد أنوفا اختبار تم استخدام وmultip لتوكي فيتم تطبيق اختبار جنيه مقارنة كاختبار بعد خاصة عندما تم العثور على الاختلافات بين الأنماط الجينية أن تكون كبيرة بواسطة اختبار ANOVA. أشرطة الخطأ تمثل SEM. شريط مقياس = 30 ميكرومتر الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
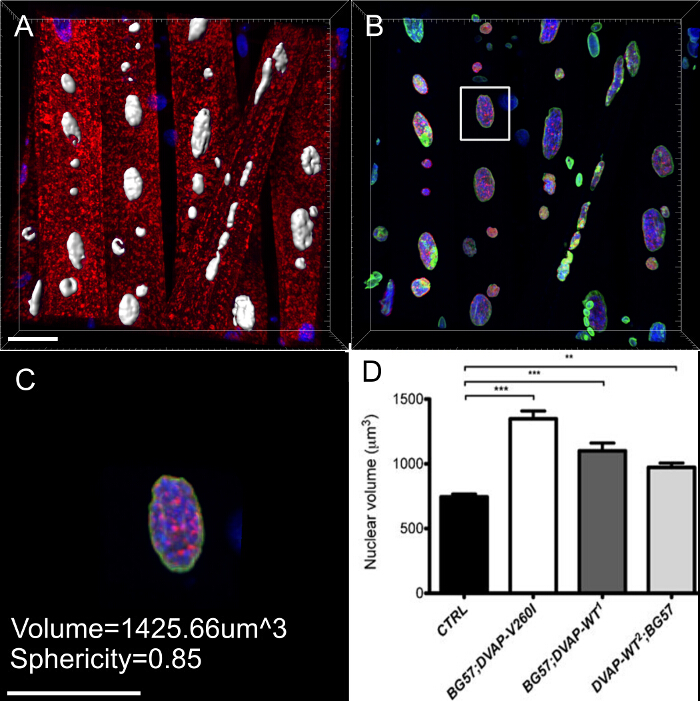
الشكل (3): صور تظهر الخطوات تمثيلية في حساب حجم النووي (أ) صورة تمثيلية تظهر نواة مجزأة باستخدام معالج إنشاء السطح. تم تجاهل نوى عند حدود الصور. وقد ملثمين (ب) صورة تظهر إشارة DVAP النووية بعد المحيطة تلطيخ DVAP باستخدام سطح إنشاؤها في قناة علامة النووية. وتقدم (C) طبقة السطحية من المعلومات من معلمات إضافيةبما في ذلك حجم النووي وكروية. (D) بيانات عن حجم النووي من مختلف الأنماط الوراثية. النجمة تدل دلالة إحصائية. كانت ملطخة لل NMJs تشريح مع أضداد DVAP (إشارة حمراء)، أضداد امين (إشارة خضراء) وعلامة النووية (إشارة الزرقاء). *** P <0.001 ** P <0.01. أشرطة الخطأ تمثل SEM. شريط مقياس = 30 ميكرومتر الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
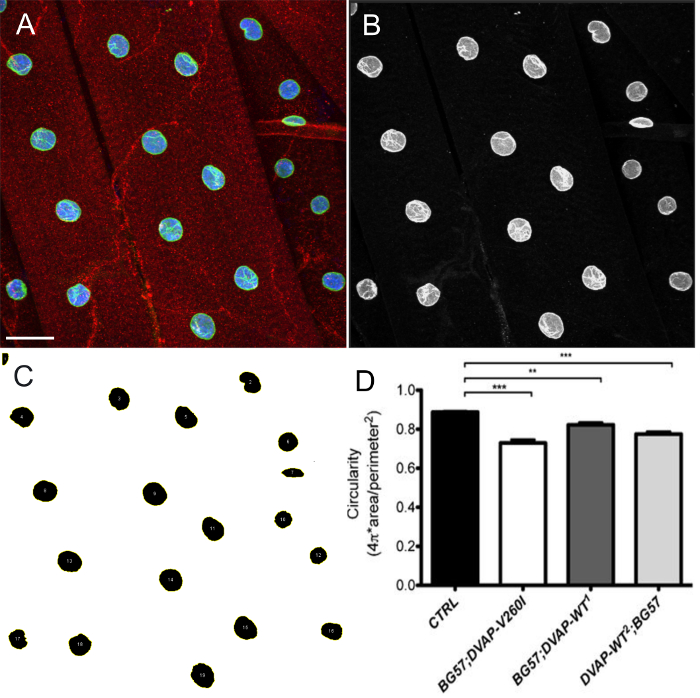
الشكل 4: صور تظهر الخطوات تمثيلية في تقدير شكل النووي يماغيج. وقد تم تحليل أقصى الإسقاط كثافة الصور باستخدام يماغيج لتقدير دائرية من نواة داخل العضلات. (أ) مثال ممثل الإسقاط كثافةالصورة ثلاث قنوات كما في الخطوة 7.9 من البروتوكول. تم اختيار (ب) صورة تظهر خطوة 7.10 البروتوكول الذي يتم تقسيم القنوات وقناة علامة النووية. (C) صورة تمثيلية توضح أنه بعد تطبيق عتبة كثافة لقطاع نوى ومدير العائد على الاستثمار المساعد في ImageJ، كل نواة من الفائدة يمكن أن يتم اختيار وشكلها تقاس من خلال واصفات الشكل (خطوات 7،11-7،15). (D) الكمي للدائرية من مختلف الأنماط الوراثية. على لل NMJs اليرقات، تشير إشارة حمراء DVAP تلطيخ بينما يحدد اللون الأخضر نوى ويتوافق مع تلطيخ امين. وصفت الداخلية من كل نواة في الزرقاء بسبب تلطيخ مع علامة النووية. النجمة تدل دلالة إحصائية. *** P <0.001 ** P <0.01. أشرطة الخطأ تمثل SEM. شريط مقياس = 30 ميكرومتر الرجاء انقر لهاالبريد لعرض نسخة أكبر من هذا الرقم.
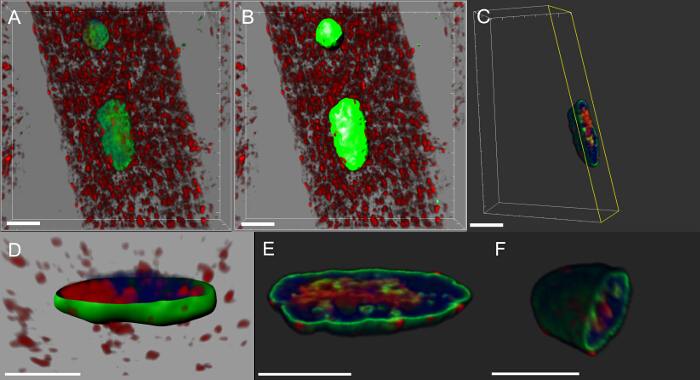
الرقم 5: صور تظهر خطوات محددة في خلق الاداءات حجم myonuclei. (أ) صورة تبين كثافة 3D المخلوطة عرض العضلات ملطخة البروتين DVAP (الحمراء)، وامين (الخضراء) وعلامة الحمض النووي (الأزرق). (ب) صورة تمثل الطبقة السطحية الناتجة عن استخدام القناة امين لقطاع نوى. (C) صورة تمثل نواة التي استخدمت الطبقة السطحية لإخفاء إشارة DVAP خارج النواة المحدد. باللون الأصفر هي طائرة لقطة التي تم إضافتها إلى الصورة. زاوية نظره وموقف يمكن تعديلها بشكل تفاعلي لتصور توزيع إشارة داخل النواة. (D) صورة الإبلاغ عن رأي مستعرضة من باليود الطبقة السطحية النووي التي تم إنشاؤهانانوغرام اندمجت قناة امين مع DVAP غير المقنعة وإشارات علامة النووية. (E و F) مقطوع إضافية الاداءات حجم من نفس النواة. شريط مقياس = 10 ميكرومتر الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
في الماضي، كان نادرا ما تؤخذ الاختلافات الشكلية داخل وبين المجموعات التجريبية في الاعتبار. ومع ذلك، فإن تطبيق الأساليب الكمية أصبحت الآن تحسب القاعدة في الدراسات المقارنة من التشكل ووصف رياضي من الأشكال التشريحية. استخدام الكمية والتحليلات في تقييم آثار التلاعب الجيني في العمليات الخلوية محددة، مبشرة في تعزيز قدرتنا على اكتشاف التغيرات المورفولوجية وفي تحسين الدقة التي تم وصفها هذه التغييرات. وعلاوة على ذلك، التحليل الإحصائي للبيانات الكمي يسمح لنا لتقييم ما إذا كانت الاختلافات الملاحظة بين الظواهر كبيرة.
في العضلات المخططة، نوى يحمل هيكل مدورة متميزة وتوزع بالتساوي على طول الألياف العضلية. على الرغم من أن الآليات الجزيئية إنشاء وصيانة حجم وشكل وبنية نواة ليست معروفة، هذه الميزات النووية المرجح رس تلعب دورا أساسيا في السيطرة على وظيفة العضلات. في الواقع، وسقوط عدد من الاعتلالات العضلية التي كتبها طفرات في الجينات التي تنظم التشكل وموقف نوى داخل العضلات. أهمية وظيفية من شكل وتوزيع نوى داخل الخلية لا يقتصر على العضلات. تراكم الأدلة تشير إلى أن ترتبط أيضا عيوب النووية مع الأمراض العصبية مثل مرض باركنسون 18،24. بالإضافة إلى ذلك، بدأنا ندرك أن التشكل، وحجم وتوزيع الخلايا من العضيات الأخرى بما في ذلك الشبكة الإندوبلازمية والميتوكوندريا قد يكون لها عواقب وظيفية. على سبيل المثال، ترتبط التغييرات في مورفولوجية الميتوكوندريا الذين يعانون من اضطرابات عصبية مثل نوع 1 البصرية ضمور (OPA1) وشاركو ماري توث نوع 2A الاعتلال العصبي 25.
للمساعدة في عملية توضيح الآليات الجزيئية الكامنة وراء هذه العمليات الهامة، فإننا نقترح الجمع بين عالية الدقة مبائرالبيانات مع برنامج التصوير والمورفولوجية ويحلل لتقييم كمي كيف التلاعب الجيني يمكن أن تؤثر على الشكل والحجم والموقع من نوى داخل الألياف العضلية. قوة وبراعة الوراثة ذبابة الفاكهة مع طبيعة نمطية للغاية من الجهاز العصبي العضلي في يرقات ذبابة الفاكهة تجعل اليرقات NMJ نموذج تجريبي مناسبة بشكل خاص لهذا النوع من التحليلات. وفي لل NMJs اليرقات، ويمكن إجراء التحليل المظهرية في قرار المشبك واحد مما يتيح تحليل المورفومترية دقيقة حيث يمكن دراسة عدد من لل NMJs داخل نفس الطاير ويمكن مقارنة حتى نفس التعرف NMJ بين الذباب من المورثات مختلفة 3،4.
التوصيف المظهري للموقف النووي والشكل والحجم في ذبابة الفاكهة اليرقات NMJ يبدأ عن طريق أداء المناعية لللل NMJs تشريح مع الأجسام المضادة التي تبرز العضلات ونوى داخل العضلات. في بروتوكول المبينة في ثيالصورة ورقة، كانت ملطخة myonuclei مع الأجسام المضادة ضد امين، علامة على المغلف النووي، مع علامة النووية تسليط الضوء على النووية الداخلية ومع الاجسام المضادة المحددة لDVAP وصمة عار على العضلات كلها. تفضلت الأجسام المضادة امين المستخدمة في هذه التجارب من قبل بول فيشر 19-22 لكن مصادر بديلة للأجسام المضادة للامين يمكن استخدامها. بالإضافة إلى ذلك، يتوفر تجاريا عددا من الأجسام المضادة أخرى محددة لالغلاف النووي. وأخيرا، علامات النووية، مثل دابي ويوديد propidium، وتتوفر أيضا في حين يمكن تصور العضلات عن طريق تلطيخ مع المضادة للالأكتين أو مكافحة تويولين الأجسام المضادة. وفي حالة تطبيق الأجسام المضادة غير تلك المستخدمة في هذا الإجراء التجريبي، فإن بروتوكول المناعية يتطلب-خطوات إضافية في أي ظروف تثبيت وتركيز العمل على الأجسام المضادة الجديدة سوف تحتاج إلى أن يكون الأمثل. خطوة حاسمة في هذا البروتوكول، وخصوصا عندما تحتاج إلى تحليل الاداءات حجم، هو الالبريد متزايدة من العينات على الشريحة. في هذه الحالة، فمن المهم أن تشمل الفواصل بين الشرائح وساترة بحيث العينات لا تحصل على سحق. ثلاث فرق من الشريط السليلوز ملفوفة حول الشريحة على كلا الجانبين من ساترة تمثل وسيلة سهلة لجعل الفواصل.
في حين تم استخدام يماغيج للصور 2D، أكثر من صورة متعددة القنوات 3D التحليلات الواردة في هذه الورقة تم القيام به، وذلك باستخدام Imaris لما له من توافر في المنزل. ومع ذلك، أي مماثلة حزمة برامج تجارية أخرى يمكن استخدامها لهذه التطبيقات.
هناك العديد من المصادر المفتوحة (على سبيل المثال، يماغيج، CellProfiler، Vaa3D، الجليدية، KNIME وغيرها) ومنصات البرمجيات التجارية المتاحة لتحليل الصور مبائر. يماغيج 26، البرمجيات الحرة من المعاهد الوطنية للصحة أو نسختها أكثر المحسن، والمعروفة باسم فيجي 27، لديها عدد كبير من المرشحات الاستيراد، وحدات الماكرو والإضافات المتاحة لالتصال التصوير في جميع أنحاء العالمتاي. وتتركز معظم هذه الإضافات على معالجة المعلومات على نحو شريحة شريحة حدة. وهناك أيضا الإضافات المتاحة لتصور وتحليل الصور 3D متعددة القنوات. ومع ذلك، في كثير من الأحيان أنها مصممة لمهمة محددة والمستخدمين قد تحتاج إلى توسيع أو التكيف مع هذه الإضافات لاحتياجاتها الخاصة. من ناحية أخرى، منصات تجارية تستهدف مستخدمين عديمي الخبرة نسبيا وغالبا ما تركز على سهولة الاستخدام، تغطية واسعة من المهام لمعالجة الصور مع سرعة لا تصدق.
إجراء التجارب إلى جانب تحليل المظهري الكمي الواردة في هذا البروتوكول، ويمكن أن تساعد في توضيح الآليات الجزيئية التي تتحكم في التشكل عضية وتوزيعها داخل الخلية. ومع ذلك، فإن هذا النهج لديه الحد الواضح من تحليل هذه العمليات في نهاية نقطة محددة. ومن المرجح أن تكون دينامية جدا وتختلف ليس فقط بين مختلف تاي خلية عملية السيطرة على التشكل وتوزيع العضياتعبوة ولكن أيضا داخل الخلية نفسها تبعا لحالة النمو أو الفسيولوجية. أن تكون ممثلة لمواصلة تنفيذ هذا التحليل من وقت التصوير مرور تسمح التغييرات في مورفولوجية عضية وموقف التي يتعين رصدها مع مرور الوقت.
Disclosures
The authors have nothing to disclose.
Acknowledgements
We are grateful to Dr. Andrea Chai for her insightful comments on the manuscript. This work was supported by the Wellcome Trust (grant number: Pennetta8920) and by the Motor Neuron Disease Association (grant number: Pennetta6231).
Materials
| Name | Company | Catalog Number | Comments |
| Micro-Forceps 0.3 mm x 0.25 mm | Fine Science Tools | 11030-12 | |
| Sylgard dissection plates | SIGMA-ALDRICH | 76103 | Mix the pre-weighed elastomer base with curing agent. Poor the mixture into a 5 cm Petri dish. Let cure it at 60 °C for at least 24 hr |
| Stainless/Steel Minutien Pins 0.1 mm diameter | Fine Science Tools | 26002-10 | |
| Microdissection scissors (ultra-fine) | Fine Science Tools | 15200-00 | |
| 1x PBS (Phosphate Buffered Saline). Composition: 3 mM NaH2PO4, 7 mM Na2HPO4, 130 mM NaCl, pH 7 | NaH2PO4 (SIGMA-S8282), Na2HPO4 (SIGMA-S7907), NaCl (SIGMA-S7653) | ||
| Bouin's Solution. Composition: Picric Acid, Formaldehyde, Acetic Acid (15:10:1) | Picric Acid (SIGMA 197378), Formaldehyde (F8775), Acetic Acid (SIGMA-1005706) | ||
| 1x PBT (Phosphate Buffered Saline with Triton). 1x PBS + 0.1% Triton | Triton-X100. SIGMA-T8787 | ||
| Normal Goat Serum | SIGMA | G9023 | |
| Guinea Pig anti-DVAP antibody | Provided by Dr. Giuseppa Pennetta (University of Edinburgh, UK). Use at 1:200 dilution in 5% NGS | ||
| Rabbit anti-HRP (Horseradish peroxidase) | Jackson ImmunoResearch | 123-065-021 | Use at 1:500 dilution in PBT containing 5% NGS |
| Rabbit anti-Lamin antibody | Provided by Dr. Paul Fisher (State Univeristy of New York at Stony Brook). Use at 1:500 dilution in PBT containing 5% NGS | ||
| TO-PRO-3 | Molecular Probes | T3605 | |
| Goat anti-rabbit antibody, Alexa Fluor488, conjugated | Jackson ImmunoResearch | bs-295G-A555-BSS | Use at 1:500 dilution in PBT containing 5% NGS |
| Goat anti-guinea pig IgG antibody, Cy3, conjugated | Jackson ImmunoResearch | bs-0358G-Cy3-BSS | Use at 1:500 dilution in PBT containing 5% NGS |
| Vectashield mounting medium for fluorescence | Vector laboratories | H-1000 |
References
- Collins, C. A., DiAntonio, A. Synaptic development: insights from Drosophila. Curr. Opin. Neurobiol. 17 (1), 35-42 (2007).
- Fortini, M. E., Skupski, M. P., Boguski, M. S., Hariharan, I. K. A survey of human disease gene counterparts in the Drosophila genome. J. Cell Biol. 150 (2), 23-30 (2000).
- Ramachandran, P., Budnik, V. Dissection of Drosophila larval body-wall muscles. Cold Spring Harb Protoc. (8), (2010).
- Brent, J. R., Werner, K. M., McCabe, B. D. Drosophila larval NMJ dissection. JoVE. (24), (2009).
- Brent, J., Werner, K., McCabe, B. D. Drosophila larval NMJ immunohistochemistry. JoVE. (25), (2009).
- Ramachandran, P., Budnik, V. Immunocytochemical staining of Drosophila larval body-wall muscles. Cold Spring Harb Protoc. (8), (2010).
- Ling, S. C., Polymenidou, M., Cleveland, D. W. Converging mechanisms in ALS and FTD: disrupted RNA and protein homeostasis. Neuron. 79 (3), 416-438 (2013).
- Nishimura, A. L., et al. A mutation in the vesicle-trafficking protein VAPB causes late-onset spinal muscular atrophy and amyotrophic lateral sclerosis. Am J Hum Genet. 75 (5), 822-831 (2004).
- Chen, H. J., et al. Characterization of the properties of a novel mutation in VAPB in familial amyotrophic lateral sclerosis. J Biol Chem. 285 (51), 40266-40281 (2010).
- Funke, A. D., et al. The P56S mutation in the VAPB gene is not due to a single founder: the first European case. Clin Genet. 77 (3), 302-303 (2010).
- Millecamps, S., et al. SOD1,ANG,VAPB,TARDBP, and FUS mutations in familial amyotrophic lateral sclerosis: genotype-phenotype correlations. J Med. Genet. 47 (8), 554-560 (2010).
- Landers, J. E., et al. New VAPB deletion variant and exclusion of VAPB mutations in familial ALS. Neurology. 70 (14), 1179-1185 (2008).
- Van Blitterswijk, M., et al. VAPB and C9orf72 mutations in 1 familial amyotrophic lateral sclerosis patient. Neurobiol Aging. 33 (12), 2951-2954 (2012).
- Brand, A. H., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118 (2), 401-415 (1993).
- Budnik, V., et al. Regulation of synapse structure and function by the Drosophila tumor suppressor gene dlg. Neuron. 17 (4), 627-640 (1996).
- Sanhueza, M., Zechini, L., Gillespie, T., Pennetta, G. Gain-of-function mutations in the ALS8 causative gene VAPB have detrimental effects on neurons and muscles. Biol Open. 3 (1), 59-71 (2014).
- Worman, H. J., Ostlund, C., Wang, Y. Diseases of the nuclear envelope. Cold Spring Harb Perspect Biol. 2 (2), a000760 (2010).
- Liu, G. H., et al. Progressive degeneration of human neural stem cells caused by pathogenic LRRK2. Nature. 491 (7425), 603-607 (2012).
- Pennetta, G., Hiesinger, P. R., Fabian-Fine, R., Meinertzhagen, I. A., Bellen, H. J. Drosophila VAP-33A directs bouton formation at neuromuscular junctions in a dosage-dependent manner. Neuron. 35 (2), 291-306 (2002).
- Fisher, P. A., Berrios, M., Blobel, G. Isolation and characterization of a proteinaceous subnuclear fraction composed of nuclear matrix, peripheral lamina, and nuclear pore complexes from embryos of Drosophila melanogaster. J Cell Biol. 92 (3), 674-686 (1982).
- Smith, D. E., Fisher, P. A. Identification, developmental regulation, and response to heat shock of two antigenically related forms of a major nuclear envelope protein in Drosophila embryos: application of an improved method for affinity purification of antibodies using polypeptides immobilized on nitrocellulose blots. J Cell Biol. 99 (1), 20-28 (1984).
- Smith, D. E., Gruenbaum, Y., Berrios, M., Fisher, P. A. Biosynthesis and interconversion of Drosophila nuclear lamin isoforms during normal growth and in response to heat shock. J Cell Biol. 105 (2), 771-790 (1987).
- Puckelwartz, M. J., et al. Disruption of nesprin-1 produces an Emery Dreifuss muscular dystrophy-like phenotype in mice. Hum Mol Genet. 18 (4), 607-620 (2009).
- Tsujikawa, M., Omori, Y., Biyanwila, J., Malicki, J. Mechanism of positioning the cell nucleus in vertebrate photoreceptors. Proc Natl Acad Sci USA. 104 (37), 14819-14824 (2007).
- Westermann, B. Mitochondrial fusion and fission in cell life and death. Nat Rev Mol Cell Biol. 11 (12), 872-884 (2010).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nat Methods. 9 (7), 671-675 (2012).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat Methods. 9 (7), 676-682 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved